- Helicobacter pylori
L’Helicobacter pylori (Hp) est l’une des infections chroniques les plus courantes chez l’Homme, la transmission se produisant le plus souvent dans l’enfance (1). En Suisse, la prévalence est estimée à environ 12%. Cependant, elle est certainement plus élevée pour les personnes nées à l’étranger (2). L’Hp a une importance pathophysiologique majeure dans les ulcères gastroduodénaux (90–95% des ulcères duodénaux et 60–90% des ulcères gastriques sont Hp-positifs) (3, 4). Elle est aussi l’une des causes de nombreuses autres maladies, dont le lymphome du MALT (5), ainsi que l’adénocarcinome de l’estomac (6). L’Hp est donc également classifié par l’OMS comme cancérogène de classe I (7). Cet article présente le diagnostic et la thérapie actuellement utilisés dans le cabinet du médecin généraliste.
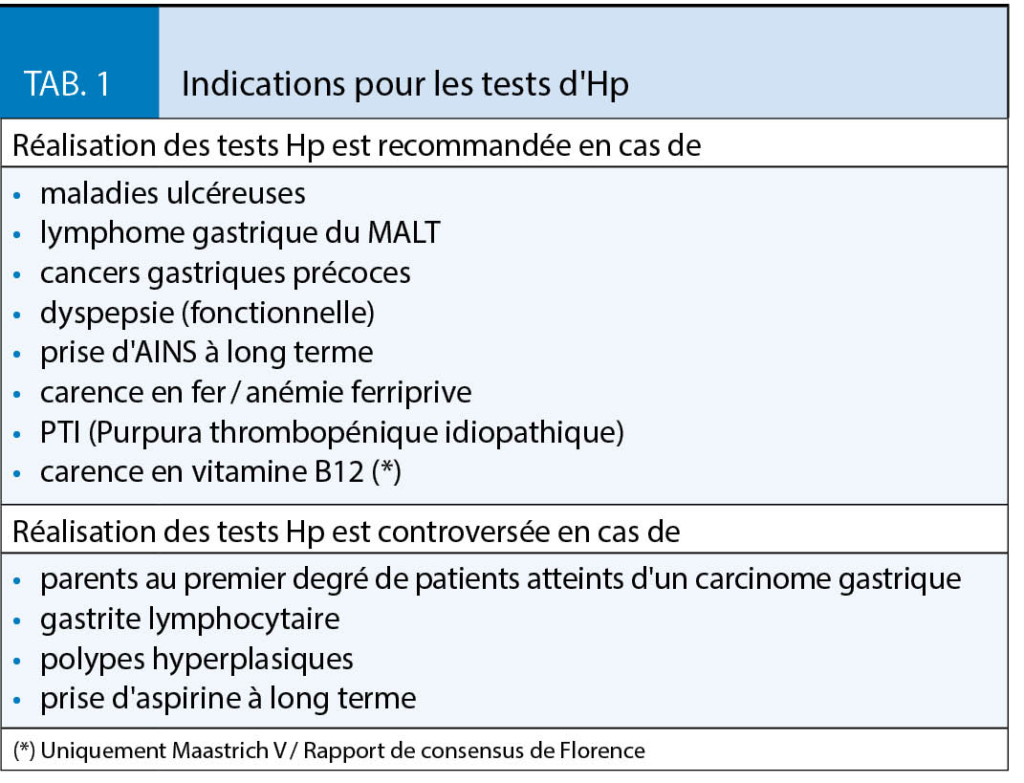
La découverte de l’Hp par B.J. Marshall et J.R. Warren en 1983 a provoqué un changement de paradigme en gastro-entérologie dont l’importance a été reconnue par l’attribution du prix Nobel de médecine à ces chercheurs en 2005. Les indications actuellement recommandées pour les tests d’Hp sont présentées dans le tableau 1 (8, 9) ci-dessous.
Quel test pour quel patient ?
Une distinction fondamentale doit être faite entre les méthodes invasives (prélèvement de biopsie avec histologie, immunohistologie et PCR) et les méthodes non invasives (antigène des selles, test respiratoire C13, sérologie et test respiratoire). Les sérologies sont rarement pertinentes, parce qu’elles ne permettent pas de faire la distinction entre infection active et éradication réussie. Dans la pratique, le test de l’’antigène des selles est recommandé. En effet, il est simple et très précis. Alternativement, un test d’haleine ayant des caractéristiques et des coûts comparables peut être utilisé. Il est important que les essais soient effectués dans des conditions optimales. En effet, pour éviter des résultats faussement négatifs, les inhibiteurs de la pompe à protons (IPP) devraient être interrompus 2 semaines avant le test et les traitements antibiotiques 4 semaines avant (10). La question de savoir si une endoscopie avec prélèvement de biopsie est indiquée fait l’objet d’une discussion controversée, en particulier concernant les patients souffrant de troubles dyspeptiques non spécifiques. L’endoscopie précoce (scope-and-treat) favorise une amélioration plus importante des symptômes, ainsi que la satisfaction des patients. Cependant, les coûts de l’endoscopie précoce sont bien plus élevés par rapport aux tests d’Hp non invasifs (test-and-treat) (11). Pourtant, l’endoscopie est fortement indiquée pour les patients âgés de plus de 50 ans ou s’il y a des symptômes d’alarme tels que la perte de poids, l’anémie, la dysphagie ou les saignements gastro-intestinaux (8, 9).
Thérapie
Il existe d’innombrables programmes d’éradication de l’Hp différant considérablement en termes de combinaisons de médicaments et de durée. La triple thérapie italienne (métronidazole, clarithromycine et IPP) et française (amoxicilline, clarithromycine et IPP) sont bien établies en Suisse, en particulier pour l’expérience d’éradication primaire. En outre, il existe des combinaisons de quatre médicaments pouvant être utilisées comme thérapie concomitante (amoxicilline, métronidazole, clarithromycine et IPP), séquentielle (amoxicilline et IPP, puis métronidazole, clarithromycine et IPP) ou quadruple thérapie hybride (amoxicilline et IPP, puis amoxicilline, métronidazole, clarithromycine et IPP). Dans les pays anglophones, la quadruple thérapie contenant du bismuth (métronidazole, tétracycline, bismuth et PPI) est fréquemment utilisée. Pylera®, la préparation combinée contenant du bismuth, est autorisée en Suisse. L’enregistrement dans la liste des spécialités est prévue pour 2018. Elle est cependant déjà disponible sur ordonnance en Allemagne. Les taux d’éradication atteints avec Pylera® sont extrêmement élevés (> 90%) (12, 13). Toutefois, l’inconvénient est qu’il faut prendre 3 x 4 comprimés de Pylera® par jour et 2 x 1 comprimé d’un IPP (un total de 14 comprimés / jour) afin d’obtenir une dose suffisante.
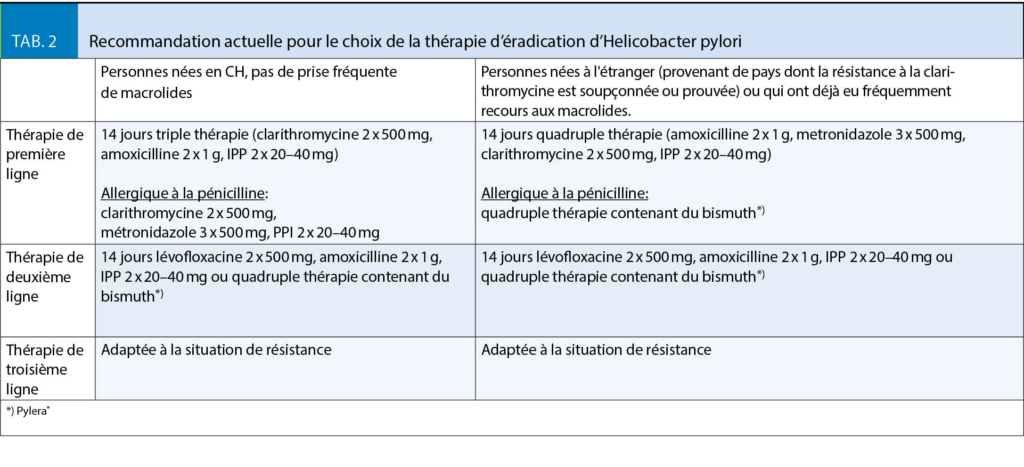
Au cours des dernières années, l’augmentation de la résistance de la population aux agents antimicrobiens a conduit à des taux d’éradication plus faibles, où la résistance à la clarithromycine est le facteur décisif (14). Cependant, la prévalence de la résistance varie considérablement d’une région à l’autre. Pour cette raison, les recommandations thérapeutiques doivent toujours être adaptées à la situation locale de résistance (10). Malheureusement, les données sont limitées pour la Suisse. Toutefois, la résistance à la clarithromycine est estimée être faible pour les personnes nées en Suisse (≤ 15%), tandis qu’elle est plus élevée pour les personnes nées à l’étranger (≥ 15%) (15, 16). La résistance fréquente au métronidazole est cliniquement moins habituelle (15, 16). Cependant, si elle se manifeste en même temps que la résistance à la clarithromycine, il en résulte des taux d’éradication plus faibles dans les thérapies ne contenant pas de bismuth (19). La résistance à l’amoxicilline est à peine existante (< 5 %) (20). Le tableau 2 donne une recommandation pour le choix du traitement d’éradication de l’Hp sur la base des directives internationales actuelles (8, 9).
Contrôle de l’éradication et échec du traitement
Si un traitement d’éradication est mis en œuvre, son succès devrait également être vérifié. Comme nous l’avons déjà mentionné ci-dessus, le moment opportun de l’examen, ainsi que les exigences de test correctes (2 semaines sans IPP, 4 semaines sans traitement antibiotique) sont importants. En cas d’échec thérapeutique, une thérapie de deuxième ligne doit être effectuée (tab. 2). En cas de nouvel échec, une nouvelle gastroscopie avec biopsie pour prouver la résistance aux macrolides (PCR) ou une culture avec détermination complète de la résistance doit être effectuée.
Conclusion
Au cours des dernières années, la prévalence de l’infection a nettement diminuée. Cependant, l’Hp n’a pas perdu de sa pertinence clinique depuis sa découverte. En effet, d’une part, la liste des indications thérapeutiques est complétée continuellement, d’autre part, les résistances rendent une éradication efficace de plus en plus difficile, ce qui signifie que l’Hp restera un problème médical actuel à l’avenir.
Gastroenterologie und Hepatologie
Medizinische Universitätsklinik Kantonsspital Baselland
Rheinstrasse 26
4410 Liestal
Gastroenterologie und Hepatologie
Medizinische Universitätsklinik Kantonsspital Baselland
Rheinstrasse 26, 4410 Liestal
emanuel.burri@ksbl.ch
Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec cet article.
- L’infection à Helicobacter pylori est fréquente et peut entraîner des maladies secondaires importantes.
- La liste des indications du traitement d’éradication s’allonge constamment.
- La détermination de l’antigène des selles est une méthode de détection simple et fiable pour l’Hp. Les sérologies doivent être effectuées avec prudence, car elles ne peuvent pas distinguer entre l’infection active et le statut après éradication.
- En cas d’infection soupçonnée à Hp, une gastroscopie est nécessaire seulement si des symptômes d’alerte existent ou si une maladie subséquente de l’infection est recherchée.
- Lors du choix du traitement antibiotique pour l’éradication de l’Hp, il faut tenir compte du pays d’origine, ainsi que des antibiothérapies précédentes.
- Le contrôle de l’éradication doit être effectué au plus tôt quatre semaines après la fin de l’antibiothérapie et après une interruption de deux semaines des IPP.
1. Malaty HM, E.-K. A. (2002). Age at acquisition of Helicobacter pylori infection: a follow-up study from infancy to adulthood. Lancet, S. 359; 931 – 5
2. Gruber D, Pohl D, Vavricka S, Stutz B, Fried M, Tutuian R. Swiss tertiary care center experience challenges the age-cohort effect in Helicobacter pylori infection. J Gastrointestin Liver Dis. 2008 Dec;17(4):373-7
3. Kuipers EJ, Thijs JC, Festen HP. The prevalence of Helicobacter pylori in peptic ulcer disease. Aliment Pharmacol Ther. 1995;9 Suppl 2:59-69
4. Huang JQ, Sridhar S, Hunt RH. Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic-ulcer disease: a meta-analysis. Lancet 2002;359:14–22
5. Leontiadis GI, Ford AC, Moayyedi P. Helicobacter pylori infection. BMJ Clinical Evidence 2009 ; 10 : 0406
6. Yoon SB , Park JM , Lim CH et al. Effect of Helicobacter pylori eradication on metachronous gastric cancer aft er endoscopic resection of gastric tumors: a meta-analysis . Helicobacter 2014; 19: 243 – 8.
7. IARC Working Group; IARC Working Group, editors. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Vol. 100B. Biological Agents. Lyon: International Agency for Research on Cancer; 2012. Helicobacter pylori; pp. 385–436
8. William D Chey, MD , FACG, Grigorio . Leontiadis, MD, PhD, Colin W. Howden, MD, FACG and Steven F.Moss, MD, FACG, ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. Am J Gastroenterol, 2017 Feb;112(2):212-239
9. Malfertheiner P, Megraud F, O’Morain CA on behalf of the European Helicobacter and Microbiota Study Group and Consensus panel, et al Management of Helicobacter pylori infection—the Maastricht V/Florence Consensus Report Gut 2017;66:6-30.
10. Megraud F1, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y; Study Group participants.. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption Gut 2013; 62: 34-42
11. Ford AC, Qume M, Moayyedi P, et al. Helicobacter pylori ‘test and treat’ or endoscopy for managing dyspepsia: an individual patient data meta-analysis. Gastroenterology 2005;128:1838–44.
12. Miehlke S, Frederking D, Günther T, Glocker E, Eisele B, Andresen V, Schröder S, Morgner A. Efficacy of three-in-one capsule bismuth quadruple therapy for Helicobacter pylori eradication in clinical practice in a multinational patient population. Helicobacter. 2017 Dec;22(6).
13. Pérez-Arellano E, Rodriguez-Garcia MI, Galera Rodenas AB, de la Morena-Madrigal E. Eradication of Helicobacter pylori infection with a new bismuth-based quadruple therapy in clinical practice. Gastroenterol Hepatol. 2017 Oct 17.
14. Luther J, Higgins PD , Schoenfeld PS et al. Empiric quadruple vs. triple therapy for primary treatment of Helicobacter pylori infection: Systematic review and meta-analysis of efficacy and tolerability . Am J Gastroenterol 2010; 105 : 65 – 73 .
15. Yuen B, Zbinden R, Fried M, Bauerfeind P, Bernardi M. Cultural recovery and determination of antimicrobial susceptibility in Helicobacter pylori by using commercial transport and isolation media. Infection 2005;33:77-81
16. Soltermann A, Perren A, Schmid S, Eigenmann F, Güller R, Weber KB, Meier J, Eichenberger P, Komminoth P. Assessment of Helicobacter pylori clarithromycin resistance mutations in archival gastric biopsy samples, Swiss medical weekly, 2005 May 28;135(21-22):327-32
17. Dore MP, Leandro G , Realdi G et al. Eff ect of pretreatment antibiotic resistance to metronidazole and clarithromycin on outcome of Helicobacter pylori therapy: a meta-analytical approach. Dig Dis Sci 2000 ; 45 : 68 – 76
18. Fischbach L, Evans EL . Meta-analysis: the eff ect of antibiotic resistance status on the effi cacy of triple and quadruple fi rst-line therapies for Helicobacter pylori . Aliment Pharmacol Th er 2007 ; 26 : 343 – 57
19. Graham DY, Lee YC, Wu MS. Rational Helicobacter pylori therapy: evidence-based medicine rather than medicine-based evidence. Clin Gastroenterol Hepatol 2014;12:177– 86.
20. Shiota S, Reddy R , Alsarraj A et al. Antibiotic resistance of Helicobacter pylori among male United States veterans . Clin Gastroenterol Hepatol 2015; 13 : 1616 – 24 .
la gazette médicale
- Vol. 7
- Ausgabe 6
- Juli 2018