- La BPCO – update 2023
La BPCO est considérée comme une maladie populaire. La prévalence mondiale de la BPCO est de 10,3% avec une tendance à la hausse en raison de l’ augmentation du nombre de fumeurs dans les pays à faible et moyen revenu (LMIC) et du vieillissement dans les pays à revenu élevé. Comme les années précédentes, la Global Initiative for Chronic Obstructive Lung Disease (GOLD), a publié une mise à jour de la recommandation publiée pour la première fois en 2001 concernant le diagnostic, la prise en charge et la prévention de la BPCO, avec quelques nouveautés essentielles. (1)
COPD is considered to be a popular disease. The global prevalence of COPD is 10.3%, with an upward trend due to the increase in the number of smokers in low- and middle-income countries (LMIC) and ageing in high-income countries. As in previous years, the Global Initiative for Chronic Obstructive Lung Disease (GOLD), has published an update of the recommendation published for the first time in 2001 concerning the diagnosis, management and prevention of COPD, with some essential new features.
Key Words: bronchopneumopathie chronique obstructive, GOLD, prévention
Entre autres, la définition de la maladie BPCO est adaptée pour prendre en compte du fait qu’ outre la fumée de tabac comme cause principale de la maladie, d’ autres mécanismes pathogéniques contribuent à la présentation clinique de la BPCO qui est une maladie très hétérogène.
La taxonomie adaptée comprend ce que l’ on appelle les étiotypes suivants de la BPCO:
– BPCO-G (genetique): BPCO déterminée génétiquement, par exemple déficience de l’ AA1AT BPCO-D (developement): causée par un développement pulmonaire anormal, par ex. naissance précoce
– BPCO-C (cigarette): due à l’ exposition à la fumée de tabac (cigarettes, exposition au tabagisme passif, vapotage/cigarette).
– BPCO-P (pollution): due à l’ exposition à des polluants (atmosphériques) provoque
– BPCO-I (infections): causée par des infections graves/répétées (dans la petite enfance) provoque
– BPCO-A (asthme): liée à l’ asthme et à l’ enfance
– BPCO-U (unknown) : maladie inconnue
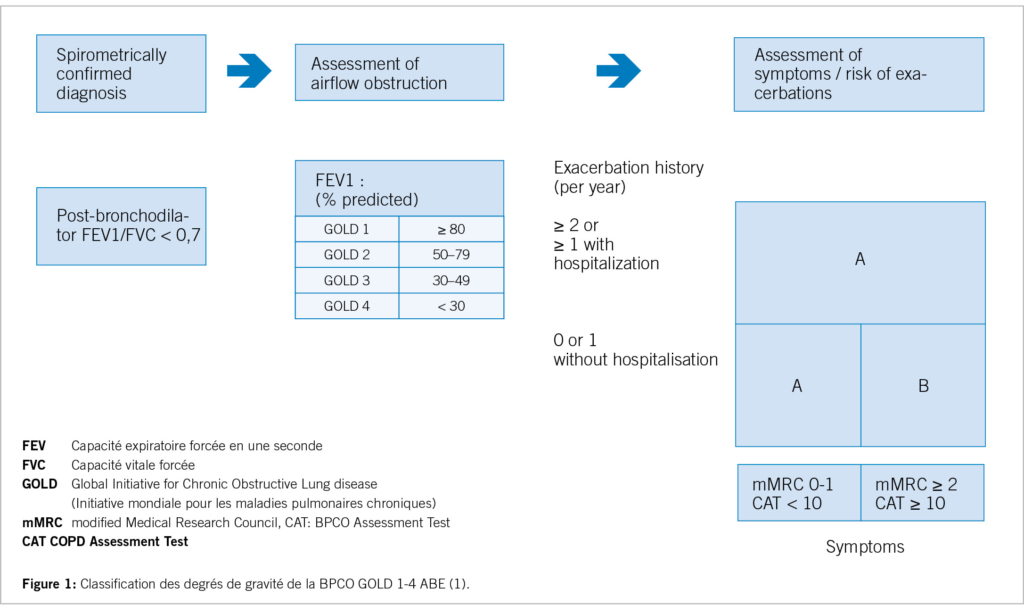
Le diagnostic de la BPCO doit être établi sur la base de l’ anamnèse, des symptômes cliniques, d’ un examen physique et d’ un examen spirométrique. Lors de la spirométrie, on considère toujours qu’ un taux du rapport postbronchodilatateur de VEMS/CVF (valeur de Tiffen-eau) inférieur à 70 % est un signe de trouble ventilatoire obstructif. Il convient cependant de noter que l’ utilisation d’ un taux fixe du rapport VEMS/CVF (inférieur à 70%) pour définir une obstruction mène a un sur-diagnostic chez les personnes âgées et un sous-diagnostic d’ un trouble respiratoire obstructif ou d’ une BPCO, en particulier en cas de maladie légère (2). Il est donc préférable d’ utiliser une valeur limite basée sur la limite inférieure des valeurs normales du VEMS/CVF (LLN : lower limit of normal).
De plus, il faut savoir qu’ une valeur VEMS abaissée (VEMS 1 inférieur à 80% de la valeur normale après bronchodilatation) avec une valeur de Tiffeneau en dessus de 70% de la valeur normale avec des troubles respiratoires peut être un signe précurseur de BPCO (PRISm: Preserved ratio impaired spirometry).
Ce groupe de patients présente également une probabilité plus élevée de comorbidités, en particulier de maladies cardiovasculaires et d’ une mortalité plus élevée, quel qu’ en soit la cause (3).
La classification des patients atteints de BPCO dans les degrés de gravité GOLD 1-4 continue de s’ effectuer en cas de limitation de la valeur de Tiffeneau inférieure à 0,7 ou 70 % selon le test de dilatation bronchique en fonction de la limitation de la capacité absolue en une seconde (GOLD 1 : moins de 80 % du volume cible VEMS 1 à GOLD 4 : moins de 30 % du volume cible VEMS 1).
En outre, en cas d’ incertitude diagnostique, le diagnostic fonctionnel pulmonaire étendu (ici surtout la pléthysmographie corporelle et la mesure de la capacité de diffusion) ainsi que des examens d’ imagerie, l’ échographie (cardiaque), la tomodensitométrie, l’ oxymétrie de pouls (également à l’ effort, p. ex. test de marche de six minutes)) sont recommandés.
Le CT thoracique doit être réalisé chez les patients présentant des exacerbations récurrentes (entre autres, question sur les bronchectasies), un VEMS inférieur à 45% (entre autres, question sur l’ hyperinflation/emphysème), des symptômes non proportionnels à la sévérité de la limitation de la capacité pulmonaire (entre autres, question sur la fibrose pulmonaire) et chez les patients qui répondent aux critères de dépistage du cancer du poumon (4).
Le GOLD souligne également l’ importance des comorbidités, comme par ex. maladies cardiovasculaires, le cancer du poumon, l’ ostéoporose, le reflux gastro-œsophagien, le diabète sucré, la dépression, les troubles anxieux et la sarcopénie qui ont une influence significative sur l’ évolution de la BPCO et le pronostic de la maladie.
Outre le tabagisme, une inflammation chronique dans l’ ensemble de l’ organisme est également soupçonnée d’ être à l’ origine des comorbidités (5).
En raison de l’ importance des exacerbations pour l’ évolution et le pronostic de la BPCO les degrés de sévérité C et D sont désormais regroupés en un seul degré de sévérité E qui, indépendamment de la sévérité des symptômes, doit être caractérisé par au moins deux exacerbations modérées, respectivement une exacerbation, mais qui conduit à une hospitalisation (figure 1).
Les symptômes doivent être évalués à l’ aide d’ un CAT (test d’ évaluation de la BPCO) ou du mMRC (modified Medical Research Council) et déterminent la classification dans le groupe A (peu de symptômes) ou B (symptômes sévères), s’ il n’ y a pas plus d’ une exacerbation modérée (sans hospitalisation) dans l’ année (6, 7).
Un nouvel aspect important est également la définition adaptée d’ une exacerbation.
Celle-ci se caractérise par une augmentation de la dyspnée et/ou de la toux avec expectoration en moins de 14 jours. Cela peut être accompagné d’ une tachypnée et/ou une tachycardie et est souvent associée à une augmentation d ’ une inflammation locale et d’ une inflammation systémique causée par des infections des voies respiratoires, la pollution de l’ air ou d’ autres irritations des voies respiratoires (8).
Les diagnostics différentiels importants en cas d’ exacerbation de la BPCO sont l’ embolie pulmonaire, la décompensation cardiaque, l’ infarctus du myocarde, la pneumonie et le pneumothorax (9).
Le pronostic à long terme d’ une exacerbation de la BPCO avec hospitalisation est mauvais, avec un taux de mortalité d’ environ 50 % à 3,6 ans. Les facteurs pronostiques indépendamment associés à une mauvaise évolution comprennent un âge plus élevé, un IMC plus faible, des comorbidités (par ex. maladies cardiovasculaires ou cancer du poumon), des hospitalisations antérieures pour exacerbation de la BPCO, la gravité clinique de l’ exacerbation et la nécessité d’ une oxygénothérapie à long terme au moment de la sortie.
Même si jusqu’ à 80 % de toutes les exacerbations peuvent être traitées en ambulatoire (médicamenteux avec des bronchodilatateurs, une thérapie de choc aux stéroïdes avec 40 mg de prednisone pendant 5 jours et des antibiotiques chez les patients présentant les trois symptômes cardinaux suivants : augmentation de la dyspnée, augmentation de la quantité de crachats et purulence des crachats) (10, 11), GOLD propose les critères suivants indications d’ hospitalisation en cas d’ exacerbation:
– Symptômes graves tels qu’ une augmentation aiguë de la dyspnée au repos, une fréquence respiratoire élevée, une mauvaise saturation en oxygène, nouvelle confusion
– Insuffisance respiratoire aiguë
– Nouvelle apparition de signes physiques tels qu’ une cyanose ou un œdème périphérique
– Absence de réponse au traitement médicamenteux initial de l’ exacerbation
– Comorbidités sévères telles qu’ insuffisance cardiaque ou apparition récente de troubles du rythme cardiaque
– Soins à domicile insuffisants.
La plupart des patients atteints de BPCO continuent à souffrir des conséquences de l’ exacerbation pendant plusieurs semaines et ne reviennent souvent jamais à leur ancien niveau clinique.
Un suivi clinique précoce devrait être effectué dans le mois suivant la sortie, de sortie et permet de réduire les rechutes ou les réexacerbations (1).
Le traitement de la BPCO stable est basé sur la symptomatologie et l’ expectoration historique des exacerbations avec une répartition dans les groupes de risque A, B et E et se divise en deux parties, d’ une part la recommandation thérapeutique initiale et d’ autre part le suivi du traitement. Le traitement de base de la BPCO consiste en principe en des bronchodilatateurs ; dans le groupe A GOLD recommande un bronchodilatateur à courte ou longue durée d’ action avec une préférence pour les préparations à longue durée d’ action, avec une certaine préférence pour les anticholinergiques. Dans les groupes B et E, le bronchodilatateur double (combinaison de LABA (long acting beta agonists) et LAMA (long acting muscarinic agonists)) est le traitement de choix.
La combinaison de LABA et d’ ICS (inhaled cortico steroid) n’ est en principe plus recommandée dans le traitement de la BPCO.
Si les ICS sont indiqués (voir graphique Critères de traitement par ISC), il convient d’ utiliser une triple combinaison de LABA, LAMA et ICS.
Le nombre de cellules éosinophiles dans l’ hémogramme différentiel (plus de 300 éosinophiles/µl) et l’ historique des exacerbations devraient servir de critères pour les ICS en tant que traitement supplémentaire dans le groupe E.
L’ administration à long terme de stéroïdes oraux/systémiques est contre-indiquée. Dans la situation de suivi, il est décisif de savoir si les patients souffrent davantage de symptômes ou si des exacerbations sont survenues entre-temps chez le patient sous traitement. En cas de traitement déjà en cours par une combinaison LABA/LAMA, une escalade avec des ICS est recommandée (combinaison LABA/LAMA/ICS = trithérapie), si le nombre d’ éosinophiles dans l’ hémogramme périphérique est supérieur à 100 cellules/µl. Il convient toutefois de noter qu’ un traitement stéroïdien systémique éventuellement administré au moment de l’ hémogramme peut masquer un nombre d’ éosinophiles supérieur à 100/µl.
Par rapport à un traitement combiné LAMA/LABA, le traitement par une trithérapie peut apporter un avantage significatif en termes de survie chez les patients symptomatiques qui présentent des exacerbations sous traitement de la maladie (12).
Les principes actifs combinés de manière fixe (appelés trithérapie fixe) offrent un avantage en termes de bénéfice maximal et d’ adhésion au traitement.
En principe, GOLD recommande d’ évaluer, de vérifier et de prendre en compte, avant/pour chaque changement de traitement, la symptomatologie et l’ historique des exacerbations, mais aussi la technique d’ inhalation et l’ observance du traitement, ainsi que les mesures non pharmacologiques telles que le sevrage tabagique ou les mesures de réhabilitations ambulatoires/stationnaires visant à augmenter l’ activité physique.
De plus, la vaccination contre la grippe, le SARS-CoV-2 et la vaccination contre les pneumocoques, la coqueluche et l’ herpès zoster est recommandée à tous les patients avec BPCO.
Enfin, pour une prise en charge optimale de nos patients atteints de BPCO, il est essentiel et indispensable d’ avoir la meilleure coopération possible entre les médecins de famille, les spécialistes, les physiothérapeutes, les nutritionnistes, les médecins de rééducation et, au stade final, les médecins palliatifs.
Copyright Aerzteverlag medinfo AG
LungenZentrum Hirslanden
Wittelikerstrasse 40
8032 Zurich
a.piecyk@lungenzentrum.ch
L’ auteur n’ a pas déclaré de conflits d’ intérêts en rapport avec cet article.
1. The Global Initiative for Chronic Obstructive Lung Disease, 2023 GOLD REPORT
2. Guder C. et al.: Gold or lower limit of normal definition? A comparison with expert based diagnosis of chronic obstructive pulmonary disease in a porspective cohort study. Respir Res 2012 Feb 6;13(1):1
3. Stolz D. et. al.: Towards the elimination of chronic obstructive pulmonary disease: a Lancet Commission. Lancet 2022 Sep 17;400(10356):921-972.
4. Galban C et. al.: Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med 2012 Nov;18(11):1711-5.
5. Fabbri L. M. et. al.: Complex chronic comorbidities of COPD. Eur Respir J 2008 Jan;31(1):204-12.
6. Fletcher CM: Standardised questionnaire on respiratory symptom: a statement prepared and approved by the MRC Committee on the Aetiology of Chronic Bronchitis (MRC breathlessness score). BMJ 196: 2: 1662.
7. Jones P.W. et al.: Development and first validation of the COPD Assessment Test. Eur Respir J 2009 Sep;34(3):648-54.
8. Celli R.B. et. al.: An Updated Definition and Severity Classification of Chronic Obstructive Pulmonary Disease Exacerbations: The Rome Proposal. Am J Respir Crit Care Med 2021 Dec 1;204(11):1251-1258.
9. Beghè B. et al.: Exacerbation of respiratory symptoms in COPD patients may not be exacerbations of COPD. Eur Respir J 2013 Apr;41(4):993-5.
10. Leuppi J.D. et. al.: Short-term vs Conventional Glucocorticoid Therapy in Acute Exacerbations of Chronic Obstructive Pulmonary DiseaseThe REDUCE Randomized Clinical Trial. JAMA. 2013;309(21):2223-2231.
11. Miravittles M. et. al.: Sputum colour and bacteria in chronic bronchitis exacerbations: a pooled analysis. Eur Respir J 2012 Jun;39(6):1354-60.
12. Martinez FJ, et al.: Reduced All-Cause Mortality in the ETHOS Trial of Budesonide/Glycopyrrolate/Formoterol for Chronic Obstructive Pulmonary Disease. A Randomized, Double-Blind, Multicenter, Parallel-Group Study. Am J Respir Crit Care Med 2021;203:553–564
la gazette médicale
- Vol. 12
- Ausgabe 7
- Dezember 2023