- Le traitement du psoriasis – quoi de neuf ?
Les avancées dans le domaine de la pathogénèse du psoriasis au cour de la dernière décennie, ont abouti au développement de nombreux nouveaux traitements biologiques, ciblant les étapes clés de la pathogenèse. Dans cette revue, nous analyserons le mécanisme d’ action, l’ efficacité et le profil de sécurité de ces nouveaux médicaments.
Le psoriasis est une dermatose auto-immune, chronique, qui peut être associée aux comorbidités systémiques, notamment l’ arthrite psoriasique ou un risque accru pour des évènements cardiovasculaires et qui affecte 2-3% de la population. La recherche au cours de la dernière décennie a permis de mieux comprendre le processus immunitaire impliqué et, en association avec les nouvelles technologies, le développement de thérapies ciblées aux étapes clés de la pathogenèse. Ces traitements ont changé radicalement la prise en charge de patients atteints de psoriasis modéré à sévère, notamment grâce à leur efficacité. Dans cette revue, nous analyserons le mécanisme d’ action, l’ efficacité et le profil de sécurité des nouveaux médicaments biologiques.
Pathogénèse
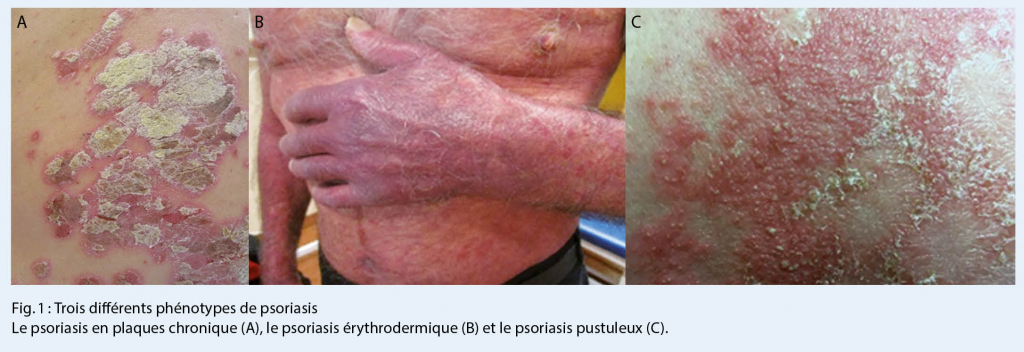
Le psoriasis est une maladie auto-immune, médiée par les cellules T et des cytokines pro-inflammatoires (1, 2). La majorité des patients souffre d’ un psoriasis en plaques. Les lésions typiques sont des plaques érythémato-squameuses, bien délimitées, qui peuvent couvrir de larges ou plus petites zones du corps (fig 1). Le modèle physiopathologique actuel propose que ce phénotype de psoriasis soit déclenché par des cellules dendritiques dermiques, qui sont activées et produisent des cytokines (Tumor nécrosis factor, TNF, et IL-23) et stimulent l’ activation de cellules CD4+ Th17 et CD8+ Tc17 (3). Une fois activées, ces lymphocytes T, migrent dans l’ épiderme, où ils reconnaissent des autoantigènes épidermiques, comprenant la kératine 7, le peptide antimicrobien LL37 et l’ antigène mélanocytaire ADAMTSL5, et produisent l’ IL-17 et l’ IL-22 (4-11). Les cytokines Th17 vont générer la réponse proliférative de kératinocytes et amplifier la réponse inflammatoire (par production de chémokines et de peptides antimicrobiens), ainsi établissant le phénotype psoriasique.
Le psoriasis pustuleux palmoplantaire (PPPP), le psoriasis pustuleux généralisé (PPG) et l’ acrodermatite continue de Hallopeau constituent un autre phénotype psoriasique, distinct du psoriasis en plaques, le psoriasis pustuleux (fig 1). Concernant ce phénotype, une autre voie inflammatoire a été récemment identifiée, impliquant des mutations de l’ antagoniste du récepteur de l’ IL-36 (IL-36RN) (12, 13), qui aboutissent à une signalisation accrue de l’ IL-36, et à une production accrue d’ IL-1 (14).
Concernant la phase précoce de psoriasis et les formes aiguës de la maladie, telles que le psoriasis érythrodermique et le psoriasis en gouttes, une autre voie inflammatoire qui est basée sur l’ expression de l’ interféron de type I (IFN-α) et a été récemment identifiée. Les cellules dendritiques plasmacytoïdes , une sous-population de cellules dendritiques, secrètent d’ importantes quantités d’ IFN de type I
dans la peau pré-psoriasique, et stimulent l’ activation chronique des cellules dendritiques dermiques (15). Cette voie inflammatoire, liée à l’ IFN de type I est dominante à la phase précoce de psoriasis et est par la suite remplacée dans les plaques chroniques par l’ inflammation liée aux TNF-IL-23-Th17 (16). L’ IFN de type I est également impliqué dans le psoriasis paradoxal, soit le psoriasis induit par les inhibiteurs du TNF-α. Des lésions psoriasiques aiguës peuvent survenir (paradoxalement) comme un effet indésirable chez 2 à 5% des patients sous traitement anti-TNF. Il a été récemment démontré que l’ IFN de type I est élevée en raison du blocage du TNF et que le psoriasis paradoxal est induit par les anti-TNF en l’ absence d’ auto-immunité médiée par les lymphocytes T (17). Le traitement anti-TNF utilisé doit être interrompu dans le psoriasis paradoxal et, si possible, remplacé par un traitement anti-IL-12/23 ou anti-IL-17.
Donc, il existe au moins trois voies inflammatoires distinctes qui peuvent conduire à des phénotypes cliniques distincts dans le psoriasis : les plaques chronique de psoriasis par TNF, le psoriasis pustuleux via IL-36/IL-1 et le psoriasis aigu via l’ IFN de type I.
Cependant, ces voies inflammatoires peuvent coexister et varier dans le temps, chez le même patient.
Thérapies ciblées (traitements biologiques et petites molécules)
La morbidité du psoriasis s’ évalue par des échelles. Un indice qui mesure l’ atteinte et l’ activité de la maladie (PASI : Psoriasis Area and Severity Index) est l’ outil le plus largement utilisé pour la mesure de la sévérité du psoriasis. PASI combine l’ évaluation de la sévérité des lésions et de la zone affectée en un score unique compris entre 0 (pas de maladie) et 72 (maladie sévère). Cet indice sert également à décrire l’ efficacité d’ un traitement. Une réponse PASI 75 / 90 / 100 correspond à une réduction du score PASI de 75 / 90 / 100%.
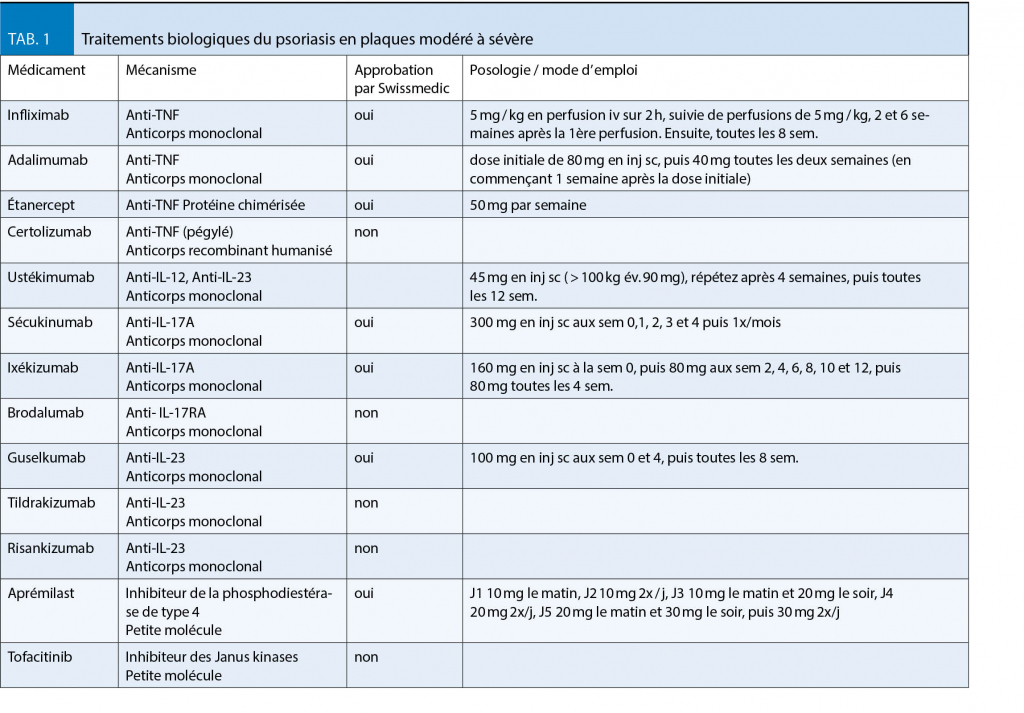
Anti-TNF : Il y a actuellement trois inhibiteurs du TNF-α qui font partie de l’ arsenal thérapeutique disponible dans le psoriasis modéré à sévère : des anticorps monoclonaux, l’ infliximab (Remicade®) ou l’ adalimumab (Humira®), ou une protéine chimérisée avec le récepteur soluble au TNF (aussi appelée immunoadhésine), l’ etanercept (Enbrel®). Ces médicaments montrent des taux de réponse différents dans le psoriasis, avec l’ infliximab étant la plus efficace (une réponse PASI 75 chez 80% des patients et PASI 90 chez 54%) (18). Un quatrième inhibiteur du TNF, le certolizumab (Cimzia®), qui est pégylé, initialement approuvé pour la maladie de Crohn et l’ arthrite psoriasique est actuellement en phase 3 d’ essais cliniques pour psoriasis. En essai clinique de phase 2, le certolizumab a montré une réponse PASI 75 à 83% des patients (19).
Inhibiteur des interleukines IL-12/IL-23 p 40 : L’ ustékinumab (Stelara®) est un anticorps monoclonal dirigé contre les interleukines 12 et 23 (via la sous-unité commune, p 40). L’ ustékinumab a montré une réponse PASI 75 chez 69% à 90 mg et 75% à 45 mg et une réponse PASI 90 chez 39% à 90 mg et 46% à 45 mg (18).
Thérapies ciblées IL-17 : Il s’ agit des anticorps monoclonaux ciblant l’ IL-17A (sécukinumab et ixékizumab) ou son récepteur (brodalumab). Le sécukinumab (Cosentyx®) a montré une réponse PASI 75 chez 81.6% et une réponse PASI 100 chez 28.6% des patients dans 12 semaines de traitement (20). Sécukinumab montre une réponse thérapeutique très rapide et le résultat peut être maintenue pendant une longue période chez un nombre significatif de patients ayant interrompu leur traitement (21% des patients ont maintenu leur réponse après 1 an et 10% après 2 ans) (21, 22). L’ixékizumab (Taltz®) a montré une réponse PASI 75 chez 89.1% et une réponse PASI 100 chez 35.3% des patients après 12 semaines de traitement (23). Les deux se sont montrés également très efficaces pour le traitement du psoriasis du cuir chevelu et des ongles (24-26). Le brodalumab n’ est pas disponible en Suisse.
Thérapies spécifiques IL-23 : Des agents se sont développés qui lient la sous-unité p19, inhibant seulement l’ IL-23 et pas l’ IL-12 (27, 28). Le guselkumab (Tremfya®), qui a été dernièrement ap-prouvé par Swissmedic, est un anticorps monoclonal dirigé contre l’ interleukine 23 et a montré une réponse PASI 75 chez 85.1% et une réponse PASI 90 chez 73.3% des patients, après 16 semaines de traitement (29). Le tildrakizumab et le risankizumab ne sont pas encore disponibles en Suisse.
Thérapies ciblées IL-36-IL-1 : Sur la base de l’ identification de la voie IL-36-IL-1 dans le psoriasis pustuleux et des cas de rémission rapide après traitement par l’ antagoniste du récepteur de l’ IL-1, l’anakinra, des essais randomisés, contrôlés contre placebo, sont en cours aux Etats-Unis et au Royaume-Uni et un anticorps contre l’ IL-36 (ANB019) a été développé pour le traitement du psoriasis pustuleux généralisé (études de phase 1).
Thérapies ciblées de l’ IFN type I : le rôle primordial de l’ IFN de type I dans les formes aiguës de psoriasis, y compris le psoriasis érythrodermique et le psoriasis en gouttes, justifie le développement d’ approches thérapeutiques ciblant cette voie. Des anti-IFN-α
et antagonistes du récepteurs α/β de l’ IFN sont actuellement développés et testés dans des essais cliniques pour des maladies autoimmunes telles que le lupus.
Petites molécules : Les avantages des petites molécules par rapport aux traitements biologiques sont le fait qu’ elles peuvent diffuser dans la cellule et cibler les voies de signalisation intracellulaires, qu’elles peuvent être administrées per os et qu’elles sont moins coûteuses. Cependant, les thérapies à petites molécules ont aussi l’ inconvénient d’ avoir une sélectivité de la cible inférieure et d’ exercer des effets hors cible, ainsi qu’ une efficacité plus faible. L’ aprémilast (Otezla®) est un inhibiteur à petites molécules de la phosphodiestérase 4 (PDE4) pris par voie orale, qui est indiqué pour le traitement des patients at-teints de psoriasis en plaques ou d’ une arthrite psoriasique. L’aprémilast n’a montré qu’ une réponse PASI 75 chez 33.1% des patients, après 16 semaines de traitement (30), mais semble être efficace pour le psoriasis palmoplantaire, du cuir chevelu et des ongles (31, 32) et ne nécessite aucune surveillance. Le tofacitinib (Xeljanz®) est un inhibiteur sélectif de la famille des JAK kinases, administré par voie orale. Actuellement, il est indiqué chez les patients atteints d’ une polyarthrite rhumatoïde. Dans les essais cliniques, tofacitinib a montré une réponse PASI 75 chez 59% et PASI 90 chez 39% des patients, à 16 semaines.
Sécurité des thérapies
Il y existe maintenant plusieurs rapports de sécurité à long terme d’ agents biologiques utilisés dans le traitement du psoriasis. Beaucoup d’ entre eux sont des rapports provenant de grands registres prospectifs multicentriques, tels que le Psoriasis Longitudinal Assessment and Registry (PSOLAR), évaluant la sécurité des traitements systémiques conventionnels et des agents biologiques (33).
Réactions allergiques et réactions sur site d’ injection : Des réactions bénignes au site d’ injection, des éruptions cutanées non spécifiques, de la cellulite et des réactions d’ hypersensibilité sont des événements indésirables relativement fréquents. Une grande variété de réactions cutanées causées par des agents biologiques ont été rapportées, allant de réactions bénignes et réversibles au site d’ injection à des réactions allergiques, nécessitant l’ arrêt de l’ agent biologique impliqué (34).
Risque d’ infection : Les données de PSOLAR ont montré que, dans leur ensemble, les produits biologiques n’ augmentent pas le risque d’ infection par rapport aux agents non biologiques. Cependant, lorsque que chaque agent biologique a été examiné séparément, des taux plus élevés des infections graves ont été observés dans les groupes infliximab (2,49 pour 100 patients/années) et adalimumab (1,97) que dans ceux sous étanercept (1,47), ustékinumab (0,83), ou des agents non biologiques (< 1,30) (35). Le TNF-α est une molécule clé dans la formation des granulomes impliqués dans le contrôle des infections par mycobactéries. Les traitements immunosuppresseurs sont associés à un risque accru de réactivation de la tuberculose, conduisant dans la plupart des cas à une maladie disséminée ou extrapulmonaire. Ainsi, le dépistage de la tuberculose est devenu obligatoire avant le traitement avec des médicaments biologiques et une chimioprophylaxie est nécessaire en cas de dépistage positif. D’ autre part, IL-17 joue un rôle important dans la surveillance immunitaire à la barrière cutanéomuqueuse des voies respiratoires et gastro-intestinales ainsi que de la peau (36, 37). Donc, les infections à Candida sont plus fréquentes sous ce traitement (38). Ces infections étaient toutes non graves et n’ ont pas nécessité l’ interruption du traitement (39). En cas d’ infection chronique connue, et si les dermocorticoïdes ne sont pas suffisants, la photothérapie, l’ acitretin ou l’ aprémilast sont proposés.
Risque oncologique : Les anti-TNF sont liés à un risque légèrement accru de cancers cutanés non mélanocytaires et possiblement après une longue exposition (> 12 mois) à une augmentation globale des taux de malignité (40, 41). Plus de données sont nécessaires pour confirmer ces résultats. Chez des patients avec des antécédents de malignité, la photothérapie, le méthotrexate, l’ acitrétine et l’ aprémilast devraient être favorisés. Cependant, il ne s’ agit pas d’ une contre-indication absolue à la thérapie biologique. Les traitements biologiques doivent être évités chez les patients atteints de tumeurs malignes actives ou de lymphomes. Concernant les autres tumeurs, un intervalle de cinq ans de rémission doit être respecté.
Risque cardiovasculaire : Dans des essais cliniques de phase précoce, l’ ustékinumab a présenté un risque accru d’ événements cardiovasculaires indésirables majeurs, fait qui n’ a pas pu être confirmé dans de plus grands essais (42) et l’ analyse des données PSOLAR n’ a pas montré de risque statistiquement significatif des événements cardiovasculaires majeurs avec l’ un des agents biologiques (43). Des études chez des souris ont montré que la signalisation du TNF-α joue un rôle régulateur crucial dans la régénération musculaire cardiaque (44). Les anti-TNF doivent donc être évités en cas d’ insuffisance cardiaque sévère. Cependant, les anti-TNF inhibitors, le méthotrexate et la photothérapie diminuent le risque cardiovasculaire en diminuant l’ inflammation au niveau cutané.
Risque neurologique : Des maladies démyélinisantes du système nerveux central ou périphérique, comme la sclérose en plaques, ont été signalées sous traitement anti-TNF, même si elles sont extrêmement rares (45). De plus dans certains cas les tentatives de traitement de la sclérose en plaques avec des inhibiteurs du TNF ont augmenté l’ activité de la maladie (46). La survenue de symptômes évocateurs nécessite donc impérativement l’ arrêt du traitement qui est contre-indiqué chez les patients ayant un antécédent personnel d’ une maladie démyélinisant. Néanmoins, comme il reflète un événement rare, l’ association causale entre l’ inhibition du TNF et la sclérose en plaques reste à prouver.
Effets secondaires immunologiques : le traitement anti-TNF peut aggraver des maladies préexistantes ou induire de nouvelles maladies auto-immunes, telles que le lupus érythémateux et le psoriasis paradoxal (47). Ces effets secondaires sont spécifiques de l’ inhibition du TNF et proviennent d’ un déséquilibre entre le TNF et les interférons de type I. En outre, touts les traitements anti-TNF peuvent induire des anticorps antinucléaires chez des patients atteints d’ arthrite psoriasique et/ou de psoriasis, sans conséquences cliniques dans la majorité des cas (48).
Effets secondaires gastroentérologiques : Des perturbations des tests hépatiques ont été décrites, donc un contrôle des tests hépatiques est recommandé avant l’ introduction d’ un traitement biologique. La réactivation des infections d’ hépatite B a été rapportée avec les anti-TNF (fatale chez certains patients). Pour cette raison ils sont donc contre-indiqués chez les patients atteints d’ hépatite B non traitée. Il n’ y a pas d’ évidence de réactivation ou de péjoration en cas d’ hépatite C chronique (49). Parmi les agents biologiques, le blocage de l’ IL-17 ou de l’ IL-12 / IL-23 pourrait en général présenter un meilleur profil d’ innocuité que les anti-TNF concernant leur utilisation chez les patients atteints d’ hépatite virale. La survenue ou l’ aggravation d’ une maladie inflammatoire intestinale a été rapportée chez des patients atteints de psoriasis traités par des inhibiteurs de l’ IL17 (50, 51). Chez les patients souffrant d’ une maladie intestinale inflammatoire anamnéstique ou active, d’ autres options de traitement, surtout des anticorps anti-TNF ou de l’ ustékinumab montrant un effet positif sur la maladie inflammatoire de l’ intestin, doivent être considérées en premier.
Perspectives
Vers un traitement personnalisé du psoriasis
Actuellement, le choix du traitement est basé sur le profil de sécurité du traitement, les comorbidités du patient et l’ indication au traitement. Cependant, les récentes découvertes du transcriptome et de la génétique indiquent des voies inflammatoires supplémentaires et suggèrent qu’ une meilleure caractérisation moléculaire et qu’une stratification clinique de la maladie peuvent nous aider à déterminer si un patient est plus susceptible de répondre à un produit biologique donné. Un exemple vient d’ une étude récente, qui a évalué l’ association entre les polymorphismes LCE3B, HLA-Cw6 et TNFAIP3 et la réponse du traitement aux agents biologiques (52): l’ étude a montré que les patients HLA-Cw6-positifs répondaient mieux et plus rapidement à l’ ustékinumab et que TNFAIP3 était associé à une meilleure réponse à l’ inhibition du TNF. Comme HLA-Cw6 est exprimé chez 90% des patients de type 1 (psoriasis précoce, avant l’ âge de 40 ans), cette étude suggère que l’ ustékinumab devrait être utilisé de préférence chez ce type de patient.
En plus de la découverte de biomarqueurs et du développement de traitements personnalisés, le domaine du psoriasis progresse rapidement grâce aux découvertes scientifiques et au développement de nouvelles technologies pharmaceutiques. Un domaine de recherche émergeant se concentre sur les altérations du microbiome (appelé dysbiose) dans la peau psoriasique (54). L’ un des principaux progrès récents dans le domaine des modalités thérapeutiques a été la conception d’ anticorps multi-spécifiques, qui ciblent au moins deux épitopes. Des anticorps bispécifiques qui bloquent à la fois le TNF-α et l’ IL-17 ont été développés et sont actuellement testés dans des essais de phase 1 / 2 pour le psoriasis (ClinicalTrials.gov Identifier: NCT02243787). Plus récemment, la technologie de génération d’ anticorps trispécifiques a été développée (55). Une autre question est de savoir si la génétique pourra prédire le psoriasis et donc permettre une intervention thérapeutique précoce. Actuellement, plus que 40 loci de susceptibilité ont été identifiés, mais l’ effet de taille de chaque variantes est trop petit pour expliquer l’ hérédité. Un certain nombre d’ études ont toutefois suggéré que la combinaison de plusieurs variantes génétiques pourrait permettre de calculer un score de risque génétique pouvant prédire le développement du psoriasis (56, 57). La capacité de guérir ou de prévenir le psoriasis reste le défi majeur pour le futur.
Service de dermatologie et vénéréologie
Hôpital de Beaumont
Avenue de Beaumont 29
1011 Lausanne
Curdin.Conrad@chuv.ch
- Le psoriasis, une dermatose auto-immune, chronique, peut être associé aux comorbidités systémiques, et affecte 2-3% de la population.
- Les nouvelles thérapies biologiques et aux petites molécules ciblent les étapes clés de la pathogenèse.
- Un domaine de recherche dans la peau psoriasique émerge sur les altérations du microbiome.
- Des anticorps multi-spécifiques ciblant au moins deux épitopes présentent un des principaux progrès récents et la technologie de génération d’ anticorps trispécifiques a été développée.
- Savoir si la génétique pourra prédire le psoriasis permettrait une intervention thérapeutique précoce.
Références
1. Lowes MA et al. Immunology of psoriasis. Annu Rev Immunol 2014;32(1):227–255. https://doi.org/10. 1146/annurev-immunol-032713-120225
2. Tonel G, Conrad C. Interplay between keratinocytes and immune cells—recent insights into psoriasis pathogenesis. Int J Biochem Cell Biol 2009;41(5):963–968. https://doi.org/10.1016/j. biocel.2008.10.022
3. Conrad C, Gilliet M. Psoriasis: from Pathogenesis to Targeted Therapies. Clinic Rev Allerg Immunol 2018;54:102-13
4. Aggarwal S et al. Interleukin-23 promotes a distinct CD4 T cell activation state characterized by the production of interleukin-17. J Biol Chem 2003;278(3):1910–1914. https://doi.org/10.1074/jbc. M207577200
5. Hijnen D et al. CD8(+) T cells in the lesional skin of atopic dermatitis and psoriasis patients are an important source of IFN-gamma, IL-13, IL-17, and IL-22. J Invest Dermatol 2013;133(4):973–9. https://doi.org/10.1038/jid.2012.456
6. Di Meglio P et al. Targeting CD8(+) T cells prevents psoriasis development. J Allergy Clin Immunol 2016;138(1):274–276 e276. https://doi.org/10.1016/j.jaci.2015.10.046
7. Boyman O et al. Spontaneous development of psoriasis in a new animal model shows an essential role for resident T cells and tumor necrosis factor-alpha. J Exp Med 2004;199(5):731–6. https://doi.org/10. 1084/jem.20031482
8. Conrad C et al. Alpha1beta1 integrin is crucial for accumulation of epidermal T cells and the development of psoriasis. Nat Med 2007;13(7):836–842. https://doi.org/10.1038/nm1605
9. Cheuk S et al. Epidermal Th22 and Tc17 cells form a localized disease memory in clinically healed psoriasis. J Immunol 2014;192(7): 3111–3120. https://doi.org/10.4049/jimmunol.1302313
10. Lande R, Botti E, Jandus C, Dojcinovic D, Fanelli G, Conrad C, Chamilos G, Feldmeyer L, Marinari B, Chon S et al. The antimicrobial peptide LL37 is a T- cell autoantigen in psoriasis. Nat Commun 2014;5:5621. https://doi.org/ 10.1038/ncomms6621
11. Arakawa A et al. Melanocyte antigen triggers autoimmunity in human psoriasis. J Exp Med 2015;212(13):2203–12. https://doi.org/10.1084/jem. 20151093
12. Marrakchi S et al. Interleukin-36-receptor antagonist deficiency and gener- alized pustular psoriasis. N Engl J Med 2011;365(7):620–8. https://doi. org/10.1056/NEJMoa1013068
13. Onoufriadis A et al. Mutations in IL36RN/IL1F5 are associated with the severe episodic inflammatory skin disease known as generalized pustular psoriasis. Am J Hum Genet 2011;89(3): 432–7. https://doi.org/10.1016/j.ajhg.2011.07.022
14. Setta-Kaffetzi N et al.Rare pathogenic variants in IL36RN underlie a spectrum of psoriasis-associated pustular phenotypes. J Invest Dermatol 2013;133(5):1366–9. https://doi.org/10.1038/jid.2012.490
15. Nestle FO et al. Plasmacytoid predendritic cells initiate psoriasis through interferon-alpha production. J Exp Med 2005;202(1):135–43. https://doi.org/10.1084/jem.20050500
16. Conrad C et al. Plasmacytoid dendritic cells in the skin: to sense or not to sense nucleic acids. Semin Immunol 2009;21(3):101–9. https://doi.org/10.1016/j.smim.2009.01.004
17. Conrad C et al. TNF block- ade induces a dysregulated type I IFN response without autoimmunity in paradoxical psoriasis. Nat Commun 2018 Jan 2;9(1):25
18. Reich K et al. Efficacy of biologics in the treatment of moderate to severe psoriasis: a network meta-analysis of randomized controlled trials. Br J Dermatol 2012;166(1):179–88. https://doi.org/10.1111/j.1365-2133.2011.10583. x
19. Reich K et al. Successful treatment of moderate to severe plaque psoriasis with the PEGylated Fab’ certolizumab pegol: results of a phase II randomized, placebo-controlled trial with a retreatment extension. Br J Dermatol 2012;167(1):180–90. https://doi.org/10.1111/ j.1365-2133.2012.10941.x
20. Langley RG et al. Secukinumab in plaque psoriasis–results of two phase 3 trials. N Engl J Med 2014;371(4):326–38. https://doi.org/10.1056/NEJMoa1314258
21. Thaci D et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate to severe plaque psoriasis: CLEAR, a randomized controlled trial. J Am Acad Dermatol 2015;73(3):400–9. https://doi.org/10. 1016/j.jaad.2015.05.013
22. Lebwohl M et al. Long-term psoriasis control following secukinumab discontinuation indicated disease modification of moderate to severe psoriasis. Presented at: 13th Annual Maui Derm for Dermatologists 20- 24th March, 2017
23. Gordon KB et al. Phase 3 trials of Ixekizumab in moderate-to- severe plaque psoriasis. N Engl J Med 2016;375(4):345–356. https:// doi.org/10.1056/NEJMoa1512711
24. Bagel J et al. The effect of secukinumab on moderate-to-severe scalp psoriasis: results of a 24-week, randomized, double-blind, placebo-controlled phase 3b study. J Am Acad Dermatol 2017;77(4):667–74. https://doi.org/10. 1016/j.jaad.2017.05.033
25. Reich K et al. Secukinumab shows high and sustained efficacy in nail psoriasis: Week 80 results from the TRANSFIGURE study. Presented at: American Academy of Dermatology 2017 Annual Meeting Orlando, FL, March 3-7, 2017
26. Langley RG et al.Improvement of scalp and nail lesions with ixekizumab in a phase 2 trial in patients with chronic plaque psoriasis. J Eur Acad Dermatol Venereol 2015;29(9):1763–70. https://doi.org/10.1111/jdv.12996
27. Tonel G et al. Cutting edge: a critical functional role for IL-23 in psoriasis. J Immunol 2010;185(10):5688–91. https:// doi.org/10.4049/jimmunol.1001538
28. Kopp T et al. Clinical improve- ment in psoriasis with specific targeting of interleukin-23. Nature 2015;521(7551):222–6. https://doi.org/10.1038/nature14175
29. Blauvelt A et al. Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the continuous treatment of patients with moderate to severe psoriasis: results from the phase III, double-blinded, placebo- and active comparator-controlled VOYAGE 1 trial. J Am Acad Dermatol 2017;76(3):405–17. https://doi.org/10.1016/j.jaad. 2016.11.041
30. Bissonnette R et al. Apremilast for the treatment of moderate to severe palmoplantar psoriasis: results from a double-blind, placebo-controlled, randomized study. J Eur Acad Dermatol Venereol 2018;32(3):403-10. https://doi.org/10.1111/jdv.14647
31. Rich P et al. Apremilast, an oral phosphodiesterase 4 inhibitor, in patients with difficult-to-treat nail and scalp psoriasis: results of 2 phase III randomized, controlled trials (ESTEEM 1 and ESTEEM 2). J Am Acad Dermatol 2016;74(1):134–42. https://doi.org/10.1016/j. jaad.2015.09.001
32. Papp K et al. Safety surveillance for Ustekinumab and other psoriasis treatments from the Psoriasis Longitudinal Assessment and Registry (PSOLAR). J Drugs Dermatol 2015;14(7):706–14
33. Otani IM et al. Cutaneous Manifestations of Reactions to Biologics. Curr Allergy Asthma Rep. 2018;18(2):12. doi: 10.1007/s11882-018-0764-z
34. Kalb RE et al. Risk of serious infection with biologic and systemic treatment of psoriasis: results from the Psoriasis Longitudinal Assessment and Registry (PSOLAR). JAMA Dermatol 2015;151(9):961–9. https://doi.org/10.1001/jamadermatol. 2015.0718
35. Cantini F et al. Risk of tuberculosis reactivation in patients with rheumatoid arthritis, ankylosing spondylitis, and psoriatic arthritis receiving non-anti-TNF-targeted biologics. Mediat Inflamm 2017:8909834. https://doi.org/10.1155/2017/8909834
36. Puel A et al. Chronic mucocutaneous candidiasis in humans with inborn errors of interleukin-17 immu- nity. Science 2011; 332(6025):65–8. https://doi.org/10.1126/science. 1200439
37. Langley RG et al. Secukinumab in plaque psoriasis–results of two phase 3 trials. N Engl J Med 2014;371(4):326–38. https://doi.org/10.1056/NEJMoa1314258
38. Conrad C et al. Secukinumab-treated subjects experience low rates of Candida and recurrent Candida infections: a pooled analysis from 10 phase 2 and 3 clinical studies in psoriasis. Presented at American Academy of Dermatology 2016 Annual Meeting, Washington, DC, 4-8th March, 2016
39. Burmester GR et al. Adalimumab: long-term safety in 23 458 patients from global clinical trials in rheumatoid arthritis, juvenile idiopathic arthritis, ankylosing spondylitis, psoriatic arthritis, psoriasis and Crohn’ s disease. Ann Rheum Dis 2013;72(4):517–24. https://doi.org/ 10.1136/annrheumdis-2011-201244
40. Fiorentino D et al. Risk of malignancy with systemic psoriasis treatment in the Psoriasis Longitudinal Assessment Registry. J Am Acad Dermatol 2017;77(5):845–54 e845. https://doi.org/10.1016/j.jaad.2017.07.013
41. Ryan C et al. Association between biologic therapies for chronic plaque psoriasis and cardiovascular events: a meta-analysis of randomized controlled trials. JAMA 2011;306(8):864–71. https://doi.org/10.1001/ jama.2011.1211
42. Bissonnette R et al. Evaluation of risk of major adverse cardiovascular events with biologic therapy in patients with psoriasis. J Drugs Dermatol 2017; 16(10):1002–13
43. Chen SE et al. Role of TNF-{alpha} signaling in regeneration of cardiotoxin-injured muscle. Am J Physiol Cell Physiol 2005;289:C1179–87
44. Zhu TH et al. Demyelinating disorders secondary to TNF-inhibitor therapy for the treatment of psoriasis: A review. J Dermatolog Treat 2016;27(5):406-13. doi: 10.3109/09546634.2015.1136385
45. TNF neutralization in MS: results of a randomized, placebo- controlled multicenter study. The Lenercept Multiple Sclerosis Study Group and the University of British Columbia MS/MRI Analysis Group. Neurology 1999;53 (3):457–65
46. Conrad C et al. TNF blockade induces a dysregulated type I IFN response without autoimmunity in paradoxical psoriasis. Nat Commun 2018;9:25. https://doi.org/10.1038/ s41467-017-02466-4
47. Pirowska MM et al. Autoimmunogenicity during anti-TNF therapy in patients with psoriasis and psoriatic arthritis. Postepy Dermatol Alergol 2015;32(4):250-4. doi: 10.5114/pdia.2015.53320
48. Iannone F et al. Safety of etanercept and methotrexate in patients with rheumatoid arthritis and hepatitis C virus infection: a multicenter randomized clinical trial. J Rheumatol 2014;41(2):286-92
49. Blauvelt A. Safety of secukinumab in the treatment of psoriasis. Expert Opin Drug Saf 2016;15(10):1413–1420. https://doi.org/10. 1080/14740338.2016.1221923
50. Reich K et al. Inflammatory bowel disease among patients with psoriasis treated with ixekizumab: a presentation of adjudicated data from an integrated database of 7 randomized controlled and uncontrolled trials. J Am Acad Dermatol 2017;76(3):441–448 e442. https://doi. org/10.1016/j.jaad.2016.10.027
51. Talamonti M et al. Pharmacogenetics of psoriasis: HLA-Cw6 but not LCE3B/3C deletion nor TNFAIP3 polymorphism predisposes to clinical response to interleukin 12/23 blocker ustekinumab. Br J Dermatol 2013;169(2):458–63. https://doi.org/10. 1111/bjd.12331
52. Langan EA et al. The role of the microbiome in psoriasis: moving from disease description to treatment prediction? Br J Dermatol 2018;178(5):1020-27. https://doi.org/10.1111/bjd.16081
53. Dimasi N et al. Development of a trispecific antibody designed to simultaneously and efficiently target three different antigens on tumor cells. Mol Pharm 2015;12(9):3490–3501. https://doi.org/10.1021/acs. molpharmaceut.5b00268
54. Kisiel B et al. The association between 38 previously reported polymorphisms and psoriasis in a Polish population: high predicative accuracy of a genetic risk score combining 16 loci. PLoS One 2017;12(6):e0179348. https://doi.org/10.1371/journal.pone. 0179348
55. Yin X et al. A weighted polygenic risk score using 14 known susceptibility variants to estimate risk and age onset of psoriasis in Han Chinese. PLoS One 2015;10(5):e0125369. https://doi.org/10.1371/journal.pone.0125369
la gazette médicale
- Vol. 8
- Ausgabe 1
- Januar 2019