- Les inhibiteurs de SGLT2 et les GLP1-RA en hépatologie
Le traitement antidiabétique moderne avec un SGLT2-I. et/ou un GLP1-RA, en plus de son effet cardioprotecteur et rénoprotecteur a également un effet hépatoprotecteur très prometteur. Ce dernier en cas de stéatose hépatique non alcoolique ou d’hépatopathie, respectivement stéatohépatite, désigné jusqu’à présent par NAFL ou NASH. Le GLP1-RA et d’autres nouveaux agonistes des récepteurs hormonaux entraînent une perte de poids significative de ≥10-15% du poids corporel et réduisent le risque de stéatose hépatique et d’autres maladies secondaires. Sous ces médicaments la stéatose hépatique et la stéatohépatite sont réversibles.
Modern antidiabetic therapy with an SGLT2-H. and/or a GLP1-RA has a very promising hepato-protective effect in addition to the cardio- and renoprotective effect. The latter in the case of non-alcoholic fatty liver or steatohepatitis; previously referred to as NAFL or NASH. GLP1-RA and other new hormone receptor agonists lead to a significant weight reduction of ≥10-15% of body weight and reduce the risk of steatotic liver disease and its sequelae. Hepatic steatosis and steato-hepatitis are reversible with these drugs.
Key Words: Non-alcoholic fatty liver disease, NAFLD/NASH, MASLD/MASH, SGLT2-I., GLP1-RA,cardiovascular disease, adiposity
Cet article est un complément aux deux publications sur les inhibiteurs de SGLT2 en cas d’insuffisance cardiaque et rénale (1,2) et se base sur une conférence en ligne récente de Diabetes Live (Streamed up) du novembre 2023.
Depuis le congrès de l’EASL de 2023, les termes “NAFL” et “NASH” sont remplacés par les termes MASLD et MASH (metabolic dysfunction associated steatotic liver disease ou metabolic dysfunction associated steatotic liver disease, associated steatohepatitis) seront utilisés. Le nouveau terme MASLD montre l’étroite interconnexion des facteurs hépatiques et métaboliques de la maladie. De plus, cela met en évidence la nécessité d’une prise en charge interdisciplinaire par des hépatologues et des spécialistes du métabolisme.
La nouvelle nomenclature comprend également la SLD/Steatotic Liver Disease comme terme générique, ALD/Alcoholic associated Liver Disease MetALD/MASLD + consommation d’alcool >10 ou 20 g/jour. Il y a aussi une aetiologie spécifique SLD (médicaments, virus, auto-immune, etc.) et une SLD cryptogénique (3).
La stéatose hépatique non alcoolique (NAFLD/MASLD) a une prévalence (DT2) allant jusqu’à 70%, une stéatohépatite (NASH/MASH) jusqu’à 40% et une maladie hépatique avancée jusqu’à 20%. On parle de MASLD lorsque chez les personnes atteintes de stéatose hépatique, au moins un des cinq facteurs de risque cardiométabolique sont présents. Il s’agit du pré-diabète, de l’obésité, de l’hypertension, de l’augmentation des triglycérides et du cholestérol LDL. Il est rare qu’une NAFL survienne chez des personnes minces. (génétique, effet secondaire de l’ immunothérapie).
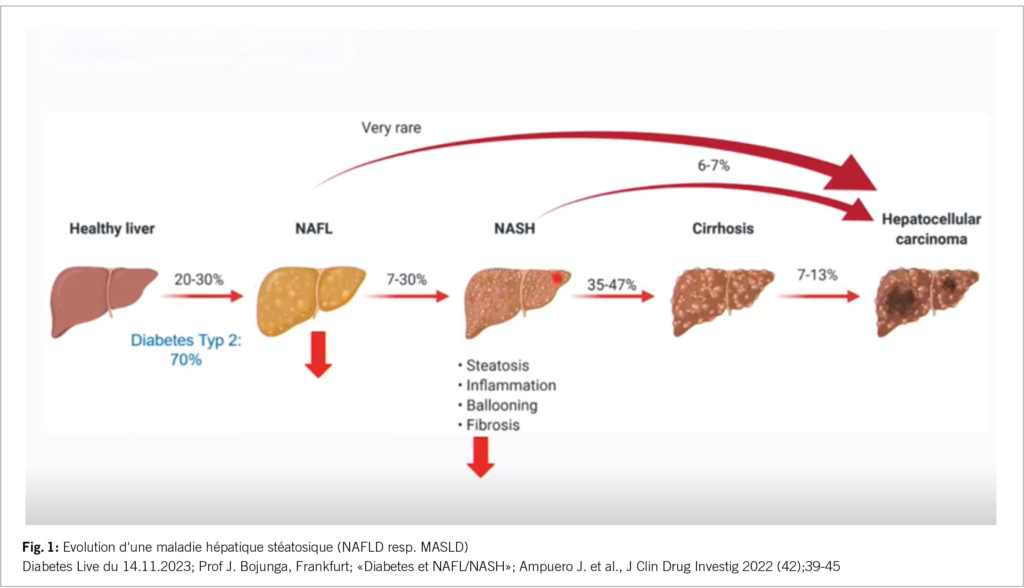
L’échographie du foie doit être utilisée comme imagerie diagnostique. Elle n’est cependant pas assez sensible pour détecter une stéatose hépatique. mais elle est très spécifique en cas de teneur élevée en graisse (>25%) lors de la mise en évidence d’un modèle échogène du foie comparé à celui du parenchyme du rein droit. Une échographie entre la NAFL et la NASH n’est pas possible – cf. Figure 1. Les transaminases AST/GOT et L’ALT/la GPT ne peuvent pas être utilisées avec certitude pour détecter une stéatose hépatique. Elles ne sont élevées que dans 6 et 10% des cas. Le Fatty-Liver Index (FLI) est utile avec une sensibilité et une spécificité élevées pour une stéatose hépatique pour une teneur en graisse >25%. Il peut être calculé à partir de l’IMC, du tour de taille, de la y-GT et des triglycérides. Plus le taux de graisse dans le foie, plus le risque cardiovasculaire (cv) est élevé (4). Le rapport de risque correspondant pour le décès cardiovasculaire, l’infarctus du myocarde non létal et l’accident vasculaire cérébral ischémique était de 1,98 chez des personnes auparavant en bonne santé. Le FLI est un marqueur de surrogat de la NAFLD, et a une valeur pronostique pour l’identification des individus avec un risque plus élevé d’événements cardio-vasculaires et de TDM, un DT2.
Une stéatohépatite se développe à partir d’une stéatose hépatique dans 7-30% des cas, avec une fibrose supplémentaire. Jusqu’à présent appelée NASH, désormais appelée MASH / metabolic dysfunction associated steatohepatitis (stéatohépatite associée à un dysfonctionnement métabolique). Celle-ci a une morbidité et mortalité hépatiques accrues. Plus la fibrose est importante, plus le pronostic à long terme est mauvais. On en trouve une chez 12-20% des patients avec DT2. Les transaminases sont également élevés en cas de DT2 et de fibrose hépatocellulaire, mais seulement dans un faible pourcentage. (18 et 28% respectivement) (5). Le diagnostic de fibrose peut être établi à l’aide du score FIB-4. Celui-ci se calcule à partir de l’âge, les plaquettes (baisse en cas de cirrhose) et des trans-aminases. En cas de DT2, ce score devrait être relevé 1x par an par le médecin généraliste ou un diabétologue, tout comme l’eGFR et l’UACR pour exclure une IRC. Si le score FIB-4 est ≥1,3 il convient de s’orienter vers un gastroentérologue/hépatologue pour un fibroscan, car il existe un risque accru de cirrhose du foie ou carcinome hépatocellulaire (CHC) – voir figure 1.
Un CHC peut également se développer à partir d’une stéatose hépatique sans cirrhose, contrairement à l’hépatite C. Il existe donc un risque élevé chez les patients atteints de DT2. Voir aussi www.DDG. de/Diabetes and fatty liver.
Un très bel article de synthèse de Xu (6) montre comment se développe une stéatose hépatique. Outre la génétique, un apport calorique trop élevé avec une obésité et une augmentation du tissu adipeux, de l’adipokine et de la leptine, joue un rôle dans une modification du microbiome, une inflammation, une résistance à l’insuline, une lipogenèse hépatique de novo et le DT2.
La thérapie
L’obésité touche plus de 500 millions de personnes dans le monde. Dans les 10 prochaines années cela sera environ ¼ de la population mondiale. L’obésité est une maladie chronique complexe qui entraîne un grand nombre de maladies secondaires. Parmi les principales comorbidités sont le DT2, l’augmentation des décès d’origine vasculaire, la thromboembolie, les troubles du sommeil et le cancer.
En plus d’une alimentation saine et d’une activité physique suffisante, une réduction du poids de 5 à 10%, une activité physique, une réduction du poids de 5 à 10 % est judicieuse en cas d’hypertension, de stéatose hépatique, de dyslipidémie et pour la prévention du DT2.
Encore mieux pour la prévention cardiovasculaire, la rémission du DT2, l’amélioration des paramètres rénaux et hépatalogiques est une réduction du poids de 10 à >15%, y compris la NASH/fibrose, une ostéoarthrite du genou et une réduction de la mortalité cardiovasculaire. Sans médicaments cet objectif de 10->15% est difficilement atteignable.
Les inhibiteurs de SGLT2, les GLP1-RA et la metformine ont un effet très positif sur la stéatose hépatique et ses complications. Les sulfonylurées et les insulines augmentent cependant ces maladies.
Les inhibiteurs SGLT2 : ils réduisent les acides gras libres dans le foie, inhibent la lipogenèse, favorisent la lipolyse, inhibent l’inflammation et l’apoptose et augmentent l’autophagie avec une diminution du stress cellulaire. Ils inhibent également la résistance à l’insuline et la lipogenèse de novo dans le foie. Ainsi, outre le HbA1c, le poids, les enzymes hépatiques et les triglycérides, la stéatose hépatique et la fibrose sont diminuées avec Cana-, Dapa- et Empagliflozin pendant 12-48 semaines.selon différentes études sur le DT2 (6). Les i- SGLT2- sans DT2 ne sont pas autorisés dans cette indication hépatologique.
Les GLP1-RA : outre son utilisation dans le cadre d’un DT2 avec une nette amélioration des paramètres métaboliques et des effets cardioprotecteurs et néphroprotecteurs. le GLP1-RA est également utilisé en cas d’obésité. Une réduction effective du poids de 10->15 peut aujourd’hui être atteinte par voie médicamenteuse. Selon les lignes directrices de l’ESC de 2023 “Diabète + cœur”, il existe une indication pour un GLP1-RA en cas de DT2 avec un IMC de 30kg/m2 ou ≥27 avec des comorbidités adaptées au poids. Selon la substance, des doses efficaces permettent une réduction du poids effective.
Ce médicament doit ètre utilisé comme le i-SGLT2, indépendamment de l’HbA1c en cas de risque cardiovasculaire très élevé ou élevé, de DT2 et d’ ASCVD ou d’un risque de 10 ans ≥20% du score de diabète; DT2 et un risque à 10 ans de 10-<20% (IA). En cas d’IMC ≥35, après échec des mesures conservatrices y compris la thérapie avec un GLP1-RA , l’utilisation de la chirurgie métabolique/bariatrique est possible, (7).
Dans l’étude STEP-HFpEF, un GLP1-RA a permis d’améliorer la qualité de vie des patients souffrant d’insuffisance cardiaque. (IC)) avec une fraction d’éjection (FE) préservée (>50%) et une obésité (IMC ≥30kg/m2), en plus d’une réduction de poids, une amélioration des symptômes de l’IC et une amélioration de la limitation physique, de la qualité de vie et une réduction de la CRP ont été obtenues (8).
Dans l’étude actuelle SELECT, la prise de 2,4 mg du sémaglutide s.c. 1x par semaine chez 8803 patients obèses à risque cardiovasculaire sans DT2, une réduction significative de 20% du critère d’évaluation primaire (décès cardiovasculaire, infarctus/accident vasculaire cérébral non fatal) l’obésité a été montré comme un facteur de risque cardiovasculaire traitable. La réduction des décès, des infarctus du myocarde et des accidents vasculaires cérébraux par le sémaglutide a été observée, en plus d’un bon traitement conforme aux lignes directrices.
Le sémaglutide, administré à faible dose (0,1/0,2/0,4mg s.c. par jour), diminue l’ALT/GPT pendant 72 semaines dans une stéatohépatite non alcoolique( 10). Cette étude de phase 2 menée chez des patients atteints d’une MASH a montré que le traitement entraînait une augmentation significative du pourcentage de patients avec une amélioration de la stéatose hépatique (59 vs 17%). L’étude n’a toutefois pas montré de nette différence entre les groupes dans le pourcentage de patients avec une amélioration du stade de fibrose.
Un agoniste triple (GIP/GLP-1/Glucagon-RA) nommé Retatrutide à 8mg resp. 12mg/semaine a entraîné chez des patients obèses sans DT2 en plus d’une réduction du poids de ≥15% dans 83% des cas, une réduction de la stéatose hépatique ; celle-ci se résorbe chez plus de 85% des participants en 48 semaines. Le médicament entraîne une réduction du poids effective de jusqu’à 24%. De plus, il y a un effet positif sur le LDL-C, l’homéostasie du glucose et les lipides et profil lipidique (11,12).
L’ampleur de la réduction de poids semble être plus importante qu’avec le sémaglutide ou le tirazépatide, un agoniste dual, avec un profil de sécurité comparable (13). Dans le cas de traitement de l’obésité pure sans DT2, ces médicaments sont souvent encore off-label Use. À l’avenir, ils pourraient partiellement remplacer la chirurgie bariatrique/métabolique.
Dans les années à venir, nous allons donc assister à plusieurs études intéressantes sur le traitement des paramètres cardiométaboliques, sur la protection cardiovasculaire et rénale, sur la stéatose hépatique et l’obésité et leurs complications avec ces agonistes des récepteurs prometteurs et leurs combinaisons.
Copyright Aerzteverlag medinfo AG
Cet article est une traduction de «der informierte arzt» 01_2024
Zelglistrasse 17
8127 Forch
L’ auteur n’ a pas déclaré de conflits d’ intérêts en rapport avec cet article.
- Une perte de poids efficace de ≥15% du poids corporel permet d’éviter la stéatose hépatique, de améliorer nettement le risque cardiovasculaire, la morbidité/mortalité hépatique et l’état métabolique. Ceci n’est possible qu’avec l’aide des GLP1-RA et d’autres agonistes innovants des récepteurs d’hormones intestinales.
Les incrétines sont disponibles dans le traitement du DT2 et de l’obésité.
Elles augmentent la sécrétion d’insuline postprandiale. et ont un effet sur différents organes cibles. - Les inhibiteurs du SGLT2 et les GLP1-RA ont un effet cardio-, néphro- et hépatoprotecteur.
1. Durst U., SGLT2-H. in der Therapie, Teil 1 Herzinsuffizienz, Der informierte Arzt, Sept. 2023
2. Durst U., SGLT2-H. in der Therapie, Teil 2 Niereninsuffizienz, Der informierte Arzt, Nov.2023
3. Rinella ME et al., A multi-society Delphi consensus statement on new fatty liver disease nomenclature, Hepatology 2023, June 24, 101133
4. Kim JH et al., Fatty liver index and development of cardiovascular disease in Koreans without pre-existing myocardial infarction and ischemic stroke: a large population-based study, Cardiovasc Diabetol.2020, (19);Mai 2;19(1):51.doi: 10.1186/s12933-020-01025-4
5. Lomanaco R. et al., Advanced Liver Fibrosis Is Common in Patients With Type 2 Diabetes Followed in the Outpatient Setting: The Need for Systematic ScreeningDiabetes Care 2021;44(2):399-406
6. Xu R. et al., SGLT2-I. for Non-Alcoholic Fatty Liver Disease : A Review, Front Biosci (Land-mark Ed) 2023;28(7):134
7. Marx N. et al., 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes, European Heart Journal (2023) 00, 1–98, https://doi. org/10.1093/ eurheartj/ehad192
8. Kosiborod MN et al., Semaglutide in patients with heart failure with preserved ejection fraction and obesity, 25. August 2023 DOI: 10.1056/NEJMoa2306963
9. Lincoff AM et al. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 2023 Nov 11. doi: 10.1056/NEJMoa2307563. Epub ahead of print. PMID: 37952131
10. Newsome PN et al., N Engl J Med 2021 Mar 25 ;384(12) :1113-1124
11. Jastreboff A.M. et al., Triple-Hormone-Receptor Agonist Retatrutide for Obesity – A Phase 2 Trial, N Engl J 2023 Aug 10, 389(6):514-526
12. Sanyal AJ et al., ADA Kongress 2023 in San Diego
13. Nauck M.A. et al., GIP und GLP-1-Rezeptoragonismus in der Therapie des Typ 2 Diabetes mit Fokus auf Tirzepatid, Diabetol. Stoffwechs 2023, Thieme Verlag
la gazette médicale
- Vol. 13
- Ausgabe 1
- Januar 2024