- Les traitements anti-amyloïdes dans la prise en charge de la maladie d’Alzheimer: lumières et ombres
La maladie d’Alzheimer est une maladie grave et fréquente, dont les traitements actuels n’ont qu’un effet symptomatique et n’influant pas sur son évolution. En Juillet 2023 et juillet 2024, des traitements par anticorps monoclonaux agissant sur une des protéines impliquées dans la physiopathologie de la maladie, la β-amyloïde, ont été approuvés par la FDA aux Etats-Unis et sont en cours d’évaluation en Suisse. Ces traitements ayant montré un bénéfice clinique statistiquement significatif sont associés à des effets secondaires caractérisés par des œdèmes ou des hémorragies cérébrales, appelés ARIA pour Amyloid Related Imaging Abnormalities. Une sélection rigoureuse des patients et une surveillance attentive seront donc indispensables pour que le rapport bénéfice risque soit favorable.
Alzheimer’s disease is a serious and common illness, and current treatments have only a symptomatic effect and have no influence on its progression. In July 2023 and July 2024, monoclonal antibody treatments acting on one of the proteins involved in the pathophysiology of the disease, B-amyloid, were approved by the FDA in the United States and are currently being evaluated in Switzerland. These treatments, which have shown a statistically significant clinical benefit, are associated with side effects characterised by cerebral oedema or haemorrhage, known as ARIA for Amyloid Related Imaging Abnormalities. Careful patient selection and monitoring will therefore be essential if the benefit-risk ratio is to be favourable.
Key words: Alzheimer, anti-amyloid, ARIA
Introduction
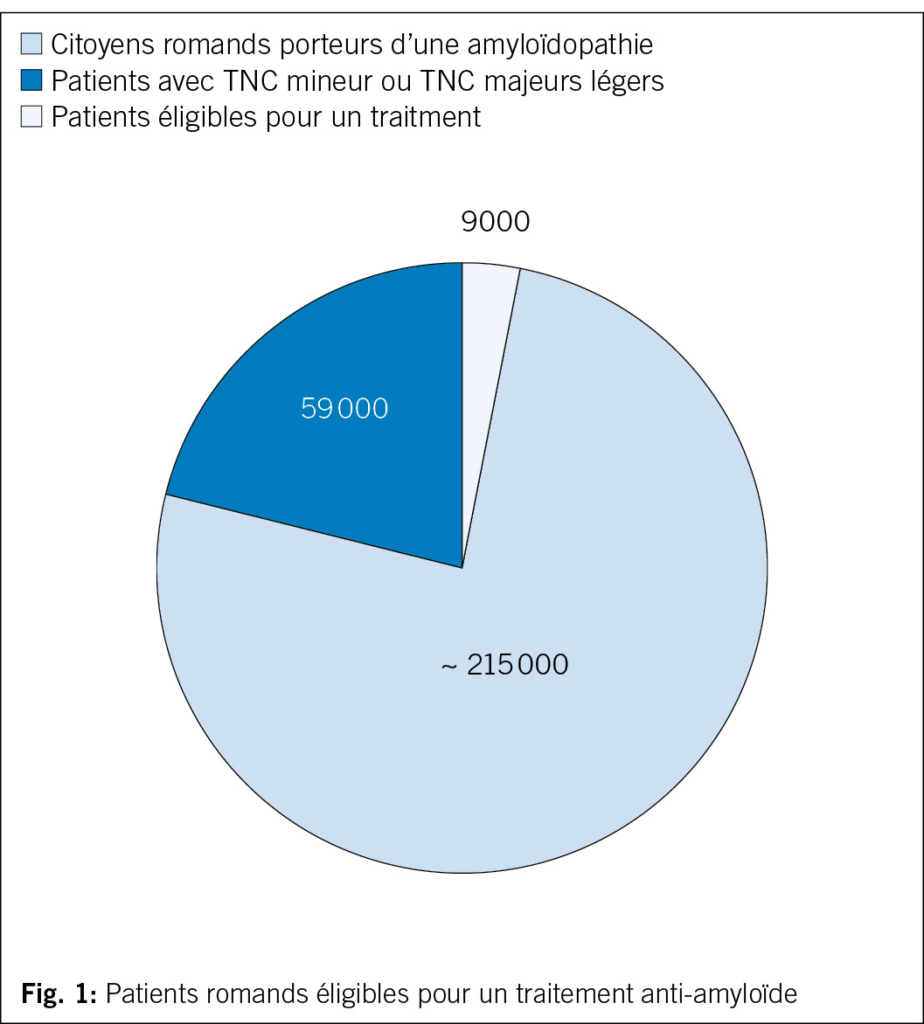
La maladie d’ Alzheimer est une maladie neurodégénérative cérébrale et représente la cause la plus fréquente de troubles neurocognitifs, se manifestant le plus souvent après les 65 ans. Elle touche actuellement 50 millions de personnes dans le monde, dont environ 25 000 en Suisse romande. En raison du vieillissement de la population, ce chiffre est voué à augmenter, avec une estimation de 152 millions de patients au niveau mondial d’ ici 2050. Outre son impact sur les patients, la maladie d’ Alzheimer impacte profondément leurs familles, les systèmes de santé et psychocociaux et le marché du travail, avec un coût mondial estimé à 1000 milliards de dollars par an (1).
Les présentations cliniques inaugurales communes de la maladie comprennent les formes amnésiques, langagières (aphasie primaire progressive logopénique) ou visuelles (atrophie corticale postérieure). Ces symptômes invalidants entraînent une perte progressive d’ autonomie à cause de troubles cognitifs progressivement globaux et une diminution de l’espérance de vie. Après sa description initiale en 1906 par Aloïs Alzheimer, il a été démontré que cette pathologie est notamment caractérisée par l’ accumulation extracellulaire progressive de protéines bêta-amyloïdes dans une conformation anormale et à l’ accumulation intracellulaire de neurofibrilles de protéines Tau phosphorylées, provoquant une dysfonction cellulaire et une mort neuronale. Cependant, les symptômes apparaissent plusieurs années après le début de ces modifications protéiques ayant une synergie et des interactions avec l’activité microgliales et vasculaires.
À l’ heure actuelle, les traitements de la maladie d’ Alzheimer visent principalement à atténuer les symptômes. Les deux principales classes de médicaments utilisées sont les anticholinestérasiques, tels que le donépézil, la galantamine et la rivastigmine, qui augmentent les niveaux d’acétylcholine dans le cerveau, et la mémantine, qui régule l’ activité du glutamate, neurotransmetteurs impliqués dans l’ apprentissage et la mémoire. Cependant, ces traitements offrent souvent des bénéfices modestes et ne modifient pas la physiopathologie de la maladie.
Compte tenu de la fréquence et de la gravité de cette maladie, la communauté scientifique tente depuis des décennies de développer des traitements capables de traiter cette pathologie ou d’ en ralentir significativement l’ évolution.
Traitements anti-amyloïdes
Suite à la découverte des plaques séniles et à la proposition de l’ hypothèse de la cascade amyloïde par Hardy et al. en 1992 (2), de nombreuses études cliniques ont été menées pour développer des traitements «disease-modifying» ciblant les protéines impliquées dans les mécanismes de la maladie. Depuis les premiers résultats prometteurs chez la souris par Schenk et al en 1999, plusieurs essais ont été réalisées chez l’ humain, qui n’ ont pas abouti en raison notamment de complications, de cibles inadaptées ou d’absence de biomarqueurs physiopathologiques. Par la suite, une meilleure sélection des cibles thérapeutiques, l’ amélioration des méthodes diagnostiques (notamment l’accès au PET-amyloïde et les dosages protéiques dans le LCR) et l’ augmentation des dosages ont permis une amélioration progressive des résultats, jusqu’ à l’ approbation du premier traitement anti-amyloïde, l’ aducanumab, en 2021 (puis retracté en 2024). Depuis, un deuxième médicament, le lecanemab, a été approuvé en 2023 et un autre traitement, le donanemab, a été approuvé en juin 2024. Ces deux derniers sont actuellement en cours d’ instruction par les autorités de régulation en Suisse. Il est essentiel d’intégrer un raisonnement bénéfices-risques afin d’ orienter les patients et de surveiller les effets indésirables. Dans cet article, nous passerons en revue les traitements en cours d’ approbation et nous discuterons des bénéfices escomptés ainsi que des risques associés.
Ces molécules sont des anticorps monoclonaux humains qui ciblent sélectivement la bêta-amyloïde, induisant une activation microgliale qui entraîne la phagocytose et la dégradation de la protéine toxique. Bien que ces molécules ciblent la même protéine, leurs mécanismes d’ action différents confèrent à l’ aducanumab une affinité plus forte avec les oligomères, au lecanemab avec les protofibrilles et au donanemab avec la plaque amyloïde.
Après une étude de phase 2 montrant des résultats prometteurs en termes d’ efficacité, l’ aducanumab a été évalué dans deux études cliniques randomisées de phase 3 (ENGAGE et EMERGE), incluant plus de 3200 patients dans 20 pays. Ces études ont montré une nette diminution dose-dépendante de la charge amyloïde et de la charge tau, ainsi qu’ un ralentissement du déclin du score CDR de 18 % sur 18 mois dans l’ étude EMERGE et de 15 % sur 18 mois dans l’ étude ENGAGE, avec des résultats significatifs uniquement pour la première de ces études (3).
Des résultats similaires ont été obtenus avec les études de phase 3 CLARITY-AD et TRAILBLAZER-ALZ 2, concernant respectivement le lecanemab et le donanemab. Le premier a mis en évidence un ralentissement de la pente du déclin cognitif de 27 % sur l’ échelle CDR-SB à 18 mois entre le groupe expérimental et le groupe placebo et le second de 36 % selon l’ échelle CDR et de 41 % dans la perte d’ autonomie aux activités instrumentales de la vie quotidienne.
Outre leur modalité d’action proche, ces traitements diffèrent dans leur modalité d’administration. Le lecanemab est administré par voie intraveineuse deux fois par mois. Le donanemab quant à lui a été administré par injection intraveineuse une fois par mois.
Ces études ont concerné des patients à des stades débutants de la maladie (MMSE > 22/30), avec un phénotype commun (amnésique) et avec une physiopathologie de maladie d’Alzheimer prouvée (amyloïde positive).
Ces résultats positifs pour les outcomes primaires ont justifié leur approbation par les autorités américaines. La significativité statistique clinique et la preuve de concept physiopathologique sont indéniables. En revanche, l’amplitude clinique de cet effet observé et le bénéfice à long terme restent une interrogation vu le design des études et leur durée limitée à 18 mois sur une population peu symptomatique. Les premiers résultats communiqués des phases d’extension et les données favorables sur les biomarqueurs de la maladie (protéine Tau) laissent penser à un effet «disease modifier» à long terme, mais c’est le suivi des cohortes de patients traités qui permettra de clarifier la vrai amplitude des effets.
Cet effet biologique a tout de même été associé à des effets indésirables cliniques et radiologiques chez plus de 30 % des patients traités, pour la majeure partie de façon asymptomatique et il est donc important de mieux les connaître.
Effets indésirables – ARIAs
Les principaux effets indésirables associés aux traitements anti-amyloïdes sont les «Amyloid Related Imaging Abnormalities», appelées ARIAs. Ces anomalies, détectées par imagerie cérébrale (IRM), sont favorisées par l’ utilisation de traitements visant à éliminer les plaques amyloïdes. On distingue deux types d’ ARIAs: les ARIA-E, caractérisées par des anomalies dues à un œdème vasogénique, et les ARIA-H qui sont des micro-hémorragies ou de l’ hémosidérose superficielle. Bien que la véritable physiopathologie des ARIAs ne soit pas connue, la dégradation de l’ intégrité des parois vasculaires en début d’immunisation (dans les 3–6 premiers mois de traitements) due à l’élimination des protéines pathologiques par les anticorps, semble en être significativement liées.
Outre le traitement et une angiopathie amyloïde prévalente, la présence d’un allèle ε4/ε4 de la protéine APOE est le 3e facteur qui augmente significativement le risque d’ARIAs. Bien que dans la majorité des cas soit asymptomatique, ces anomalies peuvent se manifester par des céphalées inhabituelles, une confusion ou des vertiges. Dans des cas plus graves, elles peuvent provoquer des signes neurologiques focaux, des troubles de la conscience, des crises épileptiques ou le décès.
Depuis leur description en 2011 lors dles essais avec le Bapineuzumab par Sperling et al., des comités d’ experts ont formulé des recommandations pour le suivi des patients traités avec des anti-amyloïdes et pour la gestion des éventuelles ARIAs (4, 5).
Quelles recommandations d’utilisation?
Des recommandations pour une utilisation appropriée sont en cours de rédaction en Suisse, à partir des critères de l’étude CLARITY et des recommandations publiées par Cummings en 2023 (6). Les traitements seront délivrés dans des établissements habilités ayant l’expertise, le plateau technique requis pour leur mise en place et la gestion des possibles effets indésirables. Les éléments les plus importants à connaitre sont les suivants:
1. Sélection des patients
Les patients éligibles seront ceux affectés par une maladie d’Alzheimer au stade débutant avec preuve biologique amyloïde. Ceux les plus à risque de complications du traitement, tels que ceux sous anticoagulants, ceux aux antécédents d’accidents ischémiques cérébraux de moins d’un an, d’une leucoaraïose sévère ou d’angiopathie amyloïde probable, nécessiteront une prise en charge adaptée tout comme ceux avec comorbidités somatiques ou psychiatriques graves (par exemple cancers ou insuffisance d’organes instable). On estime que moins de 10 % des patients avec maladie d’Alzheimer vus dans les Centres de la Mémoire auront accès au traitement (7).
2. Suivi des patients
Les patients sous traitement doivent bénéficier d’un suivi radiologique régulier par IRM et d’une imagerie immédiate en cas de symptômes évocateurs d’une ARIA. En cas d’apparition d’ARIA léger et asymptomatique, le traitement pourra être poursuivi sous surveillance rapprochée. Pour les autres cas, le traitement devra être suspendu, avec un suivi radiologique régulier jusqu’ à résolution des anomalies et des symptômes. En cas de symptômes sévères, de récidive ou d’ARIAs graves, le traitement sera interrompu définitivement, selon les recommandations du groupe de travail ADRD Therapeutics (6).
3. Prise en charge des ARIAs symptomatiques
Une consultation neurologique est recommandée pour les ARIAs, ainsi qu’ une hospitalisation si nécessaire. En fonction des symptômes, un traitement par corticoïdes ou anticonvulsivants pourra être envisagé (6).
Conclusion
Les traitements anti-amyloïdes représentent les premiers traitements modificateurs de la maladie approuvés pour la prise en charge de la maladie d’ Alzheimer au stade débutant, offrant un espoir renouvelé face à cette pathologie fréquente et grave, qui touche des millions de familles à travers le monde. Toutefois, malgré cet espoir, les bénéfices observés jusqu’ à présent demeurent relativement modestes sur les premières études et les effets secondaires peuvent être sévères. Une sélection rigoureuse des patients offrant un profil de réponse favorable avec un risque d’effets secondaires limités et un suivi attentif par des centres spécialisés sont donc indispensables pour garantir une prise en charge optimale.
Copyright Aerzteverlag medinfo AG
Centre Leenaards de la mémoire
Département des neurosciences cliniques,
CHUV et UNIL
Chemin de Mont-Paisible 16
1011 Lausanne
Centre Leenaards de la mémoire
Département des neurosciences cliniques,
CHUV et UNIL
Chemin de Mont-Paisible 16
1011 Lausanne
Centre Leenaards de la mémoire
Département des neurosciences cliniques,
CHUV et UNIL
Chemin de Mont-Paisible 16
1011 Lausanne
Les auteurs n’ont pas déclaré de conflit d’intérêts en rapport avec cet article.
1. Breijyeh Z, Karaman R. Comprehensive Review on Alzheimer’ s Disease: Causes and Treatment. Molecules. 2020 Dec 8;25(24):5789. doi: 10.3390/molecules25245789. PMID: 33302541; PMCID: PMC7764106.
2. Hardy JA, Higgins GA. Alzheimer’ s disease: the amyloid cascade hypothesis. Science. 1992 Apr 10;256(5054):184-5. doi: 10.1126/science.1566067. PMID: 1566067.
3. Budd Haeberlein S, Aisen PS, Barkhof F, Chalkias S, Chen T, Cohen S, Dent G, Hansson O, Harrison K, von Hehn C, Iwatsubo T, Mallinckrodt C, Mummery CJ, Muralidharan KK, Nestorov I, Nisenbaum L, Rajagovindan R, Skordos L, Tian Y, van Dyck CH, Vellas B, Wu S, Zhu Y, Sandrock A. Two Randomized Phase 3 Studies of Aducanumab in Early Alzheimer’ s Disease. J Prev Alzheimers Dis. 2022;9(2):197-210. doi: 10.14283/jpad.2022.30. PMID: 35542991.
4. Cummings J, Aisen P, Apostolova LG, Atri A, Salloway S, Weiner M. Aducanumab: Appropriate Use Recommendations. J Prev Alzheimers Dis. 2021;8(4):398-410. doi: 10.14283/jpad.2021.41. PMID: 34585212; PMCID: PMC8835345.
5. Cummings J, Rabinovici GD, Atri A, Aisen P, Apostolova LG, Hendrix S, Sabbagh M, Selkoe D, Weiner M, Salloway S. Aducanumab: Appropriate Use Recommendations Update. J Prev Alzheimers Dis. 2022;9(2):221-230. doi: 10.14283/jpad.2022.34. PMID: 35542993; PMCID: PMC9169517.
6. Cummings J, wstolova L, Rabinovici GD, Atri A, Aisen P, Greenberg S, Hendrix S, Selkoe D, Weiner M, Petersen RC, Salloway S. Lecanemab: Appropriate Use Recommendations. J Prev Alzheimers Dis. 2023;10(3):362-377. doi: 10.14283/jpad.2023.30. PMID: 37357276; PMCID: PMC10313141.
7. Chiabotti PS, Rouaud O, Allali G. Reader Response: Eligibility for Anti-Amyloid Treatment in a Population-Based Study of Cognitive Aging. Neurology. 2024 May 14;102(9):e209375. doi: 10.1212/WNL.0000000000209375. Epub 2024 Apr 22. PMID: 38648577.
la gazette médicale
- Vol. 13
- Ausgabe 8
- Dezember 2024










