- L’ incontinence urinaire dans la vieillesse
L’ incontinence de la femme âgée est examinée d’ un point de vue gynécologique. Nous exposons les problèmes de base, une évaluation adaptée et montrons les options thérapeutiques, leurs dangers et les limites de ce qui est possible.
Le groupe des « personnes âgées » est hétérogène. Il va de la retraitée âgée active à la résidente à peine mobile en institution. L’incontinence augmente avec l’âge (1) et la fragilité (2) (fig. 1). Les causes sont multifactorielles. Les changements anatomiques liés à l’ âge, les maladies chroniques, la polymédication ainsi que les limitations fonctionnelles et cognitives jouent un rôle. L’ incontinence est un syndrome gériatrique qui peut survenir sans perturbation du tractus urogénital. (3). L’ incontinence doit donc être comprise comme un marqueur de la fragilité et il n’ est pas rare que l’ incontinence soit – tout comme un trouble neurocognitif – une raison d’ admission dans un foyer (4, 5). Les troubles neurocognitifs et l’ incontinence vont de pair (6). En urodynamique, cependant, seule l’ hyperactivité mesurable du détrusor (7) peut être reconnue, ce qui ne rend pas justice au tableau clinique.
Chez la personne âgée, nous oscillons entre nihilisme thérapeutique et surtraitement. Pour les personnes âgées, la thérapie exige une perspective plus large et l’ implication du médecin de famille et du médecin de la maison de soins ainsi que du personnel soignant et des proches.
Changements liés à l’ âge dans l’ appareil urogénital
Changements de la vessie liés à l’ âge
Le volume de l’ urine éliminée au cours de la miction a tendance à diminuer, le détrusor devient plus instable, l’ urine résiduelle augmente, la capacité vésicale relative diminue (8), les résultats urodynamiques n’ ayant qu’ une faible corrélation avec la clinique (9). La contractilité de la vessie diminue également avec l’ âge (10). L’ hypocontractilité de la vessie et l’ augmentation des urines résiduelles qui en résulte peuvent contribuer à la pollakiurie et à la nycturie (11). Un détrusor instable combiné à une contractilité réduite est souvent observé chez les personnes âgées (12). Cette combinaison peut provoquer des symptômes d’ urgence, de stress et d’ obstruction et constitue un défi thérapeutique.
Changements liés à l’ âge dans l’ urètre
La fonction d’ occlusion de l’ urètre, mesurée comme étant la pression d’ occlusion urétrale maximale, diminue de 15 cm H2O par décennie (13, 14). La muqueuse devient de plus en plus mince, la coaptation devient insuffisante, ce qui favorise également l’ ascension des bactéries (15). Cet amincissement de l’ urètre peut s’ étendre jusqu’ au trigone de la vessie et déclencher l’ instabilité du détrusor décrite ci-dessus par le biais d’ afférences sensibles (16). Perucchini a pu montrer que la quantité de fibres musculaires striées du rhabdomyospincter urétral diminue de 1 % par année de vie (17). Le muscle lisse du sphincter urétral (18) est soumis aux mêmes modifications.
Changements liés à l’ âge dans le vagin
À la ménopause, la muqueuse vaginale s’ amincit et la valeur du pH augmente à mesure que les bactéries pathogènes remplacent les lactobacilles qui préfèrent les œstrogènes. Cela peut entraîner des infections récurrentes des voies urinaires (19).
Changements anatomiques
Les troubles obstructifs sont rares chez les femmes ; ils sont généralement causés par une descente d’ organes génitaux pertinente avec une plicature de l’ urètre consécutive ou par une intervention pour traiter l’ incontinence d’ effort.
Causes non gynécologiques contribuant à l’ incontinence
Un diabète mal contrôlé entraîne une polyurie, une cystopathie diabétique et une polyneuropathie diabétique (20) ainsi que des troubles du stockage vésical.
Les changements musculo-squelettiques peuvent accentuer une envie par l’ immobilité, car la patiente ne peut plus atteindre les toilettes dans un délai raisonnable. Des toilettes mal placées ou mal conçues, ainsi que le manque d’ assistance aggravent la situation. L’ envie est à nouveau un facteur de risque pour les chutes et les fractures (21).
Les maladies pulmonaires accompagnées d’ une toux chronique favorisent l’ incontinence à l’ effort. L’ insuffisance cardiaque ainsi que l’ insuffisance veineuse chronique aggravent la nycturie en raison de la réabsorption nocturne de l’ œdème.
Les accidents cérébrovasculaires entraînent la formation de zones ischémiques, qui sont résumées dans la terminologie neuro-
urologique comme des lésions suprapontines (lésions au-dessus du centre de miction pontine). Celles-ci peuvent réduire la fonction inhibitrice des zones corticales et sous-corticales pertinentes pour la miction au centre de miction pontine (centre de coordination). La conséquence en est une suractivité neurogène du détrusor. Un autre exemple typique est la maladie de Parkinson. L’ urine résiduelle, qui s’ explique par l’ hyopkinésie du sphincter strié de l’ urètre, est moins fréquente dans la maladie de Parkinson. Souvent, la thérapie à la L-dopa n’ améliore pas la continence (22). La maladie d’ Alzheimer et d’ autres formes de démence provoquent également des lésions suprapontines. La suractivité du détrusor d’ origine neurologique décrite ci-dessus est également évidente, ce qui s’ accompagne de difficultés d’ orientation et de coordination propres à la démence.
Les séniors qui souffrent de maladies mentales telles que la dépression peuvent perdre leur motivation à rester continents. D’ autre part, l’ incontinence aggrave la dépression (23).
La constipation est également associée à l’ incontinence urinaire (24).
La clarification de l’ incontinence de la femme âgée
L’ incontinence peut également être traitée au cours de la vieillesse : une clarification plus approfondie peut être utile. Il est possible de déterminer dans quelle mesure l’ incontinence est due à une cause urogénitale et une proposition de thérapie adaptée aux circonstances de vie de la patiente peut être élaborée en concertation avec les soignants.
Au début se trouve l’ anamnèse exacte, si nécessaire aussi par des tiers. L’ enregistrement des comorbidités et de la médication actuelle ainsi que de la situation sociale est central.
En mesurant l’ urine résiduelle au moyen d’ une échographie ou d’ un cathéter jetable, on obtient une indication de la fonction vésicale et on peut prendre des décisions thérapeutiques (25).
L’ état gynécologique reconnaît un descensus sévère, qui peut conduire à une perturbation obstructive de la miction et, en cas de formation d’ urine résiduelle pertinente, à une incontinence par regorgement (overflow). La congestion des voies urinaires supérieures est très rare et peut être exclue par une échographie rénale. Une attention particulière est accordée à la trophicité urogénitale. Un simple test de toux avec une vessie pleine suffit pour détecter cliniquement l’ incontinence d’ effort (26, 27).
Bien que l’ anamnèse, l’ examen clinique et l’ échographie puissent être très utiles et bien que le bilan urodynamique ne soit pas recommandé comme examen de routine dans la clarification de base de l’ incontinence urinaire (EAU Guidelines 2018), le bilan urodynamique et la cystoscopie peuvent également être effectuées chez les patientes âgées et aident à définir précisément le dysfonctionnement de la vessie (28). Cet examen est indiqué avant un traitement invasif. Le bilan urodynamique est indispensable en cas de lésions transversales. Chez la patiente âgée, cependant, le bilan urodynamique n’ est presque jamais au centre de l’ attention; l’ accent est mis sur la pathologie inhérente au détrusor, la formation d’ urine résiduelle, la faiblesse de l’ occlusion et l’ obstruction fonctionnelle.
Le traitement de l’ incontinence
Les thérapies comportementales doivent être essayées avant la thérapie médicamenteuse. La clé d’ attribution des postes d’ une institution ne permet pas toujours d’ obtenir l’ aide nécessaire – comme la marche assistée vers les toilettes (29).
La thérapie médicamenteuse doit être soigneusement indiquée. Elle peut être inadaptée aux patientes âgées, par exemple aux résidentes en institution qui n’ ont pas l’ intention d’ aller aux toilettes ou qui sont gravement atteintes de troubles cognitifs et fonctionnels, de sorte qu’ une amélioration par la médication n’ est plus à attendre (30).
Thérapie médicamenteuse :
L’ œstrogène local doit être commencé très tôt en tant que thérapie de base à faible dose. Les œstrogènes locaux – contrairement aux œstrogènes administrés par voie systémique – sont sans risque, préviennent ou traitent l’ atrophie qui contribue à l’ incontinence et protègent la femme ménopausée contre les infections urinaires récurrentes (31). Les œstrogènes appliqués localement traitent le syndrome ménopausique génito-urétral bien plus efficacement que l’ hormonothérapie substitutive systémique. En Suisse, seules les préparations à faible ou très faible dose sont autorisées (32).
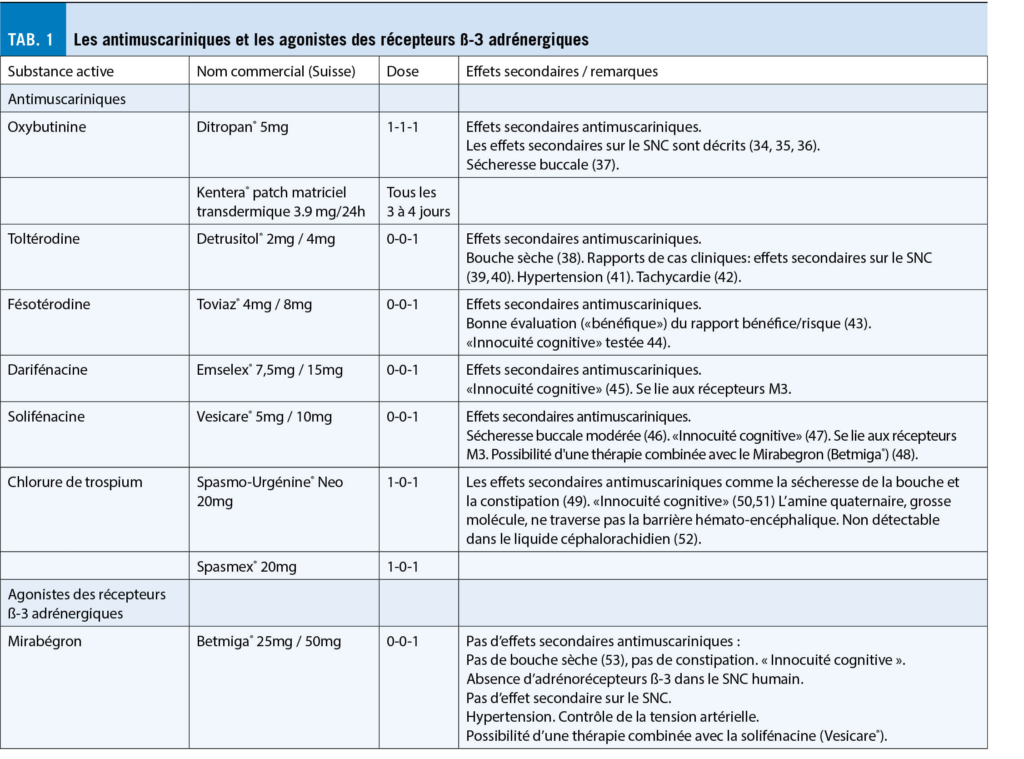
Les médicaments antimuscariniques inhibent de manière compétitive les récepteurs muscariniques du détrusor et bloquent le système nerveux parasympathique, qui est responsable de la vidange de la vessie. Ils ont un effet modéré (33) et peuvent réduire le nombre d’ épisodes d’ incontinence et la fréquence des mictions. Les médicaments antimuscariniques sont généralement testés dans le cadre d’ études utilisant des journaux de miction, par opposition à un placebo ou un médicament antimuscarinique plus ancien. Ils ne diffèrent guère les uns des autres en termes d’ efficacité, mais se distinguent par leur profil d’ effets secondaires : des effets secondaires sur le SNC ont été décrits pour l’ ancienne préparation d’ oxybutynine (Ditropan®, Kentera®, des patches matriciels transdermiques). La toltérodine (Detrusitol®) et la fésotérodine (Toviaz®) se concentreraient davantage sur la vessie, et la fesotérodine aurait un bon rapport risque-bénéfice. La solifénacine (Vesicare®) et la darifénacine (Emselex®) sont des sélectives du récepteur M3 et se lient principalement au sous-type III des récepteurs muscariniques et moins au sous-type II, qui se trouve dans le SNC, et sont considérées comme sûres en ce qui concerne les effets secondaires sur le SNC. Le chlorure de trospium, une amine quaternaire (Spasmo-Urgenin® Neo, Spasmex®), est une grosse molécule et ne peut pas passer la barrière hémato-encéphalique, étant donc « inoffensif sur le plan cognitif » (tab. 1).
Le mirabégron, un agoniste des récepteurs ß-3 adrénergiques, stimule les adrénorécepteurs ß-3 du détrusor. Ces récepteurs β-3 sympathiques sur le muscle de la vessie servent à la relaxation de la vessie et donc au remplissage de la vessie. Cet autre mécanisme est une bonne alternative aux médicaments antimuscariniques. La tension artérielle doit être contrôlée. Le mirabégron (Betmiga®) et la solifénacine (Vesicare®) ont été testés comme thérapie combinée (tab. 1).
Chez les patients âgés, la pharmacocinétique doit être prise en compte. Une insuffisance rénale ou une fonction hépatique restreinte sont souvent présentes : pour cette raison, les thérapies médicamenteuses doivent toujours être instaurées avec la dose la plus faible possible (54). La polymédication (>5 médicaments) est courante chez les personnes âgées (55), les interactions peuvent difficilement être contrôlées et certains médicaments peuvent augmenter l’ incontinence (56) : les médicaments qui augmentent le volume d’ urine comme les diurétiques ou le lithium aggravent le besoin d’ uriner et la nycturie. Les sédatifs, hypnotiques et antipsychotiques influencent la vigilance, le sommeil et la mobilité et donc la continence. Les inhibiteurs de la cholinestérase tels que la galantamine (Reminyl®), qui sont utilisés dans la maladie d’ Alzheimer, peuvent déclencher une incontinence par impériosité (57, 58). Les préparations anticholinergiques peuvent entraîner une incontinence par regorgement (overflow).
L’ éclaircissement d’ une longue liste de médicaments n’ est pas de la compétence du spécialiste en uro-gynécologie. Une bonne indication est nécessaire pour ajouter des antimuscariniques à la liste et l’ efficacité de la thérapie doit être surveillée.
Effets secondaires des médicaments
La maladie d’ Alzheimer et d’ autres formes de démence sont caractérisées par un déficit cholinergique du SNC (59). Tandis que les médicaments anticholinergiques provoquent une sécheresse de la bouche, des troubles de l’ accommodation ou de la constipation chez les jeunes, des effets secondaires plus importants tels que la sédation, le délire, les hallucinations et les chutes avec fractures consécutives peuvent se produire chez les personnes âgées (60). Les patients atteints de la maladie de Parkinson sont particulièrement sensibles aux médicaments ayant des effets antimuscariniques ( 61). Les données épidémiologiques montrent une corrélation positive entre la charge antimuscarinique à long terme et les troubles cognitifs ainsi que le développement de la démence (62, 63). Dans le cas d’ une démence préexistante, le lien est moins évident (64, 65).
Outre les médicaments antimuscariniques utilisés pour traiter la vessie hyperactive, d’ autres médicaments ont également des propriétés anticholinergiques, tels que les bipérides (Akineton®), la butylscopalamine (Buscopan®), l’ umeclidinium (Incruse Ellipta®) et également de nombreux antidépresseurs, neuroleptiques et antihistaminiques (66). La charge anticholinergique s’ accumule avec chaque préparation supplémentaire utilisée. Chez les patientes âgées, la charge anticholinergique totale doit être maintenue aussi faible que possible.
Traitement chirurgical de l’ incontinence
L’ indication de l’ opération doit être discutée avec la patiente, le médecin de famille et les soignants responsables. L’ âge et les comorbidités entraînent davantage de complications anesthésiologiques et périopératoires. Il faut s’ attendre à une hospitalisation plus longue et à un besoin de soins plus important après la sortie de l’ hôpital.
La chirurgie offre le traitement le plus efficace pour l’ incontinence d’ effort, même à un âge avancé (67). Les patientes âgées sont souvent défavorisées concernant le traitement chirurgical de l’ incontinence d’ effort : Elles sont pré-opérées, le profil de la pression urétrale est mauvais et l’ urètre n’ est pas très mobile. EIles présentent une atrophie génitale et peut-être aussi un détrusor instable. Les échecs et les récidives sont plus fréquents à un âge avancé (68, 69, 70). Néanmoins, les insertions de bandelettes sous-urétrales sont des interventions bien documentées (71), courtes et mini-invasives qui peuvent être réalisées sous anesthésie locale et analgésie. La charge de l’ opération est faible. Il en va de même pour l’ injection d’ agents gonflants (bulking agents) dans l’ urètre.
Le traitement chirurgical du détrusor hyperactif est réalisé par l’ application de la toxine onabotulique A (Botox®). Celle-ci est injectée par cystoscopie dans le détrusor et entraîne une dénervation partielle, mais aussi réversible, de la vessie, selon la dose. L’ intervention est courte et à peine gênante et est pratiquée sous anesthésie locale, si nécessaire en combinaison avec une sédation. La dose et l’ intervalle doivent être titrés individuellement. Le grand avantage : la thérapie antimuscarinique perorale est remplacée par une thérapie locale plus efficace (72, 73). La formation d’ urine résiduelle et la durée d’ action plus courte sont plus fréquentes chez les patientes âgées (74).
Produits d’ hygiène et cathéters
Pour de nombreuses personnes âgées, un approvisionnement optimal en protections contre l’ incontinence est essentiel pour la qualité de vie et conduit à un bien-être physique, psychologique et social (75). Même si cette mesure a l’ allure d’ un forfait, elle est souvent adaptée à la situation et rarement impopulaire.
L’ autocathétérisme est le traitement approprié de la vessie atone avec de grandes quantités d’ urine résiduelle (overflow). Chez les personnes âgées, cette option est généralement irréaliste en raison de l’ immobilité, des tremblements ou de la déficience visuelle. Heureusement, des quantités importantes d’ urine résiduelle peuvent être tolérées dans la vessie acontractile ou dénervée. Il n’ y a pratiquement pas de développement de pression vésicale et par conséquant le reflux et donc les dommages aux voies urinaires supérieures sont rares.
Un drainage permanent (cathéter permanent) est impopulaire et – présentant un risque accru d’ infection (danger de septicémie/délire) – ne doit être envisagé que dans certains cas, chez les patientes avec des restrictions fonctionnelles graves ou qui ont une fonction rénale compromise dans le cadre du trouble mictionnel.
Article traduit de «der informierte arzt» 07_2020
Copyright Aerzteverlag medinfo AG
Frauenklinik Stadtspital Weid und Triemli
Birmensdorferstrasse 501
8063 Zürich
daniel.passweg@triemli.zuerich.ch
Frauenklinik Stadtspital Weid und Triemli
Birmensdorferstrasse 501
8063 Zürich
Les auteurs ont déclaré n’ avoir aucun conflit d’ intérêts en rapport avec cet article.
- L’ incontinence urinaire chez la femme âgée est multifactorielle.
- Une clarification minutieuse est utile pour déterminer une stratégie thérapeutique adaptée.
- Les médicaments antimuscariniques sont possibles, mais il est important de tenir compte de la charge anticholinergique. Le mirabégron, un agoniste des récepteurs ß-3 adrénergiques, est une alternative.
- Les thérapies chirurgicales de l’ incontinence sont peu invasives et peuvent être discutées à un âge avancé le cas échéant.
1. B . Baltes, P.B. and J. Smith, New frontiers in the future of aging: from successful aging of the young old to the dilemmas of the fourth age. Gerontology, 2003. 49(2): p. 123-35.
2. Silva, V.A., K.L. Souza, and M.J. D’Elboux, [Urinary incontinence and the criteria of frailness among the elderly outpatients]. Revista da Escola de Enfermagem da U S P, 2011. 45(3): p. 672-8.
3. Inouye, S.K., et al., Geriatric syndromes: clinical, research, and policy implications of a core geriatric concept. J Am Geriatr Soc, 2007. 55(5): p. 780-91.
4. Thom, D.H., M.N. Haan, and S.K. Van Den Eeden, Medically recognized urinary incontinence and risks of hospitalization, nursing home admission and mortality. Age Ageing, 1997. 26(5): p. 367-74.
5. Prince, M., et al., The global prevalence of dementia: a systematic review and metaanalysis. Alzheimer’s & dementia : the journal of the Alzheimer’s Association, 2013. 9(1): p. 63-75 e2.
6. Byles, J., et al., Living with urinary incontinence: a longitudinal study of older women. Age Ageing, 2009. 38(3): p. 333-8; discussion 251.
7. Lee, S.H., et al., Urinary incontinence in patients with Alzheimer’s disease: relationship between symptom status and urodynamic diagnoses. International journal of urology : official journal of the Japanese Urological Association, 2014. 21(7): p. 683-7.
8. Madersbacher, S., et al., The aging lower urinary tract: a comparative urodynamic study of men and women. Urology, 1998. 51(2): p. 206- 12.
9. Resnick, N.M., Elbadawi, A. E., Yalla, S. V., Age and the lower urinary tract: what is normal? . Neurourology and Urodynamics, 1995. 14: p. 1647.
10. Malone-Lee, J., Wahedna, I., Characterisation of detrusor contractile function in relation to oldage. Br J Urol 1993. 72: p. 873-880.
11. Taylor, J.A., 3rd and G.A. Kuchel, Detrusor underactivity: Clinical features and pathogenesis of an underdiagnosed geriatric condition. J Am Geriatr Soc, 2006. 54(12): p. 1920-32.
12. Resnick, N.M. and S.V. Yalla, Detrusor hyperactivity with impaired contractile function. An unrecognized but common cause of incontinence in elderly patients. JAMA, 1987. 257(22): p. 3076-81.
13. Rud, T., Urethral pressure profile in continent women from childhood to old age. Acta obstetricia et gynecologica Scandinavica, 1980. 59(4): p. 331-5.
14. Trowbridge, E.R., et al., Effects of aging on lower urinary tract and pelvic floor function in nulliparous women. Obstetrics and gynecology, 2007. 109(3): p. 715-20.
15. Samsioe, G., et al., Occurrence, nature and treatment of urinary incontinence in a 70-yearold female population. Maturitas, 1985. 7(4): p. 335-42.
16. Kenton, K., et al., Urethral and bladder current perception thresholds: normative data in women. The Journal of urology, 2007. 178(1): p. 189-92; discussion 192.
17. Perucchini, D., et al., Age effects on urethral striated muscle. II. Anatomic location of muscle loss. American journal of obstetrics and gynecology, 2002. 186(3): p. 356-60.
18. Clobes, A., J.O. DeLancey, and D.M. Morgan, Urethral circular smooth muscle in young and old women. Am J Obstet Gynecol, 2008. 198(5): p. 587 e1-5.
19. Juthani-Mehta, M., et al., Diagnostic accuracy of criteria for urinary tract infection in a cohort of nursing home residents. J Am Geriatr Soc, 2007. 55(7): p. 1072-7.
20. Tai, H.C., et al., Metabolic syndrome components worsen lower urinary tract symptoms in women with type 2 diabetes. J Clin Endocrinol Metab, 2010. 95(3): p. 1143-50.
21. Brown, J.S., et al., Urinary incontinence: does it increase risk for falls and fractures? Study of Osteoporotic Fractures Research Group. J Am Geriatr Soc, 2000. 48(7): p. 721-5.
22. Wullner, U., et al., Autonomic dysfunction in 3414 Parkinson’s disease patients enrolled in the German Network on Parkinson’s disease (KNP e V.) the effect of ageing. European Journal of Neurology, 2007. 14(1405-1408).
23. Dugan, E., et al., The association of depressive symptoms and urinary incontinence among older adults. J Am Geriatr Soc, 2000. 48: p. 413-416.
24. Wen-Qing L., et al., Constipation and Risk of Urinary Incontinence in Women: A Meta-Analysis. Int Urogynecol J, 2019. 30(10): p. 1629-1634.
25. Smith, P.P. and G.A. Kuchel, Clinical Meaning of a High Postvoid Residual: When the Value of a Result Is Less and More than One Would Expect. J Am Geriatr Soc, 2015. 63(7): p. 1432-4.
26. Resnick, N.M., et al., Misdiagnosis of urinary incontinence in nursing home women: prevalence and a proposed solution. Neurourol Urodyn, 1996. 15(6): p. 599-613; discussion 613- 8.
27. Diokno, A.C., T.J. Wells, and C.A. Brink, Urinary incontinence in elderly women: urodynamic evaluation. J Am Geriatr Soc, 1987. 35(10): p. 940-6.
28. Resnick, N.M., S.V. Yalla, and E. Laurino, The pathophysiology of urinary incontinence among institutionalized elderly persons. N Engl J Med, 1989. 320(1): p. 1-7.
29. Schnelle, J.F., et al., A standardized quality assessment system to evaluate incontinence care in the nursing home. J Am Geriatr Soc, 2003. 51(12): p. 1754-61.
30. Narayanan, S., et al., Is drug therapy for urinary incontinence used optimally in long-term care facilities? Journal of the American Medical Directors Association, 2007. 8(2): p. 98-104.
31. Raz, R., et al.,A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. N Engl J Med, 1993. 329(11): p. 753.
32. Birkhäuser, M., Risiken einer vaginalen Estrogengabe – worum geht es?. info@gynäkologie, 2020. 4(01): p. 15–17.
33. Herbison, P., et al., Effectiveness of Anticholinergic Drugs Compared with Placebo in the Treatment of Overactive Bladder: Systematic Review. BMJ, 2003. 326(7394): p. 841-4.
34. Gray, S.L., et al., Cumulative use of strong anticholinergics and incident dementia: a prospective cohort study. JAMA internal medicine, 2015. 175(3): p. 401-7.
35. Donnellan, C.A., et al., Oxybutynin and cognitive dysfunction. BMJ, 1997. 315(7119): p. 1363-4.
36. Wagg, A., et al., Randomised, multicentre, placebo-controlled, double-blind crossover study investigating the effect of solifenacin and oxybutynin in elderly people with mild cognitive impairment: the SENIOR study. European Urology, 2013. 64(1): p. 74-81.
37. Zellner, M., et al., Trospium chloride and oxybutynin hydrochloride in a german study of adults with urinary urge incontinence: results of a 12-week, multicenter, randomized, doubleblind, parallel-group, flexible-dose noninferiority trial. Clinical therapeutics, 2009. 31(11): p. 2519-39.
38. Aziminekoo, E., et al., Oxybutynin and tolterodine in a trial for treatment of overactive bladder in Iranian women. J Family Reprod Health, 2014. 8(2): p. 73-6.
39. Tsao, J.W. and K.M. Heilman, Transient memory impairment and hallucinations associated with tolterodine use. N Engl J Med, 2003. 349(23): p. 2274-5.
40. Edwards, K.R. and J.T. O’Connor, Risk of delirium with concomitant use of tolterodine and acetylcholinesterase inhibitors. J Am Geriatr Soc, 2002. 50(6): p. 1165-6.
41. Wagg, A., et al., The efficacy and tolerability of the beta3-adrenoceptor agonist mirabegron for the treatment of symptoms of overactive bladder in older patients. Age Ageing, 2014. 43(5): p. 666-75.
42. Layton, D., G.L. Pearce, and S.A. Shakir, Safety profile of tolterodine as used in general practice in England: results of prescriptionevent monitoring. Drug Saf, 2001. 24(9): p. 703-13.
43. Oelke, M., et al., Appropriateness of oral drugs for long-term treatment of lower urinary tract symptoms in older persons: results of a systematic literature review and international consensus validation process (LUTS-FORTA 2014). Age Ageing, 2015. 44(5): p. 745-55.
44. Kay, G.G., et al., Evaluation of cognitive function in healthy older subjects treated with fesoterodine. Postgraduate medicine, 2012. 124(3): p. 7-15.
45. Kay, G., et al., Differential effects of the antimuscarinic agents darifenacin and oxybutynin ER on memory in older subjects. European Urology, 2006. 50(2): p. 317-26.
46. Herschorn, S., et al., Tolerability of solifenacin and oxybutynin immediate release in older (> 65 years) and younger (</= 65 years) patients with overactive bladder: sub-analysis from a Canadian, randomized, double-blind study. Current medical research and opinion, 2011. 27(2): p. 375-82.
47. Wesnes, K.A., et al., Exploratory pilot study assessing the risk of cognitive impairment or sedation in the elderly following single doses of solifenacin 10 mg. Expert opinion on drug safety, 2009. 8(6): p. 615-26.
48. Yamaguchi, O., et al., Safety and efficacy of mirabegron as ‘add-on’ therapy in patients with overactive bladder treated with solifenacin: a post-marketing, open-label study in Japan (MILAI study). BJU Int, 2015. 116(4): p. 612-22.
49. Sand, P.K., et al., Trospium chloride once-daily extended release is efficacious and tolerated in elderly subjects (aged >/= 75 years) with overactive bladder syndrome. BJU international, 2011. 107(4): p. 612-20.
50. Staskin, D., Kay, G., Tannenbaum,C., Goldman, H.B., Bhashi, K., Ling, J., Oefelein, M.G., Trospium chloride has no effect on memory testing and is assay undetectable in the central nervous system of older patients with overactive bladder. International journal of Clinical Practice, 2010. 64(9): p. 1294 – 1300.
51. Isik, A.T., et al., Trospium and cognition in patients with late onset Alzheimer disease. J Nutr Health Aging, 2009. 13(8): p. 672-6.
52. Staskin, D., Kay, G., Tannenbaum, C., Goldman, H.B., Bhash,i K., Ling, J., Oefelein, M.G., Trospium chloride is undetectable in older human central nervous system. Journal of the American Geriatrics Society, 2010. 58(8): p. 1618 – 1619.
53. Wagg, A., et al., The efficacy and tolerability of the beta3-adrenoceptor agonist mirabegron for the treatment of symptoms of overactive bladder in older patients. Age Ageing, 2014. 43(5): p. 666-75.
54. Rochon, P.A., et al., Age- and gender-related use of low-dose drug therapy: the need to manufacture low-dose therapy and evaluate the minimum effective dose. J Am Geriatr Soc, 1999. 47(8): p. 954-9.
55. Qato, D.M., et al., Changes in Prescription and Over-the-Counter Medication and Dietary Supplement Use Among Older Adults in the United States, 2005 vs 2011. JAMA Intern Med, 2016. 176(4): p. 473-82.
56. Kashyap, M., M. Tu le, and C. Tannenbaum, Prevalence of commonly prescribed medications potentially contributing to urinary symptoms in a cohort of older patients seeking care for incontinence. BMC Geriatr, 2013. 13: p. 57.
57. Hashimoto, M., et al., Urinary incontinence: an unrecognised adverse effect with donepezil. Lancet, 2000. 356(9229): p. 568.
58. Starr, J.M., Cholinesterase inhibitor treatment and urinary incontinence in Alzheimer’s disease. J Am Geriatr Soc, 2007. 55(5): p. 800-1.
59. Terry, A.V., Jr. and J.J. Buccafusco, The cholinergic hypothesis of age and Alzheimer’s disease-related cognitive deficits: recent challenges and their implications for novel drug development. The Journal of pharmacology and experimental therapeutics, 2003. 306(3): p. 821-7.
60. Feinberg, M., The problems of anticholinergic adverse effects in older patients. Drugs Aging, 1993. 3(4): p. 335-48.
61. Wagg, A., C. Verdejo, and U. Molander, Review of cognitive impairment with antimuscarinic agents in elderly patients with overactive bladder. International journal of Clinical Practice, 2010. 64(9): p. 1279-86.
62. Gray, S.L., et al., Cumulative use of strong anticholinergics and incident dementia: a prospective cohort study. JAMA internal medicine, 2015. 175(3): p. 401-7.
63. Fox, C., et al., Effect of medications with anticholinergic properties on cognitive function, delirium, physical function and mortality: a systematic review. Age Ageing, 2014. 43(5): p. 604-15.
64. Fox, C., et al., The impact of anticholinergic burden in Alzheimer’s dementia-the LASERAD study. Age and Ageing, 2011. 40(6): p. 730- 5.
65. Jewart, R.D., et al., Cognitive, behavioral, and physiological changes in Alzheimer disease patients as a function of incontinence medications. Am J Geriatr Psychiatry, 2005. 13(4): p. 324-8.
66. Marti, N., Nebenwirkungen aktuell. pharma-kritik, 2019. 41(4): p. 13 – 16.
67. Malek, J.M., et al., The effect of age on stress and urgency urinary incontinence outcomes in women undergoing primary midurethral sling. Int Urogynecol J, 2015. 26(6): p. 831-5.
68. Tennstedt, S., Design of the Stress Incontinence Surgical Treatment Efficacy Trial (SISTEr). Urology, 2005. 66(6): p. 1213-7.
69. Hellberg, D., et al., The very obese woman and the very old woman: tension-free vaginal tape for the treatment of stress urinary incontinence. Int Urogynecol J Pelvic Floor Dysfunct, 2007. 18(4): p. 423-9.
70. Kim, J., et al., Worse long-term surgical outcomes in elderly patients undergoing SPARC retropubic midurethral sling placement. BJU international, 2011. 108(5): p. 708-12.
71. Nilsson, C.G., et al., Long-term Results of the Tension-Free Vaginal Tape (TVT) Procedure for Surgical Treatment of Female Stress Urinary Incontinence. Int Urogynecol J Pelvic Floor Dysfunct, 2001. 12 Suppl 2: p. 5-8.
72. Everaert K, Sriram R, A. Kohan A, et al. The efficacy and safety of onabotulinumtoxinA and solifenacin compared to placebo in solifenacin-naïve patients with idiopathic overactive bladder: Results from a multicentre, randomised, double-blind, phase 3b trial. European Urology Supplements, Volume 15, Issue 3, March 2016, Pages e877, e877
73. Visco AG, Brubaker L, Richter HE, et al.; Pelvic Floor Disorders Network. Anticholinergic versus botulinum toxin A comparison trial for the treatment of bothersome urge urinary incontinence: ABC trial. Contemp Clin Trials. 2012 Jan;33(1):184- 96.
74. Liao, C.H. and H.C. Kuo, Increased risk of large post-void residual urine and decreaswed longterm success rate after intravesical onabotulinumtoxinA injection for refractory idiopathic detrusor overactivity. The Journal of urology, 2013. 189(5): p. 1804-10.
75. Getliffe, K., et al., Absorbent products for incontinence: ‘treatment effects’ and impact on quality of life. J Clin Nurs, 2007. 16(10): p. 1936-45.
la gazette médicale
- Vol. 9
- Ausgabe 7
- Dezember 2020