- Mise à jour sur le traitement du syndrome de Parkinson idiopathique
Le syndrome de Parkinson idiopathique (SPI) est l’une des maladies neurodégénératives les plus fréquentes. Le principal mécanisme pathologique est la dégénérescence des neurones dopaminergiques dans une partie du cerveau appelée substantia nigra, qui peut entraîner une bradykinésie, une rigidité et/ou un tremblement de repos et de nombreux symptômes non moteurs. L’amélioration de la qualité de vie est au premier plan du traitement. Pour le stade avancé de la maladie, les thérapies invasives telles que la stimulation cérébrale profonde et les thérapies par pompe à perfusion constituent des options établies et fondées sur des preuves. Le présent article illustre le traitement du SPI en se concentrant sur l’état actuel de la thérapie, les possibilités futures de traitement par voie orale et invasif ainsi que les approches neuroprotectrices potentielles.
Parkinson’s disease (PD) is one of the most common neurodegenerative diseases. The main pathomechanism is the degeneration of doperminergic neurons in the substantia nigra. It can lead to bradykinesia, rigidity, resting tremor, and numerous non-motor symptoms. Treatment is focused on improving the patient’s quality of life. For the advanced stages of the disease, invasive therapies such as deep brain stimulation and continuous pump treatment, are established and evidence-based options. This article deals with the therapy of PD with a focus on the current therapy, future oral and invasive treatment options, and potential neuroprotective approaches.
Key words: parkinson’s disease, deep brain stimulation, continuous pump treatment, neuroprotective approaches
La maladie de Parkinson MP (également appelée Morbus Parkinson ou syndrome parkinsonien idiopathique, SPI) est la deuxième maladie neurodégénérative la plus fréquente, avec une prévalence de 100-200 cas pour 100’000 habitants. Elle est due à la dégénérescence des neurones dopaminergiques de la substantia nigra. Selon les critères diagnostiques actuels, le diagnostic requiert entre autres une bradykinésie, une rigidité et/ou un tremblement de repos (4-6 Hz) (1).
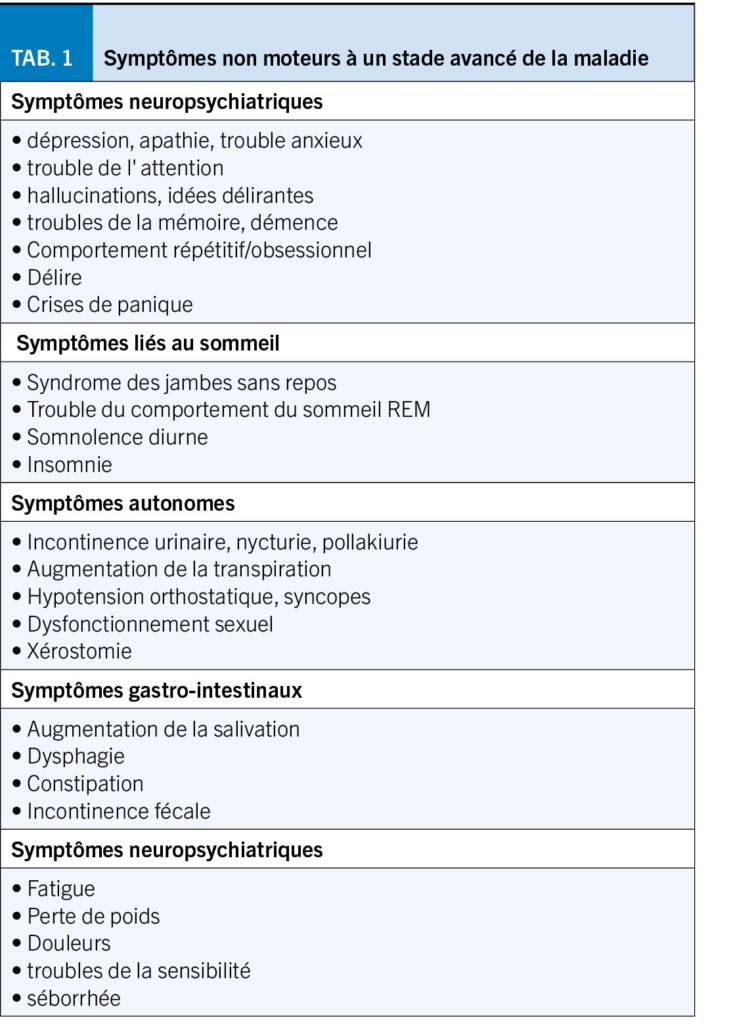
Outre les symptômes moteurs, de nombreux symptômes non moteurs peuvent également apparaître, qui sont généralement très gênants pour les patients et qui déterminent essentiellement leur qualité de vie (Tab. 1). Après plusieurs années de traitement, presque tous les patients présentent des fluctuations motrices et parfois aussi non motrices (p. ex. détérioration de la stimulation ou de la cognition en périodes OFF) et des dyskinésies.
La thérapie actuelle – médicaments par voie orale
Le traitement actuel vise un traitement symptomatique et doit être commencé lorsque des restrictions quotidiennes apparaissent. Après plus de 50 ans, la lévodopa reste le traitement le plus efficace du SPI. En règle générale, les patients atteints du SPI ressentent une amélioration significative de leurs symptômes moteurs, bien que des doses plus élevées soient souvent nécessaires pour améliorer le tremblement. Une réponse positive à la L-Dopa (>30% de l’UPDRS III) renforce le diagnostic du SPI, alors qu’une absence de réponse doit faire penser à un syndrome parkinsonien atypique.
On a longtemps spéculé sur les effets neurotoxiques de la L-Dopa. De plus, afin d’éviter les dyskinésies et les fluctuations d’efficacité comme complications tardives, le traitement par la L-Dopa a été retardé le plus longtemps possible, en particulier chez les jeunes patients, et les agonistes dopaminergiques (AD) ont été utilisés de préférence. Des études récentes ont permis de dissiper ces doutes et de montrer qu’un traitement précoce par la L-Dopa n’a pas d’effet négatif sur l’évolution de la maladie et que la survenue des complications tardives est principalement liée à la durée de la maladie elle-même et moins à la durée du traitement par la L-Dopa. De plus, la L-Dopa est supérieure aux AD en termes d’amélioration de la qualité de vie (2, 3). Un autre avantage de la L-Dopa par rapport à l’AD est son profil de risque plus favorable, avec moins d’effets secondaires tels que les hallucinations, les troubles du contrôle des impulsions et les troubles du sommeil.
Si des fluctuations motrices se développent à un stade avancé, il est possible de raccourcir les intervalles entre les prises, de prolonger la durée d’action de la L-Dopa en inhibant la dégradation de la dopamine au moyen d’inhibiteurs de la MAO-B et de la COMT ou d’ajouter un AD à longue durée d’action. Pour le traitement des dyskinésies, une réduction de la dose de L-Dopa et/ou un traitement add-on avec de l’amantadine sont envisagés.
Lors du choix des différentes classes de substances, il convient de tenir compte des différences de puissance d’effet, des effets secondaires, de l’âge du patient, des comorbidités et du profil d’exigences psychosociales.
Médicaments oraux récemment autorisés
Avec l’opicapone (Ongentys), un autre inhibiteur de la COMT a été autorisé en Suisse en 2018 pour le traitement d’appoint des fluctuations de “fin de dose”, pour lesquelles aucune stabilisation ne peut être atteinte sous association lévodopa/combinaisons. La période OFF peut ainsi être réduite de deux heures en moyenne. Par rapport aux inhibiteurs de la COMT existants (tolcapone et entacapone), l’opicapone n’est pas hépatotoxique et ne doit être pris qu’une fois par jour en raison de sa forte affinité de liaison. Pour éviter les effets secondaires tels que dyskinésies, constipation, sécheresse buccale et problèmes d’endormissement et du sommeil, il s’est avéré utile de réduire la dose de L-Dopa de 25-30% au début du traitement (4).
En Allemagne, le premier médicament à base de L-Dopa par inhalation (Inbrija) est autorisé depuis mai 2022 pour le traitement aigu des symptômes au cours de la période OFF dans la MP. Les études cliniques ont montré une amélioration des symptômes déjà après 10 minutes par rapport au placebo, avec un effet maximal statistiquement significatif après 30 minutes, c’est-à-dire environ 15 minutes plus tôt qu’après l’administration par voie orale (5).
Traitements invasifs du SPI avancé
Si les fluctuations motrices et les dyskinésies ne peuvent être contrôlées malgré un traitement par voie oral optimal, il faut envisager des thérapies invasives telles que la stimulation cérébrale profonde (SCP), généralement dans le noyau sous-thalamique, ou un traitement par pompe à perfusion continue. Pour le traitement par pompe, on dispose d’un gel de lévodopa/carbidopa (LCIG) administré par voie gastro-duodénale, via une sonde endoscopique percutanée (PEJ), ou d’apomorphine appliquée par voie sous-cutanée.
L’administration continue ou bien des taux de médicaments aussi constants que possible dans le sang permettent de réduire significativement les périodes d’efficacité réduite et d’atténuer les dyskinésies. Les patients et leurs proches doivent être impliqués dans la décision de traitement et informés des avantages et des inconvénients de chaque option thérapeutique.
Le traitement par pompe est surtout envisageable pour les patients chez qui la SCP est contre-indiqué, par exemple chez les patients âgés souffrant de démence légère ou modérée, de comorbidités psychiatriques ou de contre-indication à une intervention neurochirurgicale. La thérapie par pompe à perfusion n’est pas indiquée en cas de tremblements résistants aux médicaments et de troubles du contrôle des impulsions. Le choix entre les deux systèmes de pompe est déterminé par les effets secondaires possibles et la pratique clinique : La mise en place d’une sonde (PEJ), nécessaire pour la pompe à L-Dopa, est liée à un risque de complications locales telles qu’une péritonite ou des infections autour de la stomie, ainsi qu’à des problèmes avec la sonde (p. ex. dislocation). Plus rarement, une polyneuropathie peut survenir en raison des doses élevées de L-Dopa.
L’apomorphine, un agoniste dopaminergique pour le traitement de périodes OFF, peut également être administrée par voie sous-cutanée (s.c.), outre la forme d’injection continue. L’avantage est qu’elle peut être considéré comme le moyen le moins invasif par rapport à la Duodopa et la SCP. Une étude récemment publiée a en outre montré qu’une perfusion nocturne continue d’apomorphine pouvait améliorer de manière significative la qualité du sommeil des patients atteints du SPI (6). Les effets secondaires les plus fréquents de l’apomorphine s.c. sont l’apparition de nodules locaux et l’irritation de la peau, qui surviennent chez presque tous les patients, mais qui entraînent rarement l’arrêt du traitement (7).
Nouvelles formes d’administration futures de la L-Dopa et de l’apomorphine
L’effet d’une application sous-cutanée de L-Dopa (sous forme de foslévodopa-foscarbidopa) a été étudié dans le cadre d’un essai clinique de phase III et une demande d’autorisation de mise sur le marché a été déposée (NCT04380142). En raison de l’administration s.c., la mise en place d’une sonde n’est pas nécessaire. Parallèlement, il faut s’attendre à moins de complications systémiques telles que nausées, fatigue diurne, œdèmes périphériques, dysrégulation orthostatique, hallucinations et troubles du contrôle des impulsions par rapport à la perfusion d’apomorphine. Un facteur limitant pourrait être les réactions cutanées (8).
Une nouvelle forme d’administration a été développée : un film d’apomorphine pour une application par voie sublinguale (Kynmobi), qui représente une alternative importante pour le traitement des phases OFF et qui est actuellement testée en Europe dans le cadre d’une étude de phase III. Un effet systémique est obtenu en l’espace de 15 minutes. L’un des effets secondaires les plus fréquemment rapportés sont les réactions au niveau des muqueuses oropharyngées (9).
Du nouveau concernant la SCP
L’étude EARLY-STIM publiée en 2013 a démontré que la SCP entraîne chez les patients atteints du SPI une amélioration significative de la qualité de vie à un stade précoce de la maladie, par rapport au meilleur traitement médicamenteux possible (10, 11). Ainsi, la SCP ne doit pas être considérée comme l’ultime solution, mais plutôt comme une alternative thérapeutique chez les patients ayant des fluctuations motrices et des dyskinésies débutantes, c’est-à-dire étant à un stade plus précoce dans l’évolution de la maladie.
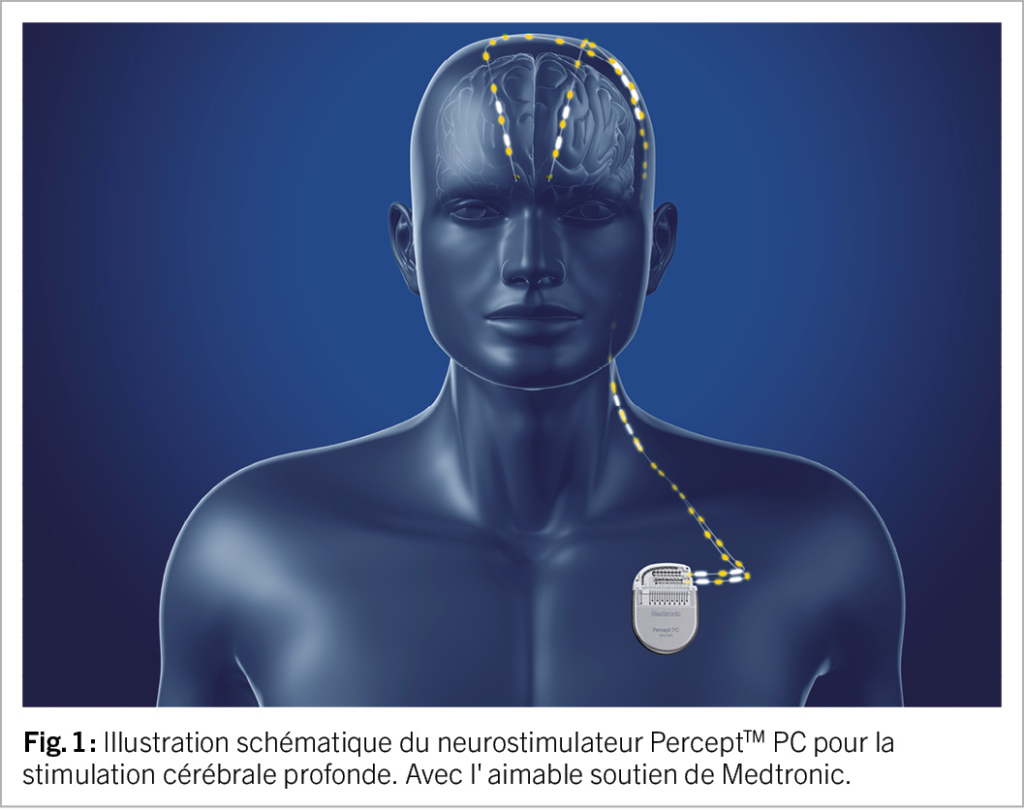
De nouveaux développements prometteurs ont vu le jour ces dernières années pour optimiser les paramètres de stimulation. De nouvelles électrodes directionnelles permettent, grâce au “steering”, d’orienter la stimulation de manière excentrée dans l’espace afin d’élargir la fenêtre thérapeutique et de réduire les effets secondaires liés à la stimulation (12). Dans le passé, la programmation de la SCP nécessitait souvent des séances répétées pour optimiser les paramètres de stimulation. Entre-temps, il existe des approches d’imagerie et d’électrophysiologie qui permettent de déterminer plus rapidement la configuration optimale de la stimulation et de réduire les efforts nécessaires pour tester la stimulation (13). Une technique dite “adaptative” ou “en boucle fermée”, c’est-à-dire l’enregistrement d’un biomarqueur électrophysiologique spécifique à la maladie (activité des ondes bêta) avec une stimulation adaptée aux besoins et couplée à ce biomarqueur, représente depuis longtemps une perspective pour améliorer l’efficacité de la SCP. Les premiers systèmes de SCP disposent déjà d’une technologie de détection qui permet d’enregistrer l’activité bêta. Cette technologie pourrait être utilisée à l’avenir dans le cadre de systèmes de SCP adaptatifs ou “en boucle fermée” (14).
Approches potentiellement neuroprotectrices
Une compréhension toujours plus approfondie des bases moléculaires du SPI pourrait ouvrir la voie à de nouveaux traitements causaux. Actuellement, plusieurs approches thérapeutiques prometteuses, potentiellement modificatrices de la maladie, sont en cours d’essais cliniques, dont certains sont déjà avancés :
► Agonistes des récepteurs du glucagon-like peptide 1 (GLP-1) : la résistance à l’insuline est associée à un risque accru de SPI. L’effet neuroprotecteur des agonistes du GLP-1, qui sont déjà autorisés dans le diabète, a déjà été démontré dans des modèles animaux et semble être confirmé dans les pre-
mières études. L’agoniste du GLP-1 l’exénatide est la substance la plus prometteuse en cours de test clinique (15).
► Stratégies d’immunisation : Les stratégies d’immunisation active et passive visent à empêcher l’agrégation pathologique de l’α-synucléine.
► Inhibiteurs de c-ABL kinase : certaines substances de cette catégorie sont déjà autorisées pour le traitement de la LLC. Dans le cas du SPI, il y a également une suractivité de cette kinase. Une régulation à la baisse de l’activité de la kinase devrait influencer positivement l’évolution de la maladie (16).
► Glucocérébrosidase : Les mutations dans la GBA représentent un facteur de risque important pour le SPI. Les approches thérapeutiques actuelles visent à augmenter l’activité de la glucocérébrosidase (17).
► LRRK2 : Une mutation dans le gène LRRK2 peut conduire à un syndrome parkinsonien monogénique. Les approches thérapeutiques actuelles tentent de modifier l’activité pathologiquement altérée (généralement gain de fonction) de cette kinase (18).
Cet article est une traduction de « der informierte arzt » 10_2022
Copyright Aerzteverlag medinfo AG
Clinique de neurologie, Hôpital cantonal de Saint-Gall
Rorschacher Strasse 95
9007 Saint-Gall
Clinique de neurologie, Hôpital cantonal de Saint-Gall
Rorschacher Strasse 95
9007 Saint-Gall
Clinique de neurologie, Hôpital cantonal de Saint-Gall
Rorschacher Strasse 95
9007 Saint-Gall
L’auteur déclare avoir participé à des comités consultatifs et avoir reçu des honoraires de conférencier de Novo Nordisk, Sanofi, MSD, Boehringer Ingelheim, Servier et Astra Zeneca.
- Le SPI est l’une des maladies neurodégénératives les plus fréquentes. Le diagnostic est posé cliniquement sur la base de la présence d’une bradykinésie, d’une rigidité et/ou d’un tremblement de repos.
- La L-Dopa reste le traitement par voie orale de la maladie de Parkinson le plus efficace. Son utilisation précoce est sûre et supérieure à l’utilisation d’AD.
- De nombreuses autres options de traitement par voie orale symptomatique sont disponibles. De nouvelles formulations de L-Dopa et d’apomorphine sont actuellement en cours de développement.
- À un stade avancé, les systèmes de pompe à perfusion continue ou la SCP constituent de bonnes alternatives au traitement par voie orale.
- Les nouvelles connaissances sur les mécanismes d’apparition de la maladie suscitent l’espoir de développer des traitements modificateurs de la maladie.
1. Postuma RB, Berg D, Stern M, Poewe W, Olanow CW, Oertel W, et al. MDS clinical diagnostic criteria for Parkinson’s disease. Mov Disord. 2015;30(12):1591-601.
2. Verschuur CVM, Suwijn SR, Boel JA, Post B, Bloem BR, van Hilten JJ, et al. Randomized Delayed-Start Trial of Levodopa in Parkinson’s Disease. N Engl J Med. 2019;380(4):315-24.
3. Cilia R, Akpalu A, Sarfo FS, Cham M, Amboni M, Cereda E, et al. The modern pre-levodopa era of Parkinson’s disease: insights into motor complications from sub-Saharan Africa. Brain. 2014;137(Pt 10):2731-42.
4. Feldman M, Margolesky J. Opicapone for the treatment of Parkinson’s disease: a review. Int J Neurosci. 2021:1-12.
5. Lipp MM, Hickey AJ, Langer R, LeWitt PA. A technology evaluation of CVT-301 (Inbrija): an inhalable therapy for treatment of Parkinson’s disease. Expert Opin Drug Deliv. 2021;18(11):1559-69.
6. De Cock VC, Dodet P, Leu-Semenescu S, Aerts C, Castelnovo G, Abril B, et al. Safety and efficacy of subcutaneous night-time only apomorphine infusion to treat insomnia in patients with Parkinson’s disease (APOMORPHEE): a multicentre, randomised, controlled, double-blind crossover study. Lancet Neurol. 2022;21(5):428-37.
7. Katzenschlager R, Poewe W, Rascol O, Trenkwalder C, Deuschl G, Chaudhuri KR, et al. Apomorphine subcutaneous infusion in patients with Parkinson’s disease with persistent motor fluctuations (TOLEDO): a multicentre, double-blind, randomised, placebo-controlled trial. Lancet Neurol. 2018;17(9):749-59.
8. Poewe W, Stocchi F, Arkadir D, Ebersbach G, Ellenbogen AL, Giladi N, et al. Subcutaneous Levodopa Infusion for Parkinson’s Disease: 1-Year Data from the Open-Label BeyoND Study. Mov Disord. 2021;36(11):2687-92.
9. Olanow CW, Factor SA, Espay AJ, Hauser RA, Shill HA, Isaacson S, et al. Apomorphine sublingual film for off episodes in Parkinson’s disease: a randomised, double-blind, placebo-controlled phase 3 study. Lancet Neurol. 2020;19(2):135-44.
10. Schuepbach WM, Rau J, Knudsen K, Volkmann J, Krack P, Timmermann L, et al. Neurostimulation for Parkinson’s disease with early motor complications. N Engl J Med. 2013;368(7):610-22.
11. Deuschl G, Schupbach M, Knudsen K, Pinsker MO, Cornu P, Rau J, et al. Stimulation of the subthalamic nucleus at an earlier disease stage of Parkinson’s disease: concept and standards of the EARLYSTIM-study. Parkinsonism Relat Disord. 2013;19(1):56-61.
12. Steigerwald F, Muller L, Johannes S, Matthies C, Volkmann J. Directional deep brain stimulation of the subthalamic nucleus: A pilot study using a novel neurostimulation device. Mov Disord. 2016;31(8):1240-3.
13. Horn A, Kuhn AA. Lead-DBS: a toolbox for deep brain stimulation electrode localizations and visualizations. Neuroimage. 2015;107:127-35.
14. Beuter A, Lefaucheur JP, Modolo J. Closed-loop cortical neuromodulation in Parkinson’s disease: An alternative to deep brain stimulation? Clin Neurophysiol. 2014;125(5):874-85.
15. Brauer R, Wei L, Ma T, Athauda D, Girges C, Vijiaratnam N, et al. Diabetes medications and risk of Parkinson’s disease: a cohort study of patients with diabetes. Brain. 2020;143(10):3067-76.
16. Zhou ZH, Wu YF, Wang XM, Han YZ. The c-Abl inhibitor in Parkinson disease. Neurol Sci. 2017;38(4):547-52.
17. Schapira AH. Glucocerebrosidase and Parkinson disease: Recent advances. Mol Cell Neurosci. 2015;66(Pt A):37-42.
18. Vuletic V, Racki V, Papic E, Peterlin B. A Systematic Review of Parkinson’s Disease Pharmacogenomics: Is There Time for Translation into the Clinics? Int J Mol Sci. 2021;22(13).
la gazette médicale
- Vol. 12
- Ausgabe 6
- Oktober 2023