- Nouveaux anticorps dans la prophylaxie de la migraine
La migraine, deuxième maladie neurologique la plus fréquente au monde, provoque une très grande souffrance. Les anticorps CGRP agissent spécifiquement sur le système douloureux du trijumeau et permettent un ciblage sélectif. Dans les directives actuelles de la Fédération européenne des céphalées, les anticorps monoclonaux sont proposés et recommandés comme médicaments prophylactiques pour la prévention des crises de migraine épisodiques et chroniques.
As the second most common neurological disease worldwide, migraine causes a great deal of suffering. The CGRP antibodies act specifically on the trigeminal pain system and allow selective targeting. In the current guidelines of the European Headache Federation, the monoclonal antibodies are proposed and recommended as prophylactic drugs for the prevention of episodic and chronic migraine attacks.
Key Words: Migraine, episodic and chronic migraine attacks, calcitonin-gene-related peptide
La migraine est la deuxième maladie neurologique la plus fréquente au monde selon la Global Burden of Disease Study. Elle est responsable de plus de charge de morbidité que toutes les autres maladies neurologiques réunies (1). Pourtant, on estime qu’ en Europe, seuls 2 à 14 % des patients éligibles prennent des médicaments préventifs contre la migraine (2).
La migraine se manifeste cliniquement par des crises récurrentes de céphalées modérées à sévères, accompagnées de nausées, de vomissements, de phonophobie et/ou de photophobie, qui durent de 4 à 72 heures (3).
En ce qui concerne la physiopathologie, il est généralement admis qu’ une activation périphérique et centrale du système trigéminovasculaire est à l’ origine de la maladie (4). Des recherches approfondies menées au cours des trois dernières décennies ont montré que le peptide lié au gène de la calcitonine (calcitonin-gene-related peptide, CGRP) joue un rôle important dans cette activation. Le CGRP est un puissant vasodilatateur ainsi qu’ un neurotransmetteur qui joue également un rôle important dans l’ homéostasie des systèmes gastro-intestinal et cardiovasculaire. Ce neuropeptide de 37 acides aminés est présent sous deux isoformes, sous forme de α-CGRP, principalement dans le système nerveux périphérique et central, et sous forme de β-CGRP dans la transmission entérique. Le CGRP transmet ses effets principalement par ses interactions avec le récepteur du CGRP (5).
Le traitement prophylactique classique comprend un grand nombre de médicaments, dont les β-bloquants (métoprolol, propranolol*), les antiépileptiques (p. ex., le topiramate*), les antagonistes du Ca (flunarizine*) [*= autorisé en CH], les sartans (candésartan) et d’ autres antihypertenseurs ainsi que divers antidépresseurs. Cependant, ce n’ est qu’ au cours des 10 à 20 dernières années que de nouveaux médicaments antimigraineux (les gépants et les anticorps monoclonaux) ciblant le CGRP ou son récepteur ont été développés.
Gépants
Les premiers antagonistes spécifiques du CGRP, appelés gépants, ont montré une efficacité dans les crises de migraine aiguë. Le telcagépant a montré une bonne efficacité avec peu d’ effets secondaires lors de la phase III. Cependant, son utilisation permanente et quotidienne a révélé une hépatotoxicité, si bien que son développement a été interrompu (5). Deux représentants de cette classe récemment développés, le rimégépant et l’ ubrogépant, n’ ont pas montré d’ hépatotoxicité pertinente et ont été approuvés par la FDA pour le traitement des crises de migraine. Entre-temps, le potentiel de cette classe de substances en tant que traitement prophylactique a également été reconnu. La FDA a récemment approuvé l’ atogépant spécifiquement pour le traitement préventif de la migraine (6). Actuellement, l’ effet prophylactique du rimégépant est également étudié dans le cadre d’ une étude clinique (7).
Anticorps anti-CGRP
En raison de leur effet prolongé (demi-vie d’ environ 30 jours), les anticorps monoclonaux anti-CGRP sont utilisés pour la prophylaxie spécifique des migraines épisodiques fréquentes et des migraines chroniques. Leur action vise à réduire la fréquence et/ou l’ intensité des crises de migraine ainsi que les symptômes associés à la migraine. Les anticorps anti-CGRP ne traversent pas la barrière hémato-encéphalique, ce qui indique que l’ action thérapeutique dans la migraine se situe à la périphérie (5).
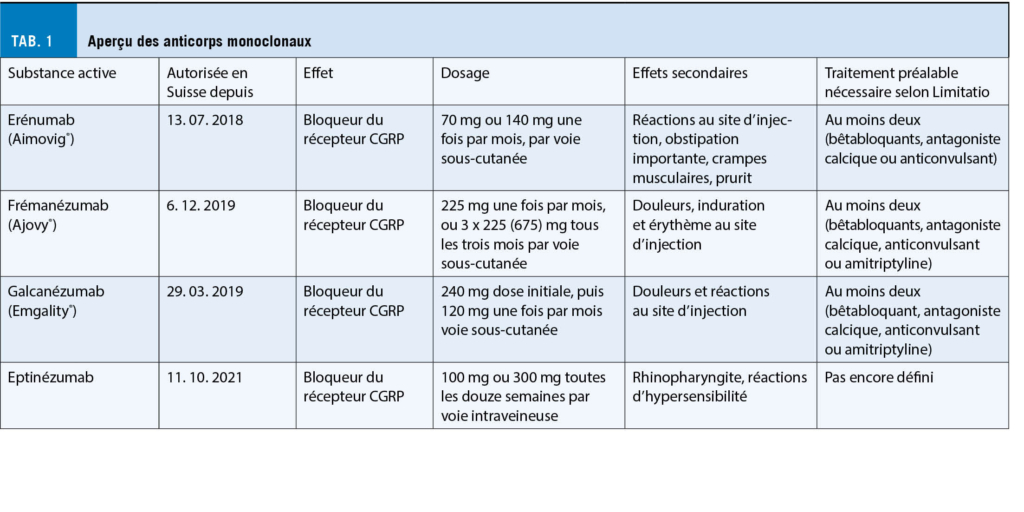
Dans la nouvelle déclaration de consensus, soutenue par la European Headache Federation et la European Academy of Neurology, les quatre anticorps monoclonaux érénumab, frémanézumab, galcanézumab et eptinézumab sont considérés comme un traitement préventif de troisième ligne (8). Le tableau 1 en donne un aperçu.
L’ un des avantages des anticorps monoclonaux CGRP par rapport aux prophylactiques classiques est leur rapidité d’ action : dès la première semaine pour l’ érénumab, le galcanézumab et le frémanézumab (9, 10, 11) et après un jour pour l’ eptinézumab (12). La toxicité hépatique potentielle comme celle des gépants et des interactions médicamenteuses hépatiques n’ ont pas été observées avec les anticorps (5).
L’ érénumab et le frémanézumab ont également été efficaces chez des patients migraineux chez lesquels 2 à 4 traitements préventifs antérieurs avaient échoué (13, 14). En outre, ils sont également utiles chez les patients souffrant de migraine chronique et de surconsommation de médicaments (11, 15, 16).
Depuis 2018, trois anticorps ont été autorisés en Suisse ; ils sont présentés ci-dessous. Pour ces trois préparations, une limitation (17) s’ applique, qui prescrit l’ utilisation d’ au moins 2 prophylaxies classiques de la migraine (bêtabloquants, antagonistes du calcium, anticonvulsants ou, pour le frémanézumab et le galcanézumab, également l’ amitriptyline). Tous les anticorps CGRP ne peuvent être prescrits que par des neurologues.
- L’ érénumab (Aimovig®) cible le récepteur CGRP lui-même. Dans deux études cliniques de phase III, ARISE (18) et STRIVE (19), une réduction du nombre de jours de céphalées mensuelles a été obtenue. Entre-temps, une étude de suivi ouverte a permis de démontrer l’ efficacité à long terme (réduction de la fréquence des migraines et amélioration de la qualité de vie liée à la santé) et l’ innocuité de l’ érénumab dans la prévention des migraines pendant 5 ans (20). Les effets secondaires les plus fréquents sont des réactions au site d’ injection, une constipation, des crampes musculaires et des démangeaisons. Le dernier résumé des caractéristiques du produit de l’ érénumab a été mis à jour afin d’ informer les médecins et de mettre en garde les patients contre les cas de constipation modérée à sévère associés à des hospitalisations. La surveillance post-marketing a mis en évidence des cas d’ hypertension artérielle comme effet secondaire (22). L’ érénumab est administré une fois par mois à raison de 70 mg en injection sous-cutanée. Avec la limitatio adaptée, une dose de 140 mg par mois peut également être prescrite en cas de réponse insuffisante (21).
- Frémanézumab (Ajovy®). Dans l’ étude multicentrique randomisée en double aveugle et en groupes parallèles FOCUS, le frémanézumab a obtenu une réduction cliniquement significative du nombre de jours de migraine, même chez les patients souffrant de migraine épisodique et chronique difficile à traiter (14). Il est également efficace dans les migraines épisodiques de haute fréquence, réduit les symptômes d’ accompagnement et le recours à la médication PRN (pro re nata), administée au besoin (23). Les effets secondaires les plus fréquents dans les études étaient la douleur, le durcissement et l’ érythème au site d’ injection. Depuis novembre 2020, un stylo prérempli est disponible en Suisse en plus de la seringue préremplie. Le patient peut choisir entre un dosage mensuel de 225 mg ou un dosage trimestriel : 3 x 225 mg (trois stylos prêts à l’ emploi). L’ application se fait par voie sous-cutanée (21). La limite a été adaptée au 01.11.2021.
- Le galcanézumab (Emgality®). Dans deux études cliniques de phase III (EVOLVE-1 et EVOLVE-2), des injections mensuelles de galcanézumab pendant 6 mois ont entraîné une réduction significative des jours de céphalées migraineuses mensuelles par rapport au placebo. Le galcanézumab a permis de réduire significativement les jours de céphalées migraineuses aussi bien dans le groupe des migraines épisodiques de basse fréquence que dans celui des migraines épisodiques de haute fréquence (10). Les doses examinées dans les études ne différaient pas en termes d’ efficacité (24, 25). Cependant, dans l’ étude EVOLVE-2, les effets indésirables semblaient être un peu plus fréquents dans le bras de traitement à 240 mg (25). Les effets indésirables les plus fréquents selon les études d’ autorisation de mise sur le marché sont les douleurs et les réactions au site d’ injection. Le galcanézumab est administré une fois par mois à raison de 120 mg en injection sous-cutanée. Au début du traitement, une dose initiale unique de 240 mg (2 injections) doit être administrée (21).
- Eptinézumab. Il s’ agit du seul anticorps monoclonal humanisé administré par voie intraveineuse qui bloque directement le CGRP. Il est administré tous les trois mois en perfusion intraveineuse. L’ eptinézumab a été approuvé par la FDA (février 2020).En Suisse, l’ autorisation de Swissmedic a été accordée en octobre 2021. Dans une étude randomisée et contrôlée par placebo (PROMISE-1), l’ administration unique de 100 et 300 mg d’ eptinézumab par voie intraveineuse sur une période de 12 semaines s’ est avérée significativement plus efficace que le placebo pour la prophylaxie de la migraine épisodique. L’ eptinézumab a été bien toléré (12). Chez les adultes souffrant de migraine, le profil de sécurité et de tolérance était favorable. La rhinopharyngite et les réactions d’ hypersensibilité sont les événements indésirables les plus fréquents (26).
Environ 20 à 30 % des patients ne répondent pas au traitement. De faibles pourcentages d’ anticorps neutralisants ont été trouvés chez les patients des groupes actifs dans les études, mais ils ne semblent pas avoir d’ influence sur les résultats cliniques, car leurs titres étaient très faibles (27).
Malgré un début d’ action généralement rapide, les anticorps doivent être utilisés pendant au moins trois à six mois à une dose maximale tolérée afin de pouvoir évaluer correctement leur efficacité. La quantification du succès du traitement peut se faire en
calculant le pourcentage de réduction des jours de migraine mensuels ou des jours de céphalées mensuels d’ intensité moyenne à forte (8). En Suisse, un traitement de 12 mois est suivi d’ une pause thérapeutique conformément à la Limitatio. Une interruption de plus longue durée, telle qu’ elle était initialement prévue, n’ est pas soutenue par les études actuelles (28).
Conclusion et perspectives : Tous les anticorps monoclonaux CGRP ont montré une bonne efficacité et une bonne tolérance dans les études cliniques, ainsi qu’ un profil de sécurité favorable. A l’ heure actuelle, il n’ existe aucune preuve de la supériorité d’ un seul anticorps par rapport aux autres pour les patients souffrant de migraine épisodique ou chronique. Des études récentes indiquent une efficacité de cette classe de médicaments dans le traitement d’ autres types de céphalées, comme la céphalée par abus médicamenteux, la céphalée en grappe (cluster headache), mais aussi les céphalées post-traumatiques.
Cet article est une traduction de « der informierte arzt » 11_2021
Copyright Aerzteverlag medinfo AG
Neurologie & Neurorehabilitation, ZURZACH Care
Quellenstrasse 34
5330 Bad Zurzach
galina.stoyanova@zurzachcare.ch
Facharzt Neurologie
Neurologie am Untertor
Erachfeldstrasse 2
8180 Bülach
www.neurologie-untertor.ch
andreas.gantenbein@zurzachcare.ch
RehaClinic Bad Zurzach und Universität Zürich
Schweiz
GS-P a reçu des bourses de voyage de Teva.
◆ Les patients présentant une fréquence ou une intensité élevée de crises de migraine ou de migraine chronique ont besoin d’ un traitement prophylactique de la migraine. Les médicaments classiques
utilisés en prophylaxie ne sont efficaces que chez une partie plutôt faible des patients.
◆ En Suisse, trois anticorps monoclonaux sont déjà disponibles pour la prophylaxie de la migraine épisodique (8 jours de migraine et plus par mois) ou chronique (15 jours de migraine et plus par mois) chez les adultes. Les jours de maux de tête doivent être consignés dans un journal pendant au moins trois mois pour que les frais soient remboursés. Les critères de limitation doivent être remplis.
◆ L’ utilisation d’ érénumab, de galcanézumab et de frémanézumab ne peut se faire pour l’ instant qu’ après l’ échec documenté d’ au moins deux autres médicaments pour la prophylaxie de la migraine ou en cas d’ intolérance à ceux-ci.
◆ La prescription et le suivi des anticorps monoclonaux doivent être effectués par un médecin spécialiste en neurologie, conformément
à la Limitatio.
◆ Lors du choix des préparations d’ anticorps, les préférences des patients en matière d’ effets secondaires et de fréquence d’ application peuvent être prises en compte.
1. GBD 2016 Neurology Collaborators. Global, regional, and national burden of neurological disorders, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol. 2019; 18:459–480.
2. Katsarava Z, Mania M, Lampl C, et al. Poor medical care for people with migraine in Europe – evidence from the Eurolight study. J Headache Pain. 2018 Feb 1;19(1):10.
3. Headache Classification Committee of the International Headache Society. The international classification of headache disorders, 3rd edition. Cephalalgia. 2018;38:1–211.
4. Ashina M, Hansen JM, Do TP, et al. Migraine and the trigeminovascular system-40 years and counting. Lancet Neurol. 2019 Aug;18(8):795-804.
5. Edvinsson L, Warfvinge K. Recognizing the role of CGRP and CGRP receptors in migraine and its treatment. Cephalalgia. 2019 Mar;39(3):366-373.
6. https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2021/215206Orig1s000ltr.pdf
7. NCT0372368. Efficacy and safety trial of rimegepant for migraine prevention in adults. Available from: https:// clinicaltrials.gov/ct2/show/NCT03732638
8. Eigenbrodt AK, Ashina H, Khan S, et al. Diagnosis and management of migraine in ten steps. Nat Rev Neurol. 2021 Aug;17(8):501-514.
9. Schwedt T, Reuter U, Tepper S, et al. Early onset of efficacy with erenumab in patients with episodic and chronic migraine. J Headache Pain. 2018 Oct 1;19(1):92.
10. Silberstein SD, Stauffer VL, Day KA, et al. Galcanezumab in episodic migraine: subgroup analyses of efficacy by high versus low frequency of migraine headaches in phase 3 studies (EVOLVE-1 & EVOLVE-2). J Headache Pain. 2019 Jun 28;20(1):75.
11. Silberstein S, Ashina S, Katsarava Z, et al. The impact of fremanezumab on medication overuse in patients with chronic migraine. Neurology. 2019;92 (15 Suppl):P1.10-026.
12. Ashina M, Saper J, Cady R, et al. Eptinezumab in episodic migraine: A randomized, double-blind, placebo-controlled study (PROMISE-1). Cephalalgia. 2020 Mar;40(3):241-254.
13. Goadsby PJ, Reuter U, Lanteri-Minet M, et al. Long-Term Efficacy and Safety of Erenumab: Results From 64 Weeks of the LIBERTY Study. Neurology. 2021 Apr 28;96(22):e2724–35.
14. Ferrari MD, Diener HC, Ning X, et al. Fremanezumab versus placebo for migraine prevention in patients with documented failure to up to four migraine preventive medication classes (FOCUS): a randomised, double-blind, placebo-controlled, phase 3b trial. Lancet. 2019 Sep 21;394(10203):1030-1040.
15. Tepper SJ, Diener HC, Ashina M, et al. Erenumab in chronic migraine with medication overuse: Subgroup analysis of a randomized trial. Neurology. 2019 May 14;92(20):e2309-e2320.
16. Dodick DW, Doty EG, Aurora SK, et al. Medication overuse in a subgroup analysis of phase 3 placebo-controlled studies of galcanezumab in the prevention of episodic and chronic migraine. Cephalalgia. 2021 Mar;41(3):340-352.
17. www.spezialitaetenliste.ch
18. Dodick DW, Ashina M, Brandes JL, et al. ARISE: A Phase 3 randomized trial of erenumab for episodic migraine. Cephalalgia. 2018 May;38(6):1026-1037.
19. Goadsby PJ, Reuter U, Hallström Y, et al. Controlled Trial of Erenumab for Episodic Migraine. N Engl J Med. 2017 Nov 30;377(22):2123-2132.
20. Ashina M, Goadsby PJ, Reuter U, et al. Long-term efficacy and safety of erenumab in migraine prevention: Results from a 5-year, open-label treatment phase of a randomized clinical trial. Eur J Neurol. 2021 May;28(5):1716-1725.
21. www.compendium.ch
22. Saely S, Croteau D, Jawidzik L, et al. Hypertension: A new safety risk for patients treated with erenumab. Headache. 2021 Jan;61(1):202-208.
23. Brandes JL, Kudrow D, Yeung PP, et al. Effects of fremanezumab on the use of acute headache medication and associated symptoms of migraine in patients with episodic migraine. Cephalalgia. 2020 Apr;40(5):470-477.
24. Stauffer VL, Dodick DW, Zhang Q, et al. Evaluation of Galcanezumab for the Prevention of Episodic Migraine: The EVOLVE-1 Randomized Clinical Trial. JAMA Neurol. 2018 Sep 1;75(9):1080-1088.
la gazette médicale
- Vol. 11
- Ausgabe 2
- März 2022