- Presbyacousie, existe-t-il un entraînement?
Selon l’OMS, on estime qu’environ 1,5 milliard de personnes dans le monde sont touchées par une déficience auditive (21). La perte auditive est donc considérée comme la déficience sensorielle la plus fréquente chez l’homme. La probabilité statistique de souffrir d’une déficience auditive augmente considérablement avec l’âge. Les conséquences d’une capacité auditive et de communication réduite peuvent être l’isolement social, la perte d’autonomie et la dépression (2). La perte auditive est également considérée comme un facteur de risque important et influençable de la démence (13). Les causes sont des modifications de l’organe auditif périphérique et du système auditif central. Il est donc évident que les deux composantes doivent être pris en compte dans le cadre d’une thérapie de réhabilitation auditive optimale (8). Ce bref article a pour but de mettre en lumière les principaux aspects de la presbyacousie et d’aborder en particulier les différentes mesures thérapeutiques.
According to the WHO, it can be assumed that around 1.5 billion people worldwide are affected by hearing impairment. Hearing loss is therefore considered the most common sensory impairment in humans. With advancing age, the statistical probability of suffering from hearing loss increases significantly. Consequences of limited hearing and communication ability can include social isolation, loss of autonomy and even depression. Hearing loss is also considered an important modifiable risk factor for dementia. The causes are changes in the peripheral as well as in the central auditory system. It is therefore obvious that both components must be taken into account as part of optimal hearing rehabilitation therapy. This short overview is intended to shed light on the most important aspects of age-related hearing loss and, in particular, to address various therapeutic options.
Key Words: hearing impairment, hearing loss, hearing rehabilitation therapy
Les bases de l’audition
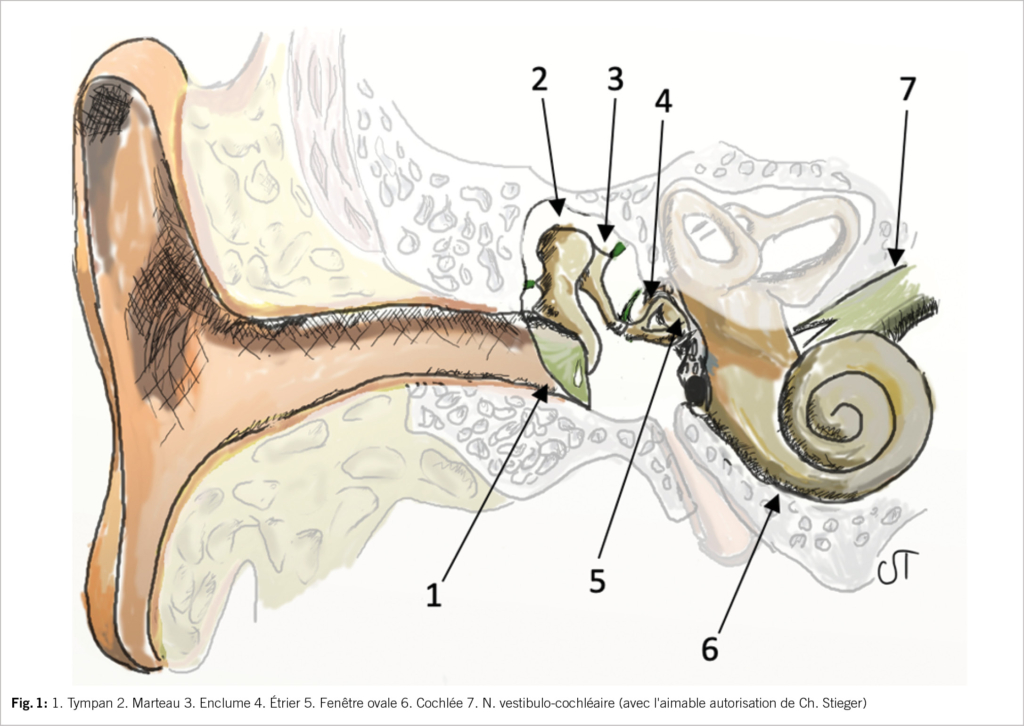
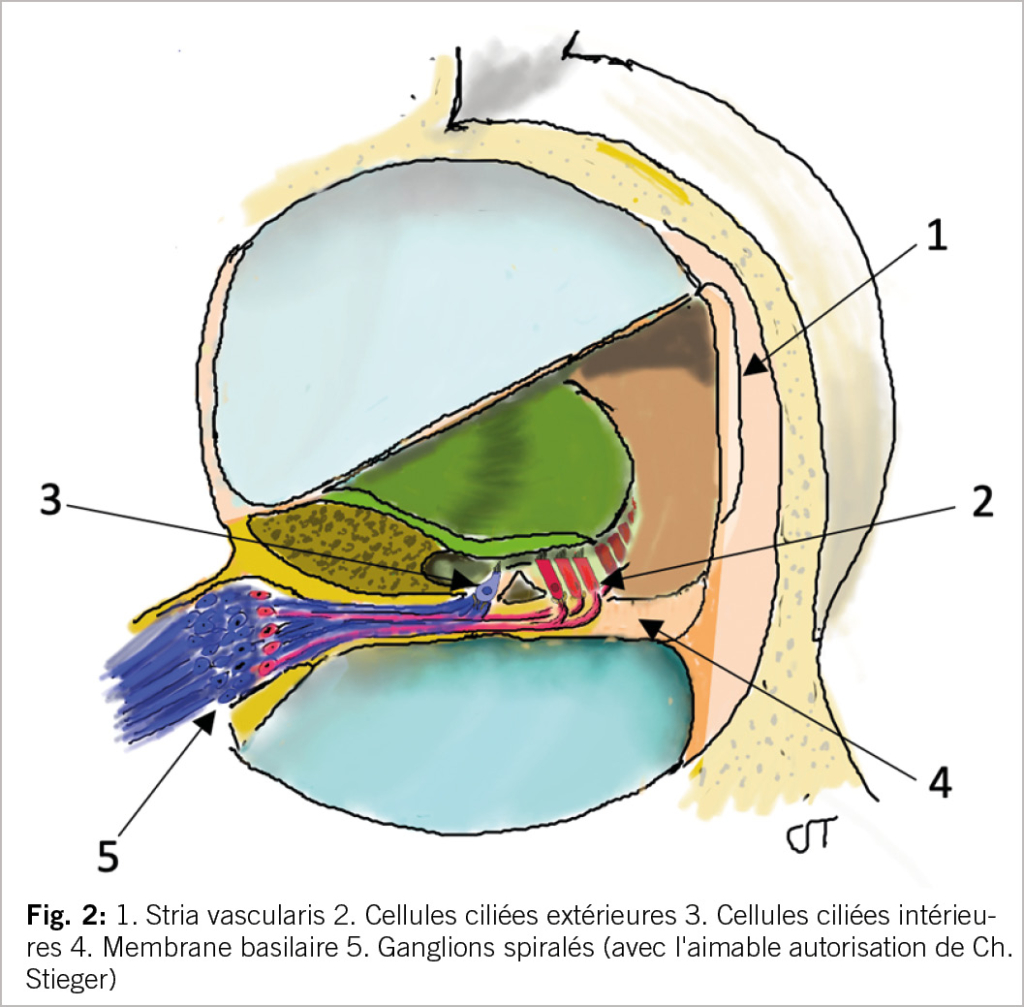
Pour qu’un événement acoustique puisse être perçu consciemment, des ondes de pression acoustique doivent atteindre le tympan et le faire vibrer. Ensuite, les osselets de l’oreille moyenne transmettent le signal sonore à la base de l’étrier. Cela est possible parce que le marteau est fermement en contact avec le tympan. Dans l’oreille moyenne, l’information acoustique n’est pas seulement transmise, mais aussi amplifiée. La base de l’étrier est reliée à l’oreille interne par la fenêtre ovale, qui est remplie de liquide (fig. 1). La vibration de la base de l’étrier génère des ondes de pression dans l’oreille interne qui, en fonction de la fréquence sonore, entraînent la déviation de la membrane basilaire à un endroit spécifique de l’oreille interne. L’organe de Corti, dans lequel sont intégrées les cellules sensorielles auditives (cellules ciliées), se trouve sur la membrane basilaire (fig. 2). La déviation de la membrane basilaire permet de générer des potentiels d’action dans les cellules ciliées, de sorte que le stimulus physique initial de la vibration acoustique est transformé en un signal neuronal. Le potentiel d’action est ensuite transmis par le VIIIe nerf crânien aux centres auditifs du tronc cérébral, puis au cortex auditif, où se produit la perception auditive consciente (15). Depuis le cortex auditif, des impulsions neuronales sont transmises à un réseau de régions cérébrales supérieures qui, à l’écoute du langage parlé, extraient et interprètent des informations acoustiques pertinentes à partir du signal acoustique, permettant ainsi de comprendre le contenu d’une phrase (9).
Les causes de la presbyacousie
L’étiologie de la presbyacousie est le plus souvent multifactorielle. Des études épidémiologiques ont montré par exemple, une forte association avec le diabète, l’obésité, le tabagisme et d’autres facteurs de risque cardiovasculaires, mais la causalité n’est pas prouvée. D’autres facteurs de risque sont l’exposition continue ou répétée au bruit. Des facteurs génétiques semblent également jouer un rôle dans la vulnérabilité aux traumatismes sonores et, plus généralement, dans la perte auditive chez les personnes âgées (3).
Il y a une trentaine d’années déjà, des efforts ont été faits pour mettre en évidence les modifications morphologiques de l’organe auditif périphérique responsables de la presbyacousie. Quatre sites principaux de lésions ont été mis en évidence. Des processus pathologiques ont pu être décelé dans l’organe de Corti, de même qu’une réduction des neurones des voies auditives périphériques et centrales. Dans certains cas, des épaississements et des calcifications de la membrane basilaire ont été mis en évidence, ce qui entrave sa capacité vibratoire. Cependant, l’atrophie de la stria vascularis, qui joue un rôle central dans l’équilibre de l’oreille interne, a été considérée comme la lésion la plus fréquente (5).
Des travaux plus récents ont pu montrer, au niveau moléculaire, que les processus hypoxiques et ischémiques semblent jouer un rôle, tout comme le stress oxydatif ou les mutations mitochondriales (8). En outre, on peut supposer qu’avec l’âge, la transmission des signaux entre les cellules nerveuses est de plus en plus perturbée, ce qui se traduit par des synaptopathies cochléaires. Malheureusement, l’audiogramme semble souvent peu sensible à ce type de modifications. Il est probablement beaucoup plus facile d’en saisir les effets en testant la compréhension de la parole dans le bruit (12).
Des modifications sont décelables avec l’âge non seulement dans l’organe auditif périphérique, mais aussi dans le système auditif central. Ainsi, le processus normal de vieillissement comprend une diminution de la densité des neurones et des synapses ainsi qu’un amincissement de la substance blanche dans la voie auditive du tronc cérébral, dans les aires auditives corticales et dans les réseaux temporaux et frontaux du cerveau, qui sont recrutés pour le traitement du langage parlé (6, 16). Ces changements structurels dans le système auditif central s’accompagnent d’une diminution de la qualité du traitement des signaux acoustiques. Pour compenser cette détérioration du traitement auditif, le cerveau des personnes âgées réagit différemment aux stimuli acoustiques que celui des jeunes. Dans des situations d’écoute particulièrement complexes, comme par exemple la compréhension de la parole dans le bruit, des zones motrices du langage sont activées en plus des réseaux auditifs pour compenser les parties floues, imprécises ou manquantes d’un signal de parole (1). Parallèlement, des régions préfrontales ou pariétales du cerveau, qui ne sont pas considérées comme faisant partie des réseaux auditifs et vocaux, sont recrutées. Les recherches actuelles partent du principe que ces régions “cognitives” soutiennent la mémoire de travail et la mémoire phonologique dans des situations d’écoute défavorables et compensent ainsi dans une certaine mesure la perte du traitement auditif (7, 20). Il se peut toutefois que cet effort supplémentaire du cerveau s’accompagne d’un effort et d’une fatigue subjectivement perceptibles.
L’examen médical
L’examen médical de l’audition commence généralement par un examen détaillé de l’histoire de la maladie, les patients faisant généralement état d’une perte auditive bilatérale. Comme la perte auditive est généralement lente et progressive, les premiers symptômes sont souvent des problèmes de compréhension de la parole, en particulier dans des situations acoustiques difficiles, par exemple en présence de bruits parasites ou dans les pièces avec réverbération. La réduction de la compréhension de la parole peut s’accompagner d’un bourdonnement de l’oreille (acouphène). De même, les personnes concernées font parfois état d’une augmentation accélérée de l’intensité sonore (recrutement). Si d’autres symptômes auriculaires tels que des vertiges, des écoulements auriculaires (otorrhée) ou des douleurs sont également signalés, il faut penser à une autre cause ou à des comorbidités. Comme les personnes âgées sont souvent sous médication permanente en raison de diverses affections de base, il est important de vérifier, en particulier dans ce groupe d’âge, si des préparations ayant un effet potentiellement nocif sur l’audition sont prises, comme par exemple des diurétiques de l’anse, des cytostatiques, des médicaments contre la malaria (quinine) ou certains antibiotiques, surtout les aminoglycosides.
Afin d’exclure une pathologie au niveau du conduit auditif externe (p. ex. un bouchon de cérumen) et du tympan, chaque examen auditif est accompagné d’une microscopie de l’oreille. En cas de presbyacousie seule, aucun résultat pathologique n’est à attendre ici. Dans le test du diapason, il faut partir du principe que le test de Weber est non lateralisé et que le test de Rinne est positif des deux côtés.
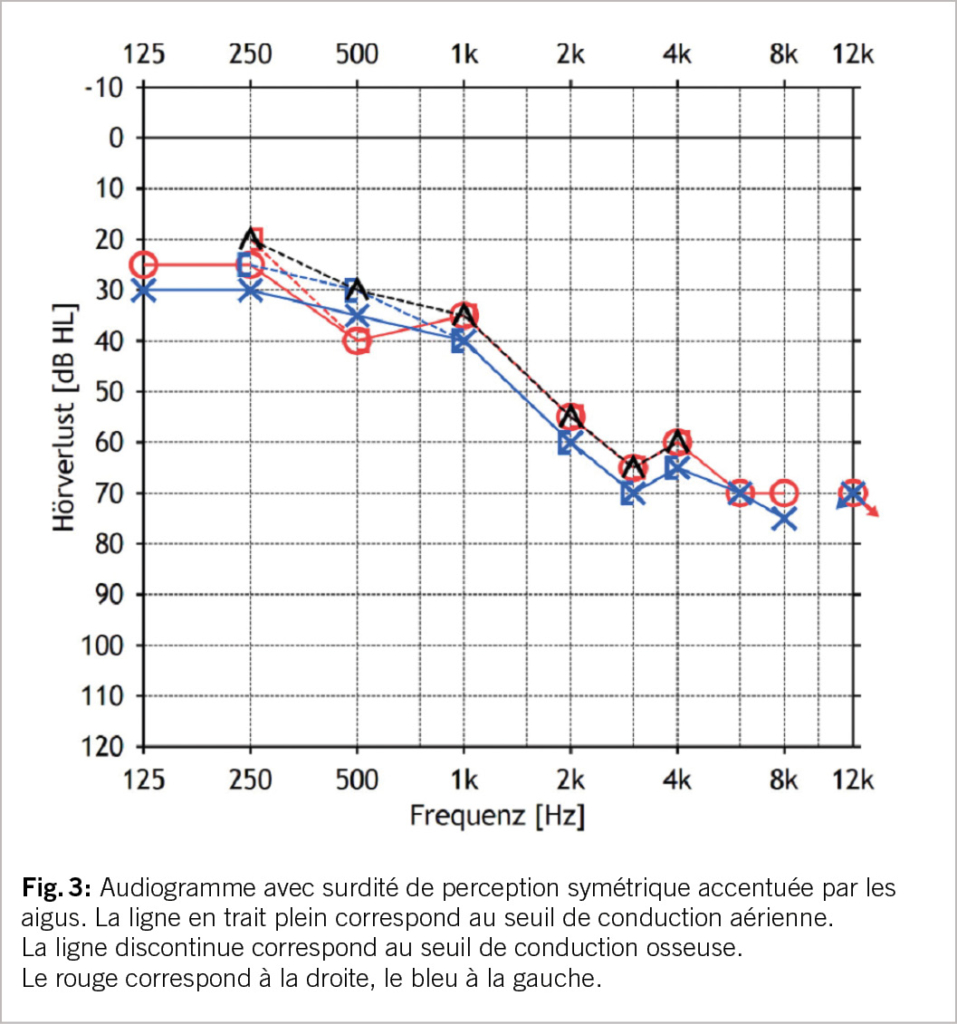
Comme test d’orientation de l’audition, on peut ensuite tester les chiffres de chuchotement. Pour une évaluation plus précise, un audiogramme est toutefois indispensable. Celui-ci révèle typiquement une surdité de perception bilatérale symétrique et accentuée par les aigus (fig. 3). Dans les pays germanophones, le test le plus fréquemment utilisé pour évaluer l’intelligibilité de la parole dans le calme est le Freiburger Sprachtest, qui teste les mots d’une ou de deux syllabes. Dans le cas de la presbyacousie, on observe souvent une divergence entre les mots monosyllabiques et les mots bisyllabiques. Les mots chiffrés (bi-syllabiques) sont relativement bien compris par rapport aux monosyllabiques. Cela peut s’expliquer, au moins en partie, par la perte des aigus typique de la presbyacousie. Pour la compréhension des chiffres, les parties vocaliques de basse fréquence suffisent souvent, alors que pour la compréhension des monosyllabes, les consonnes avec leurs spectres de haute fréquence sont primordiales.
Comme décrit plus haut, les personnes âgées ont souvent des problèmes de compréhension de la parole dans le bruit. Cela n’est pas lié en premier lieu à l’évolution de la fréquence du trouble auditif, mais surtout à des capacités cognitives réduites et à un traitement temporel réduit. Les tests de langage (par ex. le test de la phrase de Bâle), qui examinent la compréhension dans le bruit, testent ainsi non seulement l’organe auditif périphérique, mais aussi des parties centrales du système auditif (22). Une imagerie en couches fines n’est pas indiquée en cas de résultats cliniques et audiométriques typiques, comme indiqué ci-dessus. Cependant, si la courbe auditive est asymétrique ou si des symptômes supplémentaires sont présents, comme par exemple des acouphènes pulsatiles est judicieux d’exclure une pathologie rétrocochléaire ou une malformation vasculaire par l’imagerie (5, 14).
Possibilités de traitement:
Contrairement aux amphibiens, aux oiseaux et aux poissons, la régénération naturelle des cellules ciliées endommagées n’est pas possible chez les mammifères (2). Grâce à une recherche constante, la compréhension de la biologie de l’oreille interne n’a cessé de progresser, mais il n’a pas été possible jusqu’à présent de rétablir la perte auditive chez les personnes âgées par des médicaments. Dans le cadre d’études, on utilise actuellement des préparations qui doivent surtout influencer positivement le stress oxydatif sur les cellules ciliées internes ainsi que l’apoptose (3).
Pour compenser les performances réduites de l’oreille interne, on utilise en premier lieu des appareils auditifs qui amplifient le signal sonore entrant en cas de surdité de perception légère ou moyenne. En fonction de leur forme, on distingue principalement les appareils auditifs intra-auriculaires et les appareils auditifs contour d’oreille (14). Lorsque la perte auditive s’aggrave, les appareils auditifs ne sont plus d’une utilité suffisante pour les personnes concernées. L’implant cochléaire est alors la seule possibilité de percevoir suffisamment les signaux acoustiques et, en particulier, de comprendre à nouveau la parole. Pour ce faire, on introduit dans l’oreille interne, au cours d’une opération d’environ 90 minutes, une électrode capable de stimuler les ganglions spiraux du nerf auditif en contournant les cellules ciliées dysfonctionnelles (2, 4). Les patients âgés obtiennent en moyenne une compréhension de la parole aussi bonne dans le calme que les adultes plus jeunes avec un implant cochléaire. Ils obtiennent des résultats légèrement inférieurs en ce qui concerne la compréhension de la parole dans le bruit (11). Du point de vue de l’économie de la santé, il convient également de mentionner qu’en cas de surdité profonde de l’oreille interne ou de surdité, une implantation cochléaire unilatérale jusqu’à un âge très avancé présente un meilleur rapport coût/bénéfice qu’un appareillage auditif non suffisant. L’implantation cochléaire permet une amélioration avérée de la qualité de vie jusqu’à un âge avancé (10, 19).
En complément des mesures d’amélioration de l’audition périphérique, il existe de plus en plus de protocoles d’entraînement scientifiquement développés et contrôlés, qui entraînent les capacités auditives et cognitives et stimulent ainsi le système auditif central (18). Mais jusqu’à présent, ce sont surtout des entraînements simples et unilatéraux qui ont été proposés, basés par exemple uniquement sur le traitement de la fréquence ou de la longueur des sons. Dans de tels procédés, on fait par exemple écouter deux sons à une patiente qui doit ensuite décider lequel a une fréquence plus élevée. Cette fonction auditive de base, qui consiste à distinguer différentes fréquence de son, ne peut toutefois pas être facilement transposée au traitement de la parole. Cela signifie qu’il y a peu de “transfert” vers des situations communicatives quotidiennes, même si l’on s’améliore avec le temps dans la pratique. La parole est un signal beaucoup plus complexe que les soi-disant sons sinusoïdaux, qui n’existent pas vraiment dans la nature. C’est pourquoi les nouveaux entraînements adaptatifs et personnalisés, qui possèdent en outre une composante ludique et se concentrent sur le langage parlé naturel dans des situations d’écoute difficiles proches de la vie quotidienne, montrent des résultats beaucoup plus importants. Différentes approches d’entraînement peuvent être choisies en fonction du degré de perte auditive et des capacités cognitives des personnes, en se concentrant par exemple sur l’entraînement des capacités cognitives dans des contextes de communication (appelé auditory cognitive training ; ACT) ou sur une meilleure utilisation des informations vocales visuelles sur le visage des locuteurs (17) (fig. 4). La recherche à l’université de Zurich (sous la direction du professeur Giroud) développe et teste en outre d’autres procédés, comme les entraînements en réalité virtuelle ou la stimulation cérébrale.
Cette nouvelle génération d’entraînements est souvent basée sur des situations de communication pertinentes pour les personnes âgées, comme par exemple dialoguer alors que l’on se trouve dans un restaurant bruyant. La difficulté est de pouvoir se concentrer uniquement sur un locuteur et d’ignorer toutes les autres personnes et tous les bruits. De telles situations quotidiennes requièrent une écoute attentive, le traitement et l’interprétation du langage parlé, ainsi que des capacités cognitives telles que la mémorisation des informations traitées et la préparation d’une réponse à une question posée par le locuteur. Un programme d’entraînement validé scientifiquement pour le (suisse-) allemand est déjà disponible sur www.lippenlesen.ch de Pro Audito Suisse, le principal centre d’accueil pour les personnes souffrant d’une déficience auditive en Suisse (17).
Copyright Aerzteverlag medinfo AG
Cet article est une traduction de «der informierte arzt» 11_2023
Hôpital universitaire de Bâle
Clinique d’oto-rhino-laryngologie
Petersgraben 4
4031 Bâle
Groupe de recherche en neurosciences du langage et de l’audition,
Université de Zurich, Institut de linguistique informatique
Andreasstrasse 15
8050 Zurich
les auteurs n’ont pas déclaré de conflits d’intérêts en rapport avec cet article.
◆ Avec l’âge, de nombreuses personnes sont touchées par une perte auditive. Cela a des répercussions non seulement sur la qualité de vie générale, mais aussi et surtout sur les fonctions psychosociales et cognitives.
◆ La presbyacousie évolue typiquement de manière lentement progressive et est à peu près aussi prononcée des deux côtés. La cause en est des modifications décelables aussi bien dans l’organe auditif périphérique que dans le système auditif central.
◆ Si, en raison de l’importance de la perte auditive, des appareils auditifs de haute qualité ne peuvent plus apporter de bénéfice pertinent, l’évaluation d’un implant cochléaire est judicieuse jusqu’à un âge avancé.
◆ Outre les aides auditives techniques, il existe également de nouvelles possibilités thérapeutiques pour stimuler le système auditif central, comme par exemple l’entraînement à la lecture labiale ou à la communication au quotidien.
1. Alain C, Du Y, Bernstein LJ et al. (2018) Listening under difficult conditions: An activation likelihood estimation meta-analysis. Hum Brain Mapp 39:2695-2709
2. Carlson ML (2020) Cochlear Implantation in Adults. N Engl J Med 382:1531-1542
3. Cunningham LL, Tucci DL (2017) Hearing Loss in Adults. N Engl J Med 377:2465-2473
4. Dalbert A, Röösli C, Kleinjung T et al. (2021) Cochlea-Implantation. Swiss Medical Forum 21:474-478
5. Fischer N, Weber B, Riechelmann H (2016) [Presbycusis – Age Related Hearing Loss]. Laryngorhinootologie 95:497-510
6. Giroud N, Hirsiger S, Muri R et al. (2018) Neuroanatomical and resting state EEG power correlates of central hearing loss in older adults. Brain Struct Funct 223:145-163
7. Giroud N, Keller M, Meyer M (2021) Interacting effects of frontal lobe neuroanatomy and working memory capacity to older listeners’ speech recognition in noise. Neuropsychologia 158:107892
8. Hesse G, Eichhorn S, Laubert A (2014) [Hearing function and hearing loss in the elderly]. HNO 62:630-639
9. Hickok G, Poeppel D (2007) The cortical organization of speech processing. Nat Rev Neurosci 8:393-402
10. Laske RD, Dreyfuss M, Stulman A et al. (2019) Age Dependent Cost-Effectiveness of Cochlear Implantation in Adults. Is There an Age Related Cut-off? Otol Neurotol 40:892-899
11. Lenarz M, Sonmez H, Joseph G et al. (2012) Cochlear implant performance in geriatric patients. Laryngoscope 122:1361-1365
12. Liberman MC, Kujawa SG (2017) Cochlear synaptopathy in acquired sensorineural hearing loss: Manifestations and mechanisms. Hear Res 349:138-147
13. Livingston G, Huntley J, Sommerlad A et al. (2020) Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet 396:413-446
14. Lohler J, Cebulla M, Shehata-Dieler W et al. (2019) Hearing Impairment in Old Age. Dtsch Arztebl Int 116:301-310
15. Probst R, Grevers G, Iro H (2008) Hals-Nasen-Ohren-Heilkunde. Georg Thieme Verlag KG
16. Profant O, Skoch A, Balogova Z et al. (2014) Diffusion tensor imaging and MR morphometry of the central auditory pathway and auditory cortex in aging. Neuroscience 260:87-97
17. Schmitt R, Meyer M, Giroud N (2023) Improvements in naturalistic speech-in-noise comprehension in middle-aged and older adults after 3 weeks of computer-based speechreading training. NPJ Sci Learn 8:32
18. Stropahl M, Besser J, Launer S (2020) Auditory Training Supports Auditory Rehabilitation: A State-of-the-Art Review. Ear Hear 41:697-704
19. Tang L, Thompson CB, Clark JH et al. (2017) Rehabilitation and Psychosocial Determinants of Cochlear Implant Outcomes in Older Adults. Ear Hear 38:663-671
20. Wong PC, Jin JX, Gunasekera GM et al. (2009) Aging and cortical mechanisms of speech perception in noise. Neuropsychologia 47:693-703
21. World, Health, Organization (2021) World report on hearing.
22. Zust H, Tschopp K (1993) Influence of context on speech understanding ability using German sentence test materials. Scand Audiol 22:251-255
la gazette médicale
- Vol. 13
- Ausgabe 1
- Januar 2024