- Quels suppléments alimentaires chez les hémodialysés ?
La Suisse compte environ 5000 patients dialysés. Il s’ agit d’ une population vulnérable et de plus en plus âgée. Les patients dialysés présentent souvent de multiples comorbidités ; par conséquent, les soignants de différentes disciplines sont régulièrement confrontés à ces patients, ce qui nécessite des connaissances spécifiques, également en matière de leur alimentation.
Dans cette revue, nous ferons le point sur les possibles déficits et excès alimentaires qu’ on peut rencontrer chez les patients hémodialysés et les dernières recommandations thérapeutiques pour y remédier.
There are about 5000 dialysis patients in Switzerland. They represent a vulnerable and increasingly elderly population. Dialysis patients often have multiple co-morbidities ; therefore, caregivers from different disciplines are regularly confronted with these patients, which requires specific knowledge, also with regard to their nutrition. In this review, we will discuss possible dietary deficits and excesses in hemodialysis patients and the latest therapeutic recommendations.
Key Words: hemodialysis, co-morbidities, dietary, nutritional supplements, vitamins
Les patients hémodialysés en Suisse: une population vulnérable
Selon le registre national « srrqap » (Swiss renal registry and quality assessment program) on dénombre environ 5000 patients dialysés sur toute la Suisse. Ce registre inclut également depuis 2014 les caractéristiques cliniques de cette population. La plupart (90 %) effectue l’ hémodialyse et le reste (10 %) la dialyse péritonéale. Dans les deux cas de figure, il s’ agit d’ un traitement lourd. En effet, les patients hémodialysés doivent suivre en moyenne 3 séances d’ hémodialyse par semaine, à savoir que chaque séance dure 3 à 4 heures. Les patients traités par dialyse péritonéale doivent quant à eux, effectuer 2 à 5 cycles de traitement de 30 minutes par jour.
Le nombre de patients dialysés augmente lentement mais sûrement, de 1 à 2 % par an. Au niveau mondial, il y a actuellement approximativement 2 millions de patients dialysés. Cette situation est surtout liée à l’ épidémie mondiale de diabète, la cause majeure d’ insuffisance rénale terminale, mais aussi à la conséquence du vieillissement de la population. L’ âge médian des patients dialysés est de 72 ans, et 20 à 25 % ont ≥ 80 ans (données srrqap).
Les séances de dialyse et les restrictions nécessaires pour maintenir l’ homéostasie interne mettent à rude épreuve l’ état nutritionnel de cette population qui est souvent déjà fragilisée par le fait que l’ insuffisance rénale diminue l’ appétit, à cause des toxines urémiques. A savoir que le risque de dénutrition est aussi réel que le risque d’ excès de certains aliments. La frontière entre ces deux états est mince. C’ est pourquoi, il est essentiel que l’ état nutritionnel de cette population soit suivi de près et de préférence par des diététiciennes spécialisées.
Les recommandations discutées dans cet article s’ appliquent en grosses lignes aussi aux patients traités par dialyse péritonéale, mais une discussion détaillée de ce groupe serait au-delà de la portée de cet article.
Rappel technique
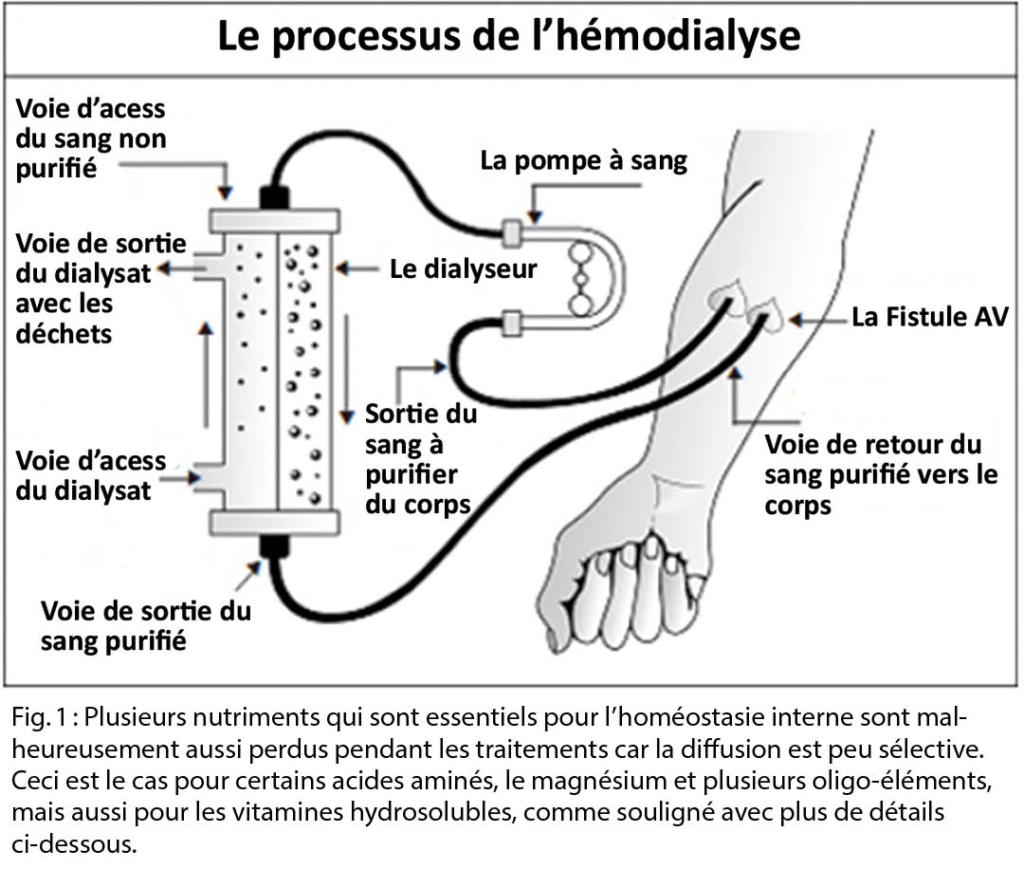
L’ hémodialyse est un traitement hautement technique, qui utilise des filtres semi-perméables, de l’ eau ultra-pure, un mélange d’ électrolytes et un système de circulation extracorporelle permettant d’ épurer le sang (Figure 1). Même s’ il s’ agit d’ un système très puissant, la clairance obtenue des substances clés telles que l’ urée et la créatinine ne dépasse pas 15 ml/min. Le traitement par dialyse ne remplace donc pas de loin toutes les fonctions du rein. En conséquence, les patients doivent continuer à prendre beaucoup de médicaments et combiner cela à des restrictions alimentaires. De plus, la plupart des patients développent une oligurie ou anurie, et doivent également respecter une restriction hydrique.
L’ épuration des substances se fait grâce au principe de diffusion. Pendant une séance d’ hémodialyse, le sang du patient vient au contact d’ un filtre nommé dialyseur (membrane artificielle semi-perméable). Lorsque le sang et la solution de dialyse présentent une concentration différente en molécules, les molécules diffusent à travers la membrane vers la concentration la plus faible. Ceci est par exemple le cas pour le potassium (concentration dans le dialysat: 2-4 mmol/l), l’ urée et le phosphate (concentration dans le dialysat: 0 mmol/l) ; leur concentration baissera fortement pendant chaque séance de dialyse, pour rebondir les heures et jours suivants, jusqu’ à la prochaine séance.
Le vieux démon n’ est pas mort : potassium
Le trouble électrolytique le plus craint chez les patients dialysés et source de multiples restrictions alimentaires, est probablement l’ hyperkaliémie. L’ hyperkaliémie est effectivement en grande partie due à l’ accumulation du potassium provenant de l’ alimentation (fruits, légumes, pommes de terre).
Il est moins connu que la constipation peut également induire ou aggraver l’ hyperkaliémie. L’ élimination du potassium par le colon est trois fois plus élevée chez les patients hémodialysés que chez les volontaires sains. Cela est probablement dû à une conductivité augmentée compensatrice des canaux potassiques des cellules épithéliales du colon(1). Il est donc important d’ éviter et/ou de traiter la constipation, de préférence avec un régime riche en fibres, et/ou avec des laxatifs osmotiques tels que le lactulose ou le polyéthylène glycol (2).
Un certain degré d’ hyperkaliémie est souvent toléré chez les patients dialysés, basé sur des études observationnelles qui ont montré que le risque de mortalité augmente seulement si la kaliémie est >5.6 mmol/l (3). En cas d’ hyperkaliémie conséquente, le néphrologue essaiera dans un premier temps d’ optimiser l’ épuration du potassium par les séances de dialyse, avant d’ insister sur des restrictions alimentaires plus sévères. Le National Kidney Foundation recommande une consommation de <3g (<77 mmol) de potassium par jour pour tous les patients hémodialysés. Afin d’ atteindre ce but, les patients dialysés doivent souvent limiter la consommation
d’ aliments riche en potassium, tels que certains fruits (bananes, abricots,) et légumes (épinards, avocats, haricots, pommes de terre). Les aliments riches en potassium sont également riches en fibres donc leur restriction peut augmenter le risque de constipation, engendrant ainsi un cercle vicieux.
Afin de palier cela, l’ utilisation des chélateurs du potassium est théoriquement une solution intéressante. Les chélateurs disponibles en Suisse sont le polystyrène sulfonate sodique (Résonium®), le polystyrène sulfonate calcique (Sorbisterit®) et plus récemment le patiromer (Veltassa®). Il s’ agit de résines ou polymères (Veltassa®) sous forme de poudre à diluer avec de l’ eau. Au niveau colique, le potassium est échangé contre le sodium ou le calcium présent dans les produits qui sont ensuite éliminés par les selles.
Malheureusement, le Sorbisterit® et le Résonium® peuvent induire dans de rares cas une nécrose et/ou une perforation du côlon (incidence rapportée de 0.27 %), notamment pendant la période post-opératoire (4). Pour cette raison, leur prescription doit être limitée dans le temps. A l’ inverse, cet effet secondaire n’ a pas été décrit pour le Veltassa®. Des études sont en cours afin d’ établir si la prise à long terme de Veltassa® permet de maintenir une alimentation plus riche en fruits, légumes et fibres.
Malnutrition, protéines et acides aminés :
La dénutrition est considérée comme l’une des complications majeures de l’ hémodialyse. Nommée « Protein-energy wasting (PEW) » dans la littérature anglophone, la dénutrition est la conséquence d’ un catabolisme des protéines corporelles supérieur à l’anabolisme. PEW est particulièrement fréquente chez les patients hémodialysés à cause des pertes protéiques dans le dialysat, les restrictions alimentaires limitant l’ hyperphosphatémie et l’ anorexie urémique qui peut persister malgré les séances de dialyse. En revanche, chez les patients avec une insuffisance rénale avancée qui ne sont pas (encore) dialysés, une alimentation trop riche en protéines est associée à un déclin plus rapide du débit de filtration glomérulaire (DFG) et ce, à cause de l’ hyperfiltration et de l’ hyperpression exercée par le régime riche en protéines sur les néphrons résiduels, déjà fortement diminués en nombre.
De manière générale, il est recommandé de consommer 0,6 à 0,8 g/kg/j lorsque le DFG est en dessous de 45 ml/min (5). Les patients en hémodialyse doivent idéalement consommer 1,0 à 1,2 g/kg/j de protéines. La transition vers la dialyse nécessite donc une augmentation importante de la quantité de protéine consommée, sans faire « exploser » le taux de phosphate. A nouveau, l’ implication des diététiciennes est primordiale pour une prise en charge optimale.
Au vu des pertes en acides aminés pendant les séances d’ hémodialyse, le dernier consensus d’ ISRNM ( International Society of Renal Nutrition and Metabolism) a conclu que les repas et les suppléments pendant l’ hémodialyse doivent être offerts à tous les patients sans contre-indications, sur la base d’ études démontrant les bienfaits sur l’ état nutritionnel et le potentiel d’ amélioration d’ autres résultats clés (p. ex., qualité de vie, satisfaction des patients, survie)(6).
Les recommandations KDOQI (Kidney Diases Outcome Quality Initiative) 2020, conseillent également chez les adultes atteints d’ IRT à risque ou présentant une perte protéino-énergétique, un essai d’ au moins 3 mois de suppléments nutritionnels oraux. Ceci améliorerait leur état nutritionnel, le cas échant où les conseils diététiques seuls ne permettraient pas d’atteindre l’ apport énergétique et protéique suffisant aux besoins nutritionnels de base. Pour les patients avec un apport chroniquement insuffisant malgré les suppléments nutritionnels oraux, il est raisonnable d’envisager un essai d’alimentation par sonde entérale (5).
Vitamines :
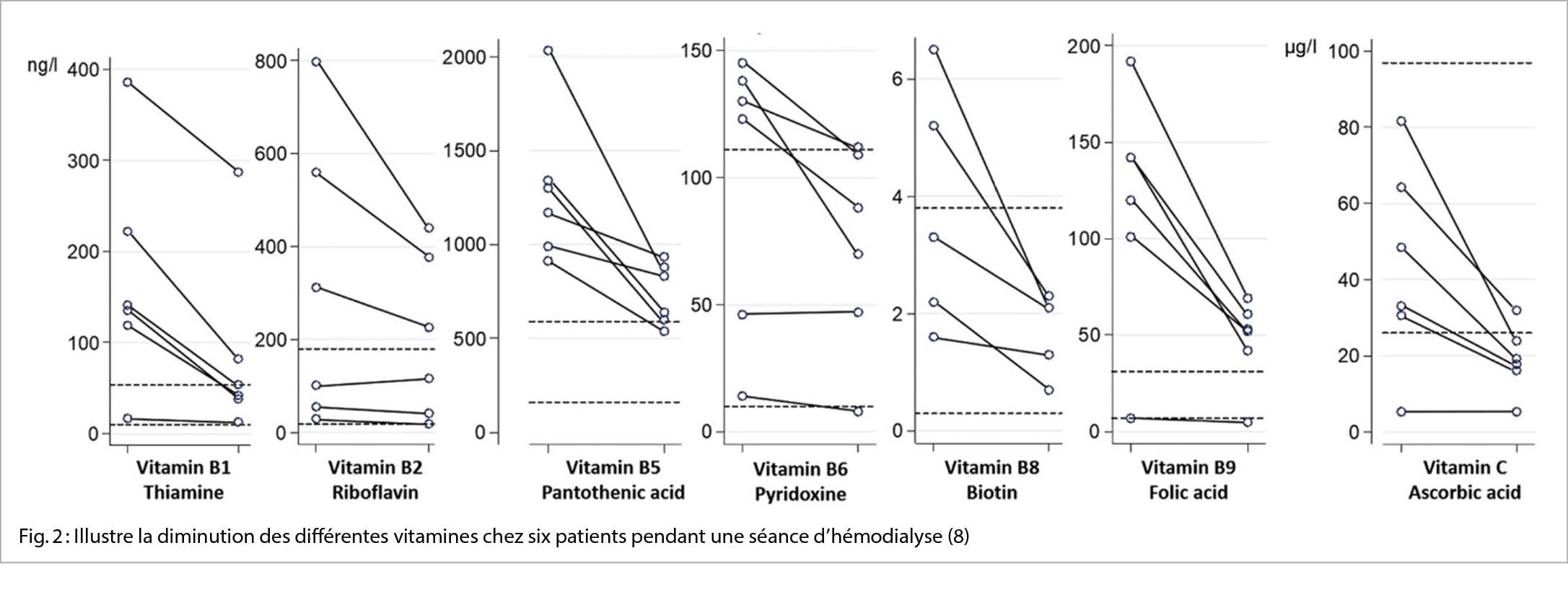
Les patients hémodialysés ont un risque accru de carences en vitamines. Les causes des carences en vitamines comprennent (a) la prescription de régimes pauvres en potassium et phosphate qui limite la consommation des fruits et légumes frais, des produits laitiers et d’autres produits riches en vitamines ; (b) un métabolisme altéré, comme c’est le cas de la pyridoxine et éventuellement du folate ; (c) une synthèse altérée (par exemple, pour 1,25-dihydroxyvitamine D) ; (d) une possible diminution de l’absorption intestinale (p. ex. la diminution de l’ absorption de riboflavine, de folate et de vitamine D a été constatée chez des rats insuffisants rénaux chroniques) ; et (e) les pertes des vitamines hydrosolubles dans le dialysat, en raison de leur faible poids moléculaire (<1 kDa) (7).
Au cours des dernières décennies, plusieurs avancées technologiques et changements dans la pratique clinique ont été mis en œuvre pour la thérapie HD, y compris l’utilisation de membranes à haut-flux (high-flux) et l’ introduction d’ hémodiafiltration (HDF) (2). Une étude récemment effectuée à Lausanne montre que les pertes vitaminiques sont encore plus importantes en mode HDF qu’ en mode HD, notamment pour la vitamine C (Figure 2) (8) La supplémentation en vitamines hydrosolubles après chaque séance de dialyse est une pratique courante chez les patients hémodialysés chroniques et compense les pertes. Les préparations le plus souvent prescrites sont le Dialvit® (contenant 50mg de vit B1, 10mg de vit B2, 40mg de vit B6, 3 mg d’ acide folique et 200mg de vit C) ou une combinaison de Becozyme forte®, d’ acide folique et de vitamine C. En complément, la plupart des patients reçoivent régulièrement des préparations de vitamine D (cholécalciférol, calcitriol).
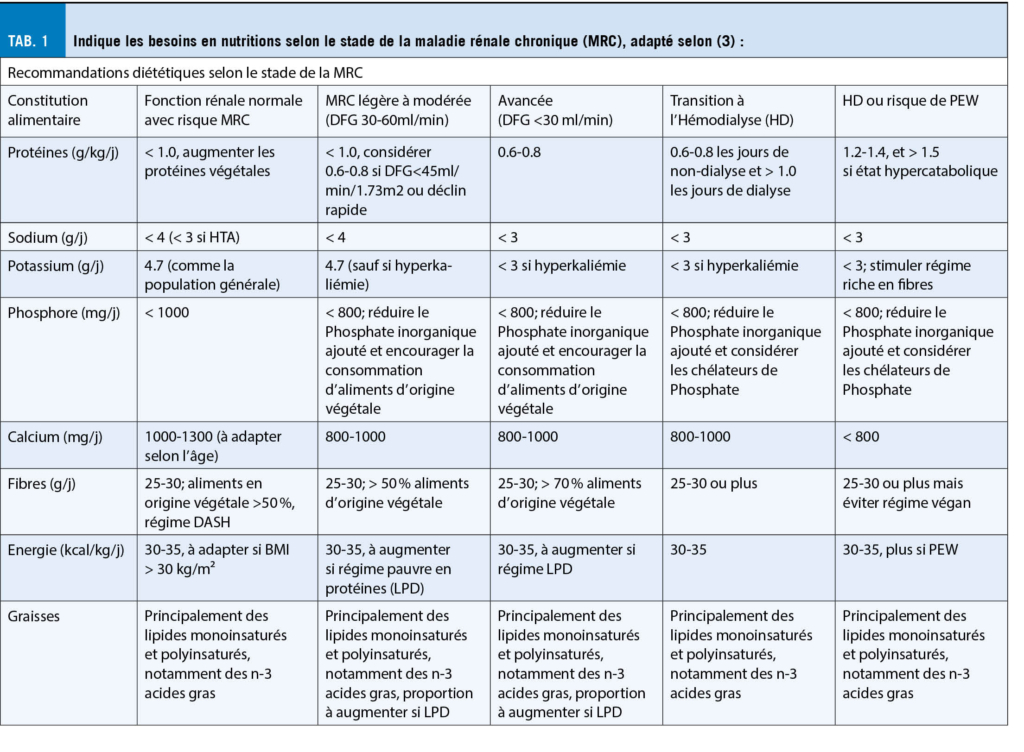
En résumé, les patients hémodialysés présentent de multiples altérations métaboliques, des troubles électrolytiques, ainsi qu’ un risque accru de déficit vitaminique et de dénutrition protéo-énergétique. Une discussion détaillée de tous les aspects est au-delà de la portée de cet article, mais les différentes recommandations alimentaires sont résumées dans le Tableau 1.
Futur : un rôle pour le microbiote ?
Le microbiote intestinal, défini comme l’ ensemble des microorganismes présent dans l’ intestin, a été le sujet de nombreuses recherches au cours de la dernière décennie. Il est devenu clair que le microbiote exerce de nombreuses fonctions bénéfiques au niveau intestinal et systémique, dont la synthèse de la vitamine K, la dégradation de l’ oxalate et la maturation du système immunitaire. Les patients souffrant de maladie rénale chronique ont une composition altérée probablement en réponse à l’ urémie, la prescription fréquente d’ antibiotiques, et les modifications alimentaires. Leur microbiote altéré conduit à une augmentation de la production de molécules telles que le p-crésyl sulfate et l’ indoxyl sulfate, qui ont des effets pro-inflammatoires et pro-calcifiants (9). A son tour, une séance d’hémodialyse est associée à une augmentation passagère de la perméabilité de la barrière intestinale et une augmentation des taux circulants des cytokines. Plusieurs études sont actuellement en cours afin de voir si la prise régulière de probiotiques (microorganismes vivants qui exercent des effets positifs sur la santé) ou prébiotiques (ingrédients alimentaires non digestibles possédant un effet bénéfique sur la composition ou l’ activité du microbiote intestinal) est capable de modifier la composition du microbiote et de retarder ou d’ inverser le trend de la PEW et de perte musculaire.
Conclusions :
L’ insuffisance rénale induit des changements majeurs dans le métabolisme et le milieu interne des patients. Il ne s’ agit pas seulement de troubles électrolytiques, de déficits vitaminiques, de risques accrus en malnutrition mais également de dénutrition protéino-énergétique. L’ hémodialyse peut aggraver le déficit en vitamines et acides aminés, à cause des pertes induites par les filtres hautement perméables. Les conseils et suivis diététiques occupent aujourd’ hui une place majeure dans la prise en charge des patients hémodialysés. D’ autant plus que les connaissances en la matière ne cessent d’ augmenter, permettant ainsi le déploiement de nouvelles stratégies afin d’ atteindre un équilibre homéostatique convenable pour les patients dialysés.
Une collaboration étroite entre néphrologues, diététicien(-ne)s, généralistes, endocrinologues et internistes est essentielle pour une prise en charge optimale de cette catégorie de patients particulièrement vulnérables. L’ avenir nous dira si la manipulation du microbiote s’ imposera comme nouvel outil dans le combat quotidien contre la dénutrition protéino-énergétique.
Copyright Aerzteverlag medinfo AG
Service de Néphrologie et d’ Hypertension
Centre hospitalier universitaire vaudois et
Université de Lausanne
Rue du Bugnon 17
1011 Lausanne
Service de Néphrologie et d’ Hypertension
Centre hospitalier universitaire vaudois et
Université de Lausanne
Rue du Bugnon 17
1011 Lausanne
menno.pruijm@chuv.ch
Nous remercions Mme Wendy Brito pour sa relecture de l’ article.
◆ L’ hyperkaliémie peut être induite ou aggravée par la constipation; en cas d’ hyperkaliémie persistante, une restriction alimentaire de <3g/j s’ impose. Les chélateurs de potassium (à l’ exception du patiromer) ne peuvent pas être prescrits pendant de longues périodes à cause du risque de perforation du côlon.
◆ Les apports protéiniques jouent un rôle important dans le pronostic des patients souffrant de maladies rénales et doivent être adaptés au stade de leur maladie.
◆ Une alimentation optimale pour les patients hémodialysés nécessite une prise en charge spécialisée et multidisciplinaire.
1. Hayes CP, Jr., McLeod ME, Robinson RR. An extravenal mechanism for the maintenance of potassium balance in severe chronic renal failure. Trans Assoc Am Physicians. 1967;80:207-16.
2. Cupisti A, Kalantar-Zadeh K. Management of natural and added dietary
phosphorus burden in kidney disease. Semin Nephrol. 2013;33(2):180-90.
3. Kalantar-Zadeh K, Fouque D. Nutritional Management of Chronic Kidney Disease. N Engl J Med. 2017;377(18):1765-76.
4. Bansal S, Pergola PE. Current Management of Hyperkalemia in Patients on
Dialysis. Kidney Int Rep. 2020;5(6):779-89.
5. Ikizler TA, Burrowes JD, Byham-Gray LD, Campbell KL, Carrero JJ, Chan W,
et al. KDOQI Clinical Practice Guideline for Nutrition in CKD: 2020 Update.
Am J Kidney Dis. 2020;76(3 Suppl 1):S1-S107.
6. Kistler BM, Benner D, Burrowes JD, Campbell KL, Fouque D, Garibotto G, et al. Eating During Hemodialysis Treatment: A Consensus Statement From the International Society of Renal Nutrition and Metabolism. J Ren Nutr. 2018;28(1):4-12.
7. Kendrick J, Chonchol M. The role of phosphorus in the development and
progression of vascular calcification. Am J Kidney Dis. 2011;58(5):826-34.
8. Schwotzer N, Kanemitsu M, Kissling S, Darioli R, Benghezal M, Rezzi S, et al. Water-Soluble Vitamin Levels and Supplementation in Chronic Online Hemodiafiltration Patients. Kidney Int Rep. 2020;5(12):2160-7.
9. Ghajarzadeh-Wurzner A, Berney M, Teta D, Genton L, Pruijm M. [Gut microbiota and kidney diseases : dangerous liaisons?]. Rev Med Suisse. 2018;14(595):422-5.
la gazette médicale
- Vol. 12
- Ausgabe 1
- Januar 2023