- Syndrome du côlon irritable
La prévalence du syndrome du côlon irritable (SCI) est estimée à environ 11 % à l’ échelle mondiale et 5 à 10 % en Europe (1, 2). Le SCI est l’ un des dysfonctionnements gastro-intestinaux les plus courants, il est même responsable de 50 % des visites chez le médecin de famille et de 25 % des visites chez le gastro-entérologue (3, 4). Les principaux symptômes du SCI sont des douleurs abdominales, des irrégularités des selles et des flatulences, souvent associées à d’ autres troubles fonctionnels, somatiques et psychiatriques. La qualité de vie des pa-tients atteints du SCI est aussi sévèrement réduite que celle des patients ayant une maladie cardiovasculaire. Ce syndrome a une influence considérable sur la capacité de travail et de la santé publique (5, 6).
Critères diagnostiques
Les nouveaux critères de la classification ROME IV ont entraîné un changement de paradigme. Les maladies gastro-intestinales associées à l’absence de causes somatiques décelables sont maintenant appelées troubles de l’interaction entre le système nerveux central et le tractus gastro-intestinal. Cette appellation et basée sur les résultats de recherches actuelles qui montrent une interaction complexe des processus pathophysiologiques au cours du développement des symptômes (7). Les critères actuels de ROME IV pour le diagnostic fondé sur les symptômes du SCI sont présentés au tableau 1.
Les changements les plus importants par rapport aux précédents critères de ROME III sont la présence obligatoire de douleurs abdominales pendant la défécation et une modification des habitudes fécales. L’ expression «malaise abdominal» a été jugée trop générale.
De plus, l’ amélioration des symptômes du SCI après défécation a été abandonnée au profit d’ un changement des symptômes associés à la défécation dans les critères de ROME IV, car de nombreux patients atteints de SCI avaient également éprouvé des douleurs pendant ou après la défécation et signalé une aggravation des symptômes après défécation (8).
Tandis que les critères de ROME III exigeaient des «douleurs abdominales» au moins 3 jours par mois, les critères de ROME IV exigent la présence de «douleurs abdominales» au moins un jour par semaine au cours du dernier mois. La sensibilité des critères de ROME IV diminue par rapport à ROME III (0,637 vs. 0,731), mais la spécificité augmente (0,971 vs. 0,931), ce qui signifie un nombre inférieur de patients atteints du SCI qui sont mal diagnostiqués (9). Les sous-types du SCI, atteints de diarrhée (SCI-D), de constipation (SCI-C) et le type mixte (SCI-M) ou indéterminé (SCI-I) restent inchangés dans les nouveaux critères de ROME IV (10).
Analyses cliniques et diagnostiques
Le diagnostic du SCI demeure un défi malgré la recommandation de renoncer aux outils diagnostiques de laboratoire et d’imagerie en l’ absence de signes d’ alarme (11). Les résultats des recherches actuelles indiquent une interaction complexe entre processus inflammatoires, perméabilité intestinale accrue, hypersensibilité viscérale, dysbiose, «joint hypermobility», facteurs génétiques et modification de l’ axe cerveau-intestin, mais il manque encore des biomarqueurs qui permettent de poser le diagnostic du SCI (2).
L’ identification des symptômes d’ alarme (âge > 50 ans, perte de poids importante, sang provenant de l’ anus, fièvre, anémie ferriprive peu claire et antécédents familiaux de carcinome du côlon, de maladie coeliaque ou de maladie inflammatoire chronique de l’ intestin (MICI)) est importante dans le diagnostic en raison de sa valeur prédictive négative. Ainsi, la combinaison des critères de ROME remplis et de l’ absence de signes d’ alarme permet un diagnostic de SCI fiable (9, 12, 13). Néanmoins, tant les médecins que les patients sont souvent très désécurisés, ce qui conduit souvent à de nouveaux tests diagnostiques inutiles (14-17).
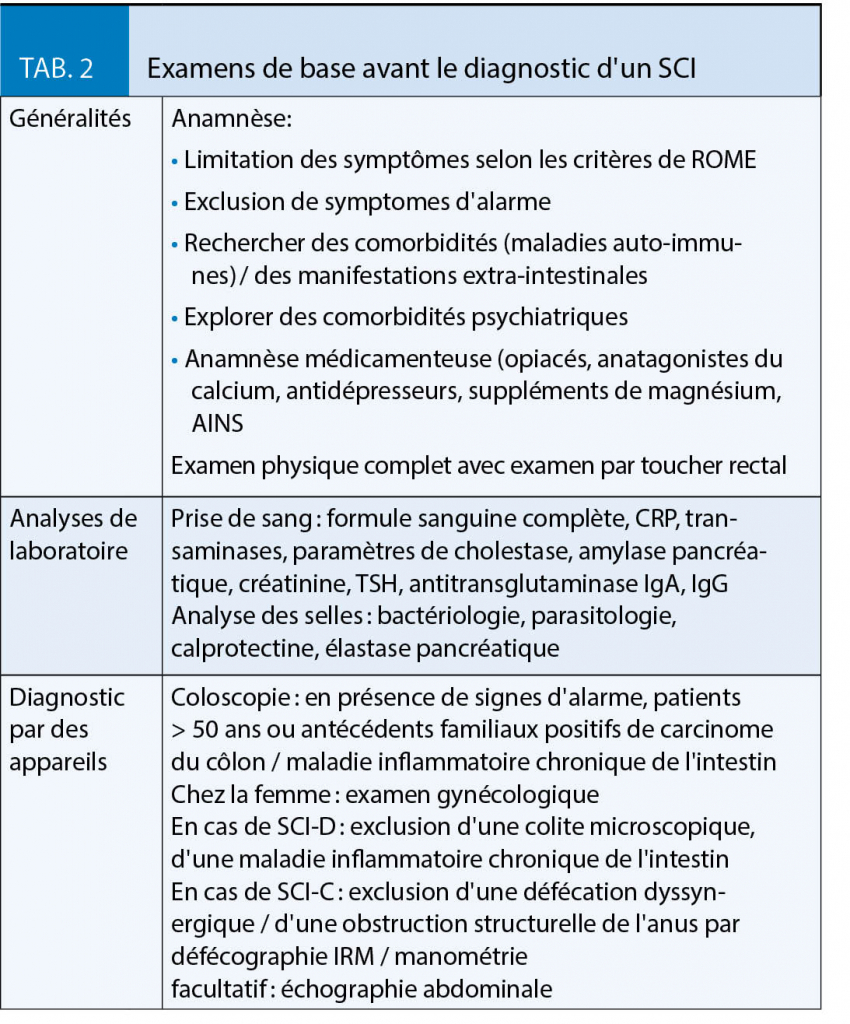
La première année au cours de laquelle les symptômes du SCI se manifestent est cruciale : l’ exclusion de maladies systémiques pertinentes est importante à ce moment là, car l’ incidence du cancer du côlon, des MICI ou de la colite microscopique augmente dès la première apparition de symptômes du SCI (11, 18) (tab. 2).
L’ exclusion de la maladie coeliaque est particulièrement recommandée chez les patients atteints de SCI-D, car une grande méta-analyse y a montré une probabilité 4 fois plus élevée d’ une présence de maladie coeliaque (19).
L’ analyse non invasive et rentable de la calprotectine dans les selles peut être utile pour distinguer le SCI d’ une MICI, car le risque de MICI lors de taux de calprotectine inférieurs à 40ug/g est extrêmement faible (< 1 %) (20, 21).
Il existe des différences significatives entre les recommandations européennes et américaines pour la coloscopie. Pour le cancer du côlon et les MICI, de vastes études, en partie non prospectives, montrent que seulement 1 % des patients présentant des symptômes typiques du SCI sans signe d’ alarme présentent en fait des néoplasies du côlon ou une MICI (22-24). Sur la base de ces études, la coloscopie aux Etats-Unis n’ est effectuée que sur des patients de plus de 50 ans, en règle générale pour un dépistage. Dans les recommandations européennes, une coloscopie avec biopsies pour exclure la colite microscopique ou une MICI est déjà recommandée pour les patients plus jeunes avec un diagnostic initial de SCI-D (11, 17, 18).
Chez les femmes présentant des symptômes de SCI, un examen gynécologique, y compris une échographie vaginale, est indiqué (18). Bien qu’ il n’ existe aucune preuve concernant l’ utilisation de l’ échographie abdominale dans le diagnostic du SCI, il s’ agit d’ une méthode rapide et rentable pour exclure les pathologies abdominales grossières. Si l’examen de base reste négatif, il convient de renoncer à d’ autres diagnostics et de communiquer et expliquer en détail au patient le diagnostic du SCI. Une réévaluation anamnestique soigneuse à la recherche de signes d’aggravation ou de modifications importantes des symptômes aggravés ou sévèrement modifiés, un examen physique ciblé et un suivi régulier à long terme sont des éléments clés d’ une prise en charge pertinente du SCI.
Prise en charge du SCI – éviter le «furor medicus»
Un grand nombre de patients souffrant de problèmes gastro-intestinaux fonctionnels peuvent être examinés et traités avec succès par leur médecin de famille (25). La prise en charge dans des consultations gastro-entérologiques spécialisées est généralement assurée pour les cas difficiles, présentant des facteurs psychologiques et psychosociaux supplémentaires et des manifestations extra-intestinales (maux de tête et de dos, symptômes urogénitaux, troubles du sommeil, fibromyalgie, dépression). Ces facteurs sont de plus en plus souvent considérés dans la littérature comme des indicateurs d’ une évolution plus grave de la maladie (26, 27).
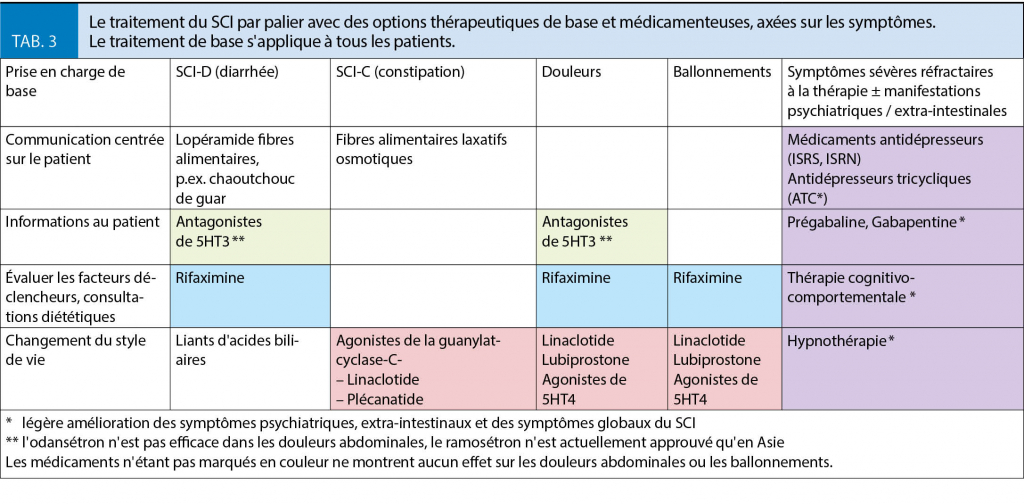
Les patients atteints du SCI se plaignent souvent d’ un manque d’ empathie, de temps et de compréhension des symptômes décrits ci-dessus de la part de leur médecin traitant. En retour, les médecins sont frustrés par des plaintes persistantes, des consultations d’ urgence fréquentes et la demande d’ autres tests diagnostiques de la part du patient. En l’ absence d’ expérience dans le traitement du SCI, les tests diagnostiques répétitifs et, dans le pire des cas, la chirurgie non indiquée peut entamer un cercle vicieux qui peut conduire à un traitement inadéquat, voire nuisible pour les patients atteints du SCI (28-30). Dans la prise en charge du SCI, il est donc recommandé d’ appliquer un schéma échelonné, qui tient compte à la fois des symptômes et de la gravité du SCI (tab. 3).
Le fondement d’ un traitement efficace du SCI est une relation médecin-patient stable. La médiation et l’ explication (verbale et non verbale) convainquante du diagnostic par le médecin traitant ont une influence décisive sur l’ évolution de la maladie. Une attitude nihiliste à l’ égard des possibilités thérapeutiques doit être évitée à tout prix.
Une communication empathique, centrée sur le patient avec une explication claire du diagnostic et de la pathophysiologie, l’ application de questions ouvertes dans l’ anamnèse, l’ exploration de la compréhension de la maladie de la part du patient et l’ inclusion de celui-ci dans les décisions thérapeutiques servent d’ outil efficace pour améliorer la satisfaction du patient et le succès thérapeutique du SCI (31-34).
L’ étape suivante, en cas de symptômes persistants, est l’ identification de facteurs déclenchants dans les aliments, l’ exclusion des intolérances alimentaires (intolérance au lactose et au fructose) et la recommandation d’un régime riche en fibres alimentaires. De plus, des conseils nutritionnels peuvent être ajoutés pour établir un régime transitoire FODMAP (oligo-, di- et monosaccharides fermentables ; voir aussi l’article de Whilelmi et al. publié dans ce numéro), ce qui peut contribuer à l’ amélioration des symptômes chez certains patients atteints du SCI. Selon les données actuelles, un régime probatoire sans gluten n’ est pas recommandé (35).
Dans le cas de troubles persistants et plus graves, il est recommandé d’ adopter une stratégie de traitement qui soit adaptée au symptôme principal du SCI et éventuellement à tout trouble extra-intestinal existant, y compris les stratégies de traitement psychopharmacologique et interdisciplinaire (tab. 3). Dans la littérature, le succès thérapeutique général de la pharmacothérapie du SCI est estimé entre 8 et 22 % par rapport au placebo (35).
SCI-D
Dans le traitement du SCI-D, le lopéramide est souvent utilisé comme thérapie à court terme. Il n’ a cependant aucun effet sur les douleurs abdominales (36).
Les antagonistes de 5HT3 tels que l’ odansétron montrent une bonne efficacité dans l’ amélioration de la diarrhée, mais pas dans les douleurs abdominales et les ballonnements (35, 36).
Bien que la rifaximine soit un traitement efficace, sûr et à faibles effets secondaires pour la surcroissance bactérienne soupçonnée dans le SCI-D, son efficacité est limitée en raison d’ un taux de récidive élevé et de la nécessité d’ une nouvelle thérapie (37).
Les liants d’acides biliaires (p. ex. la cholestyramine) sont souvent utilisés de façon empirique. Jusqu’ à présent, leur efficacité n’ a été démontrée que dans de petites études non contrôlées (35). Dans la pratique quotidienne, l’ utilisation d’ un agent de gonflement (caoutchouc Sterculia) comme élément de base prouve souvent sa valeur dans le traitement du SCI-D.
SCI-C
Augmenter la teneur en fibres en utilisant par exemple du psyllium ou des laxatifs osmotiques est une option thérapeutique efficace et économique pour améliorer la consistance et la fréquence des selles, bien que les ballonnements et les douleurs ne soient souvent pas améliorés.
Les nouveaux médicaments tels que la lubiprostone, le linaclotide ou du plécanatide montrent une bonne efficacité en ce qui concerne les plaintes de constipation, la douleur et les ballonnements. Cependant, la diarrhée et la nausée sont des effets secondaires courants. Le prucalopride en tant que représentant des agonistes de 5HT4 n’ est approuvé que pour le traitement de la constipation chronique. Néanmoins, il a également des effets positifs sur les douleurs abdominales et les ballonnements dans le SCI-C (35, 37).
Thérapie psychopharmacologique du SCI
Les symptômes SCI graves, réfractaires au traitement et présentant des troubles psychiatriques et extra-intestinaux devraient mener à orienter le patient vers un spécialiste et à le soutenir dans le cadre d’ une consultation spécialisée. L’ utilisation de psychotropes est souvent nécessaire. Les antidépresseurs tricycliques ou les ISRS ont un effet bénéfique non seulement sur les symptômes dépressifs, mais aussi sur l’ insomnie et la douleur (11). L’ efficacité de la gabapentine et de la prégabaline n’ a pas été prouvée dans le SCI, mais elles sont souvent utilisées chez les patients présentant des symptômes d’ anxiété (38).
Options de traitement non pharmacologique en cas de SCI sévère
La thérapie cognitivo-comportementale est l’ option thérapeutique non pharmacologique la plus validée pour une amélioration globale et à long terme des symptômes du SCI avec un «nombre nécessaire à traiter» de (NNR) = 3. L’ hypnothérapie est également efficace pour l’ amélioration globale des symptômes du SCI avec un NNR = 4. Le manque de thérapeutes spécialisés (39) est un facteur limitant dans l’ application de ces thérapies prometteuses.
Gastroenterologie et Hépatologie UniversitätsSpital
8091 Zurich
Gastroenterologie et Hépatologie UniversitätsSpital
8091 Zurich
Gastroenterologie-Zentrum
Klinik Stephanshorn
Brauerstrasse 95
9016 St-Gall
werner.schwizer@hin.ch
Les auteurs n’ont déclaré aucun conflit d‘intérêts en relation avec cet article.
Cet article est une traduction de l’article publié dans « der informierte arzt » 8/2017
- Le respect des critères de ROME et l’ absence de signes d’ alarme permettent un diagnostic fiable d’ un SCI.
- Après un examen de base aucun autre examen diagnostique des
symptômes du SCI ne devrait être effectué. - Une relation médecin-patient stable et une communication centrée sur le patient améliorent la satisfaction du patient et l’ évolution de la maladie.
- Dans la thérapie du SCI, un schéma échelonné devrait être utilisé avec réassurance, pharmacothérapie selon les symptômes et en cas de progressions sévères, le recours aux psychotropes.
- La thérapie cognitivo-comportementale et l’ hypnothérapie sont des mesures efficaces pour améliorer les symptômes sévères du SCI.
1. Lovell RM, Ford AC. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association 2012; 10: 712-721 e714.
2. Enck P, Aziz Q, Barbara G, et al. Irritable bowel syndrome. Nature reviews Disease primers 2016; 2: 16014-16014.
3. Harvey RF, Salih SY, Read AE. Organic and functional disorders in 2000 gastroenterology outpatients. Lancet (London, England) 1983; 1: 632-634.
4. Thompson WG, Heaton KW, Smyth GT, Smyth C. Irritable bowel syndrome in general practice: prevalence, characteristics, and referral. Gut 2000; 46: 78-82.
5. Cremonini F, Cheng V, Lembo A. Diagnosing irritable bowel syndrome: no more million dollar work-up? Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association 2013; 11: 963-964.
6. Canavan C, West J, Card T. Review article: the economic impact of the irritable bowel syndrome. Alimentary pharmacology & therapeutics 2014; 40: 1023-1034.
7. Drossman DA, Hasler WL. Rome IV-Functional GI Disorders: Disorders of Gut-Brain Interaction. Gastroenterology 2016; 150: 1257-1261.
8. Simren M, Palsson OS, Whitehead WE. Update on Rome IV Criteria for Colorectal Disorders: Implications for Clinical Practice. Current gastroenterology reports 2017; 19: 15.
9. Whitehead WE, Palsson OS, Simren M. Irritable bowel syndrome: what do the new Rome IV diagnostic guidelines mean for patient management? Expert review of gastroenterology & hepatology 2017; 11: 281-283.
10. Irritable bowel syndrome: what do the new Rome IV diagnostic guidelines mean for patient management? Expert review of gastroenterology & hepatology 2017; 11: 281-283.
11. Chey WD, Kurlander J, Eswaran S. Irritable bowel syndrome: a clinical review. JAMA 2015; 313: 949-958.
12. Vanner SJ, Depew WT, Paterson WG, et al. Predictive value of the Rome criteria for diagnosing the irritable bowel syndrome. The American journal of gastroenterology 1999; 94: 2912-2917.
13. Whitehead WE, Palsson OS, Feld AD, et al. Utility of red flag symptom exclusions in the diagnosis of irritable bowel syndrome. Alimentary pharmacology & therapeutics 2006; 24: 137-146.
14. Spiegel BM, Farid M, Esrailian E, Talley J, Chang L. Is irritable bowel syndrome a diagnosis of exclusion?: a survey of primary care providers, gastroenterologists, and IBS experts. The American journal of gastroenterology 2010; 105: 848-858.
15. Lacy BE, Rosemore J, Robertson D, Corbin DA, Grau M, Crowell MD. Physicians’ attitudes and practices in the evaluation and treatment of irritable bowel syndrome. Scandinavian journal of gastroenterology 2006; 41: 892-902.
16. Lau MSY, Ford AC. Do Lay People Accept a Positive Diagnosis of Irritable Bowel Syndrome? Gastroenterology; 149: 252-253.
17. Macaigne G, Lahmek P, Locher C, et al. Microscopic colitis or functional bowel disease with diarrhea: a French prospective multicenter study. The American journal of gastroenterology 2014; 109: 1461-1470.
18. Layer P, Andresen V, Pehl C, et al. [Irritable bowel syndrome: German consensus guidelines on definition, pathophysiology and management]. Zeitschrift fur Gastroenterologie 2011; 49: 237-293.
19. Ford AC, Chey WD, Talley NJ, Malhotra A, Spiegel BM, Moayyedi P. Yield of diagnostic tests for celiac disease in individuals with symptoms suggestive of irritable bowel syndrome: systematic review and meta-analysis. Arch Intern Med 2009; 169: 651-658.
20. Yang Z, Clark N, Park KT. Effectiveness and cost-effectiveness of measuring fecal calprotectin in diagnosis of inflammatory bowel disease in adults and children. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association 2014; 12: 253-262.e252.
21. Menees SB, Kurlander J, Goel A, Powell CC, Chey WD. Sa1079 A Meta-Analysis of the Utility of Common Serum and Fecal Biomarkers in Adults With IBS. Gastroenterology; 146: S-194.
22. Power AM, Talley NJ, Ford AC. Association between constipation and colorectal cancer: systematic review and meta-analysis of observational studies. The American journal of gastroenterology 2013; 108: 894-903; quiz 904.
23. Guerin A, Mody R, Fok B, et al. Risk of developing colorectal cancer and benign colorectal neoplasm in patients with chronic constipation. Alimentary pharmacology & therapeutics 2014; 40: 83-92.
24. Tuteja AK, Talley NJ, Joos SK, Tolman KG, Hickam DH. Abdominal bloating in employed adults: prevalence, risk factors, and association with other bowel disorders. The American journal of gastroenterology 2008; 103: 1241-1248.
25. Ilnyckyj A, Graff LA, Blanchard JF, Bernstein CN. Therapeutic value of a gastroenterology consultation in irritable bowel syndrome. Alimentary pharmacology & therapeutics 2003; 17: 871-880.
26. Bijkerk CJ, Muris JW, Knottnerus JA, Hoes AW, de Wit NJ. Systematic review: the role of different types of fibre in the treatment of irritable bowel syndrome. Alimentary pharmacology & therapeutics 2004; 19: 245-251.
27. Vu J, Kushnir V, Cassell B, Gyawali CP, Sayuk GS. The impact of psychiatric and extraintestinal comorbidity on quality of life and bowel symptom burden in functional GI disorders. Neurogastroenterology and motility : the official journal of the European Gastrointestinal Motility Society 2014; 26: 1323-1332.
28. Crocker K, Chur-Hansen A, Andrews J. Interpersonal relationships for patients with irritable bowel syndrome: a qualitative study of GPs’ perceptions. Australian family physician 2013; 42: 805-810.
29. Dhaliwal SK, Hunt RH. Doctor-patient interaction for irritable bowel syndrome in primary care: a systematic perspective. European journal of gastroenterology & hepatology 2004; 16: 1161-1166.
30. Longstreth GF. Avoiding unnecessary surgery in irritable bowel syndrome. Gut 2007; 56: 608-610.
31. Ringstrom G, Sjovall H, Simren M, Ung EJ. The importance of a person-centered approach in diagnostic workups of patients with irritable bowel syndrome: a qualitative study. Gastroenterology nursing : the official journal of the Society of Gastroenterology Nurses and Associates 2013; 36: 443-451.
32. Di Palma JA, Herrera JL. The role of effective clinician-patient communication in the management of irritable bowel syndrome and chronic constipation. Journal of clinical gastroenterology 2012; 46: 748-751.
33. Owens DM, Nelson DK, Talley NJ. The irritable bowel syndrome: long-term prognosis and the physician-patient interaction. Ann Intern Med 1995; 122: 107-112.
34. Schmulson MJ, Ortiz-Garrido OM, Hinojosa C, Arcila D. A single session of reassurance can acutely improve the self-perception of impairment in patients with IBS. Journal of psychosomatic research 2006; 61: 461-467.
35. Simren M, Tornblom H, Palsson OS, Whitehead WE. Management of the multiple symptoms of irritable bowel syndrome. Lancet Gastroenterol Hepatol 2017; 2: 112-122.
36. Ford AC, Moayyedi P, Lacy BE, et al. American College of Gastroenterology monograph on the management of irritable bowel syndrome and chronic idiopathic constipation. The American journal of gastroenterology 2014; 109 Suppl 1: S2-26; quiz S27.
37. Corsetti M, Whorwell P. Novel pharmacological therapies for irritable bowel syndrome. Expert review of gastroenterology & hepatology 2016; 10: 807-815.
38. Houghton LA, Fell C, Whorwell PJ, Jones I, Sudworth DP, Gale JD. Effect of a second-generation alpha2delta ligand (pregabalin) on visceral sensation in hypersensitive patients with irritable bowel syndrome. Gut 2007; 56: 1218-1225.
39. Ford AC, Quigley EM, Lacy BE, et al. Effect of antidepressants and psychological therapies, including hypnotherapy, in irritable bowel syndrome: systematic review and meta-analysis. The American journal of gastroenterology 2014; 109: 1350-1365; quiz 1366.
la gazette médicale
- Vol. 8
- Ausgabe 2
- März 2019