- Thérapies immunomodulatrices économes en corticostéroïdes
Médecin et science, tel était le thème du congrès qui s’est tenu pour la première fois dans l’histoire de la SSMIG à Zurich sur le thème du médecin et de la science. La science en interaction avec d’autres composantes, l’empathie, l’intuition, l’humanisme réunis en tant qu’art en tant qu’art médical pour permettre une médecine orientée vers le patient la plus optimale possible, a déclaré le professeur Lars Huber, co-président du congrès, lors de son allocution de bienvenue et de son introduction.
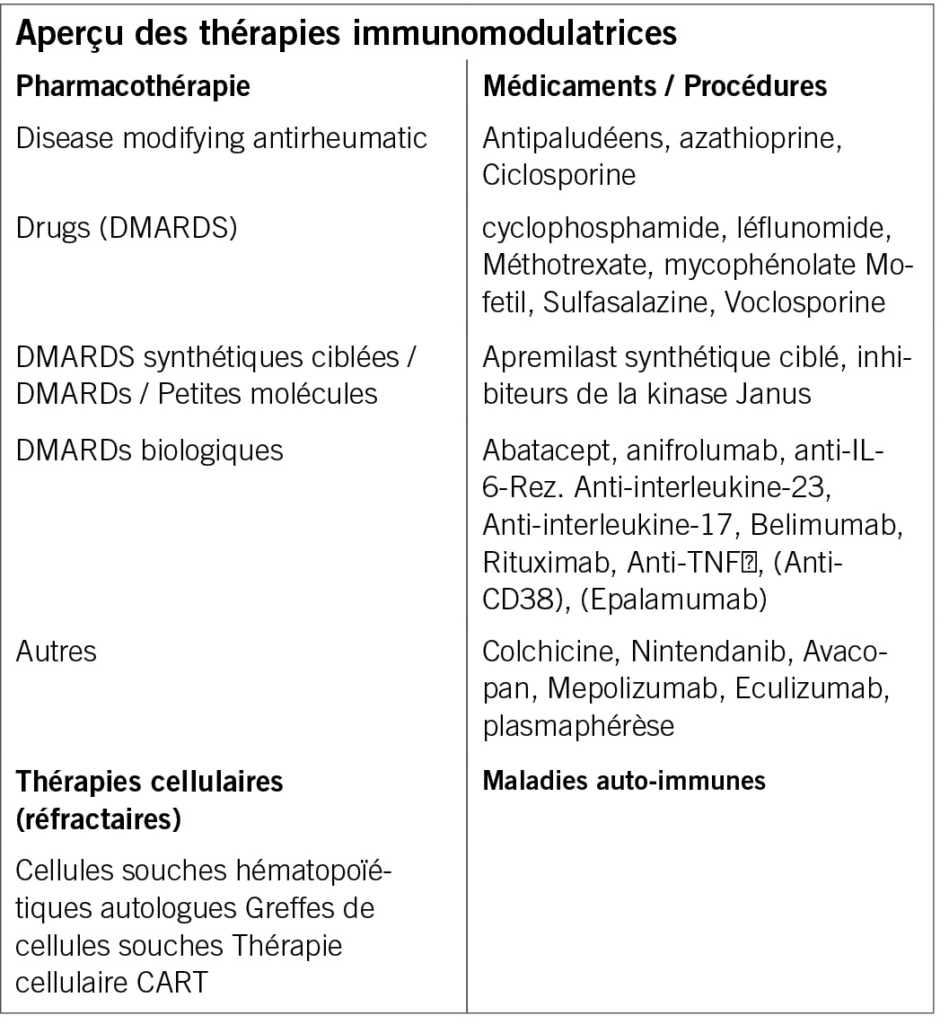
Concepts généraux de gestion de l’immunomodulation
L’évolution naturelle du lupus érythémateux disséminé (LED) et l’impact potentiel d’une stratégie de traitement ciblée : la maladie commence par une phase préclinique asymptomatique, caractérisée dans un premier temps par l’apparition d’auto-anticorps, typiques de toutes les maladies auto-immunes, puis d’auto-anticorps spécifiques du lupus. L’évolution clinique qui s’ensuit est caractérisée par des périodes d’activité variable de la maladie (mesurée par les indices d’activité de la maladie du LED), avec des poussées fréquentes qui entraînent des lésions irréversibles dues à l’inflammation.
Les dommages – mesurés par l’indice de dommages SLICC/ACR – augmentent la morbidité et la mortalité du LED. Les dommages sont d’abord causés par l’inflammation et plus tard – lorsque la maladie progresse – par le traitement. Avec le temps, les maladies associées telles que les infections, l’athérosclérose précoce et les maladies malignes deviennent une partie importante du fardeau de la maladie. Un traitement efficace, axé sur une faible activité de la maladie ou sur la rémission, a le potentiel de réduire la fréquence et la gravité des poussées de lupus et les dommages qui en résultent, avait précisé la Pre Britta Maurer, Hôpital de l’Île, Berne.
Traite pour traiter : frappe fort et tôt, recule
Traite de manière ciblée : Rémission/faible activité de la maladie
Contrôle étroit : minimise les effets nocifs du traitement, préviens les poussées de la maladie, ainsi les mots-clés de la thérapie.
Les glucocorticostéroïdes : le risque d’effets négatifs commence avec des doses supérieures à 5 mg/jour. Le principe général dans la pratique clinique est d’utiliser la dose la plus faible possible pendant la durée la plus courte possible pour obtenir l’effet thérapeutique souhaité sans prendre le risque d’effets secondaires graves inacceptables.
Le lupus érythémateux disséminé
Dans le lupus érythémateux disséminé (LED), tous les organes peuvent potentiellement être touchés : le livedo reticularis est présent dans 10% des cas, l’arthrite dans 85% des cas et une maladie neurologique dans 18% des cas. D’autres manifestations sont l’alopécie non cicatrisante (31%), le lupus cutané aigu (71%), le lupus cutané chronique 11%), l’éruption malarique (45%), les ulcères buccaux (25%), la néphropathie (21%), le syndrome de Raynaud 37%), les neuropathies crâniennes (2%) les dysfonctionnements cognitifs 2%), sérosite (19%), leucopénie (35%), thrombocytopénie (16%), syndrome des antiphospholipides 10%), lymphadénopathie (9%), anémie hémolytique (3%), fièvre (31%), ainsi qu’atteinte d’organes majeurs sans critères (19%).
Options thérapeutiques
Hydrochloroquine
L’hydrochloroquine est utilisée comme traitement permanent. L’hydrochloroquine a un effet anti-inflammatoire et anti-thrombotique. Elle a des effets métaboliques favorables : réduction du glucose et surtout des taux de cholestérol total et de LDL. Une dose de 5mg/kg/jour ne devrait pas être dépassée. En l’absence de facteurs de risque, un examen ophtalmologique doit être effectué au début du traitement, après 5 ans de prise et chaque année par la suite.
Syndrome des antiphospholipides primaires
Chez les patientes présentant des complications récurrentes de la grossesse, la chloroquine peut être envisagée au premier trimestre.
Voclosporine : La Voclosporine est un inhibiteur de la calcineurine avec une action immunosuppressive, elle bloque l’activation et la prolifération des cellules T, réduit la production de cytokines pro-inflammatoires et augmente la stabilité des podocytes, stabilise la barrière de filtration et diminue la protéinurie.
Voclosporine en cas de néphrite lupique (classe active III, IV, V,I, y compris V/V). Pas de surveillance médicamenteuse nécessaire, profil lipidique et électrolytique métabolique bénin, pas d’influence sur les taux de mycophénolate mofétil, bénéfice significatif par l’ajout de la voclosprorine au traitement standard, diminution rapide de l’anifrolumab réduit la production de cytokines pro-inflammatoires et la protéinurie, taux de rémission complète significativement plus élevé après un an.
Lupkynis : (Voclosporine) a été approuvé en 2021. Il doit être prescrit et surveillé par des experts. La dose est de 2 x 23,7 mg/j p.o. En combinaison avec un traitement immunosuppresseur de fond. Il s’agit d’un substrat du CYP3A4 et est donc contre-indiqué chez les patients prenant des inhibiteurs puissants du CYP3A4 (risque accru de néphrotoxicité aiguë/chronique). Les effets secondaires négatifs sont similaires à ceux des autres calcineurines, à l’exception de sa tératotoxicité potentielle.
L’ anifrolumab: L’anifrolumab est un anticorps monoclonalpr , qui se lie au récepteur de l’interféron α. Il exerce une action anti-inflammatoire, bloque l’activation des cellules T et B et leur prolifération. Il réduit la production de cytokines pro-inflammatoires et diminue la réponse immunitaire humorale et à médiation cellulaire contre les antigènes du soi.
Anifolumab dans le LED avec une activité modérée à sévère : il réduit (en combinaison avec un traitement de fond) l’activité globale de la maladie dans le LED, ainsi que les doses cumulées de corticostéroïdes. Il est particulièrement efficace dans les maladies cutanées et musculo-squelettiques. Une étude de phase 3 est en cours chez des patients atteints de lupus néphrétique, mais elle n’inclut pas de patients présentant des manifestations du SNC.
Le saphnelo : La substance a été autorisée en 2022. Prescription et surveillance par des experts. Dosage 300mg/4 semaines i.v. Il n’y a pas de données sur l’implication rénale ou du SNC. Les effets indésirables les plus fréquents sont les infections, c’est-à-dire la rhinopharyngite, la bronchite, l’herpès zoster, les réactions d’hypersensibilité, et les réactions à la perfusion.
L’ avacopan : L’avacopan est un inhibiteur du facteur C5a du complément u Il bloque l’auto-renouvellement de l’inflammation. Il est utilisé dans le traitement des vascularites associées aux ANCA. L’Avacopan, en association avec le rituximab ou le cyclosphosphamide, peut être envisagé pour induire une rémission dans la granulomatose avec polyangéite ou polyangéite microscopique. Il semble efficace pour maintenir la rémission, mais les données sur 52 semaines manquent. Il a également eu des effets positifs sur la qualité de vie/fatigue. La posologie est de 2x 30mg p.o. en combinaison avec le rituximab ou le cyclophosphamide plus cortocostéroïde (posologie telle qu’indiquée cliniquement).
Tavneos a été approuvé en 2022, prescription et surveillance par des experts. Pour la vascularite associée à l’anca. La posologie est de 2 x 30 mg p.o. en combinaison avec le rituximab ou le cyclophosphamide plus corticostéroïde (posologie telle qu’indiquée cliniquement).
Les effets secondaires négatifs sont : Hépatotoxicité, infections (graves, opportunistes).
récepteurs et / ou réactivation de l’hépatite B, leucopénie / lymphopénie, angioedème, céphalées, nausées. Il est potentiellement tératogène. C’est un substrat du YP3A4. Il y a des interactions avec les inhibiteurs ou les inducteurs du CYP3A4 qui augmentent ou diminuent les taux d’acopan.
Le tavneos : Le tavneos a été approuvé en 2022, prescription et surveillance par des experts. Pour la vascularite associée à l’anca. La posologie est de 2 x 30 mg p.o. en combinaison avec le rituximab ou le cyclophosphamide plus corticostéroïde (posologie telle qu’indiquée cliniquement).
Les effets secondaires négatifs sont : Hépatotoxicité, infections (graves, opportunistes).
récepteurs et / ou réactivation de l’hépatite B, leucopénie / lymphopénie, angioedème, céphalées, nausées. Il est potentiellement tératogène. C’est un substrat du YP3A4. Il y a des interactions avec les inhibiteurs ou les inducteurs du CYP3A4 qui augmentent ou diminuent les taux d’acopan.
Les récepteurs de la famille JAK et les kinases correspondantes
Inhibiteurs de JAK – objet du débat : Chez les patients atteints de polyarthrite rhumatoïde chez lesquels les DMATD conventionnels ont échoué et qui présentent de mauvais facteurs pronostiques, il convient d’utiliser un DMARD biologique doit être administré. L’utilisation d’un inhibiteur JAK ne devrait être utilisée qu’après évaluation des risques, c’est-à-dire âge supérieur à 65 ans, facteurs de risque cardiovasculaires, malignités, thrombose…
Les autorités de contrôle (Swissmedic, EMA, FDA) postulent un effet de classe potentiel et recommandent par conséquent l’utilisation d’inhibiteurs JAK chez les patients sans facteurs de risque.
L’ immunmodulation
Les stratégies anti-fibrotiques
Le nintedanibe
Le nintédanib est un inhibiteur de la multikinase qui inhibe entre autres les récepteurs tyrosine kinases des facteurs de croissance VEGF, FGF et PDGF.
Il a un effet anti-inflammatoire, anti-angiogénique et anti-fibrotique. Dans l’étude SENSCIS®, le nintedanibe a montré une activité antifibrotique et anti-inflammatoire chez les patients atteints de pneumopathie interstitielle, une manifestation fréquente de la sclérose systémique. Chez les patients prenant du mycophénolate à la base et chez ceux qui n’en prenaient pas, le nintédanibe a entraîné une réduction significative du taux annuel de diminution de la CVF (capacité vitale forcée) de 40% et 46% respectivement.- Chez les patients atteints de pneumopathie interstitielle à médiation auto-immune, le nintédanibe a également entraîné une diminution relativement moins importante de la CVF après 52 semaines.
L’ofev : autorisé en 2022, prescrit et surveillé par des experts. Dosage 2 x 150mg p.o. (2 x 100mg p.o.). Traitement à vie. Les contre-indications comprennent l’hypersensibilité aux arachides et au soja, la grossesse. Les effets secondaires négatifs sont des effets gastro-intestinaux (60%, interruption du traitement dans 5-20% des cas). Epistaxis, aggravation des anévrismes/dissections vasculaires.
Les thérapies cellulaires
Transplantation autologue de cellules souches hématopoïétiques
La thérapie cellulaire CAR T (Chimeric Antigen-Receptor-T-cell-Therapy)
Autorisée depuis 2017 pour les maladies hémato-oncologiques.
Les risques de cette thérapie sont le syndrome de libération de cytokines dans 50 à 90% des cas.
Le syndrome de neurotoxicité associé aux cellules effectrices immunitaires 20-60%. Le traitement consiste en dexaméthasone et en inhibition de l’IL-6
L’oratrice a conclu en faisant état d’une étude sur la thérapie cellulaire CAR T dans le lupus érythémateux systémique.
La thérapie cellulaire anti-CD19-T pour l’érythématose systémique réfractaire
Rationnel
La déplétion efficace/durable des cellules B CD19+ et des blastes plasmatiques (résidant dans les tissus).
Population de l’étude. Patients atteints de LED, 4 femmes, 1 homme, âgés de 18 à 24 ans, maladie multiorganique active, SLEDAI-2K médian 16, lupus néphrétique, pas d’atteinte du SNC, réfractaires à plusieurs DMARD (GC, le cyclophosphamide, le belinumab, l’ hydrochychloroquine).
Résultats
Amélioration chez tous les patients, 4SLEDAI-2K =0 après 3 mois, normalisation des taux de complément, disparition de l’ADN anti-ds. Rémission continue sans médicament après 8 mois (malgré la réapparition des cellules B après 100 jours).
Le SLEDAI-2K (indice d’activité de la maladie du lupus érythémateux disséminé 2000) est un moyen de calculer l’activité de la maladie du LED. Cette étude est un autre exemple de l’efficacité de la thérapie CAR T-cell.
riesen@medinfo-verlag.ch