- Traitement de l’ ostéoporose
L’ ostéoporose est fréquente et nécessite un traitement médicamenteux spécifique en fonction du risque de fracture estimé. Des médicaments avec des puissances et de mode d’ action différents (antirésorptif ou ostéoanabolisant) sont disponibles. Le choix de la substance devrait être basé sur le risque initial de fracture. La nature chronique de la maladie d’ une part et les caractéristiques pharmacologiques des médicaments disponibles d’ autre part imposent en général une stratégie de traitement séquentiel. Cet article a pour but de fournir des informations sur les substances actuellement utilisés afin de faciliter la mise en œuvre appropriée d’ un traitement médicamenteux anti-ostéoporotique.
Osteoporosis is common and requires specific drug therapy dependent on the estimated fracture risk. Medications with differing potency and mode of action (antiresorptive or osteoanabolic) are available. The choice of the substance should be based on the initial fracture risk. Due to the chronic nature of the disease on the one hand and the pharmacological characteristics of the available drugs on the other, a sequential treatment strategy is usually necessary. This article aims to provide knowledge about the substances actually available in order to facilitate the appropriate implementation of an anti-osteoporotic drug therapy.
Key Words: estimated fracture risk, major osteoporotic fracture, antiresorptive drugs, osteoanabolic drugs, sequential therapy
En 2019, environ 524 000 patients étaient atteints d’ ostéoporose en Suisse, dont près de 80 % de femmes. Les chiffres les plus impressionnants sont 82’ 000 nouvelles fractures qui y sont liées, ce qui correspond à 9.4 fractures par heure! La Suisse est en outre en tête en Europe en ce qui concerne les coûts liés aux fractures ostéoporotiques (env. 3.4 milliards d’ euros sur un total de 74.9 milliards) (1). Malgré l’ augmentation des possibilités de traitements médicamenteux ces dernières années, un pourcentage considérable de patient/es avec ostéoporose dépassant le risque fracturaire n’est encore pas traité (2).
Indication au traitement
L’ indication d’ un traitement contre l’ ostéoporose est aujourd’ hui posée sur la base d’ une estimation du risque de fracture. L’ estimation se fait par l’ introduction dans un calculateur (p. ex. FRAX de l’ OMS ou «Osteoporose-Plattform», TOP), des facteurs de risque à interroger (tab. 1) et du T-score le plus bas au niveau de la colonne vertébrale, de l’ ensemble de la hanche ou du col du fémur après la mesure DXA.
Ce qui importe en premier lieu pour l’ indication au traitement est le risque estimé d’ une fracture ostéoporotique majeure (en anglais «major osteoporotic fracture» (MOF), c.-à-d. fracture vertébrale, de la hanche, de l’ humérus proximal ou du radius distal. Un seuil d’ intervention adapté à l’ âge, tel qu’ il a été défini par l’ Association suisse contre l’ ostéoporose (ASCO) (fig. 1), est controversé par rapport à un seuil d’ intervention fixe (p. ex. risque à 10 ans de 20–25 %). Pour la prophylaxie en cas de traitement systémique par glucocorticoïdes ou hormono-ablatif, il convient de suivre des recommandations spécifiques qui, pour des raisons de taille, ne sont pas traitées dans cet article.
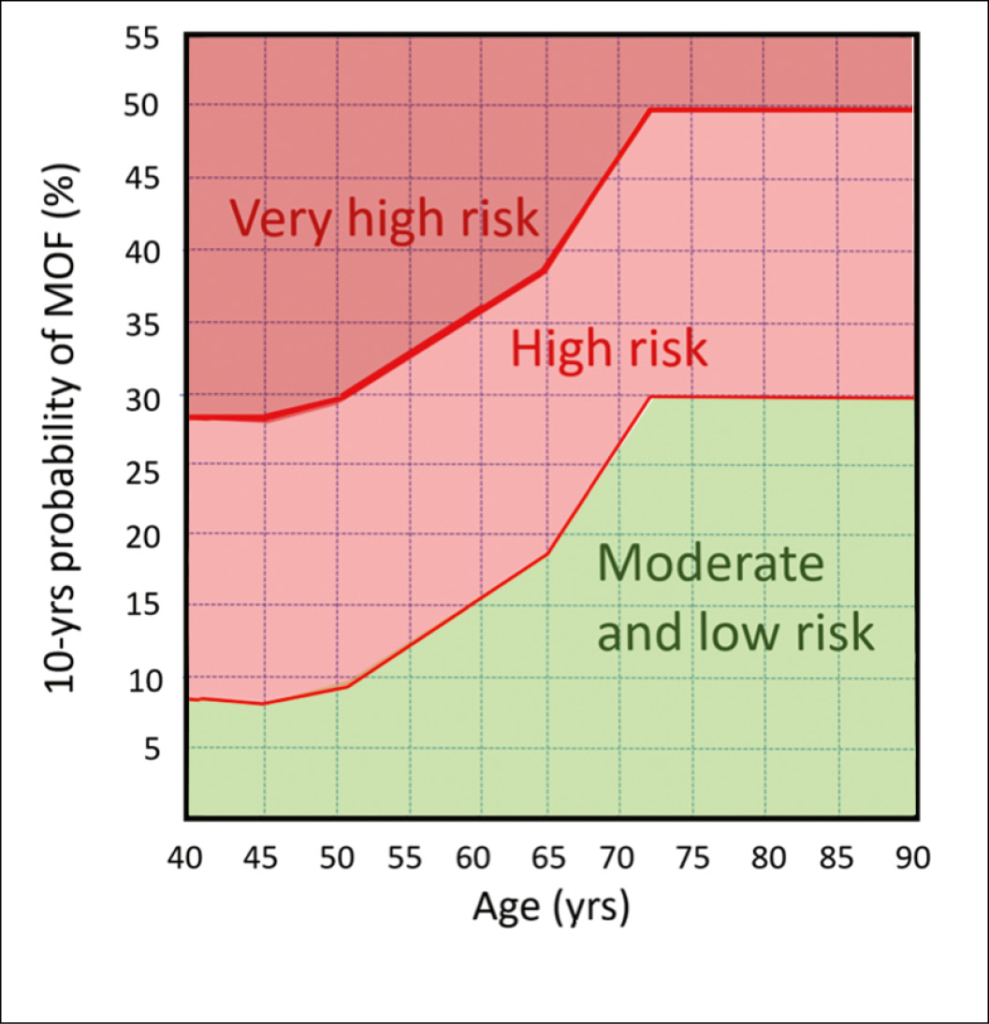
Un traitement de première ligne différent selon le risque initial
En 2020, l’ ASCO a publié des recommandations de traitement (3), basées sur une stratification par groupes de risque basée sur des critères précis (fig. 2). En cas de risque faible (ostéopénie densitométrique sans autres facteurs de risque) ou à risque modéré (ostéoporose densitométrique, risque de fracture inférieur au seuil), la prévention par substitution hormonale à côté d’ un apport suffisant en calcium et en vitamine D est généralement recommandée. La prévention avec des modulateurs sélectifs des récepteurs d’ œstrogènes (SERM) ou, en option, des bisphosphonates oraux sont au premier plan. Il est indispensable d’ avoir recours à un traitement spécifique des os en cas de risque élevé (risque supérieur ou égal au seuil d’ intervention), très élevé (risque 20% au-dessus du seuil d’ intervention) ou risque de fracture imminent. Ce dernier est présent lorsque, chez les patients de plus de 65 ans, une MOF est survenue au cours des dernières 2 années (3). Comme le montre la figure 2, en cas de fracture ostéoporotique prévalente, des recommandations concrètes pour le traitement de première ligne sont faites: le tériparatide en cas de fracture vertébrale, zolédronate en cas de fracture de la hanche et le romosozumab pour les autres MOF. Ces recommandations se basent sur l’ évidence que les médicaments correspondants ont une efficacité bonne, voire supérieure à celle des bisphosphonates oraux dans ces situations précises (4, 5, 6). En outre, la raison d’ être de l’ utilisation en première ligne de la tériparatide (ou du romosozumab) est la suivante: L’ augmentation de la densité obtenue sous traitement ostéoanabolisant est plus élevée sans traitement anti-résorptif préalable. Il convient toutefois de noter que les limites de prise en charge des différents médicaments en Suisse ne concordent pas toujours avec les recommandations de l’ ASCO (Association Suisse contre l’ Osteoporose).
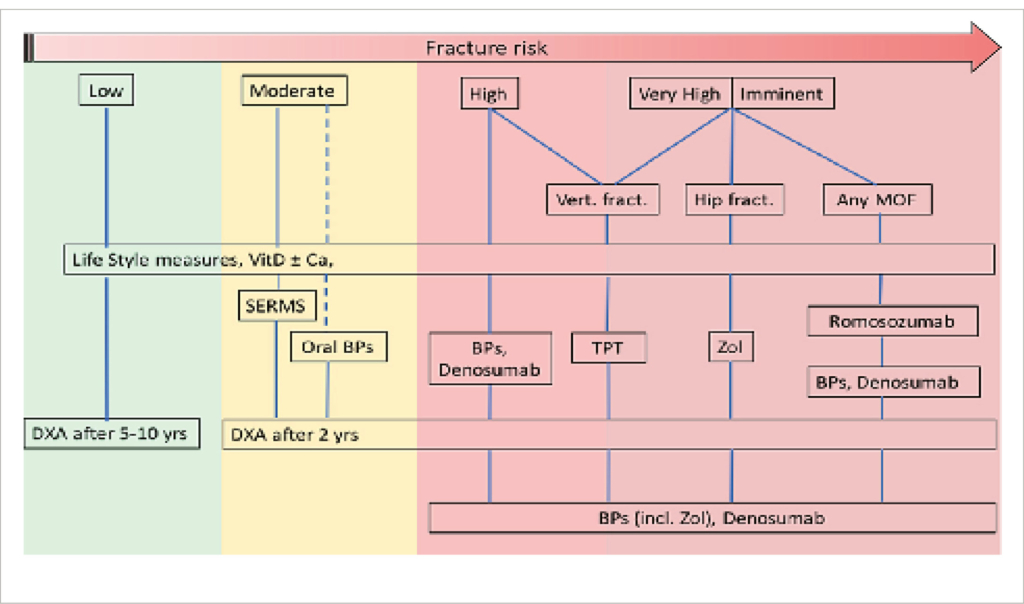
Les médicaments (voir aussi tableau 2)
Médicaments anti-résorptifs
Les bisphosphonates ont un effet antirésorptif par inhibition des ostéoclastes et sont utilisés depuis environ 30 ans dans le traitement de l’ ostéoporose. Les préparations courantes sont présentées dans le tableau 2. En raison de leur mode d’ action par fixation à la surface de l’ os, l’ effet antirésorptif persiste même après l’ arrêt/la fin du traitement, ce qui distingue les bisphosphonates de tous les autres médicaments contre l’ ostéoporose. Cet effet nommé «Tail Effect» est le plus prononcé avec le zolédronate. Des effets secondaires rares sont des ostéonécroses de la mâchoire et des fractures atypiques du fémur (= sous-trochantériennes), le risque augmentant avec la durée du traitement. En conséquence, après 3 à 5 ans de traitement par bisphosphonates une pause doit être considérée, d’ autant plus que la densité osseuse n’ augmente normalement pas davantage après cette période de traitement, malgré la poursuite de celui-ci (7). Les bisphosphonates sont contre-indiqués en cas de grossesse/d’ allaitement et d’ insuffisance rénale (DFG<35 ml/min). Le dénosumab (Prolia®) est un anticorps monoclonal entièrement humain contre le ligand RANK et agit via l’ inhibition des ostéoclastes. Contrairement aux bisphosphonates la thérapie ne montre pas de plateau de l’ augmentation de la densité osseuse après 10 ans d’ utilisation (8). Toutefois, après l’ arrêt ou suite à un retard dans l’ utilisation, une résorption osseuse excessive se produit immédiatement («effet rebond»), qui s’accompagne d’ un risque accru de survenue de multiples fractures vertébrales (9). Le dénosumab convient donc en premier lieu pour un traitement à long terme et ne doit en aucun cas être interrompu ou être administré avec du retard sans traitement de suivi. Les données disponibles pour l’ utilisation sûre à long terme du dénosumab se limitant à 10 ans (8), l’ indication doit être posée avec réserve chez les personnes plus jeunes. Si l’ arrêt du dénosumab s’ avérait nécessaire, le zolédronate, en particulier, s’ est avéré efficace comme traitement de suivi en raison de sa puissance antirésorptive. Cela permet de réduire le rebond, mais pas de l’ empêcher complètement. En ce qui concerne la mise en œuvre optimale de la thérapie de suivi les données disponibles sont encore insuffisantes. Tant pour les bisphosphonates que pour le denosumab, avant l’ initiation du traitement, une hypocalcémie ainsi qu’une carence importante en vitamine D doivent être exclues. En outre, pour réduire le risque d’ ostéonécrose de la mâchoire, il faut veiller à une bonne hygiène dentaire; les interventions chirurgicales sur l’ os de la mâchoire (extraction de dent, implant) doivent être évitées autant que possible sous traitement établi.
Anabolisants osseux
Le tériparatide est une forme recombinante de l’ hormone parathyroïdienne humaine. Il agit par la stimulation de la prolifération et de la différenciation des ostéoblastes. Une garantie de prise en charge des coûts par la caisse d’ assurance maladie est nécessaire avant l’ utilisation. La durée du traitement est limitée à 24 mois. La préparation doit être injectée quotidiennement par voie sous-cutanée. En plus de la préparation originale Forsteo®, il existe désormais de divers biosimilaires (moins chers). Le teriparatide est entre autres contre-indiqué en cas de maladies osseuses malignes ou d’ une radiothérapie antérieure du squelette. Une fois le tériparatide terminé, il est nécessaire d’ enchaîner avec un traitement ultérieur anti-resorptif de suivi, car l’ augmentation de la densité obtenue se perdra sinon totalement.
Le romosozumab (Evenity®) est un anticorps humanisé contre la sclérostine et constitue la deuxième substance à action anabolisante sur l’ os autorisée en Suisse. Outre l’ effet de formation osseuse, il existe aussi un effet antirésorptif. Ce double mécanisme d’ action distingue la substance de tous les autres médicaments à effet osseux autorisés. Le traitement se fait par des injections sous-cutanées mensuelles, sa durée est limitée à un an. Pour le romosozumab également, une garantie de prise en charge par la caisse maladie est nécessaire. La substance n’ est autorisée que pour les femmes postménopausées et est contre-indiquée en cas d’ antécédents d’ infarctus du myocarde ou d’ accident vasculaire cérébral. De même, la densité osseuse obtenue sous romosozumab se perd à la fin du traitement, à moins qu’ un traitement antirésorptif ne soit administré par la suite.
Thérapie séquentielle
Des propriétés des médicaments mentionnés résulte que dans le traitement à long terme de l’ ostéoporose, une stratégie de traitement séquentiel est souvent inévitable. Voici deux casuistiques exemplaires. Dans le deuxième cas, en plus, la possibilité d’ un traitement combiné est evoquée.
Cas 1: Une femme de 62 ans, postménopausée, en bonne santé sur le plan médical, avec une fracture récente de L1 et un score dans la DXA de –4.4 DS au rachis lombaire et de –3.3 DS au col du fémur est mise, en raison d’ un risque imminent de fracture, sous un traitement ostéoformateur de première ligne par romosozumab. Après 1 an de traitement, le T-score est de –2.9 SD à la colonne vertébrale et au col du fémur; aucune nouvelle fracture n’ est apparue. En raison de l’ espérance de vie de la patiente de plus de 10 ans, il est décidé d’ effectuer un traitement de suivi avec un bisphophonate pour 3 à 5 ans. Étant donné qu’ à l’ issue du traitement de suivi, la patiente aura toujours moins de 70 ans, une nouvelle indication de traitement sera sans doute à s’attendre plus tard dans la vie de la patiente.
Cas 2: une patiente âgée de 83 ans, en bonne santé, subit une fracture du sacrum après une chute de sa hauteur. Dans la DXA le T-score de la colonne vertébrale n’ est pas interprétable en raison des altérations dégénératives, celui de la hanche entière est de –1.3 DS et de –1.6 DS au col du fémur. Dans cette constellation, les conditions de prise en charge ne sont remplies ni pour le tériparatide ni pour le romoszumab. Ainsi comme traitement de première ligne restent un bisphosphonate ou le dénosumab. Dans le cas présent, en raison de l’ âge > 80, le choix s’ est porté sur un traitement par dénosumab.
Après 4 ans de traitement par le dénosumab, la patiente présente une fracture spontanée de la 11e vertèbre thoracique, raison pour laquelle les options d’ une escalade thérapeutique doivent être examinées. Le passage à un bisphosphonate ne serait pas une escalade en termes de puissance d’ action, d’ autant plus que le rebond après l’ arrêt du dénosumab n’ est généralement qu’ incomplètement évité par un bisphosphonate. En cas de passage du dénosumab au tériparatide un phénomène de rebond prononcé a été décrit, de sorte que cette séquence est par principe à éviter (10). En ce qui concerne la séquence dénosumab suivi de romosozumab les données disponibles sont insuffisantes. Dans le cas présent, l’ option la plus efficace est la combinaison de dénosumab avec le tériparatide (10) pendant 2 ans, avec poursuite de la thérapie au dénosumab jusqu’ à la fin de la vie.
L’ auteur a publié cet article en allemand dans « der informierte arzt – die informierte ärztin» 02_2024, la traduction en français a été réalisée par les éditeurs. L’ auteur n’ assume aucune responsabilité pour les modifications dues à une traduction.
Copyright Aerzteverlag medinfo AG
Médecin responsable en rhumatologie de
l’ Hopital Cantonal de Lucerne
Co-président de plateforme ostéoporose
Spitalstrasse
6000 Luzern
L’ auteur ne présente aucun conflit d’ intérêt avec le sujet présenté dans cet article.
◆ L’ indication de traitement de l’ ostéoporose est basée sur le risque de fracture, calculé à partir du T-score le plus bas dans la DXA (colonne lombaire, de la hanche et du col du fémur) et les facteurs de risque recensés, en utilisant un calculateur de risque.
◆ Plusieurs médicaments à effet osseux sont disponibles qui se distinguent non seulement par leur mode d’ action, mais aussi par leur puissance d’ action.
◆ Lors du choix du médicament, il convient de tenir compte du risque initial estimé, sachant qu’ en cas de risque très élevé/imminent, l’ utilisation de première ligne d’ ostéoanabolisants devrait être envisagée.
◆ Le traitement à long terme de l’ ostéoporose nécessite souvent une stratégie de traitement séquentielle.
1. Kanis JA, Norton N, Harvey NC, Jacobson T, Johansson H, Lorentzon M, McCloskey EV, Willers C, Borgström F. SCOPE 2021: a new scorecard for osteoporosis in Europe. Arch Osteoporos. 2021 Jun 2;16(1):82.
2. Lippuner K, Moghadam BY, Schwab P. The osteoporosis treatment gap in Switzerland between 1998 and 2018. Arch Osteoporos. 2023 Jan 18;18(1):20.
3. Ferrari S, Lippuner K, Lamy O, Meier C. 2020 recommendations for osteoporosis treatment according to fracture risk from the Swiss Association against Osteoporosis (SVGO). Swiss Med Wkly. 2020 Sep 29;150:w20352.
4. Kendler DL, Marin F, Zerbini CAF, Russo LA, Greenspan SL, Zikan V, et al. Effects of teriparatide and risedronate on new fractures in post- menopausal women with severe osteoporosis (VERO): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2018;391(10117):230–40.
5. Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, et al. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017;377(15):1417–27.
6. Lyles KW, Colón-Emeric CS, Magaziner JS, Adachi JD, Pieper CF, Mautalen C, et al.; HORIZON Recurrent Fracture Trial. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med. 2007;357(18):1799–809. w
7. Black DM, Reid IR, Cauley JA, Cosman F, Leung PC, Lakatos P, Lippuner K, Cummings SR, Hue TF, Mukhopadhyay A, Tan M, Aftring RP, Eastell R. The effect of 6 versus 9 years of zoledronic acid treatment in osteoporosis: a randomized second extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2015 May;30(5):934-44.
8. Bone HG, Wagman RB, Brandi ML, Brown JP, Chapurlat R, Cummings SR, Czerwinski E, Fahrleitner-Pammer A, Kendler DL, Lippuner K, Reginster JY, Roux C, Malouf J, Bradley MN, Daizadeh NS, Wang A, Dakin P, Pannacciulli N, Dempster DW, Papapoulos S. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol. 2017 Jul;5(7):513-523.
9. Anastasilakis AD, Polyzos SA, Makras P, Aubry-Rozier B, Kaouri S, Lamy O. Clinical Features of 24 Patients With Rebound-Associated Vertebral Fractures After Denosumab Discontinuation: Systematic Review and Additional Cases. J Bone Miner Res. 2017 Jun;32(6):1291-1296.
10. Leder BZ, Tsai JN, Uihlein AV, Wallace PM, Lee H, Neer RM, Burnett-Bowie SA. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study): extension of a randomised controlled trial. Lancet. 2015 Sep 19;386(9999):1147-55.
la gazette médicale
- Vol. 13
- Ausgabe 8
- Dezember 2024








