- Aktuelle Diagnostik und Therapie der chronischen Rhinosinusitis
Einleitung und Pathophysiologie
Ziel dieses Reviews ist, Grundversorger über die aktuell gültigen Guidelines zur chronischen Rhinosinusitis (CRS) zu informieren. Der hier vorgelegte Überblick basiert auf dem European Position Paper on Rhinosinusitis and Polyps, abgekürzt EPOS2020 und beschreibt die Anwendung von Biologika bei chronischer Rhinosinusitis in der Schweiz. Die Krankheit betrifft 5–12 % der Gesamtbevölkerung und tritt meist in der fünften Lebensdekade auf. Während bisher anhand des Phänotyps differenziert wurde zwischen einer CRS mit oder ohne Nasenpolypen, steht heute der diagnostisch und therapeutisch wichtige Endotyp im Vordergrund. Es werden drei Endotypen von molekularen Entzündungsmustern unterschieden. Endotyp 1 ist eine durch Interferon Gamma (IFN-γ) geprägte Entzündungsreaktion gegen intrazelluläre Pathogene, etwa Viren. Endotyp 2 ist dagegen ursprünglich gegen Parasiten gerichtet und durch IL-4, IL-5 und IL-13 vermittelt.Dies ist der vorherrschende Endotyp bei CRS und Polypen in westlichen Populationen. Endotyp 3 wehrt unter Sekretion von IL-17 und IL-22 extrazelluläre Bakterien ab. Eine traditionelle Unterteilung der CRS in eine Form mit und ohne Polypen (CRSwNP/CRSsNP) wird in der neueren Literatur zunehmend verlassen zugunsten der Endotypen. Für den klinischen Alltag hat sich eine vereinfachende Unterteilung in Typ-2- und Non-Typ-2-Entzündung durchgesetzt. Aus den Endotypen werden die Phänotypen hergeleitet, ein Endotyp kann zu verschiedenen Phänotypen führen (1).
EPOS2020 Definitionen
Eine CRS wird in der EPOS2020 als eine mindestens zwölf Wochen persistierende Entzündung der sinunasalen Schleimhaut definiert. Sie geht definitionsgemäss mit folgenden Symptomen einher:
• Nasenobstruktion/-blockierung und/oder anteriore oder posteriore Rhinorrhoe, wobei mindestens eines davon obligat vorhanden sein muss
• sowie optional Druckgefühl/Gesichtsschmerzen oder Riechminderung, sollten nicht beide erstgenannten Symptome erfüllt sein
Die klinische Definition kann im Verlauf durch eine Nasenendoskopie und ein natives CT der Nasennebenhöhlen (NNH) ergänzt werden. Dabei ist der endoskopische Nachweis von Polypen, purulentem Sekret oder entzündeter, ödematöser Schleimhaut im mittleren Nasengang notwendig. CT-graphisch ist eine Mukosaschwellung der Sinus oder in der osteomeatalen Einheit erforderlich, also dem gemeinsamen Drainageweg von Kiefer-, Stirn- und vorderer Siebbeinhöhlen (2). Die EPOS2020 unterscheidet zwischen primärer und sekundärer CRS. Sekundäre Formen entstehen auf dem Boden einer Grunderkrankung, wie z.B. einer zystischen Fibrose oder einer Vaskulitis.
Die Phänotypen
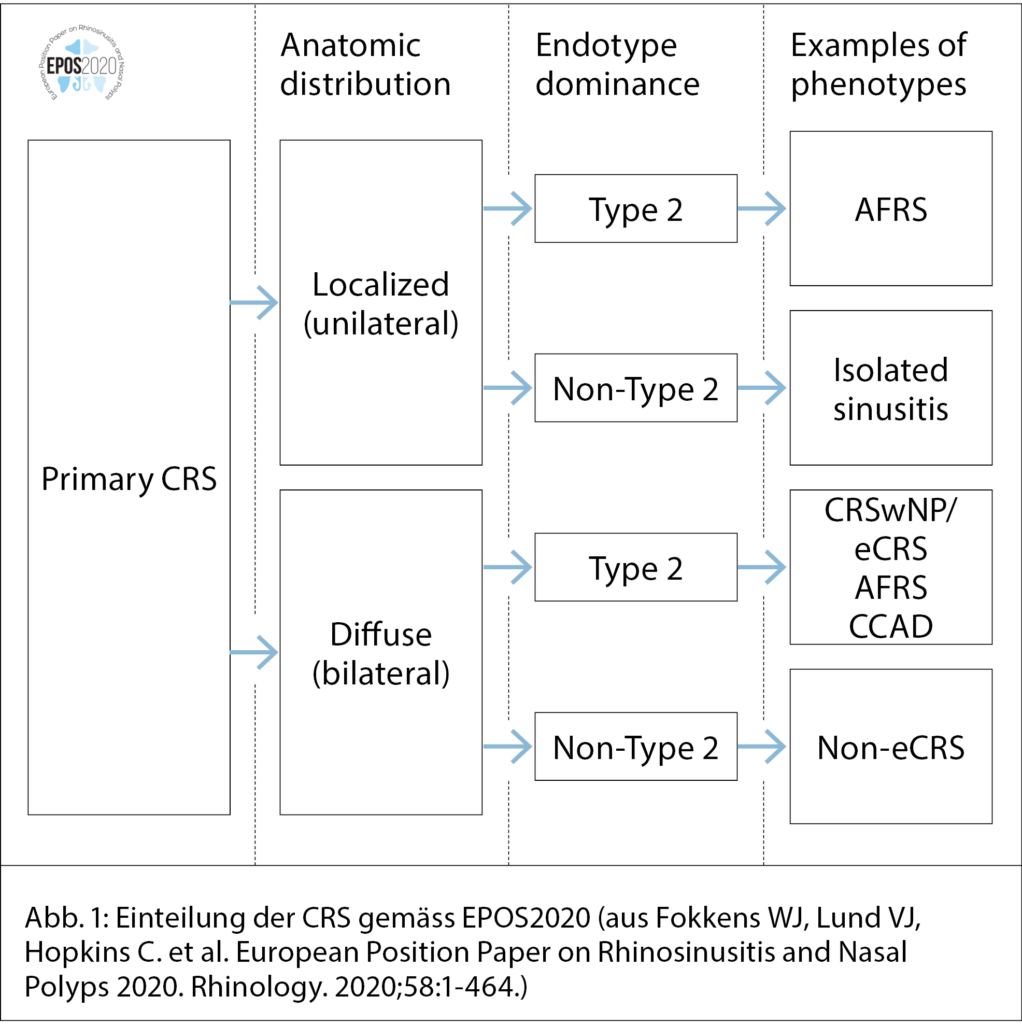
Die primäre CRS, welche in dieser Übersichtsarbeit thematisiert wird, ist nach anatomischer Beteiligung in einseitig oder beidseitig unterteilt (Abb. 1). Die weitere Unterteilung erfolgt nach dem Endotyp. Folgende klinischen Befunde, also Phänotypen, ergeben sich aus einer bilateralen primären CRS vom Endotyp 2:
• Die chronische Rhinosinusitis mit Nasenpolypen: Diese tritt meistens in der fünften Lebensdekade auf, Männer sind eher betroffen. Bei dieser Form findet sich eine Prävalenz von bis zu 31 % für Allergien auf Inhalationsantigene, ein Zusammenhang mit Asthma wird in 45 % der Fälle angegeben (1).
• Die eosinophile Form (eCRS) benötigt den histologischen und laborchemischen Nachweis von Eosinophilen (1).
• Seltenere Phänotypen sind die allergische Pilz-Rhinosinusitis und die central compartment atopic disease (CCAD), zu Deutsch atopische Krankheit der zentraleKompartimente. Die allergische Pilz-Rhinosinusitis ist eine nicht invasive Mykose der Nasennebenhöhlen, die durch eine Typ I allergische Reaktion gegen Pilzhyphen geprägt ist. Sie kommt gehäuft in feuchteren und wärmeren Gegenden vor und wird oft von einem allergischen Asthma begleitet (1).
Die bilaterale primäre CRS vom Non-Typ 2 Endotyp hat als einzigen Phänotyp die non eosinophile CRS (Non-eCRS). Entsprechend weist sie histologisch < 10 Eosinophile/Gesichtsfeld im Sinusepithel, laborchemisch eher niedrige IgE-Spiegel und normwertige Eosinophile-Anzahl auf (1). Diese Patienten leiden oft an eitriger Rhinorrhoe, manchmal begleitet von Gesichtsschmerzen, und häufigen akuten Infekten.
Eine einseitige CRS ist immer verdächtig auf eine sekundäre Form der CRS, z.B. in Form eines invertierten Papillomes, eines Malignoms oder einer dentogenen Ursache. EPOS2020 empfiehlt bei einseitiger CRS die direkte Zuweisung an einen HNO-Spezialisten und eine Bildgebung. Hervorzuheben ist zudem, dass eine isolierte Verschattung im Sinus maxillaris zwar am häufigsten bei einer dentogenen Infektion auftritt, jedoch auch ein Malignom als Ursache haben kann (1).
Diagnostik und Therapie in der hausärztlichen Sprechstunde
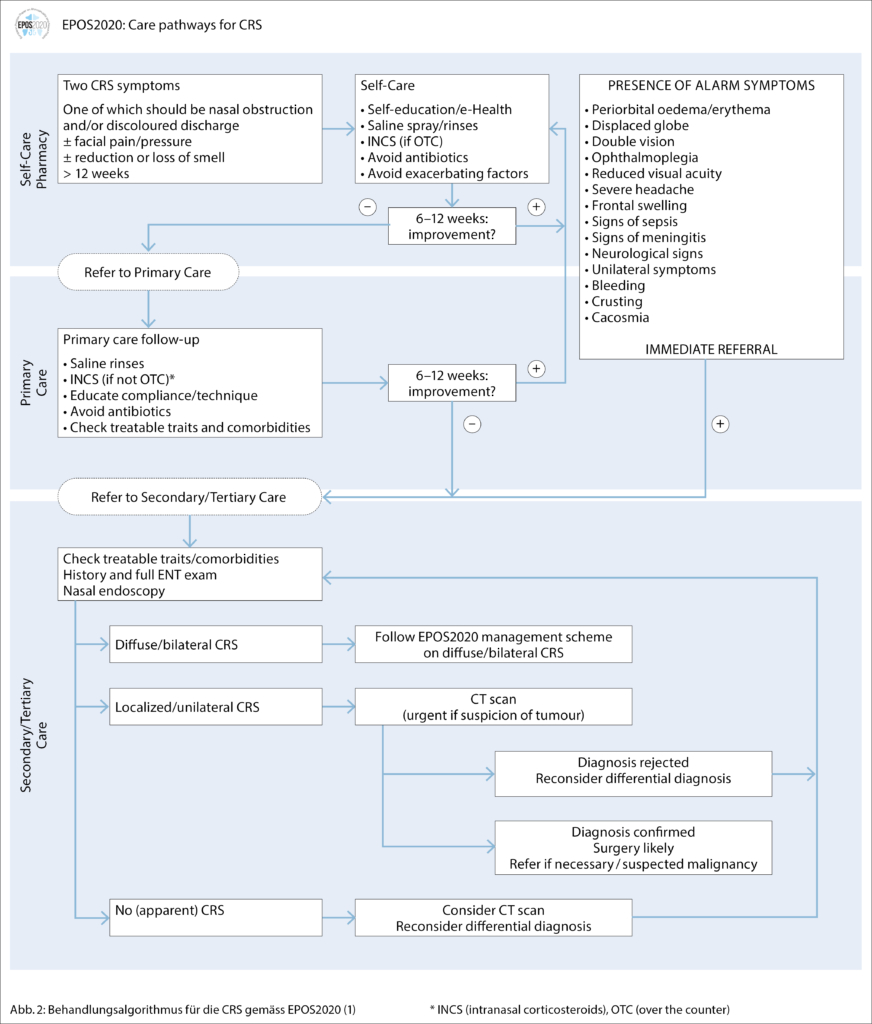
Der Hausarzt kann eine CRS anhand der Symptome, wie von den EPOS 2020 vorgeschlagen, postulieren und behandeln (Abb. 2). Zu beachten sind Warnsymtome und unilaterale Symptome, welche eine zeitnahe Überweisung notwendig machen (Abb. 2). Daneben sollen in der hausärztlichen Praxis einerseits die Komorbiditäten im Zusammenhang mit der CRS diagnostiziert und therapiert werden, andererseits wird die Basistherapie mit nasalen Steroidsprays und Nasenspülungen begonnen. Rauchen führt zu einem oxidativen Stress der Mukosa. Das metabolische Syndrom scheint ein unabhängiger Risikofaktor für die CRS zu sein. Es wird postuliert, dass das vermehrte Fettgewebe pro-inflammatorisch wirkt. Ein weiterer unabhängiger Risikofaktor für eine CRS ist das Obstruktive Schlafapnoesyndrom (OSAS), wobei hier die pathophysiologischen Zusammenhänge unklar sind. Daneben scheint ein gastroösophagealer Reflux eine CRS zu begünstigen, der Nachweis einer Besserung der CRS-Symptomatik durch die Gabe von Säureblockern steht jedoch aus. Die Exposition gegenüber Papier-, Metall-, Textilienstaub, Reinigungsmittel, Schimmel, Feuchtigkeit und toxischen Gasen begünstigt die CRS (1).
Die Aspirin Exacerbated Respiratory Disease (AERD, auch Widal-Trias genannt) ist eine chronische, eosinophile Entzündung des respiratorischen Epithels mit einer Verschlimmerung von Atembeschwerden durch die Einnahme von Aspirin und anderen NSAR. Die Betroffenen leiden unter einem Asthma und einer CRS Typ 2, in der Regel mit dem Phänotyp von Nasenpolypen. Ursache ist eine vermehrte Leukotrienbildung wegen einer Störung der Eicosanoid-Synthese. AERD-Patienten sind jünger als andere CRS-Patienten und leiden häufiger an Rezidivpolypen trotz adäquater Therapie. Empfohlen wird eine strikte Auslöserkarenz. Während früher in ausgewählten Fällen eine Aspirindesensibilisierung versucht wurde, wird man heute eine Therapie mit einem Biologikum bevorzugen.
Ein starker Zusammenhang besteht zwischen CRS und Asthma. Die Prävalenz eines Asthma bronchiale liegt je nach Endotyp der CRS zwischen 21–45 % und sogar 73 % bei AFRS. Eine gute Evidenz für oder gegen eine allergische Prädisposition und CRS gibt es nicht, hingegen sind Unterformen wie CCAD und AFRS mit Allergien vergesellschaftet. Sowohl für CRS als auch für eine allergische Rhinitis besteht die Therapie in der Anwendung von topischen Steroiden, aktuell kann bei Non-Allergikern mit CRS keine zusätzliche Antihistamintherapie empfohlen werden. Die meisten COPD- und Bronchiektasie-Patienten weisen CT-graphische Hinweise für eine CRS auf, ursächlich dafür dürfte eine Ziliendysfunktion sein (1).
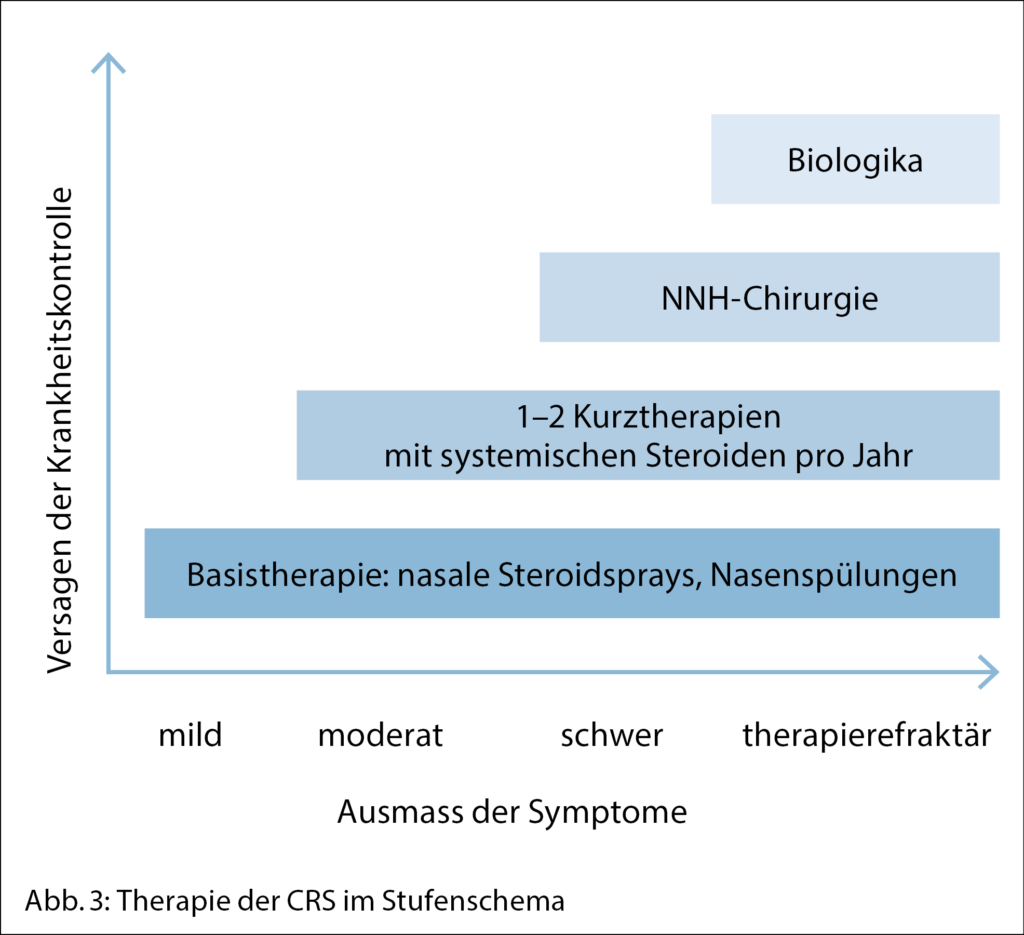
Die genaue Instruktion der Basistherapie mit Nasenspülungen und nasalen Steroidsprays ist für den Therapieeffekt und die Compliance essenziell. Für die Nasenspülung wird isotonisches Salzwasser empfohlen. Vor der topischen Steroidanwendung soll die Nase zuerst gespült und dann geschnäuzt werden. Der Spray soll vor dem Gebrauch gut geschüttelt werden, da das Kortison meist in einer Suspension vorliegt. Dann wird der Behälter mit aufrechtem Oberkörper in einer Hand gehalten und gekreuzt in das gegenseitige Nasenloch eingesprüht. Die Basistherapie wird täglich für sechs bis zwölf Wochen durchgeführt, eine Besserung ist erst nach zwei bis drei Wochen zu erwarten. Bei gutem Ansprechen auf die Basistherapie bei einer bilateralen CRS kann diese bei Bedarf über Jahre hinweg fortgeführt werden.
Bei Beschwerdepersistenz sollte eine Überweisung für eine rhinologische Abklärung bei einem HNO-Arzt erfolgen (Abb. 2). Differenzialdiagnostisch ist auch an eine sekundäre CRS zu denken, wobei hier bei Kindern vor allem eine primär ziliäre Dyskinesie oder zystische Fibrose und bei Erwachsenen eine Vaskulitis wie eine Granulomatose mit Polyangiitis infrage kommen.
Die weitere Diagnostik und Therapie beim HNO-Facharzt
Initial werden die Diagnose und Differentialdiagnose einer CRS reevaluiert. In der ergänzenden Anamneseerhebung beim HNO-Arzt wird nochmals die korrekte Spül- und Spraytechnik überprüft. Die Einschränkung der Lebensqualität bei CRS-Patienten wird mit dem SNOT-22 Formular (Sinonasal Outcome Test) festgehalten. Mittels Riechtest wird nach einer Hyposmie gesucht. Es erfolgt die Nasenendoskopie mit Beurteilung der Schleimhaut, Anatomie, Dokumentation von allfälligem pathologischen Sekret oder Polypen sowie Ausschluss einer Raumforderung. Ein Prick-Test kann bei möglichem Vorliegen einer Allergie ergänzend durchgeführt werden. Laborchemisch werden die Eosinophilen im Blutbild und das Gesamt-IgE als Hinweise für eine Typ-2-Inflammation bestimmt. Bildgebend wird nach adäquater Vorbehandlung ein CT-NNH nativ durchgeführt, einerseits um das Ausmass der Verschattung der Sinus zu bestimmen, andererseits zur Planung einer möglichen endoskopischen NNH-Operation. Therapeutisch wird bei einer CRS Typ 2 die Basistherapie mit kurzdauernden systemischen Steroidstössen (maximal ein-/zweimal pro Jahr) ergänzt. Eine funktionelle NNH-Operation, im Sinne einer endoskopischen Eröffnung der betroffenen Sinus, ist indiziert, wenn trotz Basistherapie für mindestens acht Wochen und trotz systemischen Steroiden bei CRS Typ 2 oder Antibiotika bei CRS Non-Typ 2 keine Besserung der Beschwerden eintritt. Der Patient muss sich bewusst sein, dass durch die Operation keine Heilung eintritt, sondern die weiterhin notwendige Basistherapie besser zu dem eröffneten Sinus gelangt. Bei Beschwerdepersistenz trotz stufengerechter medikamentöser und operativer Therapie sollte die Diagnose einer primären Form der CRS hinterfragt, eine sekundäre CRS in Betracht gezogen oder eine Revisionsoperation angedacht werden. Eine Option für eine therapierefraktäre, stark symptomatische CRS Typ 2 trotz adäquater medikamentöser und operativer Therapie sind Biologika (Abb. 3). Bei Vorliegen von Rezidivpolypen nach erfolgter endoskopischer NNH-Operation sollten für die Indikation zur Therapie mit einem Biologikum gemäss EPOS2020 mindestens drei der aufgeführten Kriterien erfüllt sein (1):
• Hinweise für eine Typ-2-Inflammation:
. histologisch Gewebseosinophilie ≥10 Eosinophile/Gesichtsfeld oder
. Bluteosinophilie ≥250 u/L oder
. Gesamt-IgE im Blut >100 IU/ml
• Notwendigkeit von zwei oder mehr systemischen Steroidtherapien pro Jahr oder Kontraindikation für Steroide
• SNOT-22 ≥40
• Nachweis einer Anosmie im Riechtest
• Asthmadiagnose mit Notwendigkeit von inhalativen Steroiden
Da es sich in der Regel um Patienten mit fachübergreifenden chronischen Atemwegserkrankungen handelt, sollte die Indikation zur Therapie einer CRS Typ 2 mit einem Biologikum an einem interdisziplinären Fachboard mit HNO-Ärzten, Pneumologen, Immunologen/Allergologen, Hämatologen gestellt werden (3).
In der Schweiz sind zur Zeit drei Biologika für die Behandlung der chronischen Rhinosinusitis mit Nasenpolypen (Typ-2-Inflammation) von Swissmedic zugelassen.
Omalizumab ist ein selektiver monoklonaler Antikörper, welcher IgE bindet und das Andocken von IgE an Mastzellen oder Basophilen und somit die Aktivierung der Entzündungskaskade verhindert. Omalizumab wird seit 2003 zur Behandlung von Asthma und seit 2014 bei chronischer Urtikaria eingesetzt (4). Die gewichtsadaptierte Dosis wird durch den prätherapeutischen Gesamt-IgE-Spiegel beeinflusst und alle vier Wochen subkutan verabreicht. Während der Behandlung kann der Gesamt-IgE-Spiegel steigen, da nun die IgEs an Omalizumab gebunden sind und nicht mehr an den Zellrezeptoren (5). In einer Phase-III-Studie bei CRSwNP verbesserte sich der SNOT-22 um etwa 20 Punkte nach 24 Wochen Anwendung, endoskopisch kam es zu einer Polypenreduktion (6).
Mepolizumab ist ein monoklonaler Antikörper gegen IL-5 und wird neben der CRSwNP seit 2015 bei Asthma sowie bei eosinophiler Granulomatose mit Polyangiitis und Hypereosinophilie-Syndrom angewendet (7). Bei CRSwNP ist das IL-5 im sinunasalen Epithel hochreguliert und wird von verschiedenen Entzündungszellen produziert, Eosinophile werden dadurch aktiviert und überlebensfähig gemacht (8). Mepolizumab wird alle 4 Wochen subkutan injiziert. Nach 52 Wochen Therapie fand sich in der Phase-III-Studie bei CRSwNP eine SNOT-22-Reduktion von fast 30 Punkten, ebenso wurden die Polypen kleiner (9).
Dupilumab ist ein monoklonaler Antikörper gegen IL-4 und IL-13 (10). Beide Interleukine können die Interzellularverbindungen zwischen den Epithelzellen schwächen. IL-13 kann in den B-Zellen einen IgE-Klassenwechsel herbeiführen, womit lokal mehr IgE gebildet wird, zudem kann das Zytokin Proteine bilden lassen, welche den Übertritt von Entzündungszellen vom Blut ins Gewebe erleichtern (9). Dupilumab wird alle 2 Wochen subkutan angewendet, nach 52 Wochen Therapie zeigte sich in einer Phase-III-Studie bei CRSwNP eine Verbesserung des SNOT-22 um 20 Punkte, und die Polypen wurden kleiner (10). Weitere Indikationen für Dupilumab sind Asthma, atopische Dermatitis, Prurigo nodularis und die eosinophile Ösophagitis.
Gemeinsame Nebenwirkungen von allen drei Biologika können in seltenen Fällen eine anaphylaktische Reaktion sein, die Bildung von Antikörper gegen die verabreichten monoklonalen Antikörper und eine mögliche Abschwächung der Immunantwort gegen Helminthen sein (5, 11, 12). Welches der drei Biologika das Effektivste ist, bleibt ungeklärt. Bisherige Reviews zeigen eine leichte Überlegenheit von Dupilumab, was den Geruchssinn angeht, jedoch bei eingeschränkter Vergleichbarkeit (13). Da die Kosteneffektivität von Biologika in der primären Behandlung der CRSwNP gegenüber den Standardtherapien schlecht abschneidet (14), sollte ihr Einsatz ausschliesslich schweren, therapierefraktären Formen vorbehalten bleiben. Bei fehlendem Ansprechen innerhalb von 16 Wochen sollte das Biologikum abgesetzt werden.
Abkürzungen:
AFRS Allergic Fungal Rhinosinusitis
CCAD Central Compartment Atopic Disease
COPD Chronic Obstructive Pulmonary Disease
CRS Chronische Rhinosinusitis
CRSsNP Chronic Rhinosinusitis sine Nasal Polyps
CRSwNP Chronic Rhinosinusitis with Nasal Polyps
CT Computer Tomographie
eCRS eosinophilic Chronic Rhinosinusitis
EPOS European Position Paper on Rhinosinusitis and Polyps
HNO Hals-Nasen-Ohren
IgE Immunoglobulin E
IL Interleukin
IFN Interferon
AERD Aspirin Exacerbated Respiratory Disease
NNH Nasennebenhöhlen
Non-eCR Non eosinophilic Chronic Rhinosinusitis
NSAR Nichtsteroidale Antirheumatika
SNOT Sinonasal Outcome Test
Historie:
Manuskript eingereicht: 07.03.2024
Nach Revision angenommen: 02.05.2024
Klinik für Hals-, Nasen-, Ohren- und Gesichtschirurgie
Luzerner Kantonsspital
Spitalstrasse
6000 Luzern
letizia.meier@luks.ch
Es bestehen keine Interessenkonflikte.
• Eine chronische Rhinosinusitis kann symptombezogen in der Hausarztpraxis postuliert werden. Wenn die bilaterale Krankheit durch eine Behandlung mit topischen Steroiden und Nasenspülungen erfolgreich therapiert wird, sind keine weiteren Schritte erforderlich.
• Die CRS stellt häufig eine fachübergreifende Atemwegserkrankung dar. Komorbiditäten und Risikofaktoren wie Tabakrauch, Asthma, Allergien und AERD sollen mitberücksichtigt werden. Einseitige Symptome oder nasale Warnsymptome erfordern die zeitnahe Überweisung an einen HNO-Facharzt und eine Bildgebung.
• Die CRS kann in den meisten Fällen symptombezogen und stufengerecht mit einer Basistherapie bestehend aus Salzwassernasenspülungen und topischen Steroidsprays, maximal 1–2 kurzdauernden oralen Steroidbehandlungen oder einer NNH-Operation erfolgreich behandelt werden.
• In ausgewählten Fällen kann die Therapie mit einem Biologikum bei therapierefraktärer CRSwNP sinnvoll sein. Die Indikation dazu sollte an einem interdisziplinären Fachboard getroffen werden.
1. Fokkens WJ, Lund VJ, Hopkins C, et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2020. Rhinology. 2020;58:1-464.
2. Bandyopadhyay R, Biswas R, Bhattacherjee S, Pandit N, Ghosh S. Osteomeatal Complex: A Study of Its Anatomical Variation Among Patients Attending North Bengal Medical College and Hospital. Indian J Otolaryngol Head Neck Surg. 2015;67:281-6.
3. Stellungnahme der AG Rhinologie der Schweiz. ORL-Gesellschaft zur monoklonalaen Antikörpertherapie bei chronischer Rhinosinusitis 2019 (; letzter Zugriff 10.02.2024)
4. Drugsite Trust, Dallas TX, USA; 2024. www.drugs.com/history/xolair.html letzter Zugriff 14.04.2024
5. HCl Solutions AG. Bern; Compendium 2024. www.compendium.ch/product/1471129-xolair-inj-los-75-mg-0-5ml-fertigspritze/mpro#Mpro7550; letzter Zugriff: 26.01.2024.
6. Gevaert P, Omachi TA, Corren J et al. Efficacy and safety of omalizumab in nasal polyposis: 2 randomized phase 3 trials. J Allergy Clin Immunol. 2020;146:595-605.
7. Drugsite Trust, Dallas TX, USA; 2024. www.drugs.com/history/nucala.html; letzter Zugriff 14.04.2024
8. Bachert C, Zhang N, Cavaliere C, Weiping W, Gevaert E, Krysko O. Biologics for chronic rhinosinusitis with nasal polyps. J Allergy Clin Immunol. 2020;145:725-39.
9. Han JK, Bachert C, Fokkens W et al. SYNAPSE study investigators. Mepolizumab for chronic rhinosinusitis with nasal polyps (SYNAPSE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med. 2021;9:1141-53.
10. Bachert C, Han JK, Desrosiers M et al. Efficacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52): results from two multicentre, randomised, double-blind, placebo-controlled, parallel-group phase 3 trials. Lancet. 2019;394:1638-50.
11. HCl Solutions AG. Bern; Compendium 2024. www.compendium.ch/product/1439675-nucala-inj-los-100-mg-ml-fertigpen/mpro#MPro7250; letzter Zugriff: 10.02.2024
12. HCl Solutions AG. Bern; Compendium 2024. www.compendium.ch/product/1411258-dupixent-300-mg-2ml-fertspr-safe-sys/mpro#MPro7450; letzter Zugriff: 10.02.2024
13. Hellings PW, Verhoeven E, Fokkens WJ. State-of-the-art overview on biological treatment for CRSwNP. Rhinology. 2021;59:151-63.
14. Scangas GA, Wu AW, Ting JY et al. Cost Utility Analysis of Dupilumab Versus Endoscopic Sinus Surgery for Chronic Rhinosinusitis With Nasal Polyps. Laryngoscope. 2021;131:E26-33
PRAXIS
- Vol. 113
- Ausgabe 5
- Mai 2024