- Akutes Koronarsyndrom: Diagnose und Behandlung
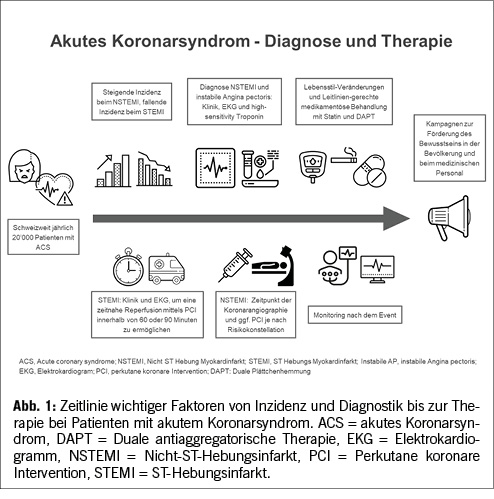
In der Schweiz sind jährlich rund 20 000 Personen von einem akuten Koronarsyndrom betroffen. Ein akutes Koronarsyndrom umfasst den ST-Hebungsinfarkt (STEMI), den Nicht-ST-Hebungsinfarkt (NSTEMI) und die instabile Angina pectoris. Die Diagnostik basiert auf der klinischen Präsentation, auf kardialen Biomarkern und dem EKG. Bei Patienten mit akutem STEMI gilt die Prämisse ‚Zeit ist Herzmuskel‘ und es gilt, die verschlossene Koronararterie so schnell wie möglich mittels perkutaner koronarer Intervention (PCI) wieder zu eröffnen. Bei Patienten mit NSTEMI oder instabiler Angina pectoris wird der Zeitpunkt der Koronarangiographie und ggf PCI nach vorgängiger Risikostratifikation festgelegt. Eine optimale Sekundärprävention und strikte Kontrolle der kardiovaskulären Risikofaktoren sind bei allen Patienten mit akutem Koronarsyndrom essenziell.
Einleitung und Übersicht
Das akute Koronarsyndrom (‘acute coronary syndrome’, ACS) umfasst die Entitäten ST-Hebungsinfarkt (STEMI), Nicht-ST-Hebungsinfarkt (NSTEMI) und die instabile Angina pectoris. In diesem Artikel fokussieren wir auf den Myokardinfarkt
Typ 1 (durch einen Plaque-Event verursacht) sowie den Myokardinfarkt Typ 2 (durch ein Missverhältnis zwischen Sauerstoffangebot und -nachfrage verursacht). Auf MINOCA (myocardial infarction without obstructive coronary arteries) wird in diesem Artikel nicht näher eingegangen (1).
Die koronare Herzkrankheit stellt die häufigste Todesursache in der Schweiz dar. Seit 2002 ist die Zahl der Hospitalisationen aufgrund von Herz-Kreislauf-Erkrankungen um 12% angestiegen, was primär durch das Wachstum und das Älterwerden der Bevölkerung erklärt wird (2). Im Jahr 2021 erlitten 19‘145 in der Schweiz wohnhafte Personen einen Myokardinfarkt (2). Die Mortalität des ACS ist aufgrund der verbesserten Diagnostik und Therapie erfreulicherweise seit 2002 um 17% gesunken (2).
Diagnostik des ACS
Das ACS stellt eine wichtige Differenzialdiagnose bei thorakalem Druckgefühl, thorakalem Brennen, in die Arme oder den Hals ausstrahlende Schmerzen oder auch eher atypischen thorakalen Symptomen und Dyspnoe dar. Dies ist insbesondere auch bei jüngeren Männern, Frauen oder Patienten ohne bekannte kardiovaskuläre Risikofaktoren, welche primär nicht als besonders gefährdet gelten, wichtig. Gerade bei Frauen, älteren Patienten oder bei Diabetikern muss ein ACS auch bei diffusen Symptomen wie abdominellen Beschwerden, Nausea, Erbrechen, Synkope oder allgemeiner Schwäche in Betracht gezogen werden. Es gilt zudem zu beachten, dass bis zu einem Drittel aller Patienten mit einem ACS ohne Thoraxschmerzen präsentieren (3).
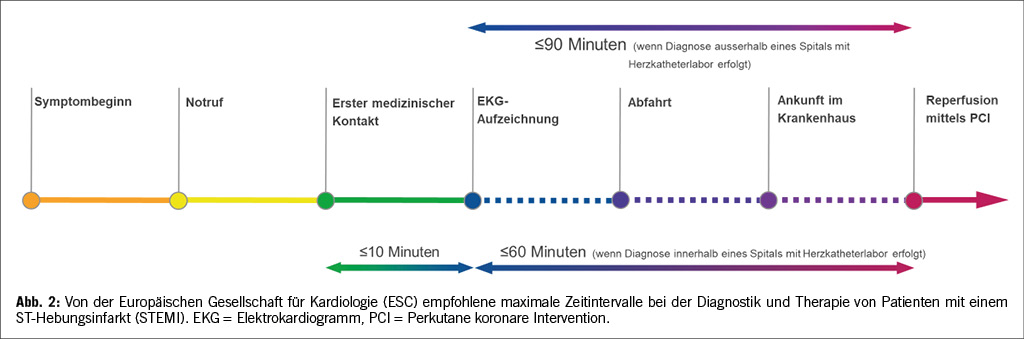
Beim ACS gilt die Prämisse: ‘Zeit ist Herzmuskel’. Innerhalb von 10 Minuten sollte daher bei Patienten mit Verdacht auf ein ACS ein 12-Kanal-EKG geschrieben werden (Abbildung 2). Ein 12-Kanal-EKG erlaubt das sofortige Erkennen eines STEMIs. Zu den EKG-Kriterien eines STEMIs gehören ST-Hebungen >1 mm in zwei benachbarten Ableitungen. In den Ableitungen V2 und V3 werden ST-Hebungen >1.5 mm bei Frauen und >2 mm bei Männern über 40 Jahre und >2.5 mm bei Männern unter 40 Jahre als diagnostisch erachtet. Ein neu aufgetretener Links- oder Rechtsschenkelblock gelten als STEMI-Äquivalent (4, 5).
Sowohl beim STEMI wie auch beim NSTEMI können die ischämie-typischen EKG-Veränderungen auf das Infarkt-Gefäss hinweisen. Es gilt aber zu berücksichtigen, dass das initiale EKG in einem Drittel der Patienten nicht diagnostisch ist (6). Daher muss das EKG bei klinischem Verdacht in regelmässigen Abständen wiederholt werden. Sollte sich trotz suggestiver Symptomatik in den konventionellen EKG-Ableitungen keine klare Diagnose ergeben, müssen zusätzlich die rechtsseitigen und die posterioren Ableitungen aufgezeichnet werden.
Bei eindeutiger EKG-Diagnose eines akuten STEMIs sollte die Behandlung nicht durch weitere Diagnostik verzögert werden. Eine arterielle Blutuntersuchung mit Bestimmung insbesondere des Hämoglobins und der Elektrolyte erlaubt es, eine schwere Anämie oder Elektrolytstörung (z.B. Hyperkaliämie) auszuschliessen, welche in seltenen Fällen das Bild eines STEMIs imitieren können.
Kann ein akuter STEMI ausgeschlossen werden, erfolgt als nächster Schritt eine Blutentnahme mit Bestimmung der kardialen Biomarker. Nebst den kardialen Biomarkern sollte das Blutbild, die Gerinnung (insbesondere INR bei Patienten unter oraler Antikoagulation mit Marcoumar), die Nierenfunktion, Elektrolyte sowie die Schilddrüsenparameter bestimmt werden. Letztere sind wichtig zum Ausschluss von Krankheiten wie einer autoimmunen Hyperthyreose (früher Morbus Basedow) oder autonomer Schilddrüsenknoten. Hier kann die unkontrollierte Aufnahme von Jod (bei Applikation von jodhaltigem Kontrastmittel) eine thyreotoxische Krise verursachen.
Zur Diagnose eines Myokardinfarktes wird das ‘high-sensitivity’ Troponin verwendet, wobei Troponin T und Troponin I den gleichen Stellenwert aufweisen. Ein Wert gilt dann als erhöht, wenn er über der 99igsten Perzentile des oberen Referenz-Limits liegt, wobei sowohl der initial Wert als auch die Dynamik der Biomarker im Verlauf wichtig sind. Die Referenzwerte unterscheiden sich je nach verwendetem Assay. Die Guidelines der Europäischen Gesellschaft für Kardiologie (ESC) zum Management von Patienten mit NSTEMI empfehlen, zur Diagnostik eines Myokardinfarktes einen 0/1-Stunden oder 0/2-Stunden Algorithmus (‘rule-in’ oder ‘rule-out’) zu verwenden (5, 7). Es gilt zu beachten, dass die Troponingrenzwerte einen hohen negativ prädiktiven Wert bei eher niedrigem positiv prädiktivem Wert aufweisen.(8) Ist die Diagnose initial unklar, empfiehlt es sich, bei Patienten mit hoher Vortestwahrscheinlichkeit eine weitere Troponin-Bestimmung nach drei Stunden sowie eine weitere Diagnostik mittels transthorakaler Echokardiographie durchzuführen. Bei ausgewählten Patienten mit niedriger Vortestwahrscheinlichkeit kann auch eine Herz-Computertomographie durchgeführt werden, um Stenosen in den epikardialen Herzkranzgefässen ausschliessen oder nachweisen zu können (9). Auch wenn zusätzliche kardiale Biomarker wie die Kreatin-Kinase (CK) und die Kreatin-Kinase CK-MB (‘muscle brain‘) nicht zwingend sind, können sie weitere hilfreiche Informationen zur Abschätzung der Dynamik eines Myokardinfarktes liefern.
Die Behandlung des STEMI
Das primäre Ziel bei der Behandlung eines Patienten mit einem STEMI ist das sofortige Wiedereröffnen des Infarktgefässes, um so den Myokardschaden möglichst gering halten zu können und die Mortalität zu reduzieren (4, 5). Die initiale medikamentöse Therapie besteht aus der Gabe von Aspirin (500 mg i.v. oder oral) und Heparin (5’000 Einheiten i.v.) und je nach Schmerzintensität zusätzlich Morphium. Eine Gabe von Nitroglycerin sollte insbesondere bei Vorliegen eines Rechtsherzinfarktes aufgrund der Neigung zu ausgeprägten Hypotonien nach Senkung der Vorlast vermieden werden. Die Applikation von Sauerstoff wird ausschliesslich bei einer peripheren O2-Sättigung <90% empfohlen (4, 5).
In den ESC Guidelines für die Behandlung von Patienten mit ACS wird die Wichtigkeit einer zeitnahen Revaskularisation betont (5). Sofern das Zeitintervall von der STEMI-Diagnose bis zur Revaskularisation unter 120 Minuten liegt, sollte eine perkutane koronare Intervention (PCI) angestrebt werden, was in der Schweiz aufgrund der nahen Distanzen gut möglich ist. Kann kein Herzkatheterlabor zeitnah erreicht werden, bleibt die Fibrinolyse die Therapie der Wahl. Abbildung 1 gibt eine Übersicht über die Zeitintervalle, welche bei Patienten mit STEMI eingehalten werden sollten. Nach Diagnose eines STEMIs sollte die Zeit bis zur Reperfusion mittels PCI maximal 90 Minuten dauern, wenn die initiale Diagnose in einem Spital ohne Herzkatheterlabor gestellt wird (5, 10). Wird die Diagnose eines STEMIs in einem Spital mit Herzkatheterlabor gestellt, sollten nicht mehr als 60 Minuten bis zur Revaskularisation des Infarktgefässes vergehen (5).
Im Herzkatheterlabor erfolgt zuerst eine diagnostische Koronarangiographie, wenn möglich über einen radialen Zugangsweg (5). Aus Sicht der Autorinnen empfiehlt sich die Durchführung einer Lävokardiographie sowie die Messung der linksventrikulären Füllungsdrücke (LVEDP), um das Volumenmanagement von Anfang an optimal gestalten zu können. Die Lävokardiographie ermöglicht zudem, mechanische Infarktkomplikationen wie eine gedeckte Ventrikel-Ruptur, einen Infarkt-Ventrikelseptumdefekt oder einen Papillarmuskelabriss schnell erkennen zu können. Nach diagnostischer Koronarangiographie erfolgt die Behandlung des Infarktgefässes, meist mittels Implantation eines Stents. Bei Patienten mit akutem Myokardinfarkt tritt in 5-10% ein kardiogener Schock auf, der Einsatz eines mechanischen Herzkreislauf-Unterstützungssystems (Impella, ECMO) muss hier sorgfältig abgewogen werden. Die Datenlage ist auf dem Gebiet noch unzureichend. Die kürzlich publizierte Comparison of Standard Treatment Versus Standard Treatment Plus Extracorporeal Life Support in Myocardial Infarction Complicated with Cardiogenic Shock (ECLS-SHOCK) Studie konnte keinen Mortalitätsbenefit eines mechanischen Herzkreislauf-Unterstützungssystems bei Patienten mit Herzinfarkt und kardiogenem Schock zeigen (11).
Bei der Hälfte der STEMI-Patienten zeigt sich eine koronare Mehrgefässerkrankung. Diese Patienten weisen neben der Infarkt-Läsion weitere Stenosen in Nicht-Infarktgefässen auf (12).Verschiedene randomisierte Studien konnten den Vorteil einer kompletten Revaskularisation, welche die interventionelle Behandlung aller relevanter Stenosen in Nicht-Infarkt-Gefässen beinhaltet, im Vergleich zu einer alleinigen Revaskularisation des Infarktgefässes belegen, darunter die Preventive Angioplasty in Acute Myocardial Infarction (PRAMI) Studie, die Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation (DANAMI-3 PRIMULTI) Studie, die Complete Versus Lesion-Only Primary PCI Trial (CULPRIT) Studie, die Fractional Flow Reserve–Guided Multivessel Angioplasty in Myocardial Infarction (Compare-Acute) Studie und insbesondere die Complete versus Culprit-Only Revascularization Strategies to Treat Multivessel Disease after Early PCI for STEMI (COMPLETE) Studie (13-16).
Der optimale Zeitpunkt der Revaskularisation der Nicht-Infarkt-Läsionen bei STEMI-Patienten wurde in der kürzlich publizierten Immediate versus Staged Complete Revascularization with Multivessel PCI for ST-Segment Elevation Myocardial Infarction (MULTISTARS AMI) Studie untersucht (17, 18). Die Studie schloss 840 Patienten mit STEMI und koronarer Mehrgefässerkrankung ein, welche entweder in eine sofortige Behandlung der Nicht-Infarktgefässe oder eine zweizeitige Behandlung der Nicht-Infarktgefässe randomisiert wurden. MULTISTARS AMI zeigte erstmals, dass bei Patienten mit STEMI eine sofortige Revaskularisation der Nicht-Infarktläsionen einer zweizeitigen nicht unterlegen und mit einer niedrigeren Rate an Reinfarkten und erneuten Ischämie-bedingten Revaskularisationen vergesellschaftet ist. Die Immediate versus staged complete revascularisation in patients presenting with acute coronary syndrome and multivessel coronary disease (BIOVASC) Studie schloss ein breites ACS-Patientenkollektiv mit STEMI, NSTEMI oder instabiler Angina pectoris ein und zeigte bei diesen Patienten ebenfalls die Nicht-Unterlegenheit einer sofortigen Revaskularisation (19). Bei Patienten mit akutem Myokardinfarkt und kardiogenem Schock zeigte die The Culprit Lesion Only PCI versus Multivessel PCI in Cardiogenic Shock (CULPRIT-SHOCK) Studie hingegen, dass eine alleinige Revaskularisation des Infarktgefässes einer kompletten Revaskularisation überlegen ist (20).
In der Akut-Phase eines Myokardinfarktes erfolgt eine kontinuierliche Rhythmusüberwachung auf einer Überwachungs- oder Intensivstation, um Rhythmusstörungen schnell detektieren und behandeln zu können. Zudem sollte – sofern der Patient eine eingeschränkte linksventrikuläre Funktion hat und nicht Symptome einer akuten Dekompensation zeigt – mit einer Herzinsuffizienztherapie begonnen werden. Die Sekundärprävention ist – wie bei allen Patienten mit etablierter koronarer Herzkrankheit – bei Patienten mit einem STEMI von äusserster Wichtigkeit. Neben Lifestyle-Massnahmen, zu welchen auch der Rauchstopp gehört, ist eine hochdosierte Statintherapie indiziert. Wirksamkeit und Sicherheit hochdosierter Statintherapien wurden in zahlreichen randomisierten Studien belegt (21). Bei den angestrebten low-density lipoprotein (LDL) Cholesterin-Werten gilt ein Zielbereich von <1.4 mmol/l und eine Reduktion um mindestens 50% (22). Kann unter maximal tolerierter Statindosis keine ausreichende Senkung des LDL-Cholesterins erzielt werden, sollte eine Kombination mit Ezetimib erfolgen (22, 23). Wird auch mit dieser Therapie nicht der gewünschte Erfolg erzielt, ist eine Therapie mit einem Proproteinkonvertase Subtilisin/Kexin Typ 9 (PCSK9)-Hemmer indiziert (22, 24).
Nach dem Spitalaufenthalt ist bei Patienten mit STEMI eine ambulante oder stationäre Rehabilitation empfohlen. Es konnte gezeigt werden, dass hierdurch eine signifikante Reduktion der kardialen Mortalität erzielt werden kann (25).
Behandlung NSTEMI und instabile Angina pectoris
Die Grundpfeiler der Therapie sind bei Patienten mit NSTEMI und der instabilen Angina pectoris dieselben wie bei Patienten mit STEMI. Der Unterschied liegt insbesondere im Zeitpunkt der Durchführung der Koronarangiographie und ggf. PCI. Währenddessen beim STEMI eine sofortige PCI erfolgt, wird der Zeitpunkt der Koronarangiographie und ggf. PCI beim NSTEMI nach erfolgter Risikostratifikation individuell festgelegt. Gemäss Guidelines der ESC für die Behandlung von Patienten mit ACS wird bei Patienten mit einem NSTEMI und hohem Risiko eine Koronarangiographie und ggf. PCI innerhalb von 24 Stunden empfohlen, bei Patienten mit sehr hohem Risiko sollte diese sofort durchgeführt werden (5). Risiko-Scores wie der Global Registry of Acute Coronary Events (GRACE) Risk Score helfen hierbei, das Risiko abzuschätzen, zu quantifizieren und zu objektivieren (26, 27). Der GRACE Score enthält unter anderem Variablen wie das Alter, die Herzfrequenz, den systolischen Blutdruck, Zeichen einer kardialen Dekompensation oder das Vorliegen eines Herz-Kreislaufstillstandes bei Hospitalisation, das Vorliegen von ST-Strecken-Veränderungen im EKG sowie Laborwerte wie Kreatinin und Troponin. Es konnte auch gezeigt werden, dass der GRACE 2.0 Score die Mortalität bei Frauen klar unterschätzt. Der neu entwickelte GRACE 3.0 Score trägt diesem Umstand Rechnung und erlaubt eine verbesserte Risikostratifikation bei Frauen und Männern (28).
Eine optimale Sekundärprophylaxe und aggressive Kontrolle der kardiovaskulären Risikofaktoren ist bei allen Patienten mit koronarer Herzkrankheit – wie oben bereits beschrieben – sehr wichtig.
Duale antiaggregatorische Therapie (DAPT)
Bei Patienten mit ACS ist die Gabe eines P2Y12-Inhibitors indiziert mit entsprechender Ladedosis, wobei bei Patienten mit Myokardinfarkt Prasugrel und Ticagrelor in randomisierten Studien dem Clopidogrel überlegen waren und deshalb prioritär eingesetzt werden (5, 29, 30). Eine duale Thrombozytenaggregationshemmung (DAPT) ist grundsätzlich für ein Jahr nach ACS indiziert, kann aber je nach Blutungs- oder Ischämie-Risiko individuell verkürzt oder verlängert werden (Tabelle 1) (5, 31, 32). Eine gleichzeitige Therapie mittels Protononenpumper-Inhibitor wird für die Dauer der DAPT bei Patienten mit erhöhtem Risiko einer gastrointestinalen Blutung empfohlen (5).
Bei Patienten mit hohem Blutungsrisiko kann die Dauer der DAPT auf 1 bis 3 Monate verkürzt werden (5). Der Ticagrelor with Aspirin or Alone in High-Risk Patients after Coronary Intervention (TWILIGHT) Studie folgend kann beispielsweise nach 3-monatiger DAPT auf eine Monotherapie mit Ticagrelor gewechselt werden (33). In die TWILIGHT Studie wurden Patienten 3 Monate nach erfolgreicher PCI eingeschlossen, wenn sie zusätzlich mindestens einen klinischen oder angiographischen Risikofaktor für ischämische Ereignisse oder Blutungen aufwiesen (33). Die Studie zeigte, das eine Monotherapie mit Ticagrelor nach 3-monatiger DAPT mit einem niedrigeren Blutungsrisiko vergesellschaftet war bei vergleichbarer Rate ischämischer Ereignisse (33). Eine Verkürzung oder De-Eskalation der DAPT von einem potenteren P2Y12 Hemmer auf Clopidogrel sollte nur dann in Erwägung gezogen werden, wenn im Verlauf keine erneuten ischämischen Ereignisse aufgetreten sind.
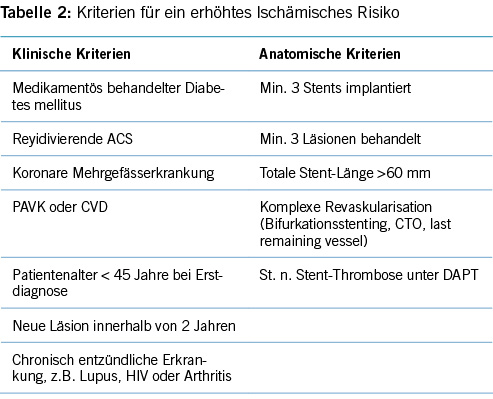
Patienten mit hohem ischämischem Risiko können von einer prolongierten Antikoagulation/Antiaggregation nach einer 12-monatigen DAPT profitieren, vorausgesetzt, es sind zwischenzeitlich keine Blutungsereignisse aufgetreten (Tabelle 2) (5). Somit sollte erst 1 Jahr nach ACS über eine mögliche Verlängerung der Antikoagulation/Antiaggregation entschieden werden. Verschiedene Therapie-Schemata wurden in randomisierten Studien untersucht. Die Prevention of Cardiovascular Events in Patients with Prior Heart Attack Using Ticagrelor Compared to Placebo on a Background of Aspirin–Thrombolysis in Myocardial Infarction (PEGASUS-TIMI) 54 Studie konnte zeigen, dass eine verlängerte Therapie mit Ticagrelor (in reduzierter Dosis von zweimal 60 mg täglich) die Rate an ischämischen Ereignissen signifikant reduziert, dies bei erhöhten Blutungsraten (32). In die Studie wurden Patienten mit stattgehabtem Myokardinfarkt (vor 1-3 Jahren) und mindestens einem weiteren Risikofaktor (Alter >65 Jahre, Diabetes mellitus, stattgehabte Myokardinfarkte, koronare Mehrgefässerkrankung oder chronische Niereninsuffizienz) eingeschlossen (32). Alternativ kann nach 12-monatiger DAPT – der (Cardiovascular Outcomes for People Using Anticoagulation Strategies) COMPASS Studie folgend – ein Wechsel auf Aspirin in Kombination mit Rivaroxaban in niedriger Dosierung (zweimal 2.5 mg täglich) erfolgen (34). In die COMPASS Studie wurden Patienten mit stabiler koronarer Herzkrankheit oder peripher arterieller Verschlusskrankheit eingeschlossen, bei Patienten unter 65-jährig wurde zusätzlich eine atherosklerotische Erkrankung in mindestens zwei Gefässbetten oder das Vorliegen von mindestens 2 weiteren Risikofaktoren (Rauchen, Diabetes mellitus, eine eingeschränkte Nierenfunktion, eine Herzinsuffizienz oder ein Schlaganfall) verlangt (34). Die Studie zeigte eine verminderte Rate ischämischer Ereignisse unter der Kombinationstherapie Aspirin und niedrigdosiertem Rivaroxaban bei auch hier erhöhtem Risiko von Blutungsereignissen (34).
Bei Patienten unter oraler Antikoagulation erfolgt für die ersten 1-3 Wochen nach PCI eine Tripel-Therapie (Aspirin, Clopidogrel, orale Antikoagulation) mit anschliessender dualer Therapie mit Clopidogrel und oraler Antikoagulation (5). Nach einem Jahr erfolgt eine alleinige orale Antikoagulation (5). Bei erhöhtem ischämischem Risiko kann eine Multiplate Analyse zur Testung der Thrombozytenaggregation unter Clopidogrel in Erwägung gezogen werden, da Clopidogrel in der Bevölkerung eine grosse Wirksamkeitsbreite zeigt (35).
Im Artikel verwendete Abkürzungen
ACS Akutes Koronarsyndrom
STEMI ST-Hebungsinfarkt
NSTEMI Nicht-ST-Hebungsinfarkt
MINOCA Myocardial infarction without obstructive coronary arteries
ESC European Society of Cardiology
PCI Perkutane koronare Intervention
ECMO Extrakorporalen Membran Oxygenation
LVEDP Linksventrikulärer Füllungsdruck
DAPT Duale Thrombozytenaggregationshemmung

Universitätsspital Zürich, Klinik für Kardiologie /
Universitäres Herzzentrum
Rämistrasse 100
8091 Zürich
Barbara.staehli@usz.ch
Historie:
Manuskript eingereicht: 01.09.2023
Nach Revision angenommen: 18.10.2023
Es bestehen keine Interessenskonflikte.
Trotz grossen Fortschritten in Prävention und Behandlung der koronaren Herzkrankheit erleiden weiterhin gegen 20‘000 Personen in der Schweiz jedes Jahr ein akutes Koronarsyndrom. In der Akut-Phase des STEMIs spielen Klinik und EKG die wichtigste Rolle in der Diagnostik, beim NSTEMI nimmt das high-sensitivity Troponin zusätzlich eine wichtige Stellung ein und erlaubt eine frühe Bestätigung oder einen Ausschluss eines Myokardinfarktes. Während beim STEMI eine notfallmässige Koronarangiographie und Wiedereröffnung des Infarktgefässes indiziert ist, erfolgt beim NSTEMI eine initiale Risikostratifikation, um den optimalen Zeitpunkt der Koronarangiographie und ggf weitere Abklärungen festzulegen. Bei allen Patienten mit koronarer Herzkrankheit sind im weiteren Verlauf Sekundärprävention und eine optimale Kontrolle der kardiovaskulären Risikofaktoren wichtig.
1. Thygesen, K., et al., Fourth Universal Definition of Myocardial Infarction (2018). J Am Coll Cardiol, 2018. 72(18): p. 2231-2264.
2. Herz- und Kreislauf-Erkrankungen. 5.7.2023 5.7.2023); Bundesamt für Statistik. https://www.bfs.admin.ch/bfs/de/home/statistiken/gesundheit/gesundheitszustand/krankheiten/herz-kreislauf-erkrankungen.html.
3. Canto, J.G., et al., Prevalence, clinical characteristics, and mortality among patients with myocardial infarction presenting without chest pain. Jama, 2000. 283(24): p. 3223-9.
4. Ibanez, B., et al., 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J, 2018. 39(2): p. 119-177.
5. Byrne, R.A., et al., 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J, 2023, 2023 Oct 12;44(38):3720-3826.
doi: 10.1093/eurheartj/ehad191.
6. Fesmire, F.M., et al., Usefulness of automated serial 12-lead ECG monitoring during the initial emergency department evaluation of patients with chest pain. Ann Emerg Med, 1998. 31(1): p. 3-11.
7. Collet, J.P., et al., 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J, 2021. 42(14): p. 1289-1367.
8. Badertscher, P., et al., Direct Comparison of the 0/1h and 0/3h Algorithms for Early Rule-Out of Acute Myocardial Infarction. Circulation, 2018. 137(23): p. 2536-2538.
9. Litt, H.I., et al., CT angiography for safe discharge of patients with possible acute coronary syndromes. N Engl J Med, 2012. 366(15): p. 1393-403.
10. Bagai, A., et al., Emergency department bypass for ST-Segment-elevation myocardial infarction patients identified with a prehospital electrocardiogram: a report from the American Heart Association Mission: Lifeline program. Circulation, 2013. 128(4): p. 352-9.
11. Thiele, H., et al., Extracorporeal Life Support in Infarct-Relatwed Cardiogenic Shock. N Engl J Med, 2023.
12. Park, D.W., et al., Extent, location, and clinical significance of non-infarct-related coronary artery disease among patients with ST-elevation myocardial infarction. JAMA, 2014. 312(19): p. 2019-27.
13. Wald, D.S., et al., Randomized trial of preventive angioplasty in myocardial infarction. N Engl J Med, 2013. 369(12): p. 1115-23.
14. Gershlick, A.H., et al., Randomized trial of complete versus lesion-only revascularization in patients undergoing primary percutaneous coronary intervention for STEMI and multivessel disease: the CvLPRIT trial. J Am Coll Cardiol, 2015. 65(10): p. 963-72.
15. Engstrøm, T., et al., Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation myocardial infarction and multivessel disease (DANAMI-3—PRIMULTI): an open-label, randomised controlled trial. Lancet, 2015. 386(9994): p. 665-71.
16. Smits, P.C. and B.M. Boxma-de Klerk, Fractional Flow Reserve-Guided Multivessel Angioplasty in Myocardial Infarction. N Engl J Med, 2017. 377(4): p. 397-8.
17. Stahli, B.E., et al., Rationale and design of the MULTISTARS AMI Trial: A randomized comparison of immediate versus staged complete revascularization in patients with ST-segment elevation myocardial infarction and multivessel disease. Am Heart J, 2020. 228: p. 98-108.
18. Stahli, B.E., et al., Timing of Complete Revascularization with Multivessel PCI for Myocardial Infarction. N Engl J Med, 2023.
19. Diletti, R., et al., Immediate versus staged complete revascularisation in patients presenting with acute coronary syndrome and multivessel coronary disease (BIOVASC): a prospective, open-label, non-inferiority, randomised trial. Lancet, 2023. 401(10383): p. 1172-1182.
20. Thiele, H., et al., PCI Strategies in Patients with Acute Myocardial Infarction and Cardiogenic Shock. N Engl J Med, 2017. 377(25): p. 2419-2432.
21. Baigent, C., et al., Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet, 2010. 376(9753): p. 1670-81.
22. Mach, F., et al., 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J, 2020. 41(1): p. 111-188.
23. Cannon, C.P., et al., Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med, 2015. 372(25): p. 2387-97.
24. Schwartz, G.G., et al., Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med, 2018. 379(22): p. 2097-2107.
25. Anderson, L., et al., Exercise-Based Cardiac Rehabilitation for Coronary Heart Disease: Cochrane Systematic Review and Meta-Analysis. J Am Coll Cardiol, 2016. 67(1): p. 1-12.
26. Eagle, K.A., et al., A validated prediction model for all forms of acute coronary syndrome: estimating the risk of 6-month postdischarge death in an international registry. JAMA, 2004. 291(22): p. 2727-33.
27. Collet, J.P., et al., 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J, 2021. 42(14): p. 1289-1367.
28. Wenzl, F.A., et al., Sex-specific evaluation and redevelopment of the GRACE score in non-ST-segment elevation acute coronary syndromes in populations from the UK and Switzerland: a multinational analysis with external cohort validation. Lancet, 2022. 400(10354): p. 744-756.
29. Wiviott, S.D., et al., Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med, 2007. 357(20): p. 2001-15.
30. Wallentin, L., et al., Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med, 2009. 361(11): p. 1045-57.
31. Palmerini, T., et al., Three, six, or twelve months of dual antiplatelet therapy after DES implantation in patients with or without acute coronary syndromes: an individual patient data pairwise and network meta-analysis of six randomized trials and 11 473 patients. Eur Heart J, 2017. 38(14): p. 1034-1043.
32. Bonaca, M.P., et al., Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med, 2015. 372(19): p. 1791-800.
33. Mehran, R., et al., Ticagrelor with or without Aspirin in High-Risk Patients after PCI. N Engl J Med, 2019. 381(21): p. 2032-2042.
34. Eikelboom, J.W., et al., Rivaroxaban with or without Aspirin in Stable Cardiovascular Disease. N Engl J Med, 2017. 377(14): p. 1319-1330.
35. Gurbel, P.A., et al., Clopidogrel for coronary stenting: response variability, drug resistance, and the effect of pretreatment platelet reactivity. Circulation, 2003. 107(23): p. 2908-13.
PRAXIS
- Vol. 113
- Ausgabe 1
- Januar 2024