- Brucellose als Reisesouvenir
Anamnese und Befunde
Anamnese
Die Zuweisung des 66-jährigen-Patienten in der infektiologischen Sprechstunde des Zuger Kantonsspitals erfolgte zur Abklärung eines unklaren Entzündungszustandes. Anamnestisch bestanden seit einem Monat trockener Husten, Kopfschmerzen, generalisierte Myalgien und Arthralgien. Weiter wurden über Müdigkeit, vermehrtes Schwitzen sowie Inappetenz mit konsekutivem Gewichtsverlust von 2 Kilogramm seit Symptombeginn berichtet. Die Beschwerden hätten anlässlich eines mehrwöchigen Ferienaufenthaltes mit seiner Familie im Heimatland Kosovo begonnen. In der medizinischen Vorgeschichte des Patienten fanden sich eine koronare Herzkrankheit, eine arterielle Hypertonie, eine Dyslipidämie sowie eine periphere arterielle Verschlusskrankheit.
Befunde
Klinisch präsentierte sich der Patient in leicht reduziertem Allgemeinzustand, hämodynamisch stabil mit einer Temperatur von 37.1 °C, in leicht reduziertem Allgemeinzustand. Bis auf ein 2/6 Systolikum mit Punctum maximum über dem 2. Interkostalraum rechts ergaben sich keine pathologischen Untersuchungsbefunde.
Im Labor bestand eine isoliert humorale Entzündungsaktivität (CRP 54 mg/l; Norm < 5 mg/l). Das Blutbild war bis auf eine milde normochrome normozytäre Anämie unauffällig (Hb 138 g/l; Norm 140–180 g/l). Elektrolyte, Nierenfunktion, Transaminasen und Cholestaseparameter waren normal.
Differenzialdiagnostische Überlegungen
Die klinische Präsentation sowie die laboranalytischen Befunde erlaubten eine breite Differenzialdiagnose aus dem infektiologischen, onkologischen und rheumatologischen Formenkreis. Aufgrund der grippalen Symptomatik dachten wir an eine virale Genese, insbesondere HIV, Hepatitis B und C. Gegen diese Hypothese sprachen eine unauffällige Expositionsanamnese sowie normwertige Transaminasen. Weiter dachten wir aufgrund der Reiseanamnese an mit einer Reise oder mit dem Heimatland des Patienten assoziierte Erkrankungen wie Tuberkulose, Brucellose und Q-Fever. Gemäss Angaben des Patienten hatte der Patient im Heimatland unpasteurisierten Ziegenkäse gegessen. Aufgrund der protrahierten konstitutionellen Symptome erwogen wir auch eine infektiöse Endokarditis. Auch ein Malignom, insbesondere ein Bronchuskarzinom oder ein Lymphom, erschien uns plausibel. Die generalisierten Myalgien und Arthralgien liessen uns weiter an eine rheumatologische Erkrankung denken.
Weitere Abklärungsschritte und Diagnosestellung
Es wurden Blutkulturen asserviert. Zudem erfolgte eine Testung auf Hepatitis B, C und HIV, welche negativ ausfielen. Die Bestimmung des Rheumafaktors war negativ. Im Röntgen-Thorax ergaben sich keine pathologischen Veränderungen, insbesondere keine Hinweise für eine Tuberkulose. Nach einer Bebrütungszeit von zwei Tagen zeigten sich die Blutkulturen positiv mit Nachweis von Brucella melitensis. Somit konnte die Diagnose eines Maltafiebers (Brucellose) gestellt werden.
Therapie und Verlauf
Eine antiinfektive Therapie mit Gentamicin 5 mg/kg i.v. alle 24 h und Doxycyclin 100 mg p.o. alle 12 h wurde eingeleitet. Aufgrund von zwischenzeitlich entwickeltem Fieber und dem neu beschriebenen Systolikum wurde eine transthorakale und danach eine transösophageale Echokardiographie durchgeführt, welche als unauffällig beurteilt wurden. Bei zwei Minor-Duke-Kriterien (Mikrobiologie, Fieber) wurde somit eine Endokarditis als unwahrscheinlich erachtet. Unter der etablierten Antibiotikatherapie zeigte sich ein rasches klinisches Ansprechen. Gentamicin wurde für sieben Tage verabreicht, Doxycyclin für sechs Wochen. Am Therapieende war der Patient beschwerdefrei. Das Blutbild war normalisiert, und es bestand keine Entzündungsaktivität mehr.
Akquiriert wurde die Infektion mutmasslich durch den Verzehr kontaminierter Lebensmittel. Der Patient hatte anlässlich seines Aufenthaltes im Kosovo, rund zwei Wochen vor Symptombeginn, unpasteurisierten Ziegenkäse gegessen.
In den folgenden drei Monaten stellte sich die Ehefrau und später der Sohn des Patienten in unserem Spital vor. Sie litten an Fieber, Schüttelfrost und Kopfschmerzen. Bei beiden gelang der Nachweis von B. melitensis in den Blutkulturen. Unter Therapie mit Gentamicin und Doxycyclin kam es zu einer Restitutio ad integrum. Es stellte sich heraus, dass auch Ehefrau und Sohn denselben Ziegenkäse gegessen hatten, mit welchem sich auch der Patient mutmasslich infiziert hatte.
Kommentar
Die Brucellose ist eine Zoonose, welche durch Bakterien der Gattung Brucella verursacht wird. Brucellen sind hitzeempfindliche, aerob wachsende gramnegative kokkoide Stäbchenbakterien. Humanpathogen sind die Spezies B. melitensis, B. suis und B. canis. Die Transmission erfolgt durch Konsum kontaminierter Lebensmittel oder durch direkten Kontakt zu infizierten Nutz- und Haustieren. Bei Brucella melitensis, dem Auslöser des Maltafiebers, sind Ziegen und Schafe das Reservoir. Unpasteurisierte Schaf- und Ziegenmilchprodukte stellen die Hauptinfektionsquelle dar (1, 2).
Die Inzidenz der Brucellose ist nicht bekannt. 2006 wurde global von ca. 500 000 Neuinfektionen pro Jahr berichtet (3). Aufgrund von mangelhafter Surveillance wird von einer grossen Dunkelziffer ausgegangen. Eine aktuelle modellbasierte Schätzung postuliert weltweit über zwei Millionen Fälle pro Jahr (4, 5). Der Mittelmeerraum, Afrika, Asien, Mittel- und Südamerika sowie die arabische Halbinsel stellen das Endemiegebiet dar (3, 6). Durch Tourismus, Migration und Tierhandel können Erkrankungsfälle aber auch in Länder, wie z. B. die Schweiz, importiert werden, welche als brucellosefrei gelten. In der Schweiz sind Infektionen mit Brucella sp. sowohl beim Menschen wie auch beim Tier meldepflichtig. Die Fallmeldungen beim Menschen in der Schweiz lagen in den letzten Jahren konstant unter zehn pro Jahr (7) (Abb. 1).
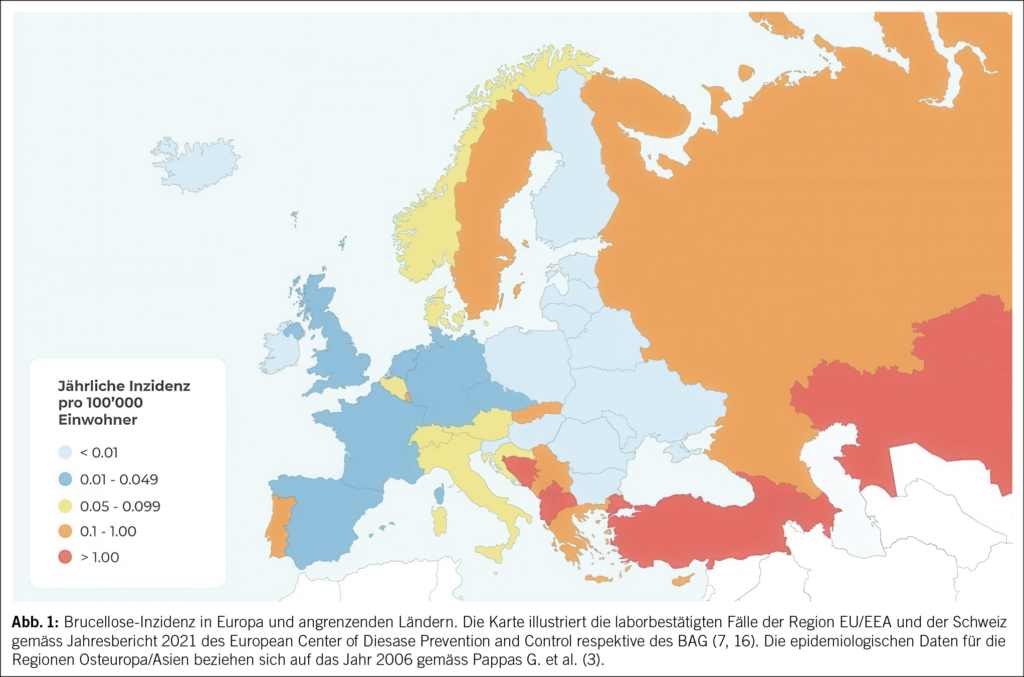
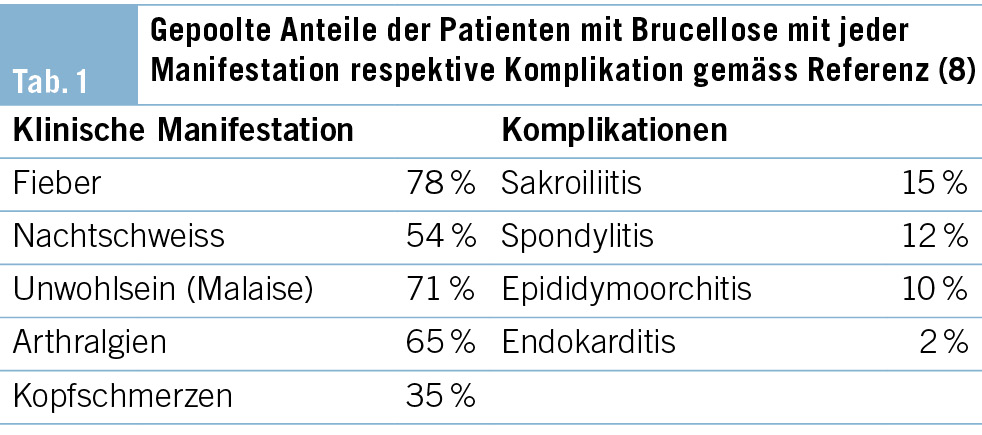
Ein Pathogenitätsmerkmal von Brucellen ist die Fähigkeit, intrazellulär zu überleben und sich zu vermehren. Nach Inokulation werden Brucellen durch Gewebelymphozyten aufgenommen und gelangen via regionale Lymphknoten in die Blutbahn. Durch hämatogene Dissemination kann es in nahezu jedem Organ zu einer Absiedelung kommen, wobei ein Tropismus für das retikuloendotheliale System besteht (1). Die klinische Manifestation der Erkrankung ist entsprechend der Pathogenese vielfältig. Leitsymptom ist anhaltendes, intermittierend oder schubweise auftretendes Fieber. Begleitend kann es zu ausgeprägtem Schwächegefühl, Arthralgien und Nachtschweiss kommen (8). Die Mehrheit der Infektionen verlaufen jedoch subklinisch. Unbehandelt können sich lokale Komplikationen und chronische Verläufe entwickeln. Osteoartikuläre Komplikationen, insbesondere Sakroiliitis und vertebrale Osteomyelitis, treten bei bis zu 70 % der betroffenen Patienten auf. Wesentlich seltener sind urogentiale (Orchitis, Epididymitis) und neurologische Komplikationen (Meningitis, Encephalitis, Myelitis) (9–11).
In Anbetracht der unspezifischen klinischen Präsentation bedarf es zur Diagnosestellung einen hohen Verdachtsgrad. Schlüsselelement ist eine detaillierte Anamnese und beinhaltet das Erfragen der Reiseaktivität, des Konsums von unpasteurisierten Milchprodukten oder Kontakts zu (kranken) Tieren in einem Endemiegebiet. Die variable Inkubationszeit (Wochen bis mehrere Monate) sollte bei der Anamnese berücksichtigt werden. Die klinische Untersuchung und Laboruntersuchungen weisen oft unspezifische Befunde auf und sind daher für den diagnostischen Prozess wenig hilfreich. Gemäss einer Metaanalyse aus China, in welche 68 Studien inkludiert wurden, zählten Lymphadenopathie (32 %), Hepato- (23 %) oder Splenomegalie (29 %) zu den häufigsten klinischen Auffälligkeiten, im Labor waren es Anämie (23 %), Thrombopenie (15 %) und Leukozytose (10 %) (12) (Tab. 1).
Die definitive Diagnose kann durch den kulturellen Nachweis des Organismus aus Gewebe oder Körperflüssigkeiten (Blut, Liquor, Urin) gestellt werden. Die Kultur gilt zwar als Goldstandard, die Anzucht von Brucellen ist aber aufgrund ihrer Anforderungen an Kulturbedingungen anspruchsvoll. Alternativ kann die Diagnosesicherung mittels Serologie erfolgen. Ein vierfacher Titeranstieg in zwei aufeinanderfolgenden (im Abstand von zwei bis drei Wochen entnommenen), parallel untersuchten Serumproben gilt als beweisend für eine akute Infektion (13). Bei begründetem Verdacht auf eine Infektion mit Brucella sp. sollte das mikrobiologische Labor informiert werden, da die Verarbeitung der klinischen Proben die Einhaltung erhöhter Sicherheitsmassnahmen (Biosicherheitsstufe 3) bedingt.
Therapie der Wahl ist Doxycyclin p.o. für 6 Wochen in Kombination mit Gentamicin i.v. für sieben Tage. Alternativ kann anstelle des Aminoglykosids Rifampicin für sechs Wochen verabreicht werden, mit dem Vorteil einer peroralen Gabe und reduzierter Nephrotoxizität bei allerdings breitem Interaktionspotenzial. Von Monotherapien oder verkürzter Therapiedauer ist aufgrund von hohen Rezidivraten abzusehen (14). Patienten mit osteoartikulären Komplikationen, Endokarditis und Neurobrucellose werden deutlich länger und zum Teil mit angepassten Therapieschemata behandelt (15). Trotz adäquater Behandlung kann es zu einem Rezidiv der Erkrankung kommen, dieses tritt meist innerhalb der ersten sechs Monate nach Therapieende auf (17). Bis anhin kam es bei sämtlichen Familienmitgliedern aus unserer Fallserie zu keinem Rezidiv.
Historie
Manuskript eingegangen: 23.10.2024
Manuskript angenommen: 08.01.2025
Schlössliweg 2
6345 Neuheim
vmonaco1289@gmail.com
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
• Die Brucellose ist eine meldepflichtige Zoonose.
• Leitsymptom der Erkrankung ist Fieber. Dieses ist oftmals begleitet von unspezifischen Allgemeinsymptomen (Malaise, Arthralgien, Nachtschweiss). Die Verdachtsdiagnose ergibt sich bei Fieber, passender Reise- und Expositionsanamnese (Konsum von unpasteurisierten Milchprodukten, Kontakt zu kranken Schafen/Ziegen).
• Goldstandard ist der kulturelle Erregernachweis aus Blut oder anderen biologischen Materialien. Alternativ kann die Diagnose serologisch gestellt werden.
• Das Labor sollte über die Verdachtsdiagnose der Brucellose informiert werden. Die Probenverarbeitung bedarf erhöhte Sicherheitsmassnahmen (BSL 3).
1. Pappas G, Akritidis N, Bosilkovski M, Tsianos E. Brucellosis. N Engl J Med. 2005;352:2325-36.
2. Cohen J, Powderly W, Opal S. Infectious Diseases. Elsevier Health Science; 2016, Page 1098 – 1101.
3. Pappas G, Papadimitriou P, Akritidis N, Christou L, Tsianos EV. The new global map of human brucellosis. Lancet Infect Dis. 2006;6:91-9.
4. Laine CG, Johnson VE, Scott H, Arenas-Gamboa AM. Global Estimate of Human Brucellosis Incidence. Emerg Infect Dis. 2023;29:1789-1797.
5. Laine CG, Scott HM, Arenas-Gamboa AM. Human brucellosis: Widespread information deficiency hinders an understanding of global disease frequency. PLoS Negl Trop Dis. 2022;16:e0010404.
6. Seleem MN, Boyle SM, Sriranganathan N. Brucellosis: a re-emerging zoonosis. Vet Microbiol. 2010;140:392-8.
7. Bundesamt für Lebensmittelsicherheit und Veterinärwesen BLV und Bundesamt für Gesundheit BAG. Bericht zur Überwachung von Zoonosen und lebensmittelbedingten Krankheitsausbrüchen Daten 2021. S.25-27.
8. Dean AS, Crump L, Greter H, Hattendorf J, Schelling E, et al. (2012) Clinical Manifestations of Human Brucellosis: A Systematic Review and Meta-Analysis. PLOS Neglected Tropical Diseases 2012;6:e1929.
9. Mousa A, Muhtaseb S, Almudallal D, Khodeir S, Marafie A. Osteoarticular complications of brucellosis: a study of 169 cases. Rev Infect Dis 1987.
10. Bosilkovski M, Krteva L, Caparoska S, Dimzova M. Osteoarticular involvement in brucellosis: study of 196 cases in the Republic of Macedonia. Croat Med J. 2004;45:727-33.
11. Geyik MF, Gür A, Nas K, Cevik R, Saraç J, Dikici B, Ayaz C. Musculoskeletal involvement of brucellosis in different age groups: a study of 195 cases. Swiss Med Wkly. 2002;132:98-105.
12. Zheng R, Xie S, Lu X, Sun L, Zhou Y, Zhang Y, Wang K. A Systematic Review and Meta-Analysis of Epidemiology and Clinical Manifestations of Human Brucellosis in China. Biomed Res Int. 2018;2018:1-10.
13. Brucellosis Reference Guide: Exposure, Testing and Prevention. Center of Disease Control and Prevention. Update 2017. https://www.cdc.gov/brucellosis/pdf/brucellosi-reference-guide.pdf. Letzter Zugriff 31.05.2024
14. Skalsky K, Yahav D, Bishara J, Pitlik S, Leibovici L, Paul M. Treatment of human brucellosis: systematic review and meta-analysis of randomised controlled trials. BMJ. 2008; 336:701-4.
15. Zhao S, Cheng Y, Liao Y, Zhang Z, Yin X, Shi S. Treatment Efficacy and Risk Factors of Neurobrucellosis. Med Sci Monit. 2016;22:1005-12.
16. European Centre for Disease Prevention and Control. Brucellosis. In: ECDC. Annual epidemiological report for 2021. Stockholm: ECDC; 2023.
17. J Ariza et al., Characteristics of and risk factors for relapse of brucellosis in humans. Clin Infect Dis. 1995;20:1241-9
PRAXIS
- Vol. 114
- Ausgabe 2
- Februar 2025





