- CARE-(CArdiovasculaR prEvention) Score – ein Instrument zur Erfassung der Versorgungsqualität von kardiovaskulären Risikopatient/-innen in der Hausarztpraxis
Einleitung
Ungeachtet enormer Fortschritte in der Prävention und Therapie kardiovaskulärer Erkrankungen in den letzten Jahrzehnten sind kardiovaskuläre Erkrankungen in Europa gemäss Angaben der World Health Organization (WHO) und der Krankheitsstatistik der europäischen Gesellschaft für Kardiologie (European Society of Cardiology, ESC) mit bis zu 3.9 Millionen Todesfällen für circa 45 % aller Todesfälle verantwortlich (1, 2).
In der Schweiz liegt der relative Anteil kardiovaskulärer Erkrankungen an allen Todesfällen etwas tiefer, so sind gemäss dem schweizerischen Gesundheitsobservatorium (OBSAN) 20.463 entsprechende Todesfälle im Jahre 2022 oder 27.5 % aller Todesursachen kardiovaskulärer Natur (3). Damit sind auch in der Schweiz kardiovaskuläre Erkrankungen die häufigste Todesursache. Eine Gesellschaft wie die unsere mit einem höheren Anteil älterer Menschen geht naturgemäss mit einer höheren Prävalenz an kardiovaskulären Erkrankungen einher, da das Lebensalter ein wesentlicher Risikofaktor für deren Entwicklung darstellt. Dennoch gibt es zahlreiche Studien, die zeigen, dass das Potenzial in der Primär- und vor allem auch der Sekundärprävention kardiovaskulärer Erkrankungen nur unzureichend ausgeschöpft wird.
Dabei ist die den therapeutischen Interventionsmöglichkeiten zugrunde legende Evidenz überwältigend, so ist klar belegt, dass es einen linearen Zusammenhang zwischen dem LDL-Cholesterinspiegel im Blut und dem Risiko, ein kardiovaskuläres Ereignis zu erleiden, gibt, wie Mendelsche Randomisierungsstudien durch die Simulation einer lebenslangen Exposition eindrucksvoll belegen (4). Andererseits zeigte eine Schweizer Studie, die 4.349 Patienten und Patientinnen nach einem erlittenen Myokardinfarkt verfolgte, dass gerade einmal 6.9 % der Patientinnen die in den Leitlinien empfohlenen drei wichtigsten sekundärpräventiven Medikamente nach einem Jahr erhielten. Allein die Statintherapie ging in der Studie mit einer Risikoreduktion von fast 50 % (OR: 0.59 (0.45–0.77, 95 % CI)) für Mortalität und 0.54 (0.43–0.68) für MACE (major cardiovascular events) einher und zeigte damit den stärksten sekundärpräventiven Effekt aller Medikamente, noch vor der dualen Plättchenhemmung (5).
Analoges gilt für den Blutdruck: Eine aktuelle Analyse, die Blutdruckwerte aus dem National Health and Nutrition Examination Survey über einen Zeitraum von 19 Jahren (1999–2018) anhand von 53.289 Menschen analysierte, zeigte erneut den J-förmigen Zusammenhang zwischen Blutdruck und kardiovaskulärer Mortalität und belegte erneut eindrucksvoll, dass das niedrigste Risiko bei einem Druck von unter 120 mmHg systolisch respektive 80 mmHg diastolisch vorliegt (6). Im hausärztlichen Alltag erscheint es oft schwierig, Patienten und Patientinnen, die jahrzehntelang an – wenn auch oft nur leicht – hypertensive Werte gewöhnt sind, auf diese Blutdruckwerte einzustellen. Die Evidenz zeigt aber klar, dass auch eine grenzwertige Hypertonie frühzeitig behandelt werden sollte, wie dies den Blutdruckzielwerten der ESC und insbesondere den noch strengeren Zielwerten der American Heart Association/American College of Cardiology entspricht. Dennoch zeigen Studien, dass nur ein geringer Teil der Patient/-innen diese Zielwerte erreicht. Positiv zu vermerken ist, dass sich in den letzten 10 Jahren in der Schweiz die Blutdruckkontrolle verbessert hat, so wiesen gemäss der europäischen EURIKA-Studie 2010 nur 37.4 % der Patient/-innen einen Blutdruck im empfohlenen Zielbereich auf, während in einer aktuellen Arbeit mit Daten von 80.759 Patient/-innen 44.9 % Blutdruckwerte im Zielbereich der ESC-Guidelines aufwiesen (7). Allerdings bedeuten die aktuellen Ergebnisse immer noch, dass über 50 % die Zielwerte nicht erreichen.
Analog zur Therapie kardiovaskulärer Risikofaktoren zeigte vor Jahren eine Studie mit Daten des Krankenversicherers Helsana eine unzureichende Umsetzung von Leitlinienempfehlungen bei Diabetikern (8). Diese Ergebnisse veranlasste die Schweizer Gesellschaft für Endokrinologie und Diabetologie, evidenzbasierte Kriterien einer Diabetikerversorgung im sogenannten «SGED Score» zusammenzufassen (9). Der Begriff «Score» bezieht sich dabei nicht – wie sonst im medizinischen Kontext meist üblich – auf ein Risiko, sondern der Score-Wert reflektiert das Ausmass der Umsetzung der Leitlinienempfehlungen; er stellt somit einen Adherence-Score dar. Der SGED-Score beträgt im Maximum 100 Punkte, wobei als Zielwert im Sinne einer Guideline-adhärenten Versorgung mindestens 70 Punkte vorgegeben werden.
Kardiovaskuläre Erkrankungen zeigen eine weit höhere Prävalenz als der Diabetes, ein analoges Instrument, dass die Versorgungsqualität bei kardiovaskulären Erkrankungen widerspiegelt, existiert bisher aber noch nicht. Im Dezember 2022 hat sich eine interdisziplinäre Gruppe aus Hausärzt/-innen und Kardiolog/-innen zusammengefunden und in Anlehnung an den SGED-Score ein analoges Evidence-Adherence Instrument zur Quantifizierung der Qualität der Versorgung kardiovaskulärer Risikopatient/-innen, den Take-CARE-Score (CArdiovasculaR prEvention score), entwickelt.
Methodik
Beginnend im Dezember 2022 wurde eine interdisziplinäre Projektgruppe aus Allgemeininternist/-innen und Kardiolog/-innen formiert, die neben den Autoren weitere Stakeholder, insbesondere auch aus dem Bereich der Krankenversicherer, dem Forum Managed Care und hausärztlicher Netzwerke umfasste. Das Ziel war es, einen evidenzbasierten Summenscore zu entwickeln, der die Qualität der Versorgung kardiovaskulärer Risikopatient/-innen, im Hinblick auf ihre Zielwerterreichung, quantifiziert. Grundlage für die Zielwerte waren die Leitlinien der ESC respektive deren adaptierte Leitlinien für das Schweizer Grundversorgersetting aus dem Institut für Hausarztmedizin der Universität Zürich.
Der Score sollte aus den üblichen hausärztlichen Routinedaten errechenbar sein, die im Rahmen der Betreuung von kardiovaskulären Risikopatient/-innen gemäss Leitlinien zu dokumentieren sind. Ziel des Scores ist es, dem einzelnen Arzt oder der Ärztin einen einfachen und pragmatischen Überblick über die «Performance» und Guideline-Adherence der eigenen Versorgung zu bieten. Natürlich können diese Daten auch in Qualitätszirkeln oder in Netzwerken zu Qualitätsmassnahmen genutzt werden. Eine Stärke des SGED-Score ist es, nicht nur Prozesse abzubilden, sondern auch klinische Outcomes, wie das HbA1c oder den Blutdruck, abzubilden, dies sollte analog auch im CARE-Score erfolgen. Diese kontinuierlichen, klinischen Variablen werden je nach Zielwerterreichung in beiden Scores mit einem Score-Wert verknüpft.
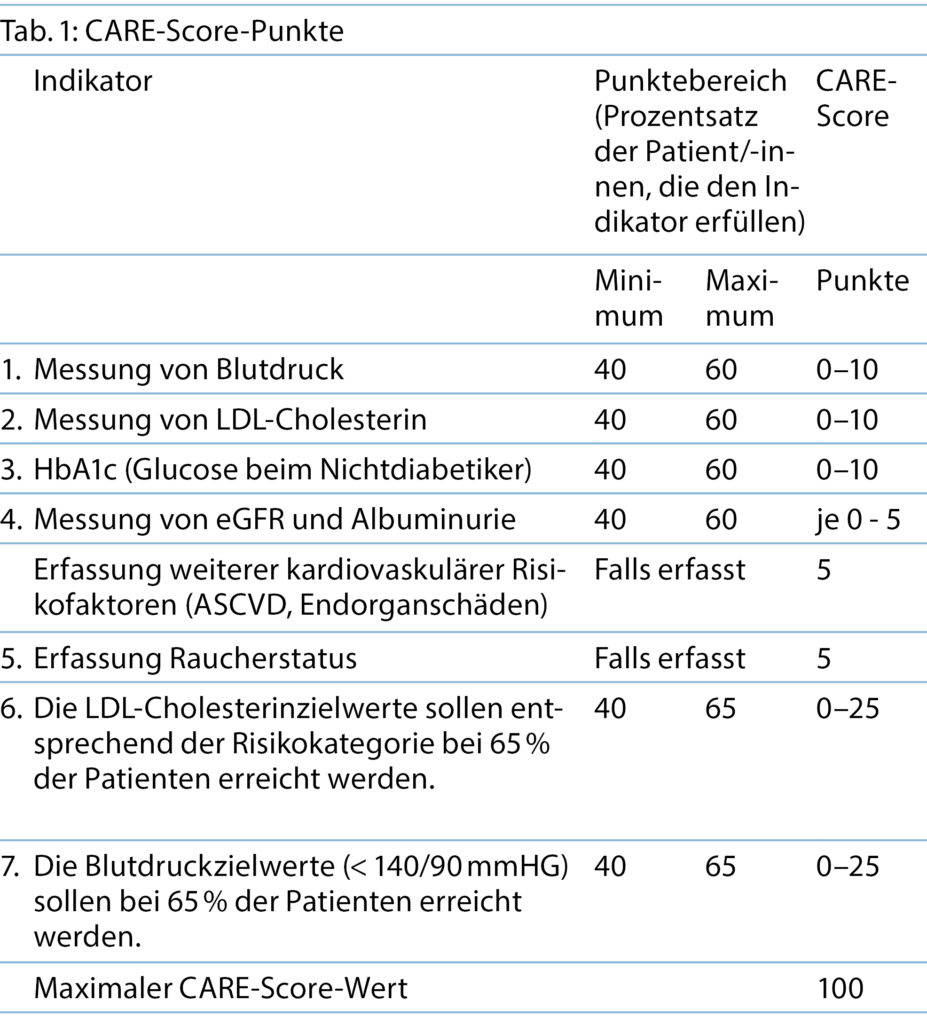
Für den CARE-Score wurden die nachfolgenden Variablen, basierend auf den Empfehlungen der ESC, identifiziert (10), (Tabelle 1).
Die Leitlinien machen grösstenteils keine Empfehlung, wie häufig die jeweiligen Werte zu kontrollieren sind, die Vorgabe für den CARE-Score ist eine mindestens einmalige jährliche Messung respektive Kontrolle der Parameter 1–6. Die KDIGO-Leitlinie und die Empfehlung der Schweizer Gesellschaft für Nephrologie sehen ein Screening bei Patient/-innen mit arterieller Hypertonie, Diabetes mellitus, Adipositas und Herz-Kreislauf-Erkrankungen mittels eGFR und Albuminausscheidung im Urin mindestens einmal jährlich vor. Für jeden Test, eGFR und Albumin, werden im CARE-Score je 5 Prozesspunkte vergeben (11, 12).
Zielwerte
Auf der Basis der in der Schweiz vorhandenen Zielwerterreichungsgrade erschien es der Projektgruppe sinnvoll, 40 % Zielerreichung als untersten Wert zu definieren, ab dem es einen CARE-Score-Punkt gibt. Wenn bei mindestens 60 % aller Patient/-innen die entsprechenden Parameter gemessen werden, wird bereits der maximale CARE-Score-Wert von 10 vergeben. Für die Erfassung von Raucherstatus oder Endorganschäden respektive einer vorhanden ASCVD werden bei erfolgter Dokumentation 5 CARE-Score-Punkte vergeben.
Um den Outcomes mehr Bedeutung beizumessen als dem reinen Messen und somit den Prozessparametern, sind die Zielwerterreichungen im LDL-Cholesterin respektive dem Blutdruck höhere Score-Punkte zugeordnet. Beginnend wiederum bei 40 % als Minimum wird hier pro Prozentpunkt höherer Zielwerterreichung ein Score-Punkt mehr vergeben, bis der maximale Score-Punktewert bei 65 % erreicht ist. Rational für den unteren Schwellenwert von 40 % Patient/-innen, die mindestens den Zielwert erreichen sollten, um einen CARE-Score-Punkt zu erhalten, ist die verfügbare Literatur, die zeigt, dass in der Schweizer Grundversorgung dieser Wert beim Hypertonus im Median leicht überschritten wird, beim LDL-Cholesterin in Abhängigkeit von der ESC-Risikokategorie unterschritten oder knapp erreicht wird (4, 8). Im Bereich von 40–65 % Patient/-innen auf Zielwert gibt es pro 2 % höherem Patientenanteil, der dies erreicht, je 1 CARE-Score-Punkt, bis zum Maximum von 25 bei 65 %. Bereits bei 65 %, wenn also knapp zwei Drittel aller Patientinnen und Patienten im Zielbereich sind, gibt es somit die volle Punktzahl.
Somit können bis zu 35 % der Patient/-innen aufgrund mangelnder Adherence, Alter und Multimorbidität aus der Betrachtung der Performance ausgeklammert werden. Dieser Wert liegt weit über den Werten, die von General Practicioners im englischen Pay-for-Performance-Programm im Rahmen des Quality and Outcomes-Framework des National Health Service (NHS) durch sie tatsächlich ausgeschlossen werden (13). In der Summe resultieren daraus 100 Punkte, wobei 50 Punkte auf Prozessparameter entfallen und 50 Punkte auf Outcomevariablen. Wichtig ist hierbei zu betonen, dass der CARE-Score und der SGED-Score komplementär sind, das heisst, bei Diabetikern kommen beide zum Einsatz. Grundsätzlich sollte der CARE-Score bei allen Patient/-innen über 40 Jahren und mit einem Risiko für ein kardiovaskuläres Ereignis im ESC-Score von grösser einem Prozent erfasst werden und alle drei Jahre überprüft werden, dies reflektieren die EVIPREV-Empfehlungen für die Schweiz (https://eviprev.ch/).
Ergebnisse – Proof of concept
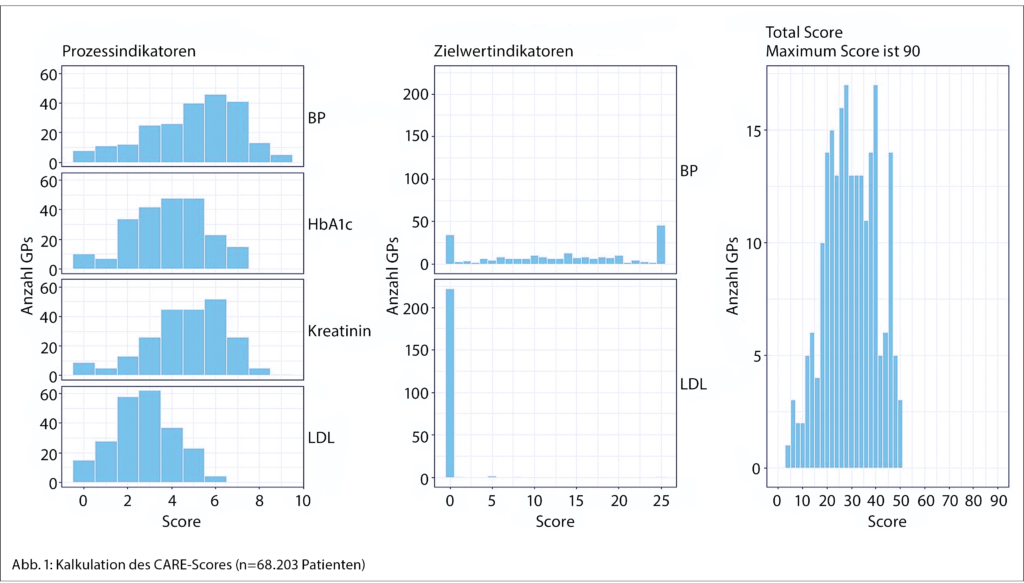
Um die Machbarkeit und die Resultate des CARE-Scores in real-life zu testen, führten wir eine Kalkulation innerhalb des FIRE-Forschungsnetzwerkes des Instituts durch. Eingeschlossen wurden hierbei 463 Hausärzte mit einem Schwerpunkt in der Deutschschweiz (die räumliche Verteilung der Praxen ist unter https://www.fireproject.ch einzusehen, 68.203 Patient/-innen). Das mittlere Alter der Patient/-innen betrug 67.9 Jahre (SD 12.8), 46.3 % davon waren Frauen.
Abbildung 1 zeigt deutlich, dass vor allem die Prozessparameter häufig umgesetzt werden und daraus entsprechende CARE-Score-Punkte resultieren, bei den Blutdruckzielwerten zeigt sich, dass es sowohl zahlreiche Hausärztinnen und Hausärzte gibt, die nicht mindestens 40 % ihrer Patient/-innen auf Zielwert haben, dass es aber auch eine grosse Anzahl an Hausärztinnen und Hausärzten gibt, die die volle CARE-Score-Punktzahl erreichen, also mehr als 65 % der Patient/-innen im Blutdruckzielbereich haben.
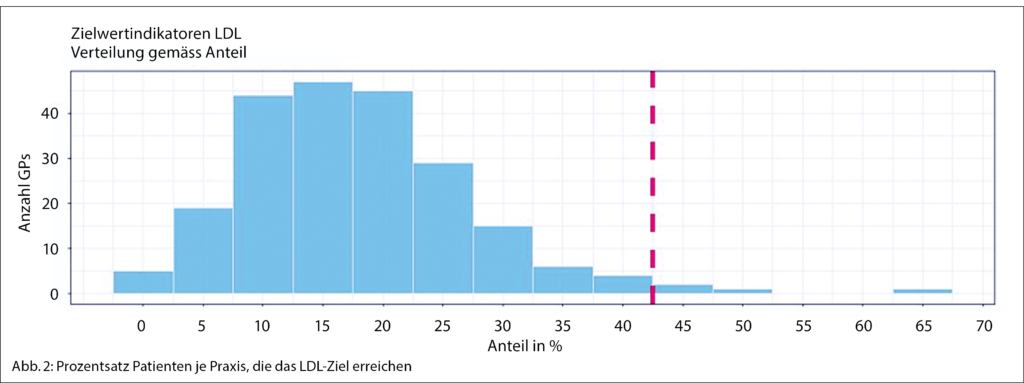
Beim LDL-Zielwert zeigte sich, dass nur ganz wenige Ärzte den Schwellenwert von mindestens 40 % erreichten, um mindestens 1 CARE-Score-Wert zu erreichen. Die grundsätzliche Erreichbarkeit wurde allerdings dadurch belegt, dass es 5 Ärzte gab, die 65 % oder mehr aus LDL-Zielwerten hatten. Abbildung 2 liefert ein differenziertes Bild der LDL-Zielwerterreichung. Hier zeigt sich, dass der Grossteil der Patient/-innen den Schwellenwert im LDL-Zielwert von mindestens 40 %, die auf LDL-Zielwert sind, nicht erreichen. Die meisten Hausärzt/-innen erreichen den LDL-Zielwert nur bei 10–20 % ihrer Patient/-innen.
Diskussion
Kardiovaskuläre Erkrankungen sind die führende Todesursache in der Schweiz, und es gibt eine überwältigende medizinische Evidenz, dass die heute zur Verfügung stehenden medikamentösen Interventionsmöglichkeiten zu einer signifikanten Reduktion von Morbidität und Mortalität führen. Zahlreiche Studien belegen jedoch ebenso, dass diese Massnahmen nur bei einem geringen Teil umgesetzt werden, obgleich auch in der Schweiz die notwendige Evidenz durch hausärztliche Guidelines zur Verfügung steht (14, 15). Strukturierte Tools, die Versorgungsqualität valide abbilden, können Ärztinnen und Ärzte hierbei unterstützen und machen zudem die Leistung transparent und vergleichbar.
Im Bestreben, medizinische Behandlungsqualität erfassbar zu machen, wurden in den letzten Jahren Qualitätsindikatoren, insbesondere im stationären Setting, in grosser Zahl entwickelt und untersucht. Häufig handelt es sich hierbei allerdings um Prozessindikatoren, die kein wirklich valides Bild liefern. Insbesondere im Kontext von Eingriffen wären die Indikations- und Ergebnisqualität weitaus bessere Indikatoren, insbesondere die Indikationsqualität ist aber sehr schwer zu erfassen. Qualitätsindikatoren oder entsprechende Qualitätsscores können daher häufig auch eine Scheinqualität vortäuschen, und ihre Aussagekraft ist oft allein schon aufgrund der unterschiedlichen Patientenpopulationen limitiert (16, 17).
International sind viele Anstrengungen unternommen worden, den evidence-performance-gap zu minimieren, gerade auch im kardiovaskulären Bereich (18, 19). Das Chronic Care Model wurde als Vorlage zur Versorgung chronisch kranker Patient/-innen entwickelt (20–22), aber auch heute noch scheitert eine wirksame Umsetzung bereits an den verfügbaren elektronischen Krankengeschichten (KGs), mit welchen sich diese Parameter weder adäquat aufbereiten noch ausreichend informativ für den Nutzer zur Verfügung stellen lassen. Fehlende Standards verhindern zudem eine digitale Vernetzung zwischen den Ärzten (23).
Der SGED-Score hat sich in der Schweiz als Score zur Erfassung der Versorgungsqualität bei Diabetikern fest etabliert (9). Mittlerweile hat der SGED-Score sogar Eingang in Managed-Care-Verträge zahlreicher Versicherer mit Ärztenetzwerken gefunden. Mit dem CARE-Score wurde der Versuch unternommen, ein ähnliches Instrument für die noch weitaus grössere Gruppe von Patient/-innen mit einem erhöhten kardiovaskulären Risiko zu entwickeln. Der CARE-Score nutzt wie der SGED-Score die vorhandene medizinische Evidenz aus international akzeptierten und teilweise lokal adaptierten medizinischen Guidelines, die den Kriterien des Instituts of Medicine entsprechen respektive von der FMH akkreditiert sind (10, 14).
Anhand einer Berechnung des CARE-Scores auf Basis der im FIRE-Netzwerk verfügbaren Daten konnte hier gezeigt werden, dass der CARE-Score aus hausärztlichen Routinedaten ohne jeden Mehraufwand für die beteiligten Ärzt/-innen errechnet werden kann. Einzig die Dokumentation von Raucherstatus und Endorganschäden und ASCVD sind nicht in allen elektronischen KGs in Form von strukturierten Feldern möglich. Hier wurden aber für den FIRE-Datensatz Ansätze mit künstlicher Intelligenz entwickelt, die die Extraktion dieser Angaben zumindest zum Teil auch dann ermöglicht, wenn sie nicht in einem von der elKG vorgegebenen Feld dokumentiert wurden.
Die Simulation des CARE-Scores am FIRE-Datensatz hat – wie zuvor nationale und internationale Studien – gezeigt, dass es noch Verbesserungspotenzial in der Umsetzung der Leitlinienempfehlung gibt, insbesondere in den klinischen Outcomes. Der evidence-performance-gap, also die Lücke aus theoretischer Evidenz und täglicher Praxis, ist noch erheblich (24). Der Einwand von Kritikern, die Zielvorgaben im CARE-Score seien zu ambitioniert respektive aufgrund von Multimorbidität und mangelnder Adherence von Patientinnen und Patienten nicht erreichbar, wird widerlegt durch die Hausärztinnen und Hausärzte im FIRE-Netzwerk, die dies durchaus erreicht haben. Zudem scheinen die Zielvorgaben – mit einem Maximalwert bereits bei 65 %, also noch nicht einmal zwei Drittel aller Patient/-innen auf Zielwert – durch die Literatur gut abgestützt. Zudem muss man sich vor Augen führen, dass im staatlichen Gesundheitssystem Englands, dem NHS beispielsweise, der Erreichungsgrad beispielsweise beim Blutdruckzielwert (140/90 mmHg) im Jahre 2023 bei weit über 70 %, in vielen Praxen bei fast 80 % lag (25). Im englischen Pay-for-Performance-Programm ist es den General Practitioners erlaubt, Patient/-innen aufgrund mangelnder Adhärenz und anderen Gründen wie Alter oder Multimorbidität, die eine vollständige Umsetzung der Leitlinien verhindern, auszuschliessen. Eine Analyse von 8.105 englischen Hausarztpraxen zeigte jedoch, dass im Median nur 5.3 % aller Patient/-innen aus diesen Gründen ausgeschlossen wurden (13). Mit einem maximal avisierten Zielerreichungsgrad von 65 % im CARE-Score wird somit Alter, Multimorbidität und vor allem Non-Adherence der Patientinnen und Patienten mehr als Rechnung getragen.
Limitationen
FIRE ermöglicht eine routinemässige Kalkulation von Qualitätsindikatoren respektive dem CARE-Score, dennoch sind bei der Betrachtung der Ergebnisse einige Limitationen zu beachten: Im Gegensatz zur Situation in UK, wo die Hausärztinnen und Hausärzte sich bewusst mit den Zielerreichungsgraden auseinandersetzen, erfolgte die Dokumentation in den elektronischen Krankenakten in der Schweiz wesentlich individueller, und Werte werden beispielsweise nicht in den von der elKG vorgegebenen strukturierten Feldern erfasst. Dies kann zu einer Verschlechterung der Resultate führen. Diesem Umstand wurde in den jüngsten FIRE-Datenexporten und mithilfe künstlicher Intelligenz, die strukturelle «Fehleingaben» korrigieren kann, Rechnung getragen, gilt aber noch nicht für länger zurückliegende Behandlungsperioden und ältere Werte, die hier teilweise in die Berechnung mit eingeflossen sind. Eine weitere Limitation, die zu (scheinbar) schlechteren Ergebnissen führt, ist die Tatsache, dass in UK die Qualitätsindikatoren incentiviert sind, was für den CARE-Score nicht gilt. Incentivierungen haben aber naturgemäss einen erheblichen Einfluss auf die Dokumentation und Outcomes (26, 27). Daher sind die in diesem Artikel errechneten Werte nicht als absolut zu werten, sondern einzig als «Proof-of-concept», dass der CARE-Score automatisiert aus Routinedaten zu errechnen ist. Eine Analyse aus einem Ärztenetzwerk, das den SGED-Score als Behandlungsmassstab bereits implementiert hat, zeigte zudem deutlich bessere Ergebnisse. Dies kann als Hinweis gewertet werden, dass bei einer Implementierung des CARE-Scores die Awareness unter den Ärzten derart erhöht wird, dass sich rasch deutliche Verbesserungen abbilden, allein schon durch eine bessere Dokumentation.
Schlussfolgerung
Der Erfassung von medizinischer Behandlungsqualität kommt auch in der ambulanten Praxis in der Schweiz eine zunehmend grössere Bedeutung bei. Scores wie der etablierte SGED-Score zur Versorgung von Diabetikern oder der hier vorgestellte CARE-Score für kardiovaskuläre Risikopatient/-innen zeichnen aufgrund der Erfassung von Prozess- wie auch Ergebnisqualität ein zuverlässiges Bild der Guideline-Adhärenz und der Versorgungsqualität. Sie können auf der Basis hausärztlicher Routinedaten aus elektronischen KGs ohne Mehraufwand errechnet werden und eignen sich für Massnahmen zur Qualitätsdokumentation und vor allem Qualitätssteigerung, indem sie beispielsweise die Grundlage eines entsprechenden Austausches in Ärztenetzwerken und Qualitätszirkeln bilden. Durch die Anpassung der Zielwerterreichungsgrade sind sie an unterschiedliche Versorgungskontexte und Populationen flexibel anpassbar, die im aktuellen CARE-Score reflektierten Werte tragen mangelnder Patienten-Adherence ebenso Rechnung wie hohem Patientenalter und Multimobidität.
Der CARE-Score stellt somit ein einfaches und pragmatisches Instrument dar, den evidence-perfomance-gap wirksam zu verkleinern.
Historie:
Manuskript eingereicht: 08.04.2024
Angenommen nach Revision 30.04.2024
Institut für Hausarztmedizin
Universitätsspital Zürich
Pestalozzistrasse 24
8091 Zürich
thomas.rosemann@usz.ch
Die Autoren haben keine Interessenkonflikte in Zusammenhang mit diesem Artikel deklariert.
Roth GA, Johnson C, Abajobir A, Abd-Allah F, Abera SF, Abyu G, et al. Global, Regional, and National Burden of Cardiovascular Diseases for 10 Causes, 1990 to 2015. J Am Coll Cardiol. 2017;70(1):1-25.
2. Timmis A, Vardas P, Townsend N, Torbica A, Katus H, De Smedt D, et al. European Society of Cardiology: cardiovascular disease statistics 2021. European Heart Journal. 2022;43(8):716-99.
3. 2023;Pages. Accessed at OBSAN at https://ind.obsan.admin.ch/indicator/monam/herz-kreislauf-erkrankungen-hospitalisierung-und-mortalitaet.
4. Ference BA, Ginsberg HN, Graham I, Ray KK, Packard CJ, Bruckert E, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2017;38(32):2459-72.
5. Huber CA, Meyer MR, Steffel J, Blozik E, Reich O, Rosemann T. Post-myocardial Infarction (MI) Care: Medication Adherence for Secondary Prevention After MI in a Large Real-world Population. Clin Ther. 2019;41(1):107-17.
6. Elfassy T, German CA, Muntner P, Choi E, Contreras G, Shimbo D, Yang E. Blood Pressure and Cardiovascular Disease Mortality Among US Adults: A Sex-Stratified Analysis, 1999-2019. Hypertension. 2023;80(7):1452-62.
7. Di Ganghi SB, R. Grischott, T. Burgstaller, J. Senn O., Rosemann, T. Markun S. Arterial Hypertension Control and Treatment in Swiss General Practice – cross sectional study using routine data from the FIRE primary care database. . submitted.
8. Huber CA, Brandle M, Rapold R, Reich O, Rosemann T. A set of four simple performance measures reflecting adherence to guidelines predicts hospitalization: a claims-based cohort study of patients with diabetes. Patient Prefer Adherence. 2016;10:223-31.
9. Gastaldi G, Lucchini B, Thalmann S, Alder S, Laimer M, Brandle M, et al. Swiss recommendations of the Society for Endocrinology and Diabetes (SGED/SSED) for the treatment of type 2 diabetes mellitus (2023). Swiss Med Wkly. 2023;153:40060.
10. Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111-88.
11. Kidney Disease: Improving Global Outcomes CKDWG. KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2024;105(4S):S117-S314.
12. Richtlinien zu Screening und Identifikation der Chronischen Niereninsuffizienz für Allgemeinmediziner und Internisten. Schweizer Gesellschaft für Nephrologie, Postfach 567, 3076 Worb; 2023.
13. Doran T, Fullwood C, Reeves D, Gravelle H, Roland M. Exclusion of patients from pay-for-performance targets by English physicians. N Engl J Med. 2008;359(3):274-84.
14. Rosemann A, Senn O, Neuner-Jehle S, Markun S, Rosemann T. [Why Switzerland needs evidence-based guidelines for its general practice medicine]. Praxis (Bern 1994). 2023;112(10):488-91.
15. Rosemann T, Bachogner, A. Strehle, O. Kardiovaskuläre Erkrankungen in der Schweiz – Prävalenz und Versorgung. Praxis (Bern 1994). 2024;in press.
16. Mant J. Process versus outcome indicators in the assessment of quality of health care. Int J Qual Health Care. 2001;13(6):475-80.
17. Salampessy BH, Portrait FRM, van der Hijden E, Klink A, Koolman X. On the correlation between outcome indicators and the structure and process indicators used to proxy them in public health care reporting. Eur J Health Econ. 2021;22(8):1239-51.
18. Astley CM, Macdougall CJ, Davidson PM, Chew DP. Lost in translation: health resource variability in the achievement of optimal performance and clinical outcome. Circ Cardiovasc Qual Outcomes. 2011;4(5):512-20.
19. Boden WE, McKay RG, Cabin HS, Radford MJ, Krumholz HM, Zaret BL, et al. The Connecticut Cardiovascular Consortium: a unique, state-wide research collaboration to advance clinical outcomes in patients with heart disease. Conn Med. 2001;65(10):597-604.
20. Bodenheimer T, Wagner EH, Grumbach K. Improving primary care for patients with chronic illness: the chronic care model, Part 2. JAMA. 2002;288(15):1909-14.
21. Coleman K, Austin BT, Brach C, Wagner EH. Evidence on the Chronic Care Model in the new millennium. Health Aff (Millwood). 2009;28(1):75-85.
22. Glasgow RE, Orleans CT, Wagner EH. Does the chronic care model serve also as a template for improving prevention? Milbank Q. 2001;79(4):579-612, iv-v.
23. Rodriguez HP, Ivey SL, Raffetto BJ, Vaughn J, Knox M, Hanley HR, et al. As good as it gets? Managing risks of cardiovascular disease in California‘s top-performing physician organizations. Jt Comm J Qual Patient Saf. 2014;40(4):148-58.
24. Bakhai S, Bhardwaj A, Sandhu P, Reynolds JL. Optimisation of lipids for prevention of cardiovascular disease in a primary care. BMJ Open Qual. 2018;7(3):e000071.
25. Campbell S, Reeves D, Kontopantelis E, Middleton E, Sibbald B,
Roland M. Quality of primary care in England with the introduction of pay for performance. N Engl J Med. 2007;357(2):181-90.
26. Meier R, Muheim L, Senn O, Rosemann T, Chmiel C. The impact of financial incentives to improve quality indicators in patients with diabetes in Swiss primary care: a protocol for a cluster randomised controlled trial. BMJ Open. 2018;8(6):e023788.
27. Meier R, Chmiel C, Valeri F, Muheim L, Senn O, Rosemann T. The Effect of Financial Incentives on Quality Measures in the Treatment of Diabetes Mellitus: a Randomized Controlled Trial. J Gen Intern Med. 2022;37(3):556-64.
PRAXIS
- Vol. 113
- Ausgabe 5
- Mai 2024