- Das Anti-Hu-Syndrom – eine aussergewöhnliche Schwindelursache
Wir beschreiben den Fall eines Patienten mit einem kleinzelligen Bronchuskarzinom, welcher seit sechs Jahren, jedoch verstärkt seit sechs Monaten zunehmend unter ausgeprägtem Schwindel mit Koordinationsstörungen litt. Nach diversen Abklärungen konnte als Ursache dafür ein paraneoplastisches neurologisches Syndrom (PNS) mit Hu-Antikörpern eruiert werden. PNS sind verschiedene neurologische Störungen, welche häufig in bestimmten Mustern auftreten. Die Ursache ist dabei immunvermittelt durch einen Tumor, weshalb die Therapie der PNS auch die Behandlung des zugrunde liegenden Tumors umfasst.
Schlüsselwörter: Paraneoplastisches Syndrom, Schwindel, Hu-Antikörper
Fallbeschreibung
Hintergrund
Paraneoplastische neurologische Syndrome (PNS) sind definiert als neurologische Störungen, welche jeden Teil des Nervensystems betreffen können und häufig in einem stereotypen Muster auftreten (1). Sie sind mit einem Tumor assoziiert und haben eine immunvermittelte Pathogenese. Es handelt sich um ein seltenes Krankheitsbild, das bei weniger als 1 % der Patienten mit einem Malignom beobachtet werden kann. Deshalb muss auch davon ausgegangen werden, dass die Diagnose regelmässig verpasst wird. Häufig treten die neurologischen Zeichen Monate bis Jahre vor der Diagnosestellung eines Tumors auf, werden jedoch zu diesem Zeitpunkt fehlgedeutet (2).
Anamnese
Der 65-jährige Patient leidet seit sechs Jahren an einer Schwindelsymptomatik mit Hörverlust des linken Ohres und einem Tinnitus auf der gleichen Seite. Diese Beschwerden wurden mehrfach als Morbus Menière bewertet.
In den letzten sechs Monaten wurde der Patient wiederholt wegen des Schwindels vorstellig. Neben der subjektiv klar verstärkten Schwindelsymptomatik kam es in den letzten Wochen zusätzlich zu einer begleitenden Gangunsicherheit. Es wurde ein MRI des Neurokraniums durchgeführt, welches regelrechte Strukturen darstellte. Durch die Kollegen der HNO wurde keine periphere Genese des Schwindels gefunden.
Ungefähr vier Monate nach Beginn des verstärkten Schwindels wurde im Rahmen einer ausgedehnten internistischen Abklärung die Diagnose eines metastasierten pulmonalen Tumorleidens mit lymphogenen und ossären Metastasen gestellt. Histologisch zeigte sich das Bild eines kleinzelligen Bronchuskarzinoms. Initial wurde eine tumorspezifische Kombinationstherapie mit Carboplatin, Etoposid und Durvalumab eingeleitet. Nach kurzer Therapiedauer kam es zu einer raschen Verschlechterung des Allgemeinzustandes, aufgrund dessen von einer weiteren tumorspezifischen Therapie abgesehen wurde.
Status
Die Zuweisung auf die Palliativstation erfolgte zur symptomorientierten Therapie aufgrund des zunehmenden Schwindels mit Nausea und Emesis. Klinisch zeigte sich bei Eintritt eine progrediente Gangstörung mit gleichzeitigen sensiblen Defiziten des linken Unterschenkels, eine ausgeprägte Ataxie der Extremitäten und eine Dysarthrie. Weiter bestand ein dysmetrischer Finger-Nase-Versuch links sowie ein Absinken des linken Armes im Armvorhalteversuch, ein feinschlägiger Tremor und eine verminderte Kraft des linken Beines mit Standunsicherheit und linksseitigen Ausfallschritten.
Verlauf
Wir leiteten eine stufenweise ausgebaute Therapie der Nausea mit Domperidon, Haloperidol, Cinnarizin, Betahistin und Dexamethason ein, welche jedoch keine zufriedenstellende Besserung der Symptomatik brachte. Durch die konsiliarisch hinzugezogenen Neurologen wurde die Diagnose einer sensibel betonten axonal-demyelinisierenden Polyneuropathie gestellt, wobei die axonale Komponente massgeblich mit der cisplatinhaltigen Chemotherapie assoziiert war. Die Gangstörung erschien diesbezüglich jedoch zu ausgeprägt.
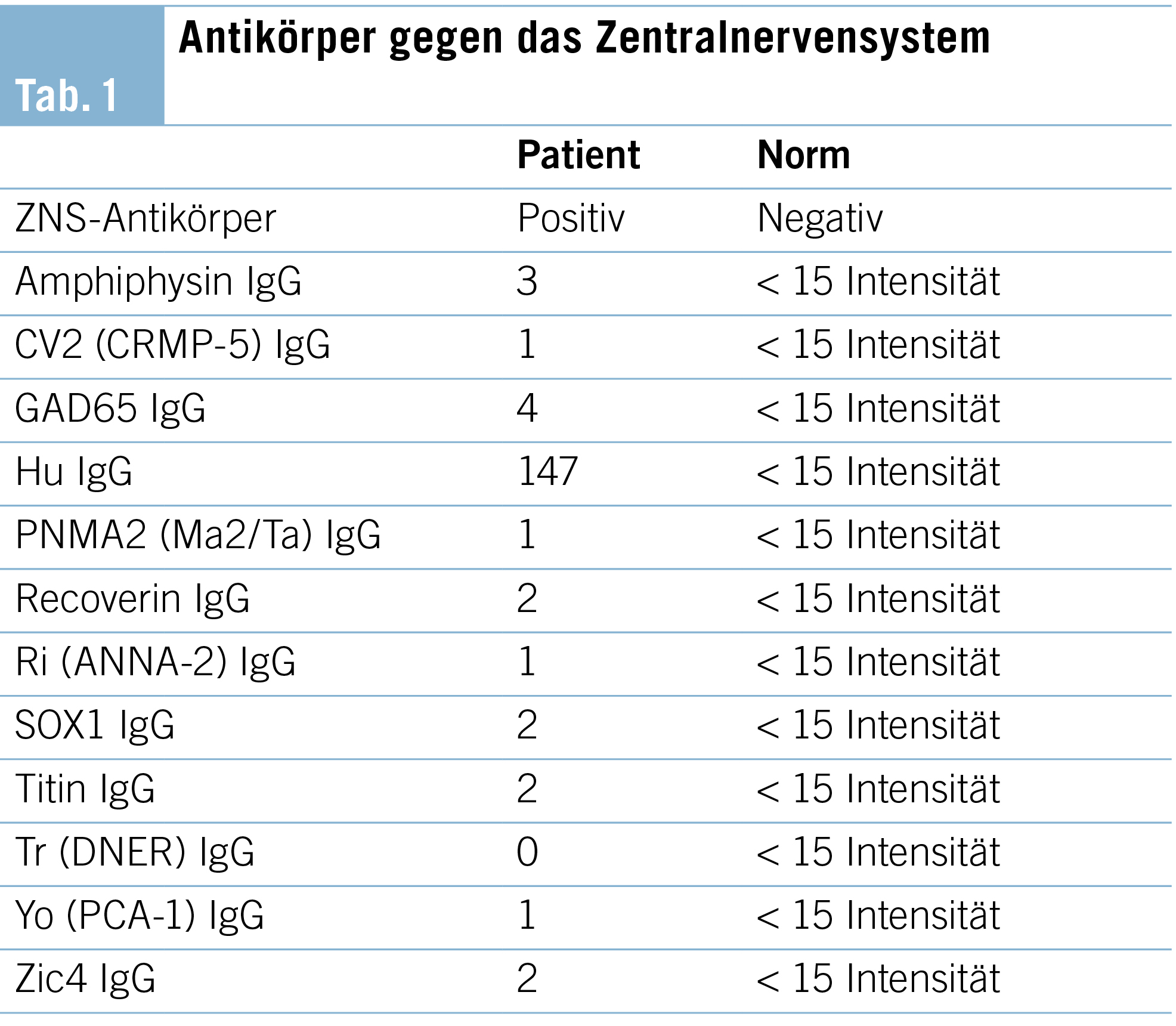
Die weiter gehenden Abklärungen zeigten positive Antikörper gegen das Zentralnervensystem, welche sich in der Differenzierung als Anti-Hu-Antikörper mit einer Intensität von 147 (Norm < 15) erwiesen. Sämtliche weiter bestimmte Antikörper waren negativ. Somit konnten wir die Diagnose eines paraneoplastischen Anti-Hu-Syndroms stellen, mit welchem die Beschwerden gut erklärt werden konnten, siehe Tabelle 1.
Therapie
Die Behandlung eines paraneoplastischen neurologischen Syndroms (PNS) liegt in der Behandlung des auslösenden Tumors. Eine immunsuppressive Therapie bringt, im Gegensatz zu anderen antikörpervermittelten Erkrankungen, jedoch keinen Benefit. In unserem Fall war wegen des stark reduzierten Zustandes keine kausale Therapie mehr möglich.
Bei zunehmender Symptomatik mit vollständiger Gangunfähigkeit, starker Dysarthrie und zunehmender Vergesslichkeit versuchten wir, ohne wesentlichen Erfolg, eine Steroidstosstherapie mit 1.g Methylprednisolon über drei Tage. Bei massiver Progredienz der Erkrankung war schlussendlich nur noch eine rein symptomatische Behandlung möglich, und es kam zu einem Versterben des Patienten drei Monate nach Diagnosestellung des kleinzelligen Bronchuskarzinoms.
Diskussion
Ein Expertengremium hat im Jahr 2021 eine neue Einteilung der paraneoplastischen neurologischen Syndrome (PNS) vorgeschlagen, wobei die Symptomkonstellationen in «Phänotypen mit intermediärem Risiko» und «Hochrisiko-Phänotypen» eingeteilt wurden (1). Das Risiko bezieht sich hierbei auf die Wahrscheinlichkeit, dass die Ätiologie der Symptome auf ein PNS zurückzuführen ist. Das Gremium hat dabei eine dreistufige Klassifizierung in definitiv, wahrscheinlich und möglich vorgenommen. Jede Stufe kann mithilfe des PNS-Care-Scores (Tab. 2) eingeschätzt werden. Dabei werden klinischer Phänotyp, Antikörpertyp, das Vorhandensein oder Nichtvorhandensein eines Malignoms und die Beobachtungszeit erfasst. Die eindeutige Diagnosestellung eines PNS erfordert das Vorhandensein von Antikörpern mit hohem oder mittlerem Risiko mit Ausnahme beim Opsoklonus-Myoklonus.
Zu den Hochrisiko-Phänotypen (früher: klassische PNS) gehören:
Die Enzephalomyelitis, die limbische Enzephalitis, das rapidly progressive zerebelläre Syndrom, der Opsoklonus-Myoklonus, die gastrointestinale Pseudoobstruktion (enterische Neuropathie), das Lambert-Eaton-Myasthenie-Syndrom sowie die sensorische Neuronopathie (1). Auf die einzelnen Krankheitsbilder gehen wir hier nicht ein.
Bei den «Phänotypen mit intermediärem Risiko» sollte vor allem an ein paraneoplastisches Geschehen gedacht werden, wenn keine plausiblen alternativen Diagnosen gefunden werden können und ein rascher Progress (weniger als drei Monate) sichtbar wird. Dies gilt auch dann, wenn Entzündungszeichen im Liquor oder MRI des Neurokraniums/Rückenmarks gefunden werden. Zu dieser Gruppe gehören beispielsweise eine Enzephalitis, welche nicht die Präsentation einer klassischen limbischen Enzephalitis aufweist, oder auch eine isolierte Myelopathie. Weiter gehört auch das Stiff-Person-Syndrom dazu, wobei es hier zu schmerzhaften Muskelspasmen kommt, welche spontan auftreten oder durch Bewegung oder äussere Reize getriggert werden können.
Für diese einzelnen paraneoplastischen neurologischen Syndrome können diverse Autoantikörper bestimmt werden. Hierbei unterscheidet man Antikörper mit hoher (> 70 %; früher onkoneurale Antikörper genannt), mittlerer (30–70 %), tiefer (< 30 %) oder fehlender Assoziation zu einem zugrunde liegenden Tumor.
Es ist wichtig, dass eine gezielte Testung vorgenommen wird, denn ein unüberlegtes Testen erhöht die Wahrscheinlichkeit für falsch positive und falsch negative Resultate. Serum und Liquor sollen auf Antikörper getestet werden, wobei insbesondere die IgG-Antikörper eine diagnostische Aussagekraft haben.
Anti-Hu- (ANNA-1)-Antikörper zeigen sich insbesondere beim Phänotyp einer sensorischen Neuropathie, einer Enzephalomyelitis oder auch einer gastrointestinalen Pseudoobstruktion. Die häufigsten Tumorarten sind das kleinzellige Lungenkarzinom und deutlich weniger häufig andere nicht kleinzellige Lungenkarzinome oder neuroendokrine Tumore (3, 4). Seltener können auch bei Patienten ohne ein Malignom Anti-Hu-Antikörper nachgewiesen werden (5).
In unserem Fall begannen die Beschwerden mit Schwindel, was in der Palliativmedizin ein häufiges Problem darstellt und oftmals schwierig zu behandeln und für die Betroffenen sehr beeinträchtigend ist. Vielfach kann die genaue Ätiologie nicht eruiert werden. Differenzialdiagnostisch vermuteten wir initial mögliche, bisher noch nicht sichtbare Hirnmetastasen und versuchten bei fehlenden kausalen Therapieoptionen, eine medikamentöse Behandlung des Schwindels einzuleiten. Eine zerebrale Bildgebung zeigte keine Hinweise für einen zerebralen Befall durch das bekannte kleinzellige Bronchuskarzinom. Im Rahmen der weiteren Abklärung konnten wir dann die Diagnose des Anti-Hu-Syndroms stellen, siehe Tabelle 2. Dies erbrachte mehr Klarheit und Verständnis für den Patienten und seine Angehörigen. Damit war jedoch auch klar, dass die Symptomatik und Koordinationsschwierigkeiten nur sehr schwer behandelbar sind.
Rückblickend lässt sich nicht genau klären, ob es sich bei der Schwindelsymptomatik vor sechs Jahren bereits um erste Anzeichen der Tumorerkrankung gehandelt hatte. Aufgrund der theoretischen Grundlagen der PNS wäre es möglich, jedoch war die klinische Präsentation unterschiedlich, weshalb es wahrscheinlich eine andere Ätiologie war. Eine so lange Latenzzeit von Erstsymptomatik bis zur Erstdiagnose erscheint zudem bei einem kleinzelligen Bronchuskarzinom sehr unwahrscheinlich.
Die Schwindelsymptomatik vier Monate vor klinischer Manifestation eines kleinzelligen Bronchuskarzinoms war, retrospektiv gesehen, mit hoher Wahrscheinlichkeit der Beginn des PNS. Ataxie, Stand- und Gangunsicherheit würden zu einer Kleinhirndegeneration passen, wobei das MRI, wie in unserem Fall, in einer Frühphase häufig normal ausfällt. Veränderungen in der Bildgebung, wie beispielsweise eine Kleinhirndegeneration, sind teilweise im späteren Verlauf zu sehen. Die Symptome können von Patienten und nicht spezialisierten Untersuchern als unspezifischer Schwindel gesehen werden und erlangen somit nicht die richtige Beachtung. Eine präzise Anamnese zur genauen Erfassung der Symptomatik ist von äusserster Wichtigkeit und kann bei der Diagnosestellung weiterhelfen.
Die diagnostizierte periphere Polyneuropathie, welche initial im Rahmen der cisplatinhaltigen Chemotherapie interpretiert wurde, könnte retrospektiv ebenfalls mit dem Anti-Hu-Syndrom assoziiert gewesen sein.
Für die Praxis
Paraneoplastische Syndrome sind selten und schwierig zu diagnostizieren.
Im Falle einer unklaren, länger dauernden Symptomatik des Schwindels sollen eine weiter gehende Abklärung und genaue Anamnese erfolgen.
Nach Ausschluss der üblichen Ursachen des Schwindels kann eine paraneoplastische Ursache mit Bestimmung der entsprechenden Antikörper evaluiert werden.
Die Behandlung richtet sich einerseits nach der Ursache, andererseits kann auch eine rein symptomatische Behandlung in Anbetracht der Tumorsituation gewählt werden.
Ein paraneoplastisches neurologisches Syndrom kann auch bei nicht bekanntem Malignom vorliegen.
Palliative Care
Kantonsspital Graubünden
CH-7000 Chur
Leiter Palliative Care
Kantonsspital Graubünden
Loëstrasse 170 Chur
7000 Chur
cristian.camartin@ksgr.ch
Die Autorin und der Autor haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Graus F, Vogrig A, Muñiz-Castrillo S, Antoine JG, Desestret V et al. Updated Diagnostic Criteria for Paraneoplastic Neurologic Syndromes. Neurol Neuroimmunol Neuroinflamm. 2021 May 18;8(4):e1014.
2. Darnell RB, Posner JB. Paraneoplastic syndromes involving the nervous system. N Engl J Med. 2003 Oct 16;349(16):1543-54.
3. Graus F. Anti-Hu-associated paraneoplastic encephalomyelitis: analysis of 200 patients. Brain. 2001;124(pt 6):1138-1148.
4. Yu Z, Kryzer TJ, Griesmann GE, Kim K, Benarroch EE, Lennon VA. CRMP-5 neuronal autoantibody: marker of lung cancer and thymoma-related autoimmunity. Ann Neurol. 2001;49(2):146-154.
5. Honnorat J, Didelot A, Karantoni E, et al. Autoimmune limbic encephalopathy and anti-Hu antibodies in children without cancer. Neurology. 2013;80(24): 2226-2232.
PRAXIS
- Vol. 113
- Ausgabe 10
- November 2024