- Demenz: Übersicht zur Nomenklatur und den häufigsten Formen
Dieser Artikel erläutert die gebräuchliche Nomenklatur der Demenz und stellt die für die häufigsten Demenzformen typischen Symptome und Befunde in einem kurzen Überblick vor. Ein besonderer Fokus wird auf die häufig unterdiagnostizierte Lewy-Body-Demenz gelegt.
Schlüsselwörter: Demenz, Nomenklatur, Demenzformen, Lewy-Body-Demenz
Dementia: Overview of Nomenclature and the Most Common Forms
This article explains the nomenclature of dementia in common use and presents a brief overview of the typical symptoms and findings of the most common forms of dementia. A particular focus is placed on Lewy body dementia, which is often underdiagnosed.
Keywords: Dementia, nomenclature, forms of dementia, Lewy body dementia
Démence: Aperçu de la nomenclature et des formes les plus courantes de démence
Cet article explique la nomenclature de la démence en cours et donne un bref aperçu des symptômes et des résultats typiques pour les formes les plus courantes de démence. Un accent particulier est mis sur la démence à corps de Lewy, souvent sous-diagnostiquée.
Mots-clés: Démence, nomenclature, formes de démence, démence à corps de Lewy
Neurodegenerative Erkrankungen stellen eine der grössten Herausforderungen der öffentlichen Gesundheit weltweit dar [1]. Bereits heute leben in der Schweiz schätzungsweise 150 000 Menschen mit einer Demenzerkrankung, mit etwa 32 200 Neuerkrankungen jährlich, wobei aufgrund der demografischen Entwicklung mit einer deutlichen Zunahme der Patientenzahlen auszugehen ist [2, 3]. So stellt das Alter den grössten Risikofaktor für eine Demenzerkrankung dar [3]. Nach dem 65. Lebensjahr steigt das Risiko, an einer Demenz zu erkranken, auf 1:3 bis 1:4 [3]. Für das Jahr 2050 wird in der Schweiz mit etwa 300 000 demenzerkrankten Personen gerechnet, weltweit mit 135 Millionen [4, 5]. Die Kosten aufgrund von Demenzerkrankungen betragen in der Schweiz ungefähr 7 Milliarden Franken [3]. Die Demenz verläuft progressiv und kann zur kompletten Pflegebedürftigkeit führen [6]. Ein frühzeitiges Erkennen des Krankheitsbildes ermöglicht Betroffenen eine autonome Zukunftsplanung sowie medikamentöse und nicht-medikamentöse Therapiemöglichkeiten im Sinne eines interprofessionellen Krankheitsmanagements [7]. Nur solange die Urteilsfähigkeit gegeben ist, können Vorsorgeauftrag, Patientenverfügung und Erbschaften geregelt werden [3]. Massnahmen zur Progressionsverlangsamung, Therapie einer begleitenden Depression, Unterstützung für Angehörige und Hinauszögern einer Institutionalisierung werden möglich [7].
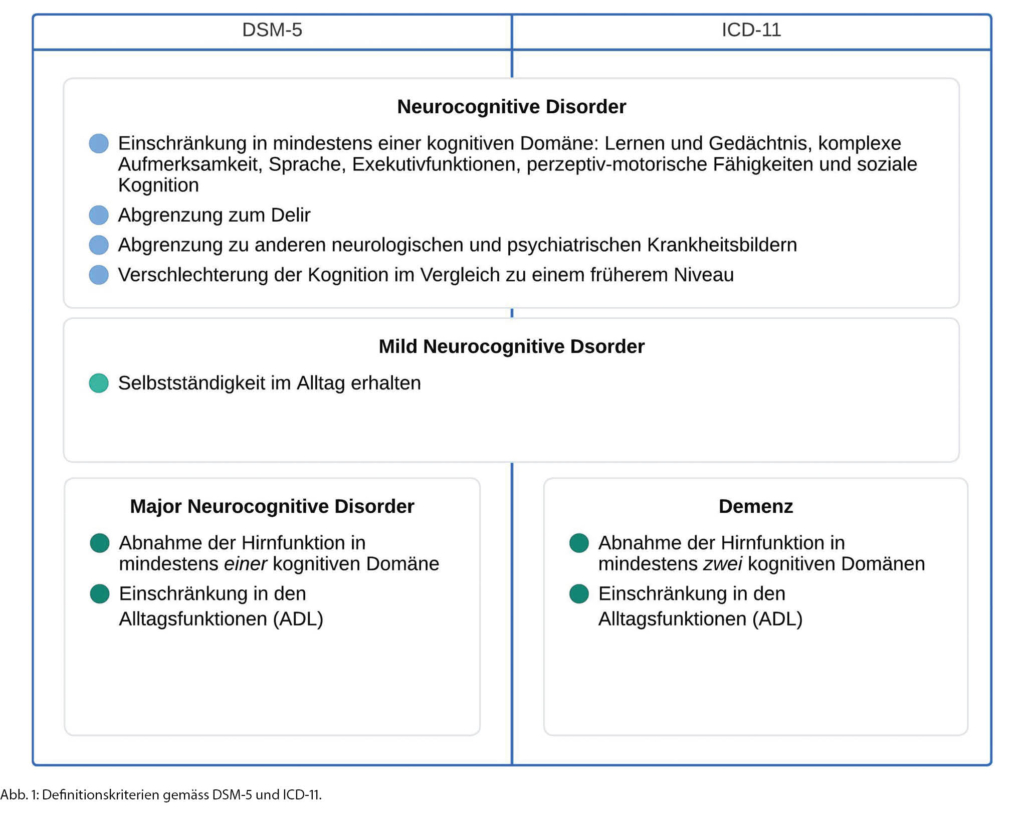
Nomenklatur
Demenz beschreibt ein Syndrom, bei dem es zu einer Abnahme der Leistungsfähigkeit in einer oder mehreren kognitiven Domänen (Lernen und Gedächtnis, komplexe Aufmerksamkeit, Sprache, Exekutivfunktionen, perzeptiv-motorische Fähigkeiten und soziale Kognition) kommt, die sich im Alltag funktionell und/oder sozial beeinträchtigend auswirken [8, 9]. Die gebräuchliche Nomenklatur richtet sich nach dem «Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition» (DSM-5) und der 11. Revision der «International Classification of Diseases (ICD-11)» (Abbildung 1) [8, 9]. Gemäss der ICD-11-Klassifikation ist bei der Demenz eine Einschränkung in mindestens zwei kognitiven Domänen zu erwarten [9]. Die Kognitionseinschränkungen sind dabei nicht allein durch das Patientenalter erklärbar und repräsentieren eine Verschlechterung der Kognition im Vergleich zu einem früheren Zeitpunkt [9]. Bei der DSM-5 wird eine Abnahme der Hirnfunktion in mindestens einer der genannten kognitiven Domäne als «Neurocognitive Disorder» beschrieben [8]. Bleibt die Selbständigkeit im Alltag erhalten, wird von «Mild Neurocognitive Disorder» gesprochen [8], weniger gebräuchlich wird anstelle von «Mild» auch der Term «Minor» verwendet [8]. Zeigen sich Einschränkungen in den Alltagsaktivitäten («activites of daily living», ADL) sind die Kriterien einer Demenz erfüllt und es besteht eine «Major Neurocognitive Disorder» [8]. Diese wird im klinischen Alltag semiquantitativ in drei Schweregrade unterteilt, wobei die Übergänge häufig kontinuierlich sind [8]. Eine leichte Demenz bedeutet, dass die Person Schwierigkeiten in den instrumentellen Aktivitäten des täglichen Lebens hat («instrumental Activites of Daily Living», iADL), z.B. gelingt der Zahlungsverkehr oder die Benützung des öffentlichen Verkehrs nicht mehr [8]. Bei einer mittelschweren Demenz besteht ein Supervisions- resp. Unterstützungsbedarf in den basalen Aktivitäten des täglichen Lebens («basic Acitivites of Daily Living», bADL) wie beispielsweise der Körperpflege oder dem An- und Auskleiden [8].
Im schweren Demenzstadium besteht kompletter Pflegebedarf [8]. Für die Demenz vom Alzheimer-Typ erfolgt die Einteilung in die Stadien des «Clinical Dementia Rating» (CDR-Stadien) [10]. Weiter sollten die Kognitionsstörungen zum Zeitpunkt der Diagnosestellung nicht allein durch ein Delir oder eine psychiatrische Erkrankung (z.B. Depression) erklärbar sein [8]. Neben den kognitiven Einschränkungen leiden Patientinnen und Patienten mitunter auch unter Verhaltenssymptomen (früher auch behaviorale und psychologische Symptome der Demenz (BPSD) genannt) [11]. Diese haben prognostische Bedeutung und beeinflussen die Selbständigkeit im Alltag und die Lebensqualität und belasten unter Umständen das soziale Umfeld [11, 12]. Gerade in frühen Stadien, bei Komorbiditäten (z.B. Depression), Überlappungen zwischen den Demenzformen und deren Koexistenz kann eine Diagnosestellung schwierig sein [13, 14]. Es erfolgt ein schrittweises Vorgehen: Die gesamte medizinische Vorgeschichte muss eingeholt, eine neurologische Untersuchung durchgeführt und die Resultate der kognitiven Untersuchung müssen interpretiert werden [15]. Zusätzlich sind Laboruntersuchungen und bildgebende Verfahren notwendig [6]. Ziele der Diagnosestellung sind der Ausschluss behandelbarer Ursachen, die Etablierung einer Therapie und Unterstützung der Betroffenen und Angehörigen sowie das Vermeiden von Gefahrensituation (z.B. Abklärung der Fahreignung oder Testierfähigkeit) [3]. Die Empfehlungen des Vereins «Swiss Memory Clinics» können hier hilfreich sein [16].
Demenzformen
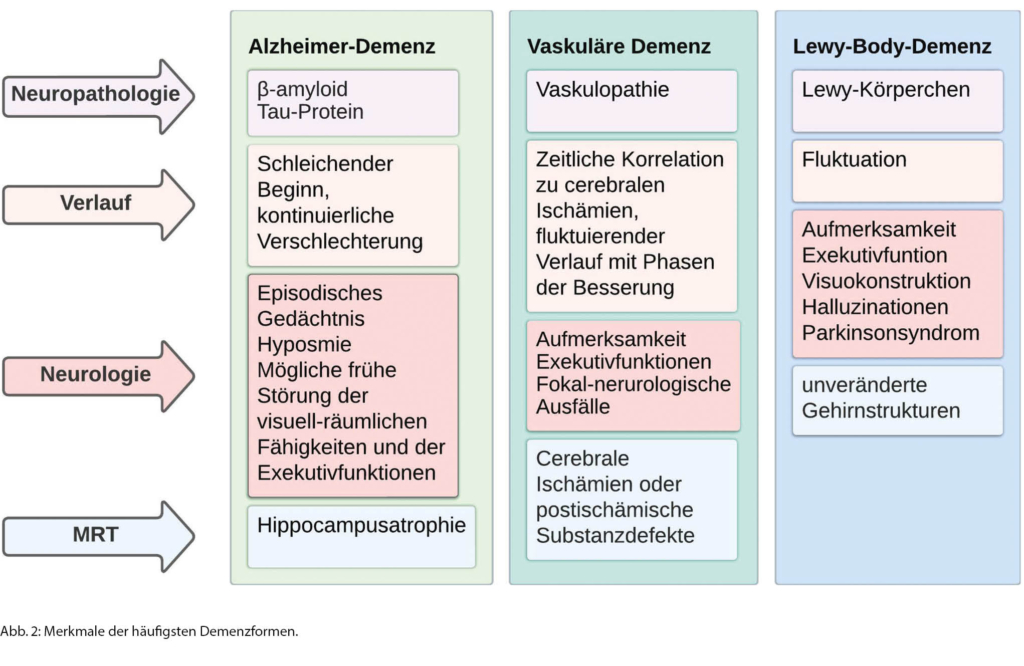
Basierend auf der zugrundeliegenden Neuropathologie erfolgt die Klassifizierung in verschiedene Demenzformen [14]. Die neurodegenerativen Demenzerkrankungen sind geprägt von einer abnormalen Proteinaggregation in den Neuronen und in der Glia [14]. Die meisten neurodegenerativen Demenzformen werden durch eine Fehlfaltung folgender Proteine verursacht: β-amyloid (Aβ), Tau-Protein, «TAR DNA-Binding Protein 43» (TDP-43), Alpha-Synuclein und Prionen [13, 14]. Zu diesen gehören die Alzheimer-Demenz (AD) (Aβ, Tauopathie), die frontotemporale Demenz (FTLD) (Tauopathie, TDP-43) und die Lewy-Body-Demenz (LBD) (Lewy-Körperchen bestehend aus alpha-synuclein) [3, 17]. Eine typische Prionenerkrankung ist die Creutzfeld-Jakob-Erkrankung [17]. Die häufigste nicht-neurodegenerative Demenzform stellt die vaskuläre Demenz dar [18]. Die unterschiedlichen Ursachen einer Demenz führen zu unterschiedlichen Krankheitsbildern, auf denen die Diagnosestellung beruht (Abbildung 2) [13, 14]. Oftmals kommt es zu Überlappungen zwischen den verschiedenen Krankheitsbildern [19]. Auf die häufigsten Demenzformen sowie die gemischte Demenz wird nachfolgend eingegangen.
Alzheimer-Demenz
Die AD ist mit 50–75 % die häufigste Demenzform [20, 21]. Die Prävalenz steigt mit zunehmendem Alter [20, 21]. Es ist davon auszugehen, dass nach dem 90. Lebensjahr etwa 40 % der Bevölkerung unter einer AD leidet. [3]. Das «National Institute on Aging and Alzheimer‘s Association Research Framework» definiert die AD anhand der zugrundeliegenden Neuropathologie: dem Vorliegen von Aβ und phosphorylierten Tau-Proteinen [22]. Klinisch ist die AD durch einen schleichenden Beginn charakterisiert [23]. Am häufigsten findet sich ein amnestisches Syndrom mit Einschränkungen im Lernen und Gedächtnis [23]. Bei den non-amnestischem Erscheinungsbildern finden sich Wortfindungsstörungen (logopenische Variante), Einbussen in den visuospatialen Fähigkeiten (posteriore kortikale Atrophie) oder Störungen in den Exekutivfunktionen (frontale Variante) [23]. Eine genetische Form bei Mutation des «Amyloid Precursor Protein» (APP), Präsenilin-2 (PSEN2) oder des Präsenilin-1 (PSEN1) ist bei autosomal-dominanter Vererbung mit fast vollständiger Penetranz bei auffälliger Familienanamnese und einem Symptombeginn von unter 65 Jahren zu vermuten [3, 23]. Diese ist jedoch mit einer Prävalenz von unter 1 % sehr selten anzutreffen [24].
Vaskuläre Demenz
Eindeutige Diagnosekriterien liegen nicht vor, vielmehr umfasst die vaskuläre Demenz heterogene Vaskulopathien, die eine Demenz verursachen können [18]. Studien haben gezeigt, dass der grösste Teil der Patientinnen und Patienten mit einer vaskulären Demenz an einer subkortikalen vaskulären Demenz leidet, weniger hingegen an der kortikalen vaskulären Demenz (Multiinfarkt-Demenz) [25]. Erstere beruht auf einer Erkrankung der kleinen Gefässe («small vessel disease»), die zu kleinen Infarkten (Lakunen) und kortikaler Atrophie führt [18]. Begleitend finden sich inkomplette respektive komplette Infarkte [18]. Inkomplette Infarkte äussern sich in den für die subkortikale vaskuläre Demenz typischen periventrikulären Läsionen der weissen Hirnsubstanz, die vaskuläre Leukenzephalopathie [3, 18]. Die ischämischen Läsionen betreffen insbesondere die präfrontalen subkortikalen Schaltkreise, was die klinischen Eigenschaften der subkortikalen vaskulären Demenz erklärt. So finden sich in erster Linie Aufmerksamkeitsstörungen, Einschränkungen in den Exekutivfunktionen und eine psychomotorische Verlangsamung [26].
Lewy-Body-Demenz
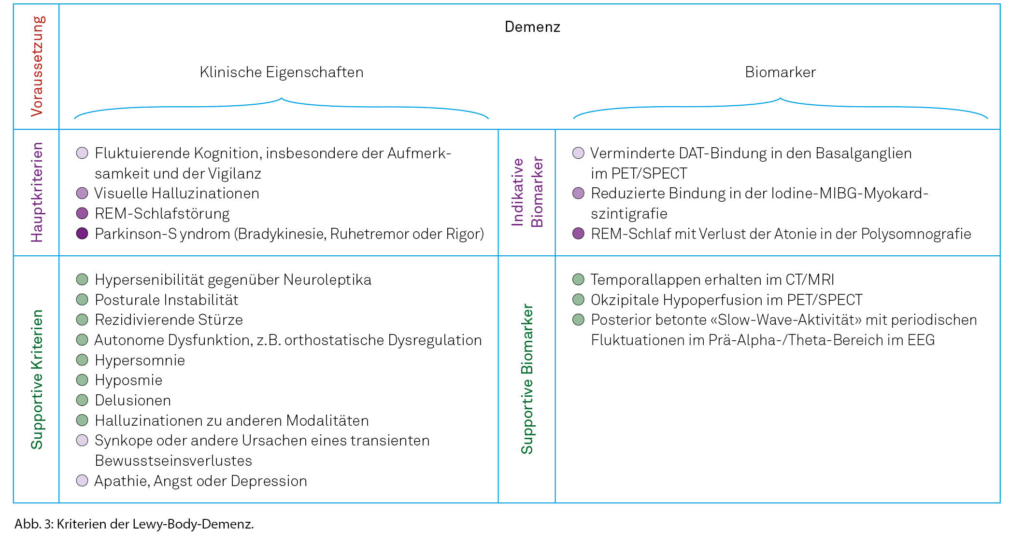
Bei Personen über 65 Jahre repräsentiert die LBD nach der AD die zweithäufigste neurodegenerative Demenzform [27]. Sie beinhaltet die Demenz mit Lewy-Körperchen (DLB) und die Parkinson-Demenz (PD) [28]. Beiden Erkrankungen liegt dieselbe Pathophysiologie zugrunde und beide stellen vermutlich ein Kontinuum einer Lewy-Körperchen-Erkrankung dar [29]. Unterschieden werden sie durch den zeitlichen Ablauf motorischer und kognitiver Symptome: Bei der PD bestehen die motorischen Veränderungen mindestens ein Jahr vor Auftritt der Kognitionsstörungen, bei der DLB tritt die Demenz entweder vor Beginn des Parkinsonsyndroms, gleichzeitig oder innerhalb eines Jahres danach auf [27]. Die Punkte-Prävalenz einer Demenz bei Personen mit einer Parkinsonerkrankung liegt bei ungefähr 25 %, und das Risiko, eine Demenz zu erleiden, steigt mit der Erkrankungsdauer [30]. So beträgt diese etwa 50 % nach einer Dauer von 10 Jahren [31]. Trotz ihrer Häufigkeit wurde die LBD oft nicht diagnostiziert oder als AD missinterpretiert, sodass 2017 eine Revision der Diagnosekriterien zur LBD erfolgte [32]. Neu werden klinische Eigenschaften sowie diagnostische Biomarker unterschieden (Abbildung 3) [32]. Grundsätzliche Voraussetzung ist das Vorliegen einer Demenz [32]. Bei der LBD zeigen sich insbesondere Einschränkungen in der Aufmerksamkeit, in den Exekutivfunktionen und der Visuokonstruktion [32]. Kernmerkmale sind eine Fluktuation der Kognition, visuelle Halluzinationen, REM-Schafstörungen und mindestens ein klinisches Symptom eines Parkinsonsyndroms [32]. Fluktuationen erscheinen als Veränderungen der Kognition, der Aufmerksamkeit und der Psychomotorik [32]. Typischerweise treten diese als Lethargie oder inkohärentes Sprechen auf [32]. Komplexe, detailreiche visuelle Halluzinationen zeigen sich oft in Form von Menschen oder Tieren; sie können durch die kranke Person selbst berichtet werden [32]. Bei den REM-Schlafstörungen, bei denen es zum Verlust der normalen REM-Schlaf-Atonie kommt, wird nicht selten seitens der Partnerin/des Partners von Verletzungen aufgrund von Extremitätenbewegungen der betroffenen Person während des Träumens berichtet [32]. In den supportiven klinischen Kriterien wurde neu die Hypersomnie, typischerweise als ausgeprägte Tagesschläfrigkeit, aufgenommen [32]. Biomarker beinhalten den Nachweis einer reduzierten Bindung der Dopamintransporter (DAT) in der Positronen-Emissions-Tomografie (PET)/«Single-Photon Emission-Computed Tomography» (SPECT) [32]. Weiter ist für die LBD eine reduzierte Aufnahme in der Iodine- Metaiodbenzylguanidine(MIBG)-Myokardszintigrafie sowie die Bestätigung einer fehlenden REM-Schlaf-Atonie mittels Polysomnografie charakteristisch [32].
Gemischte Demenz
Der Begriff «gemischte Demenz» verweist auf das Vorliegen mehrerer Demenzursachen [19]. Häufig wird die Kombination einer Alzheimer- und vaskulären Demenz beschrieben [19]. Neuropathologisch korreliert eine Demenzerkrankung oft mit den Befunden der Alzheimererkrankung oder der vaskulären Demenz, Autopsie-basierte Studien suggerieren jedoch eine unterschätzte Prävalenz der gemischten Demenz [33]. Weiter ergab eine Autopsie-basierte Studie, dass bei Hochbetagten das Vorhandensein multipler Pathologien mit einer erhöhten Wahrscheinlichkeit und Schwere einer Demenz verbunden ist [34]. Bei einer prospektiven Studie mit 209 Teilnehmern war die gemischte Demenz sogar am häufigsten vertreten [35]. Die Diagnose erschwert sich weiter durch den fehlenden Konsens zu klinischen und auch apparativen Diagnosekriterien [19]. So wird die gemischte Demenz gemäss DSM V unter «Major Neurocognitive Disorder» aufgrund mehrerer Ätiologien beschrieben [8]. Laut ICD-10 kann die Diagnose bei Personen gestellt werden, die Kriterien einer Alzheimer- und vaskulären Demenz erfüllen [36].
Lernfragen
1. Um die Diagnose einer Demenz zu stellen, müssen gemäss DSM-5 und ICD-11 folgende Kriterien erfüllt sein (Mehrfachauswahl):
a) Einschränkungen in mindestens drei kognitiven Domänen
b) Einschränkungen in den Alltagsaktivitäten oder -funktionen
c) Ausschluss eines Delirs
d) Verschlechterung im Vergleich zur früheren kognitiven Leistungsfähigkeit
2. Eine Lewy-Body-Demenz ist eher unwahrscheinlich, wenn folgende Befunde vorliegen (Mehrfachauswahl):
a) Rezidivierende Stürze
b) Cerebrovaskuläre Erkrankungen, die das klinische Bild verursachen können
c) REM-Schlafstörungen
d) Parkinsonsyndrom als alleiniges Kernmerkmal
e) Reduzierte Aufnahme der DAT-Liganden in der PET/SPECT
3. Eine 69-jährigen allein lebende Patientin leidet unter zunehmenden Gedächtnisstörungen und benötigt seit einem Jahr Unterstützung in den administrativen Aufgaben. Die Tochter der allein lebenden Frau bestätigt häufiges Nachfragen und eine zunehmende Verwahrlosung des Haushalts ihrer vormals sehr ordentlichen Mutter. Folgende Aussagen sind zutreffend (Mehrfachauswahl):
a) Aufgrund der geschilderten Gedächtnisstörungen ist das Vorliegen einer Depression sehr unwahrscheinlich.
b) Eine sekundäre Demenzursache sollte ausgeschlossen werden.
c) Sollte eine Diagnostik eine Alzheimer-Demenz nachweisen, wäre bereits ein schweres Demenzstadium erreicht.
d) Die Empfehlungen der «Swiss Memory Clinics» bieten Hilfestellung für weitere Abklärungsschritte.
e) Es empfiehlt sich eine genetische Abklärung der Tochter hinsichtlich einer Alzheimer-Demenz, da die Mutter vor dem 70. Lebensjahr erkrankt ist.
Stadtspital Zürich Waid
Tièchestrasse 99
8037 Zürich
catherine.klaghofer2@stadtspital.ch
Es bestehen keine Interessenskonflikte.
Historie
Manuskript eingereicht: 14.01.2023
Nach Revision angenommen: 18.01.2023
ORCID
Catherine Klaghofer
https://orcid.org/0000-0002-1930-3082
- Die Nomenklatur richtet sich nach dem «Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition» (DSM-5), wobei hier eine Abnahme der Hirnfunktion in mindestens einer der genannten kognitiven Domäne als «Neurocognitive Disorder» beschrieben wird: Lernen und Gedächtnis, komplexe Aufmerksamkeit, Sprache, Exekutivfunktionen, perzeptiv-motorische Fähigkeiten und soziale Kognition.
- Bleibt die Selbständigkeit im Alltag erhalten, wird von «Mild Neurocognitive Disorder» gesprochen. Zeigen sich Einschränkungen in den Aktivitäten des täglichen Lebens, sind die Kriterien einer Demenz erfüllt und es besteht eine «Major Neurocognitive Disorder».
- Zu den häufigsten Demenzformen gehören die Alzheimer-Demenz, die gemischte Demenz, die vaskuläre Demenz und die Lewy-Body-Demenz.
- Ziele der Diagnosestellung einer Demenz umfassen den Ausschluss behandelbarer Ursachen, die Etablierung einer Therapie und die Unterstützung der Betroffenen und Angehörigen sowie das Vermeiden von Gefahrensituation (z.B. Abklärung der Fahreignung oder Testierfähigkeit).
1. Prince M, Albanese E, Guerchet M, Prina M. Dementia and risk reduction: an analysis of protective and modifiable risk factors. World Alzheimer report Alzheimer’s Disease International. 2014.
2. BAG BfG. Zahlen und Fakten zu Demenz. https://www.bag.ad min.ch/bag/de/home/zahlen-und-statistiken/zahlen-fakten-demenz.html2022; letzter Zugriff: 24.01.2023.
3. Felbecker A, Limmroth V, Tettenborn B. Demenzerkrankungen. Elsevier Essentials. 2019.
4. Schweiz A. Demenz in der Schweiz. https://www.alzheimer-schweiz.ch/de/ueber-demenz/beitrag/demenz-in-der-schweiz/ 2022; letzter Zugriff: 24.01.2023.
5. Robinson L, Tang E, Taylor JP. Dementia: timely diagnosis and early intervention. Bmj. 2015;350:h3029.
6. Knopman DS, Boeve BF, Petersen RC. Essentials of the proper diagnoses of mild cognitive impairment, dementia, and major subtypes of dementia. Mayo Clin Proc. 2003;78(10):1290–1308.
7. Prince M, Bryce R, Ferri C. World Alzheimer Report 2011. The benefits of early diagnosis and intervention. Alzheimer’s Disease International (ADI). 2011.
8. Association AP. Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition (DSM-5), American Psychiatric Association. 2013.
9. The L. ICD-11. Lancet. 2019;393(10188):2275.
10. Morris JC. The Clinical Dementia Rating (CDR): current version and scoring rules. Neurology. 1993;43(11):2412–2414.
11. Calsolaro V, Femminella GD, Rogani S, et al. Behavioral and Psychological Symptoms in Dementia (BPSD) and the Use of Antipsychotics. Pharmaceuticals (Basel). 2021;14(3).
12. Lyketsos CG, Carrillo MC, Ryan JM, et al. Neuropsychiatric symptoms in Alzheimer’s disease. Alzheimers Dement. 2011; 7(5):532–539.
13. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. Neurodegenerative diseases target large-scale human brain networks. Neuron. 2009;62(1):42–52.
14. Elahi FM, Miller BL. A clinicopathological approach to the diagnosis of dementia. Nat Rev Neurol. 2017;13(8):457–476.
15. Galvin JE, Sadowsky CH. Practical guidelines for the recognition and diagnosis of dementia. J Am Board Fam Med. 2012; 25(3):367–382.
16. Bürge M, Bieri G, Brühlmeier M, et al. Die Empfehlungen der SwissMemory Clinics für die Diagnostik der Demenzerkrankungen. Praxis (Bern 1994). 2018;107:435–451.
17. Morris JC. Dementia update 2005. Alzheimer Dis Assoc Disord. 2005;19(2):100–117.
18. O’Brien JT, Erkinjuntti T, Reisberg B, et al. Vascular cognitive impairment. Lancet Neurol. 2003;2(2):89–98.
19. Fierini F. Mixed dementia: Neglected clinical entity or nosographic artifice? J Neurol Sci. 2020;410:116662.
20. Prof Martin Prince DRB, Dr Cleusa Ferri, Mr Jim Jackson. Alzheimer’s Disease International. World Alzheimer Report 2009. 2009.
21. Scheltens P, De Strooper B, Kivipelto M, et al. Alzheimer’s disease. Lancet. 2021;397(10284):1577–1590.
22. Jack CR, Jr., Bennett DA, Blennow K, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimers Dement. 2018;14(4):535–562.
23. McKhann GM, Knopman DS, Chertkow H, et al. The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement. 2011;7(3):263–269.
24. Nikolac Perkovic M, Pivac N. Genetic Markers of Alzheimer’s Disease. Adv Exp Med Biol. 2019;1192:27–52.
25. Esiri MM, Wilcock GK, Morris JH. Neuropathological assessment of the lesions of significance in vascular dementia. J Neurol Neurosurg Psychiatry. 1997;63(6):749–753.
26. O’Brien JT, Thomas A. Vascular dementia. Lancet. 2015; 386(10004):1698–1706.
27. Walker Z, Possin KL, Boeve BF, Aarsland D. Lewy body dementias. Lancet. 2015;386(10004):1683–1697.
28. Taylor JP, McKeith IG, Burn DJ, et al. New evidence on the management of Lewy body dementia. Lancet Neurol. 2020;19(2): 157–169.
29. Vann Jones SA, O’Brien JT. The prevalence and incidence of dementia with Lewy bodies: a systematic review of population and clinical studies. Psychol Med. 2014;44(4):673–83.
30. Aarsland D, Zaccai J, Brayne C. A systematic review of prevalence studies of dementia in Parkinson’s disease. Mov Disord. 2005;20(10):1255–1263.
31. Williams-Gray CH, Mason SL, Evans JR, et al. The CamPaIGN study of Parkinson’s disease: 10-year outlook in an incident population-based cohort. J Neurol Neurosurg Psychiatry. 2013; 84(11):1258–1264.
32. McKeith IG, Boeve BF, Dickson DW, et al. Diagnosis and management of dementia with Lewy bodies: Fourth consensus report of the DLB Consortium. Neurology. 2017;89(1):88–100.
33. Kalaria RN. The role of cerebral ischemia in Alzheimer’s disease. Neurobiol Aging. 2000;21(2):321–230.
34. Kawas CH, Kim RC, Sonnen JA, Bullain SS, Trieu T, Corrada MM. Multiple pathologies are common and related to dementia in the oldest-old: The 90+ Study. Neurology. 2015;85(6):535–542.
35. Neuropathology Group of the Medical Research Council Cognitive Function and Ageing Study (MRC CFAS). Pathological correlates of late-onset dementia in a multicentre, community-based population in England and Wales. Lancet. 2001; 357(9251):169–75.
36. Organization WH. ICD-10-GM Version 2020, Systematisches Verzeichnis, Internationale statistische Klassifikation der Krankheiten und verwandter Gesundheitsprobleme, 10. Revision. 2019.
PRAXIS
- Vol. 112
- Ausgabe 9
- Juli 2023