- «Diabetes-Medikamente» ohne Diabetes: SGLT-2-Inhibitoren
Keine Medikamentenklasse hat im vergangenen Jahrzehnt so viel Aufsehen erregt wie die «Sodium-Glucose Linked Transporter 2 Inhibitors» (SGLT-2i) bzw. Gliflozine. Spätestens seit die SGLT-2i, ursprünglich als Diabetes-mellitus-Medikament entwickelt, unerwartet in Zulassungsstudien auch protektive Effekte für Herz und Niere gezeigt haben, sind sie heute in aller Munde. Obwohl die zellulären und molekularen Mechanismen bis heute noch nicht in allen Details geklärt sind, haben sie aufgrund der positiven Datenlage die Therapieansätze bei Diabetes mellitus, Herzinsuffizienz unabhängig von der linksventrikulären Auswurffraktion und Nephropathien revolutioniert. Dieser Artikel soll einen Überblick über die Effekte und postulierte Wirkmechanismen der SGLT-2-Inhibitoren insbesondere bei Herzinsuffizienz und Niereninsuffizienz aufzeigen sowie deren mögliche Risiken und Nebenwirkungen darlegen.
SGLT-2i bei Diabetes mellitus Typ 2
Die SGLT-2i wurden primär als eine neue Substanzklasse von Antidiabetika entwickelt. Im Gegensatz zu gängigen Antidiabetika mit Wirkung auf die Glukoseproduktion und -aufnahme verbessern die SGLT-2i die Glukosekontrolle durch eine vermehrte renale Elimination. Der HbA1c-Wert kann dadurch im Durchschnitt um 0,5–1 % gesenkt werden [1].
Der Mechanismus der glukosurischen Wirkung der SGLT-2i wurde erst mehrere Jahrzehnte nach der erstmaligen Gewinnung derer Vorgängersubstanz Phlorozin aus der Rinde des Apfelbaums im Jahr 1835 entdeckt [2]. So wurde 1980 erstmals die Hemmung der Glukose-Rückresorption im renalen Tubulussystem durch Phlorozin in Ratten mit Diabetes mellitus (DM) beschrieben [3] und schliesslich erst in den 1990er Jahren die therapeutische Glukosesenkung durch enteral besser resorbierbare Phlorozin-Derivate bei Personen mit DM dokumentiert [4, 5].
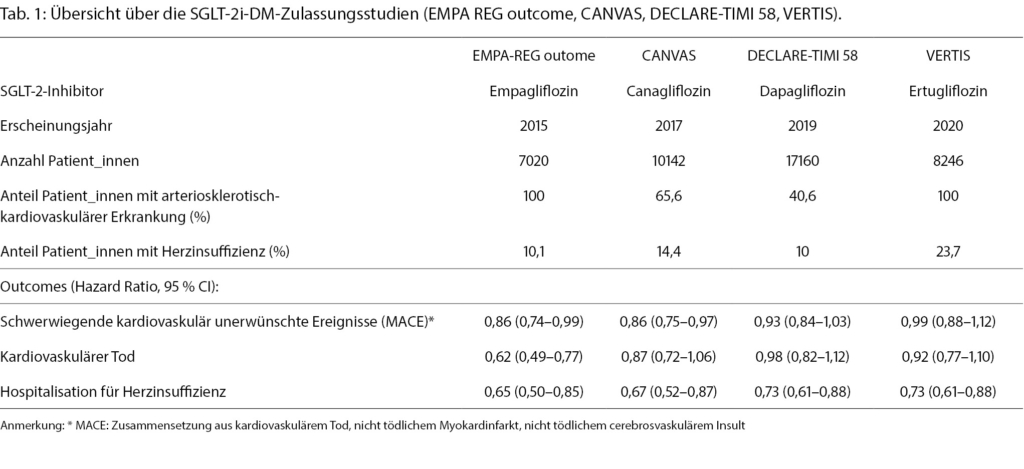
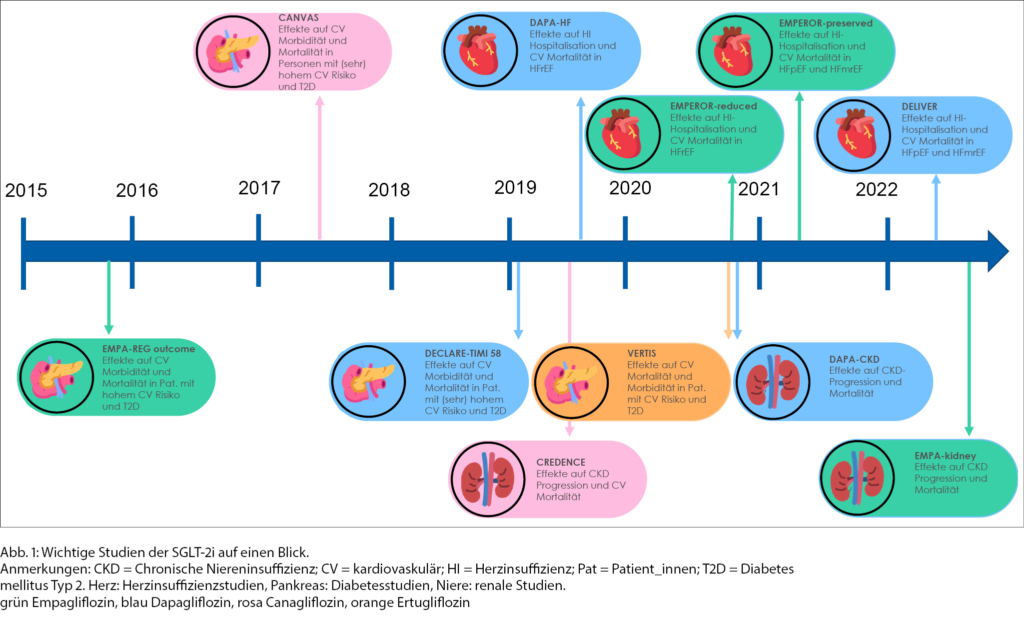
Um zu verstehen, wie aus dem Gliflozin als initiales DM-Medikament ein Therapeutikum für Herzinsuffizienz- und schliesslich auch Niereninsuffizienz unabhängig vom Diabetesstatus wurde, muss man auf die wichtigsten Outcome-Studien der SGLT-2i eingehen (Abb. 1). Die ersten vier grossen multizentrischen, randomisierten, doppelblinden, Placebo-kontrollierten kardiovaskulären Outcome-Studien (EMPA-REG outcome [6] für Empagliflozin, DECLARE-TIMI 58 [7] für Dapagliflozin, CANVAS [8] für Canagliflozin und VERTIS [9] für Ertugliflozin) zwischen 2015 bis 2020 waren initial geplant, um die kardiovaskuläre Sicherheit der neuen Diabetesmedikamentengruppe zu bestätigen (Tab. 1). Dies wurde seit 2008 von der «US Food and Drug Administration (FDA)» für Zulassungsstudien neuer Diabetesmedikamente vorgeschrieben [10].
Die erste Zulassungsstudie des SGLT-2i Empagliflozin im Jahr 2015 (EMPA-REG outcome [6]) zeigte nicht nur, dass dieses Medikament bezüglich kardiovaskulärer Risiken sicher ist, sondern, dass erstmals eine signifikante Reduktion der kardiovaskulären Morbidität und Mortalität durch ein Diabetesmedikament vorhanden war. So reduzierte Empagliflozin in dieser Studie mit 7020 DM-Typ-2-Patient_innen mit gleichzeitig kardiovaskulären Erkrankungen den primären Endpunkt, bestehend aus «Major Adverse Cardiovascular Events (MACE); Zusammensetzung aus kardiovaskulärem Tod, nicht tödlicher Myokardinfarkt, nicht tödlicher cerebrovaskulärer Insult», sowie auch Hospitalisationen für Herzinsuffizienz und Tod jeglicher Ursache, signifikant. Diese günstigen Effekte setzten bereits 2–3 Wochen nach Beginn der Therapie ein.
Die drei nachfolgenden Zulassungsstudien (CANVAS [8], DECLARE-TIMI 58 [7], VERTIS [9]) mit zum Teil tieferem kardiovaskulärem Risiko der eingeschlossenen Patient_innen (CANVAS nur 65,6 % bzw. DECLARE-TIMI 58 nur 40,6 % der Teilnehmenden mit manifester kardiovaskulärer Erkrankung) konnten bis auf CANVAS zwar keine signifikante Reduktion des primären Endpunktes (MACE) aufzeigen, jedoch wiesen wiederum alle eine signifikante Reduktion der Herzinsuffizienzhospitalisationsrate auf.
Auf Grundlage dieser erfreulichen kardiovaskulären Outcome-Daten der SGLT-2i sind diese Medikamente in der Diabetesbehandlung inzwischen fest verankert.
So wird gemäss schweizerischer Empfehlung für Endokrinologie und Diabetologie (SGED) für die Behandlung des DM Typ 2 neben einer multifaktoriellen Lebensstiländerung und Metformin (eGFR > 30 ml/min vorausgesetzt) eine medikamentöse Therapie mit einem SGLT-2i oder GLP-1-Agonist empfohlen.
SGLT-2i bei Herzinsuffizienz
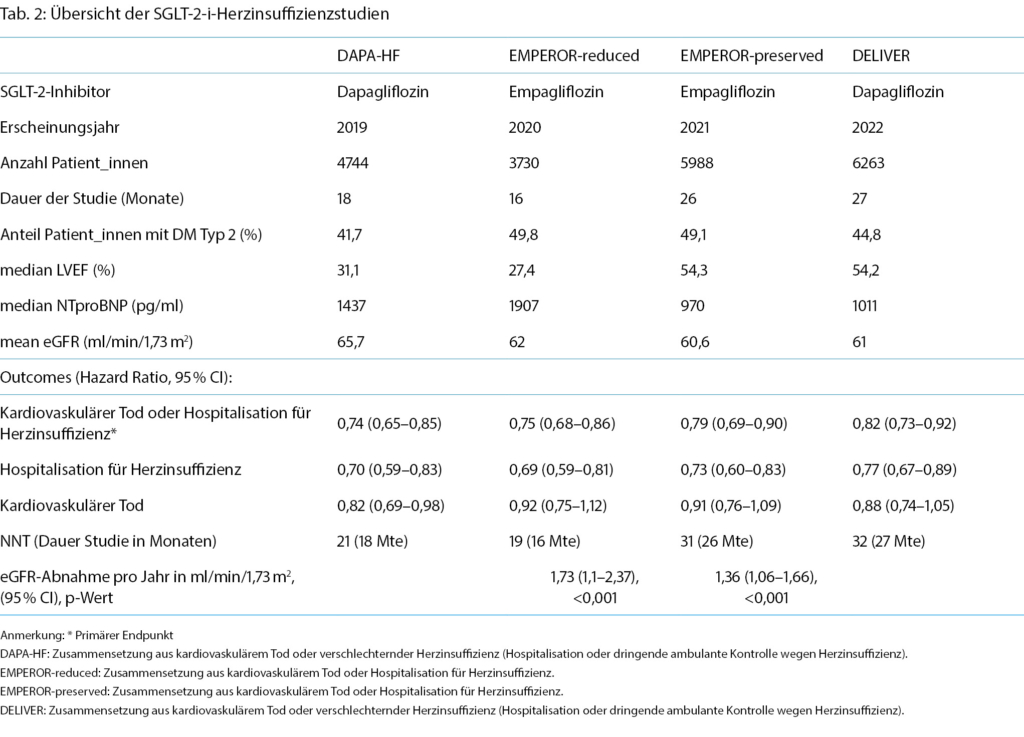
Aufgrund der konsistenten signifikanten Reduktion der Rate für Herzinsuffizienzhospitalisationen in allen Diabetes-Zulassungsstudien wurden anschliessend grosse randomisierte, doppelblinde, Placebo-kontrollierte Herzinsuffizienzstudien mit SGLT-2i bei Personen mit und ohne DM Typ 2 durchgeführt, initial nur bei Patient_innen mit reduzierter LVEF (DAPA-HF [11] und EMPEROR-reduced [12]) und kürzlich auch bei Patient_innen mit erhaltener bzw. leicht reduzierter LVEF (EMPEROR-preserved [13] und DELIVER [14]). Dies war der Zeitpunkt, an dem die Gliflozine von einem reinen Diabetesmedikament zu einem neuen Herzinsuffizienzmedikament wurden. (Tab. 2)
SGLT-2i bei Herzinsuffizienz mit reduzierter LVEF (HFrEF)
Beide Herzinsuffizienzstudien bei Patient_innen mit LVEF ≤ 40 % (DAPA HF mit Dapagliflozin und EMPEROR-reduced mit Empagliflozin) konnten erstmalig einen Benefit der SGLT-2i auf die kardiovaskuläre Mortalität und Herzinsuffizienzhospitalisationen bei bereits gut ausgebauter Herzinsuffizienztherapie unabhängig vom Vorliegen eines DM zeigen, wobei dieser wiederum getrieben durch Herzinsuffizienzhospitalisationen war. (Tab. 2) Die Studien waren ähnlich aufgebaut, allerdings schloss EMPEROR-reduced kränkere Patient_innen mit schwerwiegend eingeschränkter LVEF, höherem NTproBNP Wert und tieferer eGFR ein als DAPA-HF [15].
Der Benefit der SGLT-2i war unabhängig von einer bereits vorbestehenden Medikation mit einem Angiotensin- Rezeptor-Neprilysin-Inhibitor (ARNI). Zudem konnte unter Dapagliflozin im Vergleich zu Placebo eine signifikante Reduktion von moderaten bis schweren Hyperkaliämien (Kalium > 6 mmol/l) bei Patient_innen unter Mineralcorticoidantagonisten dokumentiert werden [16].
Basierend auf diesen hervorragenden Herzinsuffizienz-Ergebnissen wurden die SGLT-2i in den neuen ESC-Herzinsuffizienz-Guidelines mit einer Klasse I A bei HFrEF versehen [17]. Somit sind diese neben ACE-Hemmer/ARNI, B-Blocker und Mineralcorticoidantagonisten fester Bestandteil der neuen «4-Säulen-Therapie» der medikamentösen Herzinsuffizienzbehandlung, die nach neuen Kenntnissen nicht sequenziell, sondern so schnell wie möglich parallel aufdosiert werden sollte. In der Schweiz ist seit dem 1. Oktober 2022 bei HFrEF-Patient_ innen auch die Kombination von Dapagliflozin mit einem ARNI zugelassen. Bei Empagliflozin muss aktuell (Stand 02/2023) noch vor gleichzeitiger ARNI-Gabe weiterhin eine Kostengutsprache bei der Krankenkasse eingeholt werden.
SGLT-2i bei Herzinsuffizienz mit erhaltener bzw. leicht reduzierter LVEF (HFmrEF, HFpEF)
Auch die nachfolgenden zwei Studien bei Patient_innen mit LVEF >40 % (EMPEROR-preserved mit Empagliflozin und DELIVER mit Dapagliflozin) konnte eine signifikante Reduktion des primären Outcomes (Zusammensetzung aus kardiovaskulärem Tod und Hospitalisation für Herzinsuffizienz) unabhängig von DM dokumentieren, wiederum getrieben durch eine tiefere Herzinsuffizienzhospitalisationsrate (Tab. 2). Insgesamt zeigte sich in beiden Studien ein nicht-signifikanter Effekt auf die Reduktion der kardiovaskulären Mortalität, wobei die Studien dafür auch nicht ausreichend gepowert waren. Im Gegensatz zu EMPEROR-preserved gab es in DELIVER keine Hinweise für eine Abschwächung des primären Endpunktes sowie der kardiovaskulären bzw. Gesamtmortalität bei einer LVEF >60%. Zusätzlich wurden auch Patient_innen mit zuvor LVEF <40% und inzwischen verbesserter LVEF >40 % (HFimpEF) sowie (kürzlich) hospitalisierte Patient_ innen eingeschlossen, die ebenfalls von Dapagliflozin profitiert haben.
SGLT-2i sind in den ESC-Herzinsuffizienz-Guidelines bei HFmrEF und HFpEF noch nicht aufgeführt, da die oben genannten Studien erst nach Veröffentlichung der aktuellen ESC-Guidelines erschienen sind [17]. Aufgrund der vielversprechenden Datenlage werden die SGLT-2i mit hoher Wahrscheinlichkeit auch bei einem LVEF-Spektrum >40 % ihren Stellenwert finden. In den amerikanischen Guidelines [18] wurden die SGLT-2i inzwischen mit einer Klasse IIa B für die Therapie von HFmrEF und HFpEF versehen.
Eine kürzlich veröffentlichte Studie (EMPULSE [19]) zeigte ebenfalls einen Benefit von Empagliflozin für Patient_innen mit akuter Herzinsuffizienz, unabhängig von der LVEF und dem Diabetesstatus.
SGLT-2i bei Niereninsuffizienz
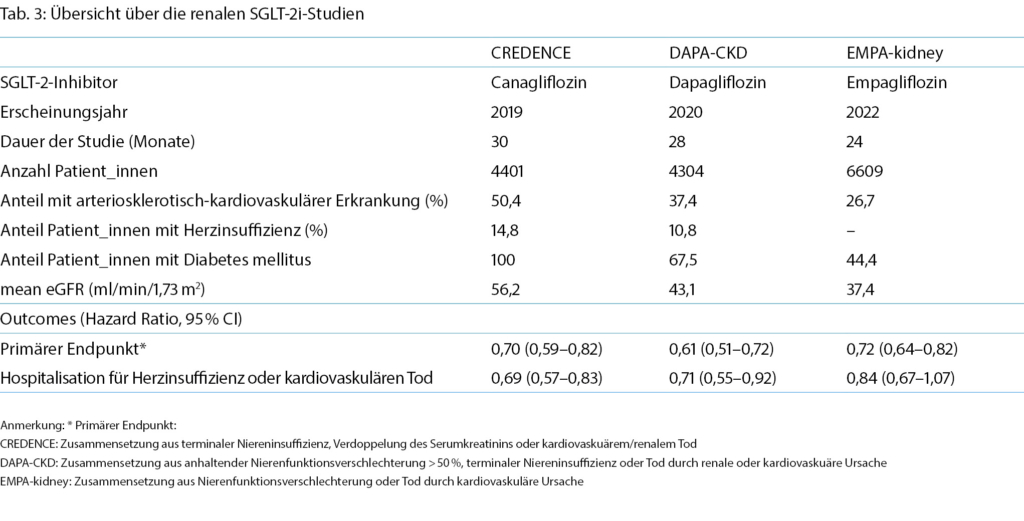
Bereits EMPA-REG Outcome und CANVAS zeigten unter SGLT-2i günstige renale Effekte mit einer Reduktion der Nierenfunktionsverschlechterung [20]. CREDENCE 2019 war die erste grosse Studie mit primär renalem Endpunkt bei Patient_innen mit DM Typ 2 und chronischer Niereninsuffizienz mit Albuminurie bereits unter Therapie mit einem RAAS-Blocker, in der unter SGLT-2i im Vergleich zu Placebo eine Reduktion des kombinierten primären Endpunkts (terminale Niereninsuffizienz, Verdoppelung des Serum-Kreatinins oder kardiovaskulärer/renaler Tod) dokumentiert werden konnte [21] (Tab. 3). Eine Metaanalyse (EMPA-REG Outcome, CANVAS, CREDENCE, DECLARE-TIMI 58) bestätigte die signifikante Reduktion bezüglich Progression in Dialyse, Transplantation oder Tod durch Niereninsuffizienz unabhängig von der Baseline-eGFR bzw. Albuminurie oder vorbestehender RAAS-Blockade [22].
DAPA-CKD (2020) (23) und EMPA-kidney (2022) [24] untersuchten den Effekt der SGLT-2i bei Personen mit chronischer Niereninsuffizienz unabhängig von kardiovaskulären Erkrankungen oder DM. Beide Studien gingen mit einer signifikanten Reduktion des kombiniert primären Endpunktes einher (Tab. 3). So zeigte die Studie DAPA-CKD, die aufgrund überragender Wirksamkeit vorzeitig abgebrochen wurde, unter Dapagliflozin im Vergleich zu Placebo eine Reduktion des primären Endpunktes aus terminaler Niereninsuffizienz (definiert als Dialyse >28 Tage oder eGFR <15 ml/min/1,73 m2), mindestens 50 % Nierenfunktionsverlust (Abnahme eGFR ≥50 %) oder renaler bzw. kardiovaskulärer Mortalität. Auch EMPA-kidney bestätigte ein tieferes Risiko für den primären Endpunkt aus Progression der Niereninsuffizienz (definiert als terminale Niereninsuffizienz mit Dialysepflichtigkeit bzw. Nierentransplantation, anhaltende eGFR < 10 ml/min/1,73 m2, Abnahme der eGFR >40 % oder Tod durch renale Ursache) oder kardiovaskulären Tod. DAPA-CKD schloss Patient_innen mit einer eGFR 25–75 ml/min/1,73 m2 und Albuminurie (Albumin/Kreatinin-Quotient 200–5000 mg/g) ein, bei EMPA-kidney wurden Patient_innen mit einer eGFR von 20–45 ml/min/1,73 m2 unabhängig von Albuminurie oder eGFR 45–90 ml/min/1,73 m2 mit Albuminurie (Album/Kreatinin-Quotient mindestens 200 mg/g) eingeschlossen.
Basierend auf diesen Daten sind in der Schweiz Dapagliflozin und Canagliflozin als Medikamente zur Senkung des Risikos der Progression einer chronischen Nierenerkrankung zugelassen: Dapagliflozin bei chronischer Niereninsuffizienz seit mindestens 3 Monaten mit einer eGFR von 25–75 ml/min/1,73 m2 und einem Albumin/Kreatinin- Quotient im Urin von >20 mg/mmol (Albumin/Kreatinin- Quotient >200 mg/g) und Canagliflozin bei diabetischer Nephropathie mit DM Typ 2 und Albuminurie (Albumin/ Kreatinin-Quotient >300 mg/g).
Der Wirkmechanismus der SGLT-2i
Der Wirkmechanismus der SGLT-2i auf den Glukosestoffwechsel ist relativ simpel.
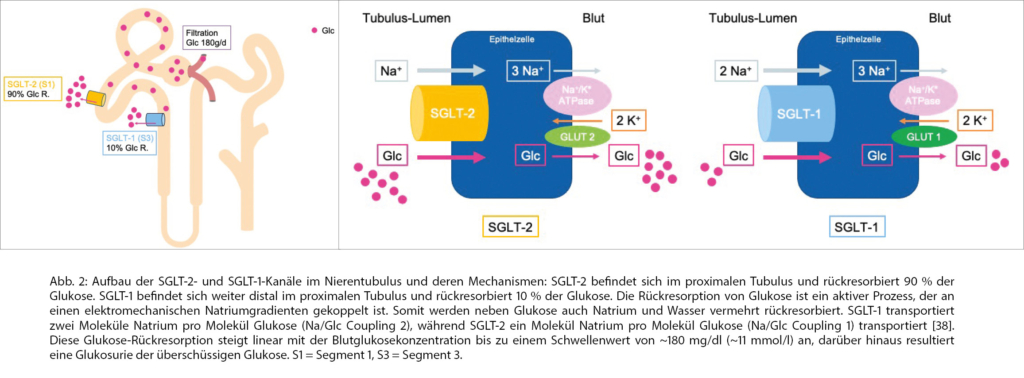
Bei Gesunden wird in der Niere die gesamte im Glomerulum filtrierte Glukosemenge im nachgeschalteten Tubulussystem durch Sodium-Glucose Cotransporter 1 und 2 (SGLT-1 und SGLT-2) vollständig rückresorbiert. Die Rückresorption geschieht vorwiegend (90 %) durch SGLT-2, das im proximalen Tubulus (Pars convoluta, Segment S1/2) lokalisiert ist und praktisch nur renal exprimiert wird [25]. Die restlichen 10% der gefilterten Glukose werden durch SGLT-1 rückresorbiert, der eine höhere Affinität und niedrigere Kapazität als SGLT-2 hat und weiter distal des proximalen Tubulus (Segment S3) lokalisiert ist und auch extrarenal wie zum Beispiel im Dünndarm exprimiert wird [26, 27] (Abb. 2a und b).
Bei Patient_innen mit DM Typ 2 besteht eine glomeruläre Hyperfiltration von Glukose mit Hochregulation der SGLT-2 Expression, sodass vermehrt Glukose im proximalen Tubulus rückresorbiert wird. SGLT-2i senken die maximale Rückresorptionsfähigkeit der Glukose im proximalen Tubulus mit resultierender Glukosurie der überschüssigen Glukose [28, 29]. Dieser glukosurische Effekt der SGLT-2i ist abhängig von der Nierenfunktion (reduziert ab einer GFR <45 ml/min/1,73 m2) und der Plasmaglukosekonzentration. Mit steigenden Blutglukosewerten nimmt die ausgeschiedene Glukosemenge zu, während im hypoglykämen Bereich nur geringfügig Glukose ausgeschieden wird und somit auch Hypoglykämien vermieden werden können. Durch Glukosurie und gleichzeitige Natriurese erfolgt auch eine vermehrte Wasserausscheidung.
Inzwischen wurden mehrere hypothetische pathophysiologische Mechanismen zur Erklärung der kardiorenalen Effekte der Gliflozine vorgeschlagen. Da die SGLT-2i nicht nur bei DM, sondern auch unabhängig davon bei Herz-und Niereninsuffizienz protektive Effekte gezeigt haben, war ein rein Glukose-abhängiger Effekt der SGLT-2i unwahrscheinlich. Dafür sprach auch die Abnahme des glukosereduzierenden Effekts bei eingeschränkter Nierenfunktion, während der kardiovaskuläre und renale Nutzen auch bei fortgeschrittener Niereninsuffizienz persistierte.
Bezüglich des kardialen Benefits wurde unter anderem ein «Smart-Diurese»-Effekt diskutiert durch verstärkte osmotische Diurese bei Glukosurie bzw. Natriurese [30]. Diese These wird durch die konsistente und relativ früh nach SGLT-2i-Beginn beobachtete Abnahme der Herzinsuffizienzhospitalisation (EMPEROR-reduced erste statistische Reduktion nach 12 Tagen) untermauert und erklärt auch teilweise den beobachteten Anstieg des Hämatokrits und Abnahme des systemischen Blutdrucks unter SGLT-2i. Ebenfalls kardioprotektiv wird ein SGLT-2i vermittelter, vermehrt ketogener Metabolismus beschrieben, der nicht nur in einer Gewichtsreduktion, sondern auch in einer Verbesserung der mitochondrialen Dysfunktion und reduziertem oxidativem Stress unter anderem für das Myokard resultiert [31].
Bezüglich des renalen Nutzens wurden Veränderungen der glomerulären Hämodynamik mittels Drosselung der Hyperfiltration sowie eine Verbesserung der tubulären Energiebilanz durch reduzierten ATP- und O2-Verbrauch im proximalen Tubulus beschrieben. So führt die durch den SGLT-2i vermehrte Natriurese mit folglich erhöhter Natriumkonzentration an der Macula densa über den tubuloglomerulären Feedbackmechanismus zur Konstriktion der afferenten glomerulären Arteriolen, die eine Senkung des intraglomerulären Drucks und somit Verminderung der Albuminurie bzw. Proteinurie zur Folge haben. Durch den reduzierten Sauerstoffbedarf im Sinne einer verbesserten tubulären Energiebilanz können sich auch hypoxisch tubuläre Schäden verringern [32, 33].
Empfehlungen für die Praxis
SGLT-2i sind insgesamt gut verträglich und einfach in der Handhabung.
Zur Behandlung der Herzinsuffizienz kann direkt die Standarddosis von jeweils 10 mg verabreicht werden. Aufgrund des potenziell diuretischen Effekts sollte bei gleichzeitiger diuretischer Medikation eine engmaschige Kontrolle des Volumenstatus erfolgen. SGLT-2i können bis zu einer eGFR von 20 ml/min/1,73 m2 verabreicht werden (EMPA-kidney). Nach Beginn kann es innerhalb der ersten zwei Wochen zu einer passageren Abnahme der eGFR (ca. bis 5 ml/min/1,73 m2) kommen, was am ehesten auf die hämodynamische Adaptation an den SGLT-2i zurückzuführen ist. Es bestehen Hinweise dafür, dass eine initiale Abnahme der eGFR unter Dapagliflozin sogar mit einem besseren klinischen Outcome assoziiert ist [34]. Insgesamt zeigt sich unter SGLT-2i langfristig eine Stabilisierung der Nierenfunktion [20, 35, 36].
Das in den DM-Zulassungsstudien beschriebene gehäufte Risiko für Hypoglykämie und diabetische Ketoacidose hat sich in den anschliessenden Herzinsuffizienzstudien nicht bestätigt. Allerdings treten häufiger urogenitale Infekte, insbesondere Vulvovaginitis, Balanitis und verwandte Infektionen des Genitalbereichs auf. Patient_innen sollten somit vor Therapiebeginn mit einem SGLT-2-Hemmer auf eine gute Genitalhygiene hingewiesen werden. Da diabetische Ketoacidosen unter SGLT-2i vor allem in Kombination mit Insulintherapie oder Dehydratation beschrieben wurden, sollte das Medikament während einer akuten Erkrankung oder vor operativen Eingriffen pausiert werden. Bei suggestiven Symptomen wie Fieber oder gastrointestinalen Symptomen empfehlen wir eine Blutgasanalyse und ggfls. Bestimmung der Serum-Ketonkörper unabhängig vom Blutzucker [37]. DM-Typ 1 ist nicht eine absolute Kontraindikation für SGLT-2i, jedoch besteht ein erhöhtes Risiko für Ketoacidosen, sodass diesbezüglich mit den Spezialist_innen der Endokrinologie Rücksprache gehalten werden soll. Bei Schwangerschaft oder Stillen ist der SGLT-2i kontraindiziert.
Universitätsspital Zürich
Klinik für Kardiologie
Rämistrasse 100
8091 Zürich
danae.parianos@usz.ch
Historie
Manuskript akzeptiert: 13.02.2023
Interessenskonflikte
PD Dr. med. Matthias Herman hat Research Grants von Ingelheim
Boehringer und Astra Zeneca bekommen.
ORCID
Danaë Parianos
https://orcid.org/0000-0003-2218-3779
Matthias Hermann
https://orcid.org/0000-0002-0694-7719
Die ursprünglich als Diabetesmedikamente entwickelte SGLT-2i haben die Therapie der Herz- und der Niereninsuffizienz unabhängig von Diabetes mellitus grundlegend verändert. Sie sind sicher in der Anwendung, einfach zu dosieren und in der Regel gut verträglich.
Lernfragen
1. Welche Aussage stimmt nicht?
a) Die Vorgängersubstanz der SGLT-2 i wurde ursprünglich
aus der Rinde des Apfelbaums gewonnen.
b) SGLT-2i wirken über vermehrte renale Elimination
von Glukose antidiabetisch, wobei die meiste Glukose über SGLT-2 ausgeschieden wird.
c) EMPA-REG outcome war 2015 die erste Diabetes-
Zulassungsstudie, die eine signifkante Reduktion der kardiovaskulären Morbidität und Mortalität der SGLT-2i gezeigt hat.
d) Die Studien EMPEROR-reduced und DELIVER haben
SGLT-2i bei HFrEF Patient_innen untersucht.
2. Welche Aussage stimmt? SGLT-2i …
a) … sollten bei einer eGFR < 45 ml/min/1,73 m2 gemäss
EMPA-kidney-Studie nicht verabreicht werden.
b) … kann unabhängig vom DM-Typ verabreicht werden.
c) … kann man während einer akuten Erkrankung
oder vor Interventionen wie Coloskopie stets bedenkenlos weiter verabreichen.
d) … sind in der Schwangerschaft nicht kontraindiziert.
e) … haben unter anderem kardiorenal günstige Effekte.
1. Vasilakou D, Karagiannis T, Athanasiadou E, et al. Sodium-glucose cotransporter 2 inhibitors for type 2 diabetes: a systematic review and meta-analysis. Ann Intern Med [Internet]. 2013 Aug 20 [cited 2022 Dec 30];159(4):262–274.
2. Petersen C. Analyse des Phloridzins. Annalen der Pharmacie 1835; 15(2): 178. https://doi.org/10.1002/jlac.18350150210
3. Rossetti L, Smith D, Shulman G 1, Papachristou D, Defronzo RA. Correction of hyperglycemia with phlorizin normalizes tissue sensitivity to insulin in diabetic rats. J Clin Invest. 1987 May;79(5):1510–5.
4. Oku A, Ueta K, Arakawa K, et al. T-1095, an Inhibitor of Renal Na +-G l u c o s e Cotransporters, May Provide a Novel Approach to Treating Diabetes. 1794 DIABETES [Internet]. 1999 [cited 2022 Dec 31];48. Available from: http://diabetesjournals.org/diabe tes/article-pdf/48/9/1794/365068/10480610.pdf
5. Tsujihara K, Hongu M, Saito K, et al. Na(+)-glucose cotransporter inhibitors as antidiabetics. I. Synthesis and pharmacological properties of 4’-dehydroxyphlorizin derivatives based on a new concept. Chem Pharm Bull (Tokyo) [Internet]. 1996 [cited 2022 Dec 31];44(6):1174–1180. Available from: https://pubmed.ncbi.nlm.nih.gov/8814948/
6. Steiner S. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. Vol. 13, Zeitschrift fur Gefassmedizin. Krause und Pachernegg GmbH; 2016:17–18.
7. Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2019;380(4):347–357.
8. Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med [Internet]. 2017 Aug 17 [cited 2022 Dec 31];377(7):644–657. Available from: https://www.nejm.org/doi/full/10.1056/nejmoa1611925
9. Cannon CP, Pratley R, Dagogo-Jack S, et al. Cardiovascular Outcomes with Ertugliflozin in Type 2 Diabetes. N Engl J Med. 2020 Oct 8;383(15):1425–1435.
10. Nissen SE, Wolski K. Effect of Rosiglitazone on the Risk of Myocardial Infarction and Death from Cardiovascular Causes. n engl j med [Internet]. 2007 [cited 2022 Dec 31];24:2457–71. Available from: www.nejm.org
11. McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med [Internet]. 2019 Nov 21;381(21):1995–2008. Available from: http://www.nejm.org/doi/10.1056/NEJMoa1911303
12. Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020 Oct 8;383(15):1413–1424.
13. Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021 Oct 14;385(16):1451–1461.
14. Solomon SD, McMurray JJV, Claggett B, et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med [Internet]. 2022 Sep 22 [cited 2022 Dec 31];387(12):1089–98. Available from: https://pubmed.ncbi.nlm.nih.gov/36027570/
15. Zannad F, Ferreira JP, Pocock SJ, et al. SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta-analysis of the EMPEROR-Reduced and DAPA-HF trials. Lancet [Internet]. 2020 Sep 19 [cited 2022 Dec 31];396(10254):
819–29. Available from: http://www.thelancet.com/article/S0140673620318249/fulltext
16. Kristensen S, Docherty K, Jhund P, et al. Heart Failure-Heart Failure with Reduced Ejection Fraction Dapagliflozin reduces the risk of hyperkalaemia in patients with heart failure and reduced ejection fraction: a secondary analysis DAPA-HF.
17. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Vol. 42, European Heart Journal. Oxford University Press; 2021:3599–3726.
18. Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Vol. 145, Circulation. Lippincott Williams and Wilkins; 2022;E895–E1032.
19. Voors AA, Angermann CE, Teerlink JR, et al. The SGLT2 inhibitor empagliflozin in patients hospitalized for acute heart failure: a multinational randomized trial. Nat Med. 2022;28(3):568–574.
20. Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med. 2016 Jul 28;375(4):323–334.
21. Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med. 2019;380(24):2295–2306.
22. Neuen BL, Young T, Heerspink HJL, et al. SGLT2 inhibitors for the prevention of kidney failure in patients with type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol [Internet]. 2019 Nov 1 [cited 2022 Dec 31];7(11):845–854.
23. Heerspink HJL, Stefánsson B V., Correa-Rotter R, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020 Oct 8;383(15):1436–1446.
24. The EMPA-KIDNEY Collaborative Group; Herrington WG, Staplin N, et al. Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med [Internet]. 2022. [cited 2022 Dec 31]; Available from: https://pubmed.ncbi.nlm.nih.gov/36331190/
25. Vallon V, Platt KA, Cunard R, et al. SGLT2 Mediates Glucose Reabsorption in the Early Proximal Tubule. J Am Soc Nephrol [Internet]. 2011 Jan [cited 2022 Dec 31];22(1):104.
26. Kanai Y, Lee WS, You G, Brown D, Hediger MA. The human kidney low affinity Na+/glucose cotransporter SGLT2. Delineation of the major renal reabsorptive mechanism for D-glucose. J Clin Invest [Internet]. 1994 [cited 2022 Dec 31];93(1):397–404. Available from: https://pubmed.ncbi.nlm.nih.gov/8282810/
27. Hummel CS, Lu C, F Loo DD, Hirayama BA, Voss AA, Wright EM. Glucose transport by human renal Na /D-glucose cotransporters SGLT1 and SGLT2. Am J Physiol Cell Physiol [Internet]. 2011;300:14–21.
28. Hsia DS, Grove O, Cefalu WT. An update on sodium-glucose co-transporter-2 inhibitors for the treatment of diabetes mellitus. Curr Opin Endocrinol Diabetes Obes. 2017 Feb;24(1):73–79.
29. Fonseca-Correa JI, Correa-Rotter R. Sodium-Glucose Cotransporter 2 Inhibitors Mechanisms of Action: A Review. Front Med [Internet]. 2021 Dec 20 [cited 2022 Dec 31];8:777861.
30. Cowie MR, Fisher M. SGLT2 inhibitors: mechanisms of cardiovascular benefit beyond glycaemic control. Nat Rev Cardiol 2020 1712 [Internet]. 2020. [cited 2022 Dec 31];17(12):761–72. Available from: https://www.nature.com/articles/s41569-020-0406-8
31. Santos-Gallego CG, Requena-Ibanez JA, San Antonio R, et al. Empagliflozin Ameliorates Adverse Left Ventricular Remodeling in Nondiabetic Heart Failure by Enhancing Myocardial Energetics. J Am Coll Cardiol. 2019;73(15):1931–1944.
32. Braunwald E. Gliflozins in the Management of Cardiovascular Disease. N Engl J Med [Internet]. 2022 May 26 [cited 2022 Dec 31];386(21):2024–2034.
33. Fontes-Carvalho R, Santos-Ferreira D, Raz I, Marx N, Ruschitzka F, Cosentino F. Protective effects of SGLT-2 inhibitors across the cardiorenal continuum: two faces of the same coin. Eur J Prev Cardiol [Internet]. 2022. [cited 2022 Dec 31];29(9):1352–1360. Available from: https://pubmed.ncbi.nlm.nih.gov/33659986/
34. Adamson C, Docherty KF, Heerspink HJL, et al. Initial Decline (Dip) in Estimated Glomerular Filtration Rate After Initiation of Dapagliflozin in Patients With Heart Failure and Reduced Ejection Fraction: Insights From DAPA-HF. Circulation [Internet]. 2022. [cited 2022 Dec 31];146(6):438–49.
35. Perkovic V, de Zeeuw D, Mahaffey KW, et al. Canagliflozin and renal outcomes in type 2 diabetes: results from the CANVAS Program randomised clinical trials. Lancet Diabetes Endocrinol [Internet]. 2018. [cited 2022 Dec 31];6(9):691–704.
36. Mosenzon O, Wiviott SD, Cahn A, et al. Effects of dapagliflozin on development and progression of kidney disease in patients with type 2 diabetes: an analysis from the DECLARE–TIMI 58 randomised trial. Lancet Diabetes Endocrinol [Internet]. 2019. [cited 2022 Dec 31];7(8):606–617.
37. Dumann E, Menne J. SGLT2 inhibitors: What is new? Nephrologe. 2021;16(4):241–255.
38. DeFronzo RA, Norton L, Abdul-Ghani M. Renal, metabolic and cardiovascular considerations of SGLT2 inhibition. Nat Rev Nephrol. 2016;131 [Internet]. 2016. [cited 2022 Dec 18];13(1):11–26.
PRAXIS
- Vol. 112
- Ausgabe 10
- August 2023