- Fieber und Panzytopenie – nicht immer ein Fall für die Onkologie
Anamnese und Befunde
Wir berichten über einen 68-jährigen Patienten mit Fieber bis 40 °C, Nachtschweiss, Inappetenz und Nausea ohne Emesis seit 10 Tagen. Der Patient war zuvor von einem Aufenthalt in Salerno (Süditalien) zurückgekehrt. Er besuchte dort immer wieder seine Mutter. Der Patient unternahm dort keine speziellen Aktivitäten ausserhalb des Alltags, eine Exposition zu Tieren oder Insektenstiche waren nicht erinnerlich.
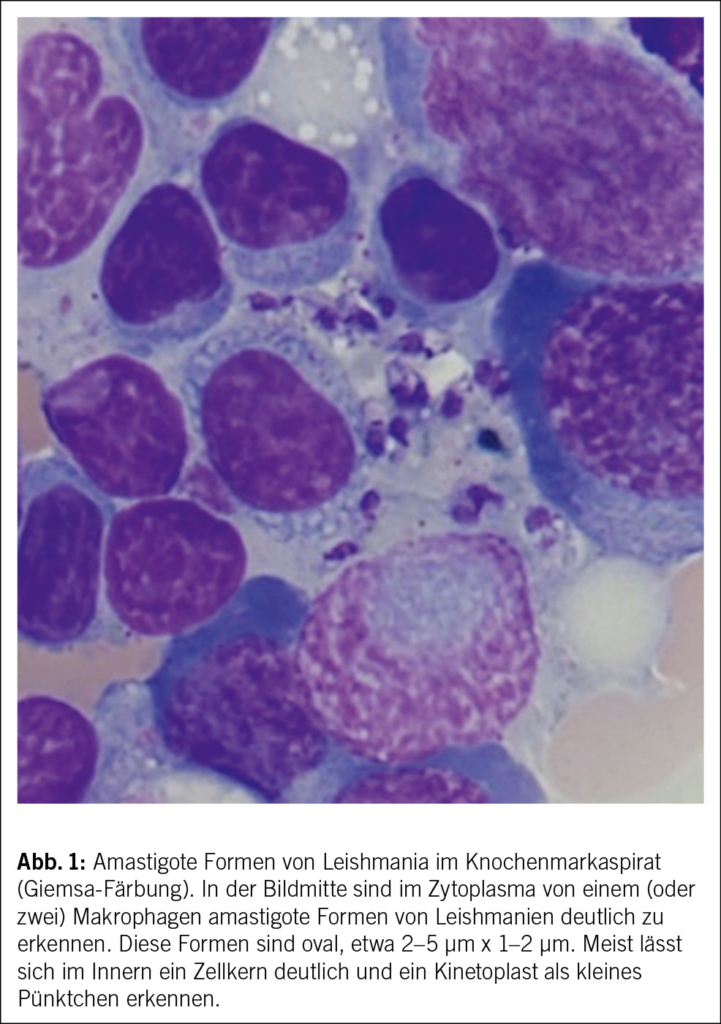
Initial zeigte sich ein kardiopulmonal stabiler Patient in reduziertem Allgemeinzustand. Klinsch präsentierte sich ein febriler Patient ohne objektivierbare kardiopulmonale oder abdominelle Auffälligkeiten. Laboranalytisch konnte eine leichte Panzytopenie mit deutlich erhöhtem CRP nachgewiesen werden (Tab. 1a). Bei persistierendem Fieber, zervikaler Lymphadenopathie und unklarem Infektfokus erfolgte eine CT des Halses/Thorax/Abdomens zur Suche nach Infektfokus, neoplasieverdächtiger Raumforderung und pathologischen Lymphknoten. Diese zeigte eine zervikale Lymphadenopathie und eine Splenomegalie ohne weitere pathologische Befunde. Bei unklarem Infektfokus erfolgte initial eine empirische antimikrobielle Therapie mit Co-Amoxicillin und Valacyclovir.
Differenzialdiagnostische Überlegungen
Fieber und Panzytopenie erfordern eine umfassende Abklärung, da sie auf bakterielle, virale oder parasitäre Infektionen, hämatologische Erkrankungen wie aplastische Anämie, Myelodysplastisches Syndrom oder Leukämie, Autoimmunerkrankungen wie systemischer Lupus erythematodes oder maligne Knochenmarkinfiltrationen hinweisen können. Auch medikamentöse Ursachen müssen differenzialdiagnostisch miteinbezogen werden.
Weitere Abklärungsschritte und Verlauf
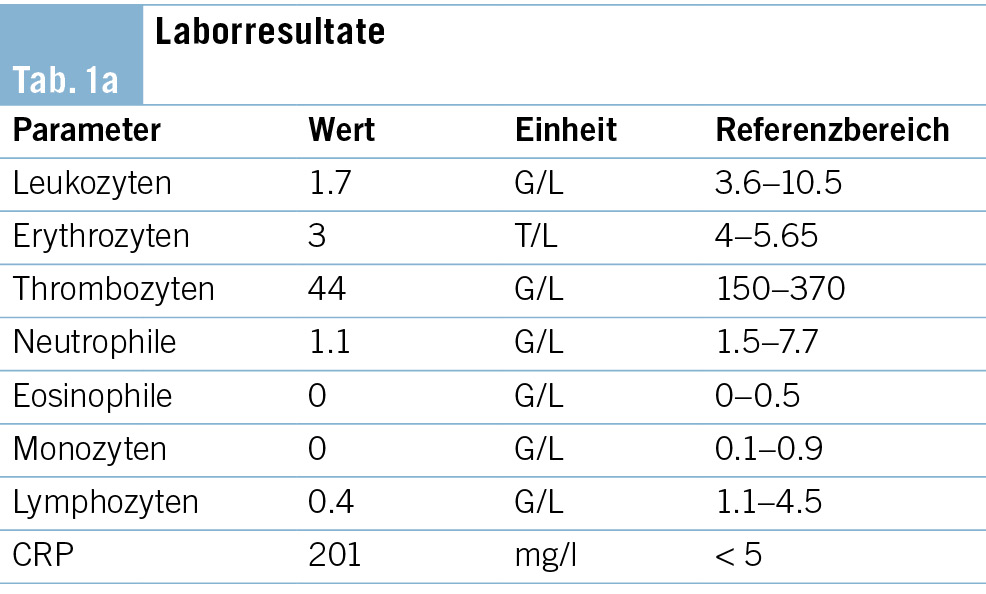
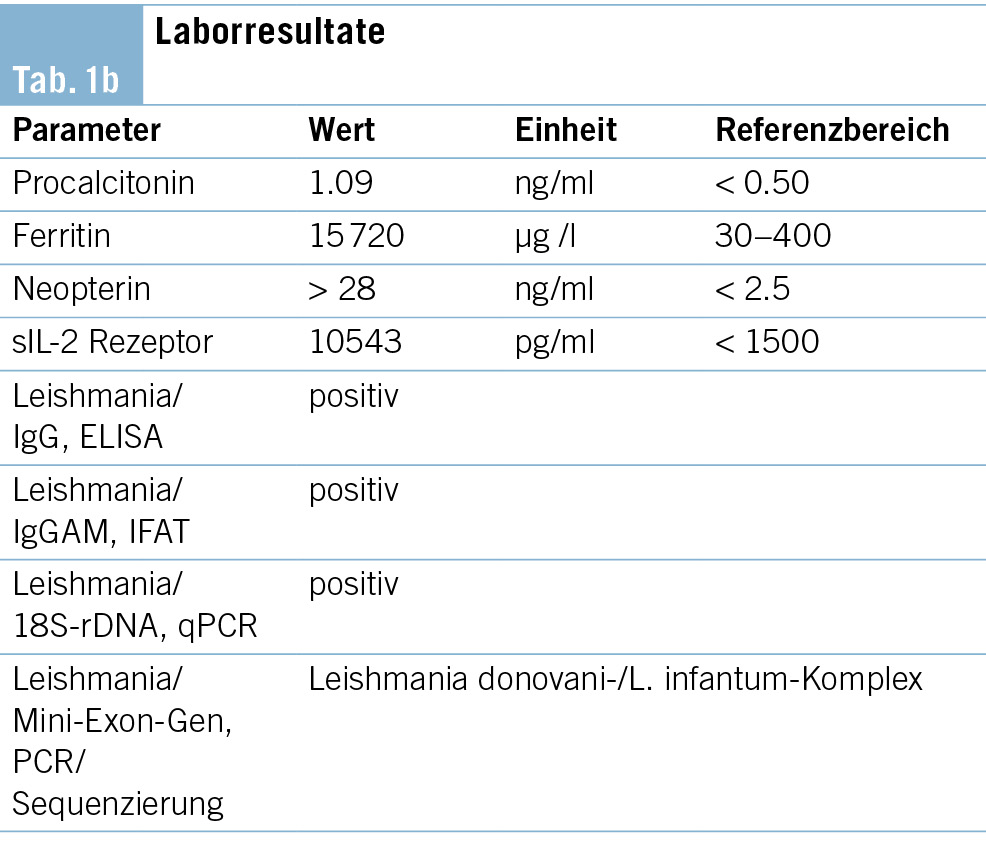
In der serologischen Diagnostik gelang ein Ausschluss von HIV, viralen Hepatitiden, CMV, EBV, der nasopharyngeale Abstrich auf SARS-CoV-2 und Influenza war negativ. In den Blutkulturen gelang kein Keimnachweis. Mittels Immunfixation konnte eine monoklonale Gammopathie ausgeschlossen werden. Im mikroskopischen Differenzial-blutbild am Eintrittstag wurden in den Monozyten keine Leishmanien beschrieben, im zur Anreicherung hergestellten «Dicken Tropfen» gelang ebenfalls kein Nachweis von Malaria oder anderen Parasiten. Im weiteren Verlauf kam es zu einer Progredienz der Panzytopenie mit laboranalytischen Zeichen einer disseminierten intravasalen Koagulopathie (DIC) (sinkende Thrombozyten und Fibrinogen, erhöhte D-Dimere) sowie einem Anstieg des CRP, Neopterins und Interleukin-2-Rezeptors (sIL-2 Rezeptor). In der erweiterten infektiologischen Diagnostik konnten HSV, Parvovirus, Rickettsien und Francisella tularensis ausgeschlossen werden. Die Leishmanien-Serologie war hingegen positiv. Zeitgleich erfolgte aufgrund der Progredienz der Panzytopenie eine Knochenmarkbiopsie 5 Tage nach Eintritt. Hier konnte kein klarer Nachweis auf einen lymphoproliferativen Prozess oder eine Plasmazell-Dyskrasie gefunden werden. Stattdessen zeigten sich phagozytierende Histiozyten mit intrazytoplasmatischen Strukturen, verdächtig auf eine Leishmaniose (Abb. 1). Die qPCR für Leishmania sp. aus Blut und Knochenmark war positiv. Die Sequenzierung des Mini-Exon-Gens identifizierte den Erreger als Vertreter des L. donovani-/L. infatum-Komplexes (Tab. 1b).
Diagnose
Bei passender Klink (Fieber, AZ-Reduktion), Epidemiologie (Aufenthalt in Salerno), Labor (Panzytopenie, Hämophagozytose, erhöhtes Neopterin), radiologischen Befunden (Splenomegalie) sowie positiver Leishmanien-Serologie und mikroskopischem und molekularem Nachweis von Leishmanien im Knochenmarkaspirat waren die Beschwerden des Patienten im Rahmen einer viszeralen Leishmaniose erklärt.
Bei erhöhtem löslichem Interleukin-2-Rezeptor (sIL-2- Rez.) und Hyperferritinämie waren zusätzlich die laboranalytischen Kriterien für ein Makrophagenaktivierungssyndrom (MAS) erfüllt.
Kommentar
Die Tropenkrankheit Leishmaniose, eine parasitäre Infektionskrankheit, stellt auch im 21. Jahrhundert weiterhin eine Herausforderung für die öffentliche Gesundheit dar. Die Leishmaniose ist besonders in Mittelamerika, West- und Südostasien sowie in Nord- und Ostafrika vertreten (1). In Europa ist die viszerale Leishmaniose (VL) eher sporadisch und hauptsächlich im Mittelmeerraum verbreitet mit Vorkommen insbesondere in Italien, Spanien und Griechenland (2). 2022 wurden der WHO aus der Schweiz 8 allochthone Fälle gemeldet (1), die Erkrankung ist allerdings nicht meldepflichtig. Bei der VL handelt es sich um eine disseminierte Form der Leishmaniose. Die Leishmaniose selbst ist eine parasitäre Infektionskrankheit ausgelöst durch Protozoen der Gattung Leishmania (3).
Bei immunkompetenten Patienten verursachen Leishmania donovani und Leishmania infantum die viszerale Form der Leishmaniose (4). Als Vektor dient die weibliche Sandmücke (Phlebotominae), die Übertragung erfolgt über ihren Stich (3). Patienten präsentieren meist Fieber, Gewichtsverlust, Diarrhoe und eine Hepatosplenomegalie. Eine Lymphadenopathie in Zusammenhang mit VL ist selten in Gebieten ausserhalb von Ostafrika und hat daher, bei Ansteckungen innerhalb Europas, meist keine klinische Relevanz (5). Laboranalytisch zeigt sich typischerweise die Reduktion einzelner Zelllinien im peripheren Blut oder eine Panzytopenie (6).
Derzeit wird davon ausgegangen, dass nach der Übertragung L. infantum und L. donovani über die Haut in Lymphknoten einwandern und von dort in Milz, Knochenmark und Leber vordringen. Überwindet der Parasit die Immunabwehr, folgt eine Anpassung der Immunantwort an die Bedürfnisse des Parasiten inklusive der Hochregulierung von Makrophagen, die Erkrankung bricht aus (3). Im Rahmen der Hochregulierung von Makrophagen kommt es zu einem Anstieg von Neopterin (7).
Das MAS ist eine akute, generalisierte Entzündungsreaktion. Ein MAS kann z. B. im Rahmen rheumatologischer Erkrankungen oder als Komplikation von Infektionen (parasitär, viral, bakteriell) auftreten (8, 9). Pathophysiologisch betrachtet liegt eine verminderte Aktivität der Killerzellen und Perforin vor. Dies führt zu einer übermässigen Aktivierung von Lymphozyten mit der Ausschüttung von INF‑γ- und Granulocyte-Macrophage-Colony-Stimulating-Factor (GM-CSF). Es kommt zu einer unkontrollierten Aktivierung und Proliferation von Makrophagen (9). Derzeit besteht noch kein internationaler Konsens bezüglich Diagnosekriterien für das MAS. Davi et al. benennen die 9 häufigsten klinischen, laboranalytischen und histopathologischen Merkmale des MAS wie folgt: fallende Thrombozytenzahl, Hyperferritinämie, Makrophagen-Hämophagozytose im Knochenmark, Transaminasenerhöhung, fallende Leukozytenzahl, Fieber > 38 °C, fallende BSG, Hypofibrinogenämie, Hypertriglyceridämie (10). Als weniger häufig wird ein Anstieg des sIL-2-Rez. genannt.
Im hier vorgestellten Fall präsentierte der Patient bei beiden Krankheitsbildern beschriebene Merkmale. Passend zur Diagnose des MAS zeigten sich eine Erhöhung des sIL-2-Rez. sowie eine Hypofibrinogenämie und Hyperferritinämie. Bei zusätzlichem Nachweis von Leishmanien im Knochenmark und Leishmania-DNA und IgG mit erhöhtem Neopterin waren aus unserer Sicht die Diagnosekriterien für sowohl MAS als auch VL erfüllt. Aus Sicht der Autoren sollte die Diagnose einer (viszeralen) Leishmaniose bei Fieber, Gewichtsverlust, Hepatosplenomegalie, Panzytopenie und Aufenthalt in einem Endemiegebiet in Betracht gezogen werden. Zur Diagnostik ist in der Schweiz eine PCR Goldstandard, die Serologie ist hauptsächlich in wenig entwickelten Ländern mit hoher Prävalenz wichtig, da Sensitivität und Spezifität mit steigender Prävalenz ebenfalls zunehmen (11). Im peripheren Blutausstrich sind nur selten Amastigoten zu sehen, weshalb dieser im Alltag zur Diagnostik einer Leishmaniose keine Relevanz hat (5).
Die Therapie der VL hängt von der Region ab, in der die Infektion erworben wurde. Derzeit ist liposomales Amphotericin B die empfohlene Erstlinientherapie basierend auf Daten verschiedener Endemiegebiete weltweit (4). Die Dosierung und Therapiedauer variieren gemäss Endemiegebiet und Immunstatus. Bei unserem Patienten erfolgte die Gabe von 3 mg/kg KG liposomales Amphotericin B an den Tagen 1–5, 14 und 21 (12). Eine Kostengutsprache zur Verschreibung von Amphotericin B, auch im ambulanten Setting, ist nicht notwendig. Gemäss der Spezialitätenliste des Bundesamts für Gesundheit darf die Erstverschreibung allerdings nur durch eine/einen Fachärzt/-in Infektiologie oder Hämatologie erfolgen (13).
Die Therapie des MAS basiert zum grössten Teil auf der hoch dosierten, intravenösen Gabe von Steroiden. Etoposide wird in der Literatur ebenfalls als Therapieoption diskutiert (14, 15). Unser Patient erhielt Steroide und Etoposide 300 mg i.v. zweimalig im Abstand von 4 Tagen. Aufgrund der Steroidtherapie erfolgte eine Pneumocystis-jirove-
cii-Prophylaxe mit Trimethoprim/Sulfamethoxazol.
In den darauffolgenden ambulanten Verlaufskontrollen zeigten sich eine stetige Besserung des Allgemeinzustands des Patienten sowie ein kontinuierlicher Abfall der Antikörper mit zudem negativer PCR. Generell wird der Behandlungserfolg anhand klinischer Verlaufskontrollen über 12 Monate überprüft. Es sollte sich eine Besserung des klinischen Bildes mit z. B. Gewichtszunahme, Rückgang der Hepatosplenomegalie und Abklingen des Fiebers zeigen. Ein Zeitfenster von 12 Monaten sollte eingehalten werden, da die meisten Rückfälle innerhalb von 6–12 Monaten auftreten (16). Der Verlauf der Serologie hat keinen prognostischen Wert und wurde in diesem Fall aus Interesse bestimmt.
Fälle wie dieser zeigen, wie schwierig die Diagnosestellung von VL und MAS, insbesondere in Kombination, ist. Speziell bei Patienten, die nicht in Endemiegebieten leben. Verzögerte Diagnosestellung und Therapie verschlechtern die Prognose bei ohnehin deutlich erhöhtem Mortalitätsrisiko beider für sich genommenen Erkrankungen.
Historie
Manuskript eingereicht. 24.09.2024
Manuskript angenommen: 04.11.2024
Stadtspital Zürich Waid
Klinik für Innere Medizin
Tièchestrasse 99, 8037 Zürich
stephanie.kirch@gmx.net
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
• Unspezifische klinische, laboranalytische und histopathologische Merkmale, Seltenheit und ähnliche Präsentation der VL und des MAS erschweren die Diagnostik.
• Eine schnellstmögliche Diagnosestellung ist der Schlüssel zu einer erfolgreichen Behandlung bei hohem Mortalitätsrisiko.
1. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years [Internet]. [cited 2024 Mar 5]. Available from: https://www.who.int/publications-detail-redirect/who-wer9840-471-487
2. Scarpini S, Dondi A, Totaro C, Biagi C, Melchionda F, Zama D, et al. Visceral Leishmaniasis: Epidemiology, Diagnosis, and Treatment Regimens in Different Geographical Areas with a Focus on Pediatrics. Microorganisms. 2022 Sep 21;10(10):1887.
3. Costa CHN, Chang KP, Costa DL, Cunha FVM. From Infection to Death: An Overview of the Pathogenesis of Visceral Leishmaniasis. Pathogens. 2023 Jul 24;12(7):969.
4. van Griensven J, Diro E. Visceral Leishmaniasis: Recent Advances in Diagnostics and Treatment Regimens. Infect Dis Clin North Am. 2019 Mar 1;33(1):79–99.
5. Caryn Bern, MD, MPH. Visceral leishmaniasis: Clinical manifestations and diagnosis. In: UpToDate [Internet]. Available from: www.uptodate.com/contents/visceral-leishmaniasis-clinical-manifestations-and-diagnosis?search
6. Veras PST, de Santana MBR, Brodskyn CI, Fraga DBM, Solcà MS, De Menezes JPB, et al. Elucidating the role played by bone marrow in visceral leishmaniasis. Front Cell Infect Microbiol. 2023 Oct 4;13:1261074.
7. Kip AE, Wasunna M, Alves F, Schellens JHM, Beijnen JH, Musa AM, et al. Macrophage Activation Marker Neopterin: A Candidate Biomarker for Treatment Response and Relapse in Visceral Leishmaniasis. Front Cell Infect Microbiol. 2018 Jun 1;8:181.
8. Mouhoub B, Bensalah M, Berhili A, Azghar A, El Malki J, El Mezgueldi I, et al. Visceral leishmaniasis associated with macrophage activation syndrome: Case report and literature review. IDCases. 2021 Jan 1;26:e01247.
9. Bojan A, Parvu A, Zsoldos IA, Torok T, Farcas AD. Macrophage activation syndrome: A diagnostic challenge (Review). Exp Ther Med. 2021 Aug;22(2):904.
10. Davì S, Consolaro A, Guseinova D, Pistorio A, Ruperto N, Martini A, et al. An International Consensus Survey of Diagnostic Criteria for Macrophage Activation Syndrome in Systemic Juvenile Idiopathic Arthritis. J Rheumatol. 2011 Apr 1;38(4):764–8.
11. John E. Bennett, Raphael Dolin, Martin J. Blaser. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 9th Edition. Vol. 1. Elsevier; 2019.
12. Neumayr, A. Antiparasitic Treatment Recommendations, a practical guide to clinical parasitology. second edition. Tredition; 2018.
13. Ambisome Limitationsänderungen 01.03.2019.pdf.
14. Reyhanoglu G, Tadi P. Etoposide. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 [cited 2024 Mar 12]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK557864/
15. Macrophage Activation Syndrome: Practice Essentials, Pathophysiology, Etiology. 2024 Jan 10 [cited 2024 Mar 9]; Available from: https://emedicine.medscape.com/article/1380671-overview?form=fpf#a7
16. Caryn Bern, MD, MPH. Viceral leishmaniasis: Treatment. In: UpToDate [Internet]. Available from: www.uptodate.com/contents/visceral-leishmaniasis-treatment?search
PRAXIS
- Vol. 114
- Ausgabe 2
- Februar 2025





