- Grundlagen zur Nachbehandlung einer Denosumab-Therapie
Welche Nachbehandlung ist nach einer Denosumab-Therapie indiziert und wann der richtige Zeitpunkt für den Beginn?
Fragestellung
Welche Nachbehandlung ist nach einer Denosumab-Therapie indiziert und wann der richtige Zeitpunkt für den Beginn?
Definition
Rebound nach Denosumab-Stopp
Übersteigerter Knochendichteverlust in der Wirbelsäule (gemessen mit der Dual-Energy X-Ray Absorptiometry [DXA]; eigentlicher Rebound) mit exponenziellem
Anstieg der Knochenmarker (CTX, P1NP; humoraler
Rebound) verbunden mit einem erhöhten Risiko für osteoporotische Wirbelkörper-/Wirbelkörperserienfrakturen (10,3 %/1,3 %).
Abklärungen (klinisch/Labor) und Hauptoutcome der Erstkonsultation
Grundwissen
Das seit 2010 in der Schweiz zur Therapie der Osteoporose zugelassene Denosumab (Dmab) ist ein humaner, monoklonaler Antikörper (IgG2), der den RANKL (Receptor Activator of NF-κB Ligand) bindet, so die Aktivierung des transmembranen Rezeptors (RANK) verhindert, damit die Differenzierung der Osteoklastenvorläuferzellen und die Osteoklastenfunktion hemmt und deren Überleben beeinflusst.
Drei Tage nach Verabreichung von Dmab reduziert sich der Knochenresorptionsmarker Serumtyp-1-C-Telopeptid (CTX) um 85 %, als Referenz für die Hemmung der Osteoklastenaktivität.
In einer Nachanalyse der Dmab-Zulassungsstudie zeigte sich schon 2013, dass sich 9,6 Monate nach der letzten Dmab-Verabreichung (3-jährige Dmab-Therapie; 2–5 Dmab-Dosen) die Frakturrate der Interventionsgruppe der Kontrollgruppe annähert (7 % Interventionsgruppe, 9 % Kontrollgruppe) [1]. In einer Nachanalyse der verlängerten Dmab-Zulassungsstudie 2018 wurde offensichtlich, dass zwölf Monate nach einer 2-jährigen Dmab-Therapie die Knochendichte wieder auf das Niveau von vor der Behandlung zurückfällt (Definition des Rebounds).
Der Knochenresorptionsmarker CTX steigt nach der Dmab-Therapie, maximal im Durchschnitt nach 12 Monaten (Definition des humoralen Rebounds). Die wichtigste Erkenntnis war, dass 1,3 % der Interventionsgruppe vier oder mehr Wirbelkörperfrakturen erlitten, im Vergleich zur Kontrollgruppe mit 0,4 %, (Beobachtungsintervall 2,4–6 Monate!) [2].
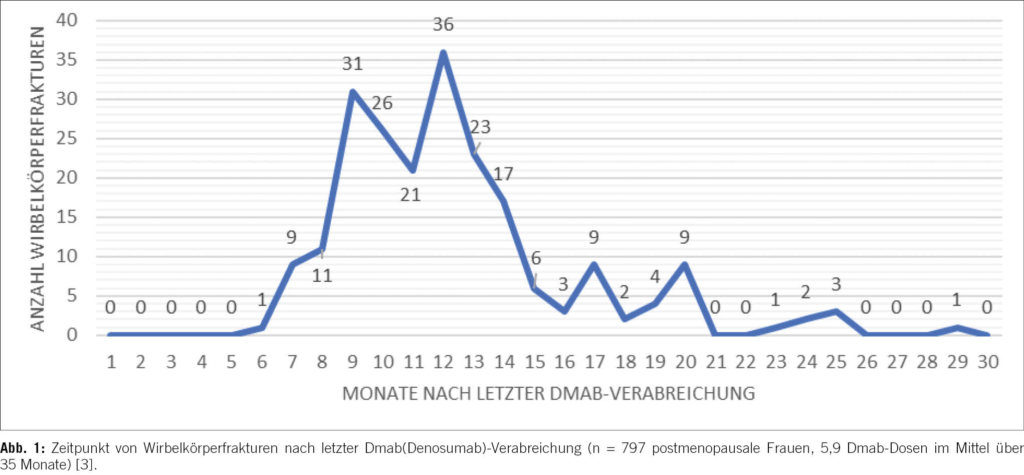
In einer wegweisenden Schweizer Studie wurden nahezu 800 postmenopausale Patient_innen auf vertebrale Frakturen im Zusammenhang mit einer Dmab-Therapie untersucht. Vor Dmab-Therapie erlitten 16,4 %, während 2,2 % (35 Monate) und danach 10,3 % (27,5 Monate) eine Wirbelkörperfraktur. Ernüchternd war die Erkenntnis, dass erste Wirbelkörperfrakturen bereits sechs Monate nach letzter Dmab-Verabreichung auftraten, mit einer maximalen Inzidenz zwischen dem 7. und 15. Monat. Das erhöhte Risiko für vertebrale Frakturen persistierte insgesamt 25–29 Monate (Abb. 1) [3].
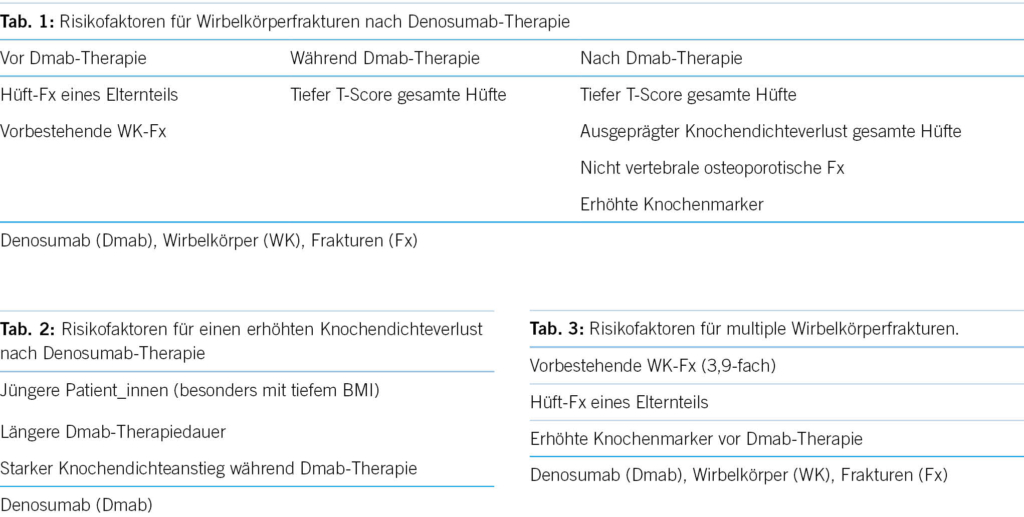
Risikofaktoren für Wirbelkörperfrakturen nach Dmab-Therapie waren vor Dmab-Therapiestart: Hüftfrakturen eines Elternteils und vorbestehende Wirbelkörperfrakturen. Risikofaktor für Wirbelkörperfrakturen nach Dmab Therapiestopp während (fett) und nach (fett) Dmab-Therapie war: ein tiefer T-Score der totalen Hüfte. Risikofaktoren für Wirbelkörperfrakturen nach Dmab-Therapiestopp nach (fett) Dmab-Therapie waren: Ausgeprägter Knochendichteverlust im Bereich der totalen Hüfte, nicht vertebrale osteoporotische Frakturen (NVF) (6-fach) und erhöhte Knochenmarker, Letztere auch für NVF und multiple vertebrale Frakturen (MVF) (Tabelle 1) [3].
Eine aktuelle Schweizer Studie untersuchte den Knochendichteverlust nach 3–6-jähriger Dmab-Therapie. Einen höheren Knochendichteverlust zeigten jüngere Patient_innen (besonders mit tiefem BMI), eine längere Dmab-Therapiedauer und einem starken Anstieg der Knochendichte während der Dmab-Therapie (Tabelle 2) [4].
Wichtigster Risikofaktor für multiple Wirbelkörperfrakturen (MVF) waren vorbestehende Wirbelkörperfrakturen (3,9-faches Risiko). Ebenfalls ein erhöhtes Risiko für MVF zeigten Hüftfrakturen eines Elternteils und erhöhte Knochenmarker vor Dmab-Therapie (Tabelle 3) [2, 3, 4].
Um das Risiko für Wirbelkörperfrakturen nach Stopp einer Dmab-Therapie einschätzen zu können, müssen die Knochendichte (vor, während und nach Dmab-Therapie), Wirbelkörperfrakturen [vor (und während) Dmab-Therapie] und Hüftfrakturen eines Elternteils bekannt sein. Essenziell ist auch das Wissen über die Dmab-Therapiedauer. Von Vorteil ist, wenn die Knochenmarker (CTX , P1NP) vor Absetzen der Dmab-Therapie bestimmt werden.
Weiteres Vorgehen und Behandlung
Zahlreiche Studien untersuchten die Nachbehandlung einer Dmab-Therapie mit unterschiedlichen Bisphosphonaten. Die besten Ergebnisse zeigte die Anwendung von Zoledronat (ZOL) als potentestes Bisphosphonat.
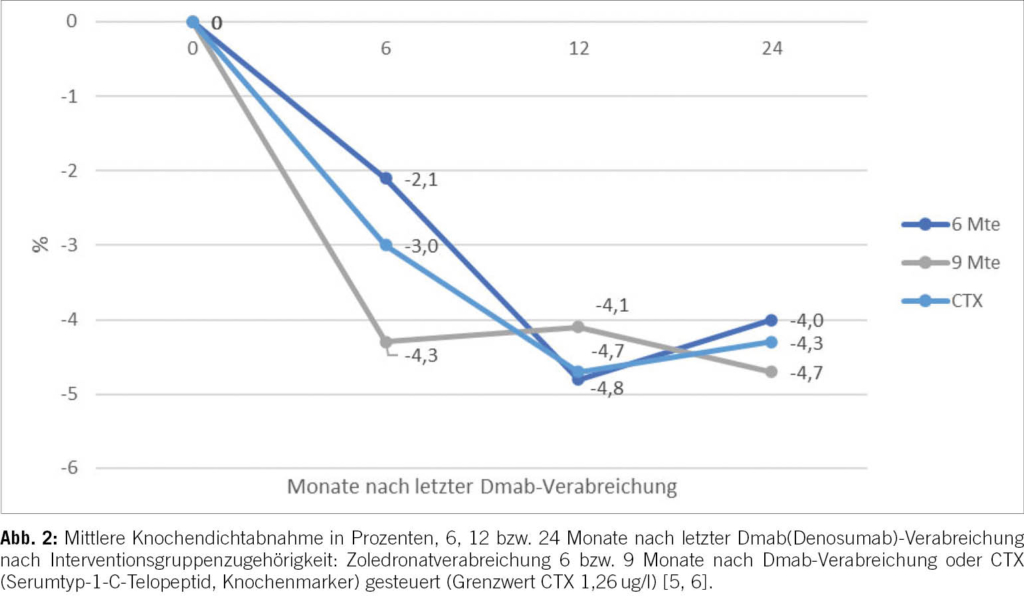
Entscheidend für die Nachbehandlung von Dmab-Therapien zur Erhaltung der Knochendichte und zur Frakturprävention ist das Zeitintervall zwischen dem Stopp der Dmab-Therapie und dem Beginn der Nachbehandlung. Als Intervall für die Anschlusstherapie mit einer einzigen ZOL-Infusion wurden sechs Monate mit neun Monaten verglichen; eine dritte Gruppe erhielt die ZOL-Infusion entsprechend der Ausprägung des humeralen Rebounds (CTX > 1,26 ug/l). Zwölf (und 24) Monate nach der ersten ZOL-Infusion zeigte die Knochendichte der LWS einen signifikanten Verlust bei allen drei Gruppen, ohne signifikanten Gruppenunterschied [–4,8 % (–4,0 %) (6 Mte); –4,1 % (–4,1 %) (9 Mte); –4,7 % (–4,3 %) (CTX gesteuert)] (Abb. 2) [5, 6].
Zwei Patient_innen der ZOL-9-Mte-Gruppe erlitten eine Wirbelkörperfraktur im ersten Jahr, konsistent zur Evidenz, dass bereits sechs Monate nach der letzten Dmab-Verabreichung ein Risiko für Wirbelkörperfrakturen besteht [3]. Zwei Patient_innen erlitten eine nicht vertebrale Fraktur im zweiten Beobachtungsjahr (hochenergetisch). 47 % (27/58) der Patient_innen mussten, gemäss Studienprotokoll, aufgrund eines Knochendichteverlustes von über 5 % erneut mit ZOL behandelt werden [14 (6 Mte), 6 (9 Mte) und 7 (CTX gesteuert)] [5, 6].
Essenziell ist die Berücksichtigung der Dmab-Therapiedauer. Bisherige Untersuchungen zeigten, dass mit zunehmender Länge dieser der Knochendichteverlust und das Risiko für Wirbelkörperfrakturen nach der Dmab-Therapie steigen [3, 4, 7].
Mit einer ZOL-Infusion sechs Monate nach der letzten Dmab-Verabreichung kann die Knochendichte im Bereich der Wirbelsäule bis zu einer Dmab-Therapiedauer von drei Jahren konserviert werden. Nach einer Dmab-Therapiedauer von über drei Jahren ist trotz einer ZOL-Infusion ein Knochendichteverlust im Bereich der Wirbelsäule von 4–7 % zu erwarten [6, 8].
Schlussfolgerungen für die Nachbehandlung von Denosumab
Dmab-Therapien (> 2 Dosen) benötigen eine Nachbehandlung mit einem Bisphosphonat. Zu empfehlen ist die Therapie mit Zolederonat (CAVE Niereninsuffizienz). Die Nachbehandlung muss spätestens sechs Monate nach der letzten Dmab-Verabreichung beginnen, bei Hochrisikopatient_innen mit vorbestehenden Wirbelkörperfrakturen sind fünf Monate zu empfehlen. Nach einer Dmab-Therapiedauer über drei Jahre (> 6 Dosen) ist die Knochendichte im Bereich der Wirbelsäule mit einer ZOL-Infusion nicht zu erhalten, wahrscheinlich können damit aber Wirbelkörperfrakturen weitgehend verhindert werden.
Zur Überwachung der Nachbehandlung wird die Bestimmung der Knochenmarker (3–6 monatlich, bis zum
30. Monat nach letzer Dmab Dosis) und eine Knochen-dichtemessung (12 Monate nach letzer Dmab Dosis) über einen Zeitraum von 24 bis 30 Monaten nach Dmab-Therapie empfohlen. Die Grenzwerte (Knochenmarkeranstieg, Knochendichteabfall) als Basis für weitere ZOL-Infusionen sind Erfahrungswerte aus der osteologischen Praxis; aus diesem Grund ist eine enge Zusammenarbeit mit erfahrenen Osteoporosespezialist_innen zu empfehlen, insbesondere bei Risikopatient_innen (Abb. 3).

Zentrum für Rheuma- und Knochenerkrankungen
Klinik Hirslanden
Bellariastrasse 38
8038 Zürich
soser@rheumazentrum.ch
Es bestehen keine Interessenskonflikte.
Historie
Manuskript eingereicht: 26.01.2023
Nach Revision angenommen: 20.02.2023
ORCID
Sven Oser
https://orcid.org/0000-0002-3487-6444
Dies ist eine interdisziplinäre und interprofessionelle Guideline die durch Vertreter mehrerer Institutionen entwickelt wurde. Sie wurde für «Praxis» zusätzlich einem
externen Reviewing unterzogen.
1. Brown JP, Roux C, Törring O, et al. Discontinuation of denosumab and associated fracture incidence: analysis from the Fracture Reduction Evaluation of Denosumab in Osteoporosis Every 6 Months (FREEDOM) trial. J Bone Miner Res Off J Am Soc Bone Miner Res. 2013;28(4):746–752.
2. Cummings SR, Ferrari S, Eastell R, et al. Vertebral Fractures After Discontinuation of Denosumab: A Post Hoc Analysis of the Randomized Placebo-Controlled FREEDOM Trial and Its Extension. J Bone Miner Res Off J Am Soc Bone Miner Res. 2018;33(2):190–198.
3. Burckhardt P, Faouzi M, Buclin T, Lamy O, The Swiss Denosumab Study Group. Fractures After Denosumab Discontinuation: A Retrospective Study of 797 Cases. J Bone Miner Res Off J Am Soc Bone Miner Res. 2021;36(9):1717–1728.
4. Everts-Graber J, Reichenbach S, Gahl B, Ziswiler HR, Studer U, Lehmann T. Risk factors for vertebral fractures and bone loss after denosumab discontinuation: A real-world observational study. Bone. 2021;144:115830.
5. Sølling AS, Harsløf T, Langdahl B. Treatment with Zoledronate Subsequent to Denosumab in Osteoporosis: a Randomized Trial. J Bone Miner Res Off J Am Soc Bone Miner Res. 2020;35(10):1858–1870.
6. Sølling AS, Harsløf T, Langdahl B. Treatment With Zoledronate Subsequent to Denosumab in Osteoporosis: A 2-Year Randomized Study. J Bone Miner Res Off J Am Soc Bone Miner Res. 2021;36(7):1245–1254.
7. Popp AW, Varathan N, Buffat H, Senn C, Perrelet R, Lippuner K. Bone Mineral Density Changes After 1 Year of Denosumab Discontinuation in Postmenopausal Women with Long-Term Denosumab Treatment for Osteoporosis. Calcif Tissue Int. 2018;103(1):50–54.
8. Makras P, Appelman-Dijkstra NM, et al. The Duration of Denosumab Treatment and the Efficacy of Zoledronate to Preserve Bone Mineral Density After Its Discontinuation. J Clin Endocrinol Metab. 2021;106(10):e4155–e4162.
PRAXIS
- Vol. 112
- Ausgabe 9
- Juli 2023