- Helicobacter pylori
Die Guidelines zu Helicobacter pylori (HP) haben stark geändert. HP soll immer als persistierende und nicht als vorübergehende Infektion gewertet werden. Bei einem positiven HP-Test soll immer therapiert werden, um Komplikationen wie Magen- bzw. Duodenalulzera und das Magenkarzinom zu verhindern. Die HP-Prävalenz nimmt seit vielen Jahren ab, bleibt aber bei Immigrant/-innen aus vielen Ländern hoch. Weil sich die Resistenzlage deutlich verschlechtert hat, empfehlen wir schon vor Erstlinientherapie immer eine Antibiotikaresistenztestung.
Schlüsselwörter: Helicobacter pylori, Magenulkus, Duodenalulkus, Magenkarzinom, Antibiotikaresistenz, Eradikationstherapie, Screening
Einleitung
Helicobacter pylori (HP) besiedelt den Magen und Zwölffingerdarm bei weltweit knapp der Hälfte der Menschen (1–3). Lange wurde angenommen, dass Ulzera primär säurebedingt entstehen. Die Entdeckung, dass HP eine Ulkusursache sein kann, führte im Jahr 2005 zum Nobelpreis. HP verläuft normalerweise asymptomatisch, aber 10–15 % der HP-Infizierten entwickeln in ihrem Leben ein Magen- oder Duodenalulkus, und 1 % (regional bis 3–5 %) entwickelt ein Magenkarzinom (4, 5).
Die Haltung gegenüber HP hat sich in letzter Zeit gewandelt. Neu ist HP – mit oder ohne Symptome – immer eine Infektionskrankheit (6). Konkret: Niemand soll mit HP besiedelt sein, und wir sollen nur auf HP testen, wenn wir auch bereit sind, eine Eradikationstherapie zu beginnen. Es sprechen aber auch wichtige Argumente für Zurückhaltung bei der HP-Diagnostik, v.a. bei hierzulande aufgewachsenen Personen: Über die letzten Jahrzehnte hat HP als Ursache von GI-Ulzera deutlich abgenommen (7), Antibiotikaresistenzen haben bei HP zugenommen, und die aktuell empfohlene Therapie mit Pylera® ist mühsam.
Mit diesem Artikel möchten wir den Hausärzt/-innen eine aktuelle, praktische Übersicht zu HP bei Erwachsenen bieten. In Tabelle 1 fassen wir die wichtigsten Merkpunkte zu HP zusammen, und es gibt empfehlenswerte Schweizer (8, 9), deutsche (10) und internationale (6, 11, 12) Guidelines und Übersichtsartikel (13, 14).

Epidemiologie
Wie wird HP übertragen?
Offenbar meist in den ersten Lebensjahren (15, 16), vermutlich am ehesten oral, von Mensch zu Mensch (10, 17, 18), und zwar via Speichel, Erbrochenem und Stuhl (19).
insbesondere Mutter, auf das Kind) und ausserhalb auftreten (z. B. Kindergarten, Schule) (1, 17, 19–24). In Ländern mit reduzierten Hygienestandards auch über Trinkwasser und Nahrungsmittel (19, 25).
Wie viele Personen sind von HP betroffen?
Knapp die Hälfte der Weltbevölkerung (1–3, 26). Die Prävalenz variiert von Land zu Land stark. Sie ist aber in westlichen Industrieländern klar rückläufig und stagniert in den Entwicklungs- und Schwellenländern (2, 26). So sank die globale Prävalenz bei Erwachsenen zwischen 2014 und 2020 von 50–55 % auf 43 % (14). Die Datenlage hierzulande ist beschränkt, denn HP ist nicht meldepflichtig (27) und wird z. B. im Sentinella-Meldesystem nicht erfasst (28). In einer Metaanalyse wurde die Prävalenz in der Schweiz 2017 auf knapp 20 % geschätzt. Dies ist im internationalen Vergleich sehr tief (Deutschland, UK, USA: ca. 35 %; Italien, Spanien, Albanien, Kroatien: über 50 % [2]; Lateinamerika: über 60 %; Portugal, Rumänien, Türkei, Afrika: über 70 % [29)]), entspricht schweizweit aber >1.5 Millionen Infizierten (2).
Hängt die Prävalenz vom sozioökonomischen Status ab?
Weltweit: ja (2, 12, 26, 30–33). Die HP-Prävalenz ist in kinderreichen Familien und bei engen Wohnverhältnissen höher (29, 31). Tiefere Prävalenz mit besserer Hygiene im Haushalt, Zugang zu sauberem Trinkwasser, adäquater Abwasseraufbereitung (26, 34) und höherem Bildungsniveau (korreliert mit besserer Hygiene) (18, 26, 31–33).
Haben Immigrant/-innen mehr HP als die Einheimischen?
Ja, ausserhalb der Schweiz Geborene waren mehr als doppelt so oft HP-positiv (35) als Einheimische (19 % vs. 4 % der Kinder [36]; 30 % vs. 7 % der Adoleszenten [37]; 27 % vs. 12 % der Erwachsenen) (35). Auch Asylsuchende in den USA und Australien waren deutlich häufiger HP-positiv als Einheimische (29, 38, 39).
Kann ich HP bei einer Tropenreise kriegen?
Vorher-Nachher-Untersuchungen zeigen bei Tropenreisenden sowohl HP-Positivierungen als auch -Negativierungen, und dies bei Rucksackreisenden (durchschnittlich 6 Monate unterwegs) (40) oder langen beruflichen Aufenthalten (7–16 Jahre) (41–43). Anders gesagt, Reisende infizierten sich nicht eindeutig öfter mit HP als die Zuhausegebliebenen, allenfalls wegen eines Anti-HP-Effekts von Malariamedikamenten oder auf der Reise eingenommenen Antibiotika (39, 40).
Gibt es nosokomiale HP-Übertragungen?
Ja, HP kann über Endoskope übertragen werden (44); offenbar könnten sich 2–3 von 1000 Patienten so anstecken (45). Eine Guidelines-konforme Desinfektion (46, 47) minimiert Keimübertragungen (48, 49).
Haben Gastroenterologinnen mehr HP als der Durchschnitt?
Gemäss meist serologischen Studien sind endoskopisch tätige Kolleginnen öfter HP-positiv (50–52). Für das Gesundheitspersonal ausserhalb der Gastroenterologie ist die Datenlage uneinheitlich (51, 53, 54).
Prophylaxe
Gibt es eine anerkannte HP-Prävention? Kommt bald eine Impfung?
Nein, es gibt keine empfohlenen Verhaltensstrategien, um HP-Infektionen im Alltag zu verhindern (10) und noch keine Impfstoffe (55), aber mehrere sind in Entwicklung (56, 57). Mit den zunehmenden Antibiotikaresistenzen ist das Interesse an einer Impfung deutlich gestiegen (58).
Welchen Einfluss hat die Ernährung?
Eine unausgewogene Ernährung (viel Kohlenhydrate, Fett, Salz, rotes verarbeitetes Fleisch) soll das HP-Infektionsrisiko erhöhen (59–63). Andere Lebensmittel könnten allenfalls vor HP schützen (64): Honig, Schwarz- oder Grüntee (65) und mehrfach ungesättigte Fettsäuren (z. B. pflanzliche Öle und Fisch) (64, 66). Rauchen und Kaffee haben keinen eindeutigen Einfluss auf die HP-Infektionsrate, und der Effekt von Alkohol bleibt unklar (67–69).
Klinik
Wie oft verläuft eine HP-Infektion asymptomatisch?
In ca. 85 % der Fälle (70, 71). Trotzdem: HP gilt heute immer als Pathogen und verursacht immer eine chronische Gastritis – unabhängig der Symptome (6, 72).
Bei funktionell scheinender Dyspepsie: Wie oft wird HP gefunden?
Dyspepsie ist ein häufiges Symptom in der Praxis. Falls es wegen Dyspepsie zur oberen GI-Endoskopie kommt, ist das Ergebnis in 90 % komplett normal, bei etwa 6–7 % wird ein Magen- oder Duodenalulkus gefunden und bei weniger als 0.4 % ein Karzinom (73). HP wird weltweit nur bei durchschnittlich etwa 5 % der dyspeptischen Patientinnen gefunden (74).
Wie häufig sind Magen- und Duodenalulzera? Wie häufig ist HP die Ursache?
Die Lebenszeitprävalenz beträgt 5–10 % (4, 5). Duodenalulzera kommen leicht häufiger vor als Magenulzera (7, 75, 76). Spannend: Die HP-Nachweisrate hat in den USA in den letzten 20–30 Jahren deutlich abgenommen. Waren damals 60–80 % der Magenulzera und über 90 % der Duodenalulzera HP-positiv, so sind es heute um die 14 % bzw. 21 % (7). Für die Schweiz liegen keine vergleichbaren Untersuchungen vor.
Bei HP-negativen Ulzera: Was ist die Ursache?
Regelmässiger NSAR-Gebrauch ist nach HP die zweithäufigste Ursache und erhöht zudem die Ulkuswahrscheinlichkeit bei HP-positiven Personen (77). Auch (Kardio-) Acetylsalicylsäure könnte – offenbar nur bei bestehender HP-Infektion – das Ulkusrisiko erhöhen (78, 79). Weitere Risikofaktoren sind, unabhängig von HP und NSAR, das Alter >60 und schwere Begleiterkrankungen wie Leberzirrhose und schwere psychische Belastungen, bedingt z. B. durch Naturkatastrophen oder Krieg (10, 80–83).
Erhöht HP die Mortalität?
In einer grossen US-Studie offenbar nicht (84). Blutungen, Perforationen, Pylorusobstruktionen und Magenkrebs sind zwar bekannte Komplikationen von HP (4, 85), aber Todesfälle sind insgesamt selten.
Kann HP Krebs verursachen?
Ja, Magenkrebs ist eine häufige und oft tödlich verlaufende Krebsart, die zu einem grossen Teil auf eine infektiöse Ursache (HP) zurückzuführen ist – wie Gebärmutterhalskrebs (HPV) und Leberzellkrebs (chronische Virushepatitis) (Tab. 2) (84). 75–90 % aller Magenkarzinome entstehen im Zusammenhang mit einer HP-Infektion (9, 86). Zudem scheint eine genetische Prädisposition zum Magenkrebsrisiko grösser als bis vor wenigen Jahren angenommen (87–90). Die WHO stuft HP als karzinogen ein (91–92). Andere onkologische Assoziationen von HP sind: das MALT-Lymphom des Magens (6, 8, 10, 93) (>90 % sind HP-positiv) (94) und möglicherweise gewisse Kolonneoplasien (adenomatöse Polypen, villöse Polypen, Adenokarzinom) (95).

Verursacht HP Refluxösophagitis?
Die Daten sind nicht eindeutig; eher senkt HP das Risiko einer Refluxösophagitis und den damit assoziierten Barrett-Ösophagus (96–98). Mögliche Erklärung: Die wegen HP entzündete Magenschleimhaut produziert weniger Magensäure (97, 99, 100). Folglich könnte eine HP-Eradikationstherapie das Risiko einer Refluxösophagitis sogar erhöhen (101–103).
Gibt es weitere günstige Assoziationen mit HP?
Ja, möglicherweise tieferes Risiko für Zöliakie (104–106), M. Crohn (107, 108) und Ösophagus-Ca. Bei der eosinophilen Ösophagitis sind die Daten nicht eindeutig (109, 110).
Verursacht HP extraintestinale Probleme?
Es gibt Berichte zu zahlreichen positiven und negativen Assoziationen von HP und allen möglichen Krankheiten (6, 111). Gemäss den Guidelines sind diese Zusammenhänge nicht stark oder eindeutig genug, um kausal zu sein (6, 10). Beispiele: Schlaganfälle (6, 84, 112), koronare Herzkrankheit (6, 113), Migräne (6, 114, 115), neurodegenerative Erkrankungen (6, 10), Asthma (111, 116), Diabetes/Insulinresistenz (6, 117–119) und Adipositas (117, 120).
Soll ich bei Vitamin-B12-Mangel an HP denken?
Die Datenlage ist unklar (6, 121, 122).
Diagnostik
Wen soll ich auf HP testen?
Die etablierten Indikationen sind in Abb. 1 aufgeführt (6, 8, 10, 123).
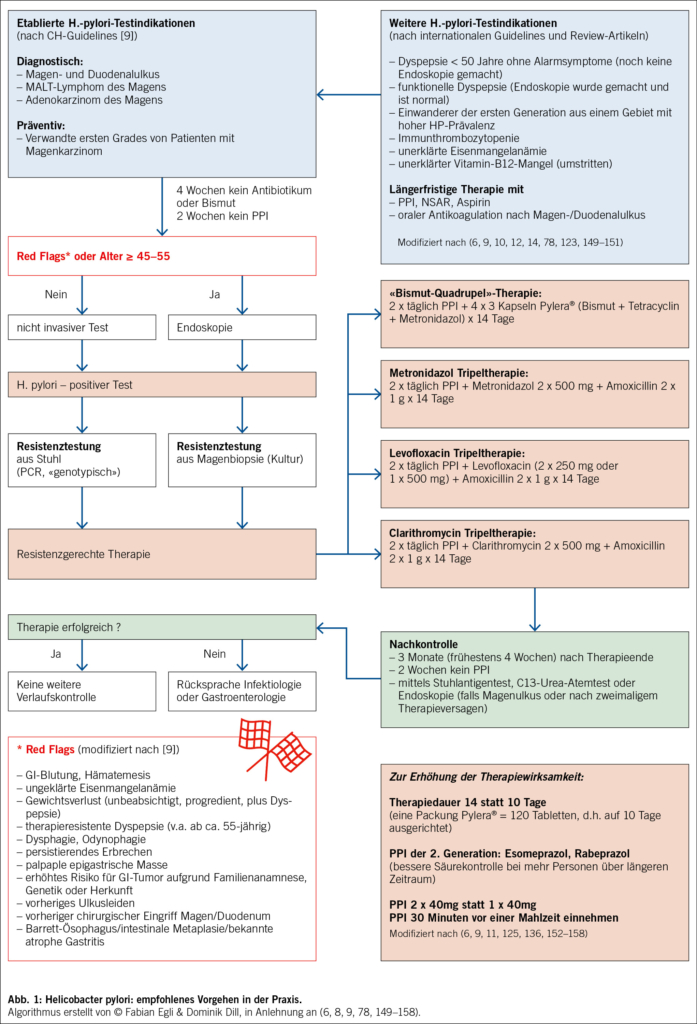
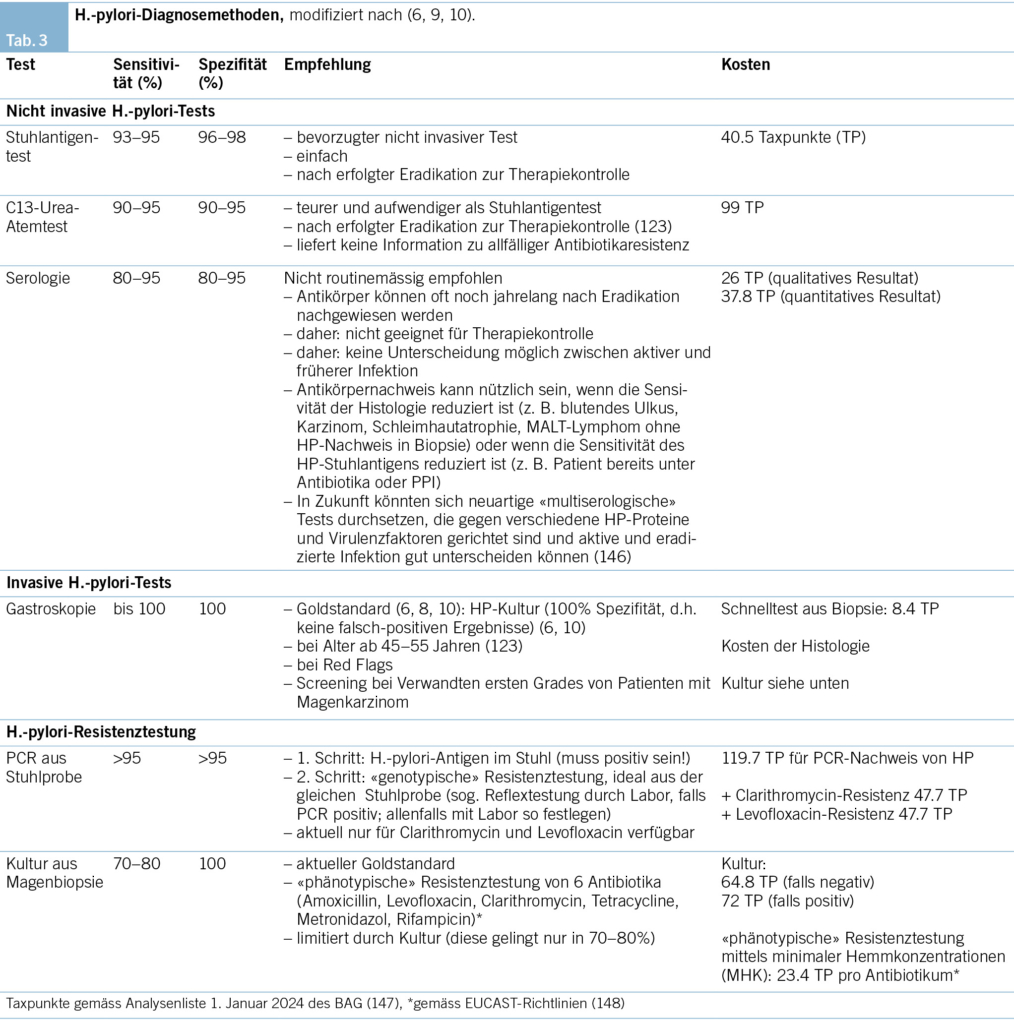
Welche Diagnosemethoden gibt es für HP?
Siehe Tabelle 3. Die endoskopische («invasive») Abklärung mit Biopsie aus der Magenschleimhaut ist der Goldstandard. Die nicht invasiven Tests können ohne Endoskopie gemacht werden, sie sind kostengünstiger, aber weniger präzise als die Histologie. Wichtig: Antibiotika 4 Wochen und Protonenpumpeninhibitoren (PPI) 2 Wochen vorher absetzen (9).
Welche Patienten soll ich zur invasiven Abklärung schicken?
Ältere Patienten (ab ca. 45–55 Jahren) (6, 8–10, 123), bei Red Flags (Abb. 1) (9) und bei Änderung von bereits vorhandenen Beschwerden (9, 123). Alternativ: C13-Urea-Atemtest. Die Serologie wird nicht empfohlen, denn sie kann nicht zwischen aktiver und abgelaufener Infektion unterscheiden (6, 9, 10, 123).
Ich habe einen Patienten mit funktioneller Dyspepsie. Soll ich ihn auf HP testen?
Entsprechend der tiefen (ca. 5 %) HP-Prävalenz bei Patienten mit Dyspepsie (74) empfehlen die Schweizer Guidelines die HP-Testung nur, falls Alarmzeichen vorhanden sind. Die internationalen Guidelines empfehlen bei Dyspepsie immer die HP-Testung, denn: ohne HP-Ausschluss keine Diagnose «funktionelle» Dyspepsie (6). Selbst wenn die HP-Testung positiv ausfiele, betonen die Schweizer Guidelines den bescheidenen Nutzen der HP-Eradikation (8, 9). Eine kürzliche Metaanalyse kommt allerdings auf eine sehr günstige «number needed to treat» von 4.5 und 14 Patientinnen bzgl. Symptomlinderung bzw. -heilung (124).
Ich habe eine Patientin mit Refluxbeschwerden. Soll ich sie auf HP testen?
Nein, die Guidelines empfehlen dies nicht (10, 12) bzw. äussern sich nicht dazu (9, 125, 126).
Wann ist 2025 eine HP-Resistenztestung indiziert?
Die Resistenztestung erfolgt entweder «phänotypisch» (Kultur aus Magenbiopsie; gelingt in ca. 70 %) oder «genotypisch» (via PCR aus Stuhlprobe; Tab. 3). Die Schweizer Guidelines «bevorzugen» schon heute immer die HP-Resistenztestung (8, 9) – die deutschen Leitlinien empfehlen das noch nicht (10). Resistenztestung spätestens also, wenn die Erstlinientherapie nicht erfolgreich ist, wenn schon einmal antibiotisch gegen HP behandelt wurde oder die Patientin aus einem Gebiet mit hohen HP-Resistenzraten kommt (Süd-, Osteuropa, Asien) (Abb. 1) (8, 10). Eine Resistenztestung aus einer Stuhlprobe ist immer möglich!
Bei welchen asymptomatischen Personen ist ein (invasives) HP-Screening sinnvoll?
Bei Personen ab 40 Jahren mit erhöhtem Risiko für ein Magenkarzinom (positive Familienanamnese bei Verwandten ersten Grades, Patientinnen mit fortgeschrittener atropher Gastritis, Patienten mit früheren Magenneoplasien) (6, 8, 10, 127). Ein generelles HP-Screening von asymptomatischen Personen wird in der Schweiz nicht empfohlen (8), in den deutschen Leitlinien hingegen seit 2021 schon, z. B. im Alter 50 im Rahmen der Kolonkarzinomvorsorge (9). Am sinnvollsten schiene ein Screening bei Immigrantinnen aus Magenkarzinom-Hochrisikoregionen (Osteuropa, Asien, Mittel- und Südamerika) (6, 9).
Soll ich Risikopersonen für ein Magenkarzinom < 40 auch screenen?
Ja. Ein nicht invasiver Test reicht, weil bis Alter 40 praktisch nie ein HP-assoziiertes Magenkarzinom auftritt (10).
Soll ich Angehörige von Patienten mit HP auch auf HP-testen?
Explizite Testempfehlungen liegen nicht vor (6, 8, 10–12). Innerhalb einer Familie kann HP gehäuft auftreten, aufgrund der Genetik (ähnliche Empfänglichkeit) oder gemeinsamer Expositionsquellen/Umweltfaktoren (19, 24, 128).
Eine Patientin mit HP-positivem Duodenalulkus ist an einem natürlichen, mikrobiom-schonenden Lebensstil interessiert. Sie möchte keine Antibiotika zur HP-Eradikation einnehmen. Was kann ich ihr empfehlen?
Der Evidenzgrad zu Probiotika ist gering. Eine anerkannte komplementärmedizinische Eradikationstherapie existiert nicht (129–131).
Therapie und Verlauf
Sind Spontanremissionen möglich?
Bei Kindern: offenbar ja (ca. 15–16 % in 2 kleinen Studien [15, 132]). Bei Erwachsenen: selten (10) (knapp 3 % der Fälle [133, 134]).
Welche HP-Therapie wird 2025 bevorzugt?
Siehe Abb. 1. Zunehmende Antibiotikaresistenzen, v.a. gegenüber Makroliden wie Clarithromycin, sind der Hauptgrund für erfolglose antibiotische Tripeltherapien. Daher ist das Ziel eine möglichst hohe HP-Eradikationsrate schon bei der ersten Therapie, um weitere Resistenzen zu verhindern (8, 10, 11). Wir empfehlen nicht mehr empirisch zu behandeln (8–10). Entsprechend den Schweizer Guidelines empfehlen wir eine resistenzgerechte Erstlinientherapie, über neu 14 statt wie bisher 10 Tage. Falls keine resistenzgerechte Therapie erfolgt, empfehlen wir Pylera® für 14 Tage.
Wie gut wird Pylera® vertragen?
Pylera® beinhaltet die tägliche Einnahme von 12 Tabletten und hat eine hohe Rate von Nebenwirkungen, v.a. Übelkeit, Erbrechen. Daher ist die Akzeptanz und Compliance erfahrungsgemäss limitiert; vorzeitige Therapieabbrüche sind häufig.
Wie wirksam sind die HP-Eradikationstherapien?
Pylera® ist aktuell ca. 80 % wirksam, sogar bei Metronidazol-resistenten HP-Stämmen. Die bisherige Standardtherapie (Omeprazol/Amoxicilin/Clarithromycin) ist heute obsolet (ca. 55 % wirksam) (135, 136). Vorsicht: Pylera® ist kontraindiziert bei Nieren- oder Leberinsuffizienz.
Wie kann ich den Erfolg der HP-Therapie erhöhen?
Bei fehlendem Therapieansprechen empfehlen wir Rücksprache mit der Gastroenterologie oder Infektiologie. Und falls noch nicht erfolgt: Resistenztestung und resistenzbasierte Therapie (9, 10).
Wie behandle ich ein HP-negatives Ulkus?
Antibiotika sind nur bei HP-positiven Ulzera wirksam, und NSAR-Gebrauch war ein Ausschlusskriterium in den grösseren antibiotischen HP-Eradikationsstudien (137, 138). Wir empfehlen die Ursachenklärung, Absetzung (wenn möglich) von NSAR und Behandlung mit PPI in Standarddosierung für min. 8 Wochen. Falls das NSAR weitergegeben werden muss, senkt eine PPI-Dauertherapie (halbe Standarddosierung) die Rezidivquote um 80–85 %. Bei «idiopathischen» Ulzera PPI für 8 Wochen geben
(4 Wochen doppelte Dosis, dann Standarddosis).
Soll ich nach HP-Eradikation eine Nachkontrolle durchführen?
Ja. 3 Monate (frühestens 4 Wochen) nach Beendigung der Eradikationstherapie und frühestens 2 Wochen nach Absetzen des PPI (8, 10, 123). Der Stuhlantigentest wird bevorzugt (8). Alternative: C13-Urea-Atemtest (8). Eine endoskopische Kontrolle wird empfohlen beim Magenulkus (10) und nach zweimaligem Therapieversagen (123).
Wie oft gibt es Reinfektionen?
Reinfektionen (Definition: tritt auf ≥12 Monate nach erfolgreicher Therapie) kommen nicht häufig vor (0.8–8 % [139–142]), sogar dann nicht, wenn weitere Familienmitglieder HP-positiv sind (140).
Wie viele HP-positive Ulkuspatientinnen muss ich behandeln, um ein wiederkehrendes Ulkus zu verhindern?
Weil die Ulkuskrankheit dazu neigt zu rezidivieren, müssten nur 2–3 HP-positive Ulkuspatienten behandelt werden, um ein Rezidiv zu verhindern – eine eindrücklich tiefe «number needed to treat» (13, 137, 138, 143)!
Die wichtigsten Referenzen
– Schweizer Guidelines (Schweizerische Gesellschaft für Infektiologie):
Kurzfassung (8), Langfassung (9)
– The Maastricht VI/Florence consensus report: Management of Helicobacter pylori infection (6)
– Aktualisierte Deutsche S2k-Leitlinie (10)
– Malfertheiner Nature Reviews 2023 Übersichtsartikel (14)
Universitäres Zentrum für Innere Medizin
Kantonsspital Baselland
4101 Bruderholz
philip.tarr@unibas.ch
Die Autorinnen und Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
• Knapp die Hälfte der Weltbevölkerung ist mit HP infiziert – in 85% der Fälle verläuft HP asymptomatisch.
• HP erhöht die Mortalität nicht, jedoch entstehen 75–90% der Magenkarzinome auf dem Boden einer chronischen HP-Infektion.
• Eine HP-Infektion sollte immer behandelt werden, wenn ein positiver HP-Test vorliegt.
• Wegen zunehmender Antibiotikaresistenzen empfehlen wir die routinemässige HP-Resistenztestung schon vor Erstlinientherapie – via PCR im Stuhl oder Magenbiopsie. Ohne Resistenztestung ist heute Pylera® empirische Therapie der Wahl.
• Nicht invasive HP-Testung bei Personen unter 50 ohne Red Flags, sonst invasive (endoskopische) Abklärung.
• Asymptomatische Personen mit erhöhtem Risiko für ein Magenkarzinom sollten gescreent werden.
1. Han S-R, Zschausch H-CE, Meyer H-GW, et al. Helicobacter pylori : Clonal Population Structure and Restricted Transmission within Families Revealed by Molecular Typing. J Clin Microbiol 2000; 38:3646–3651.
2. Hooi JKY, Lai WY, Ng WK, et al. Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology 2017; 153:420–429.
3. Zamani M, Ebrahimtabar F, Zamani V, et al. Systematic review with meta-analysis: the worldwide prevalence of Helicobacter pylori infection. Aliment Pharmacol Ther 2018; 47:868–876.
4. Lanas A, Chan FKL. Peptic ulcer disease. The Lancet 2017; 390:613–624.
5. Rosenstock SJ, Jorgensen T. Prevalence and incidence of peptic ulcer disease in a Danish County–a prospective cohort study. Gut 1995; 36:819–824.
6. Malfertheiner P, Megraud F, Rokkas T, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut 2022; 71:1724–1762.
7. Sonnenberg A, Turner KO, Genta RM. Low Prevalence of Helicobacter pylori-Positive Peptic Ulcers in Private Outpatient Endoscopy Centers in the United States. Am J Gastroenterol 2020; 115:244–250.
8. Weber R, Brugger S, Kuster S, Walther, I. Helicobacter pylori Infektion. Available at: https://ssi.guidelines.ch/guideline/4535/de. Accessed 29 September 2023.
9. Weber R, Borovicka J, Bosshard S, et al. Helicobacter pylori Infektion: Grundlagen für eine rationale Therapie – Langfassung. Available at: https://ssi.guidelines.ch/api/filestore/TcBRCzZIHbUw0C0-4U8MUEnQnnahDga6cSqwjA/data/Langfassung%20H%20pylori%20Guideline%20SSI_final.pdf.
10. Fischbach W, Bornschein J, Hoffmann J, et al. Update S2k-Guideline Helicobacter pylori and gastroduodenal ulcer disease of the German Society of Gastroenterology, Digestive and Metabolic Diseases (DGVS): August 2023 – AWMF-Registernummer: 021–001. Z Für Gastroenterol 2024; 62:261–321.
11. Fallone CA, Chiba N, Van Zanten SV, et al. The Toronto Consensus for the Treatment of Helicobacter pylori Infection in Adults. Gastroenterology 2016; 151:51-69.e14.
12. Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. Am J Gastroenterol 2017; 112:212–239.
13. Crowe SE. Helicobacter pylori Infection. N Engl J Med 2019; 380:1158–1165.
14. Malfertheiner P, Camargo MC, El-Omar E, et al. Helicobacter pylori infection. Nat Rev Dis Primer 2023; 9:19.
15. Malaty HM, El-Kasabany A, Graham DY, et al. Age at acquisition of Helicobacter pylori infection: a follow-up study from infancy to adulthood. The Lancet 2002; 359:931–935.
16. McColl KEL. Helicobacter pylori Infection. N Engl J Med 2010;
17. Kivi M, Tindberg Y, Sörberg M, et al. Concordance of Helicobacter pylori Strains within Families. J Clin Microbiol 2003; 41:5604–5608.
18. Feldman RA, Eccersley AJP, Hardie JM. Epidemiology of Helicobacter pylori: acquisition, transmission, population prevalence and disease-to-infection ratio. Br Med Bull 1998; 54:39–53.
19. Kayali S, Manfredi M, Gaiani F, et al. Helicobacter pylori, transmission routes and recurrence of infection: state of the art. Acta Bio Medica Atenei Parm 2018; 89:72–76.
20. Rothenbacher D, Winkler M, Gonser T, Adler G, Brenner H. Role of infected parents in transmission of Helicobacter pylori to their children: Pediatr Infect Dis J 2002; 21:674–679.
21. Rocha GA, Rocha AMC, Silva LD, et al. Transmission of Helicobacter pylori infection in families of preschool-aged children from Minas Gerais, Brazil: Transmission of H. pylori infection. Trop Med Int Health 2003; 8:987–991.
22. Kivi M, Johansson ALV, Reilly M, Tindberg Y. Helicobacter pylori status in family members as risk factors for infection in children. Epidemiol Infect 2005; 133:645–652.
23. Malaty HM, Logan ND, Graham DY, Ramchatesingh JE. Helicobacter pylori Infection in Preschool and School-Aged Minority Children: Effect of Socioeconomic Indicators and Breast-Feeding Practices. Clin Infect Dis 2001; 32:1387–1392.
24. Rothenbacher D, Bode G, Berg G, et al. Helicobacter pylori among Preschool Children and Their Parents: Evidence of Parent‐Child Transmission. J Infect Dis 1999; 179:398–402.
25. Klein PD, Opekun AR, Smith EO, et al. Water source as risk factor for Helicobacter pylori infection in Peruvian children. The Lancet 1991; 337:1503–1506.
26. Li Y, Choi H, Leung K, Jiang F, Graham DY, Leung WK. Global prevalence of Helicobacter pylori infection between 1980 and 2022: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol 2023; 8:553–564.
27. Bundesamt für Gesundheit BAG. Meldepflichtige übertragbare Krankheiten und Erreger. 2023; Available at: https://www.bag.admin.ch/dam/bag/de/dokumente/mt/msys/msys-flyer.pdf.download.pdf/flyer-200120-d.pdf. Accessed 17 July 2023.
28. Sentinella. Available at: https://www.sentinella.ch/de/subject. Accessed 17 July 2023.
29. Saif N, Jensen N, Farrar E, Blackstone S, Hauck FR. Prevalence of Helicobacter pylori infection among resettled refugees presenting to a family medicine clinic in the United States. Helicobacter 2022; 27:e12894.
30. Varga MG, Butt J, Blot WJ, et al. Racial Differences in Helicobacter pylori CagA Sero-prevalence in a Consortium of Adult Cohorts in the United States. Cancer Epidemiol Biomarkers Prev 2020; 29:2084–2092.
31. Malaty HM, Paykov V, Bykova O, et al. Helicobacter pylori and Socioeconomic Factors in Russia. Helicobacter 1996; 1:82–87.
32. Elshair M, Ugai T, Oze I, et al. Impact of socioeconomic status and sibling number on the prevalence of Helicobacter pylori infection: a cross-sectional study in a Japanese population. 2022; Available at: https://doi.org/10.18999/nagjms.84.2.374. Accessed 10 August 2023.
33. Zaterka S, Eisig JN, Chinzon D, Rothstein W. Factors Related to Helicobacter pylori Prevalence in an Adult Population in Brazil. Helicobacter 2007; 12:82–88.
34. Farhadkhani M, Nikaeen M, Hassanzadeh A, Nikmanesh B. Potential transmission sources of Helicobacter pylori infection: detection of H. pylori in various environmental samples. J Environ Health Sci Eng 2019; 17:129–134.
35. Gruber D, Pohl D, Vavricka S, Stutz B, Fried M, Tutuian R. Swiss Tertiary Care Center Experience Challenges the Age- Cohort Effect in Helicobacter Pylori Infection. J Gastrointestin Liver Dis 2008; 17:373–377.
36. Boltshauser S, Herzog D. Prevalence of Helicobacter pylori infection in asymptomatic 5-7-year-old children of St. Gallen canton. Schweiz Med Wochenschr 1999;
37. Heuberger F, Pantoflickova D, Gassner M, et al. Helicobacter pylori infection in Swiss adolescents: prevalence and risk factors. Eur J Gastroenterol Hepatol 2003; :179–183.
38. Abdul Rahim NR, Benson J, Grocke K, et al. Prevalence of Helicobacter pylori infection in newly arrived refugees attending the Migrant Health Service, South Australia. Helicobacter 2017; 22:e12360.
39. Cherian S, Forbes D, Sanfilippo F, Cook A, Burgner D. The epidemiology of Helicobacter pylori infection in African refugee children resettled in Australia. Med J Aust 2008; 189:438–441.
40. Potasman I, Yitzhak A. Helicobacter pylori serostatus in backpackers following travel to tropical countries. Am J Trop Med Hyg 1998; 58:305–308.
41. Lindkvist P, Wadstrom T, Giesecke J. Helicobacter pylori Infection and Foreign Travel. J Infect Dis 1995; 172:1135–1136.
42. Hyams KC, Taylor DN, Malone JD, Hawkins R, Knowles JB, Gray GC. The Risk of Helicobacter pylori Infection Among U.S. Military Personnel Deployed Outside the United States. Am J Trop Med Hyg 1995; 52:109–112.
43. Becker SI, Smalligan RD, Frame JD, et al. Risk of Helicobacter pylori infection among long-term residents in developing countries. Am J Trop Med Hyg 1999; 60:267–270.
44. Williams C.L. Helicobacter pylori and endoscopy. J Hosp Infect 1999; 41:263–268.
45. Nürnberg M, Schulz HJ, Rüden H, Vogt K. Do Conventional Cleaning and Disinfection Techniques Avoid the Risk of Endoscopic Helicobacter pylori Transmission? Endoscopy 2003; 35:295–299.
46. Balsiger B, Bieger F, Dangel M, Ehmann T. Schweizerische Richtlinie zur Aufbereitung von flexiblen Endoskopen Version 2.0. 2021; Available at: https://kssg.guidelines.ch/api/filestore/HBCZiMkAkX5ywWn4jpkOV9V4M4ybOewasPTbYw/data/CH_Richtlinie_ESGE_V2.0_2021_02_23_DE.pdf. Accessed 10 August 2023.
47. Robert Koch-Institut. Anforderungen an die Hygiene bei der Aufbereitung flexibler Endoskope und endoskopischen Zusatzinstrumentariums. Bundesgesundheitsbl Gesundheitsforsch – Gesundheitsschutz 2002; 4:395–411.
48. Fantry GT, Zheng QX, James SP. Conventional cleaning and disinfection techniques eliminate the risk of endoscopic transmission of Helicobacter pylori. Am J Gastroenterol 1995; 90:227–232.
49. swissmedic. Medizinprodukte Swissmedic-Spitalinspektionen 2021/2022. 2023; Available at: https://www.swissmedic.ch/dam/swissmedic/de/dokumente/medizinprodukte/infos/jahresbericht-spitalinspektionen-2021-2022.pdf.download.pdf/DE_Jahresbericht_Spitalinspektionen-V5.pdf. Accessed 10 August 2023.
50. Peters C, Schablon A, Harling M, Wohlert C, Costa JT, Nienhaus A. The occupational risk of Helicobacter pylori infection among gastroenterologists and their assistants. BMC Infect Dis 2011; 11:154.
51. Kheyre H, Morais S, Ferro A, et al. The occupational risk of Helicobacter pylori infection: a systematic review. Int Arch Occup Environ Health 2018; 91:657–674.
52. Hildebrand P. Risk among gastroenterologists of acquiring Helicobacter pylori infection: case-control study. BMJ 2000; 321:149–149.
53. Kim HY, Kim N, Kim SM, Seo J-H, Park E-H, Lee DH. Seroprevalence of Helicobacter pylori Infection in Korean Health Personnel. Gut Liver 2013; 7:648–654.
54. Triantafillidis JK, Gikas A, Hyphantis T, et al. Helicobacter pylori infection in hospital workers over a 5-year period: correlation with demographic and clinical parameters. J Gastroenterol 2002; 37:1005–1013.
55. Stubljar D, Jukic T, Ihan A. How far are we from vaccination against Helicobacter pylori infection? Expert Rev Vaccines 2018; 17:935–945.
56. Czinn SJ, Blanchard T. Vaccinating against Helicobacter pylori infection. Nat Rev Gastroenterol Hepatol 2011; 8:133–140.
57. Sutton P, Boag JM. Status of vaccine research and development for Helicobacter pylori. Vaccine 2019; 37:7295–7299.
58. Mladenova I. Epidemiology of Helicobacter pylori Resistance to Antibiotics (A Narrative Review). Antibiotics 2023; 12:1184.
59. Rueda-Robles A, Rubio-Tomás T, Plaza-Diaz J, Álvarez-Mercado AI. Impact of Dietary Patterns on H. pylori Infection and the Modulation of Microbiota to Counteract Its Effect. A Narrative Review. Pathogens 2021; 10:875.
60. Balendra V, Amoroso C, Galassi B, et al. High-Salt Diet Exacerbates H. pylori Infection and Increases Gastric Cancer Risks. J Pers Med 2023; 13:1325.
61. Pich OQ, Merrell DS. The ferric uptake regulator of Helicobacter pylori : a critical player in the battle for iron and colonization of the stomach. Future Microbiol 2013; 8:725–738.
62. Gaddy JA, Radin JN, Loh JT, et al. High Dietary Salt Intake Exacerbates Helicobacter pylori-Induced Gastric Carcinogenesis. Infect Immun 2013; 81:2258–2267.
63. Maddineni G, Xie JJ, Brahmbhatt B, Mutha P. Diet and carcinogenesis of gastric cancer. Curr Opin Gastroenterol 2022; 38:588–591.
64. Hołubiuk Ł, Imiela J. Diet and Helicobacter pylori infection. Gastroenterol Rev 2016; 3:150–154.
65. Boyanova L, Ilieva J, Gergova G, Vladimirov B, Nikolov R, Mitov I. Honey and green/black tea consumption may reduce the risk of Helicobacter pylori infection. Diagn Microbiol Infect Dis 2015; 82:85–86.
66. Thompson L, Cockayne A, Spiller RC. Inhibitory effect of polyunsaturated fatty acids on the growth of Helicobacter pylori: a possible explanation of the effect of diet on peptic ulceration. Gut 1994; 35:1557–1561.
67. Brenner H, Rothenbacher D, Bode G, Adler G. Inverse Graded Relation between Alcohol Consumption and Active Infection with Hellcobacter pylori. Am J Epidemiol 1999; 149:571–576.
68. Brenner H, Bode G, Adler G, Hoffmeister A, Koenig W, Rothenbacher AD. Alcohol as a Gastric Disinfectant? The Complex Relationship between Alcohol Consumption and Current Helicobacter pylori Infection: Epidemiology 2001; 12:209–214.
69. Murray LJ, Nair P. Inverse Relationship Between Alcohol Consumption and Active Helicobacter pylori Infection: The Bristol Helicobacter Project. 2002; 97.
70. Dorer MS, Talarico S, Salama NR. Helicobacter pylori’s Unconventional Role in Health and Disease. PLoS Pathog 2009; 5. Available at: https://dx.plos.org/10.1371/journal.ppat.1000544. Accessed 22 September 2023.
71. Owyang SY, Luther J, Kao JY. Helicobacter pylori : beneficial for most? Expert Rev Gastroenterol Hepatol 2011; 5:649–651.
72. Sugano K, Tack J, Kuipers EJ, et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut 2015; 64:1353–1367.
73. Nasseri-Moghaddam S, Mousavian A-H, Kasaeian A, et al. What is the Prevalence of Clinically Significant Endoscopic Findings in Subjects With Dyspepsia? Updated Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol 2023; 21:1739-1749.e2.
74. Ford AC, Mahadeva S, Carbone MF, Lacy BE, Talley NJ. Functional dyspepsia. The Lancet 2020; 396:1689–1702.
75. Aro P, Storskrubb T, Ronkainen J, et al. Peptic Ulcer Disease in a General Adult Population. Am J Epidemiol 2006; 163:1025–1034.
76. Groenen MJ, Kuipers EJ, Hansen BE, Ouwendijk RJT. Incidence of Duodenal Ulcers and Gastric Ulcers in a Western Population: Back to Where It Started. Can J Gastroenterol 2009; 23:604–608.
77. Huang J-Q, Sridhar S, Hunt RH. Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic-ulcer disease: a meta-analysis. The Lancet 2002; 359:14–22.
78. Sarri GL, Grigg SE, Yeomans ND. Helicobacter pylori and low‐dose aspirin ulcer risk: A meta‐analysis. J Gastroenterol Hepatol 2019; 34:517–525.
79. Ng JC, Yeomans ND. Helicobacter pylori infection and the risk of upper gastrointestinal bleeding in low dose aspirin users: systematic review and meta‐analysis. Med J Aust 2018; 209:306–311.
80. Gisbert JP, Calvet X. Review article: Helicobacter pylori -negative duodenal ulcer disease. Aliment Pharmacol Ther 2009; 30:791–815.
81. Chow DKL, Sung JJY. Non-NSAID non-H. pylori ulcer disease. Best Pract Res Clin Gastroenterol 2009; 23:3–9.
82. Crooks CJ, West J, Card TR. Comorbidities Affect Risk of Nonvariceal Upper Gastrointestinal Bleeding. Gastroenterology 2013; 144:1384-1393.e2.
83. Levenstein S, Rosenstock S, Jacobsen RK, Jorgensen T. Psychological Stress Increases Risk for Peptic Ulcer, Regardless of Helicobacter pylori Infection or Use of Nonsteroidal Anti-inflammatory Drugs. Clin Gastroenterol Hepatol 2015; 13:498-506.e1.
84. Chen Y, Segers S, Blaser MJ. Association between Helicobacter pylori and mortality in the NHANES III study. Gut 2013; 62:1262–1269.
85. Milosavljevic T, Kostić-Milosavljević M, Jovanović I, Krstić M. Complications of Peptic Ulcer Disease. Dig Dis 2011; 29:491–493.
86. IARC Working Group W. Helicobacter pylori eradication as a strategy for preventing gastric cancer. Lyon, France: International Agency for Research on Cancer, 2014. Available at: https://publications.iarc.fr/_publications/media/download/4050/1ab31864783821cde8c689f56e7a5e0443821ac2.pdf.
87. Usui Y, Taniyama Y, Endo M, et al. Helicobacter pylori , Homologous-Recombination Genes, and Gastric Cancer. N Engl J Med 2023; 388:1181–1190.
88. Müller A, He J. A Double Whammy on Gastric Cancer Risk. N Engl J Med 2023; 388:1225–1229.
89. Totoki Y, Saito-Adachi M, Shiraishi Y, et al. Multiancestry genomic and transcriptomic analysis of gastric cancer. Nat Genet 2023; 55:581–594.
90. Moss SF. The Clinical Evidence Linking Helicobacter pylori to Gastric Cancer. Cell Mol Gastroenterol Hepatol 2017; 3:183–191.
91. IARC by WHO. List of Classifications – IARC Monographs on the Identification of Carcinogenic Hazards to Humans. Available at: https://monographs.iarc.who.int/list-of-classifications. Accessed 3 December 2023.
92. Lu B, Li M. Helicobacter pylori eradication for preventing gastric cancer. World J Gastroenterol WJG 2014; 20:5660–5665.
93. Kuo S-H, Cheng A-L. Helicobacter pylori and mucosa-associated lymphoid tissue: what’s new. Hematol Am Soc Hematol Educ Program 2013; 2013:109–117.
94. Ishikura N, Usui Y, Ito H, et al. Helicobacter pylori (HP) infection alone, but not HP-induced atrophic gastritis, increases the risk of gastric lymphoma: a case-control study in Japan. Ann Hematol 2019; 98:1981–1987.
95. Sonnenberg A, Genta RM. Helicobacter pylori is a risk factor for colonic neoplasms. Am J Gastroenterol 2013; 108:208–215.
96. Fischbach LA, Nordenstedt H, Kramer JR, et al. The Association Between Barrett’s Esophagus and Helicobacter pylori Infection: A Meta-Analysis: Association Between Barrett’s Esophagus and Helicobacter pylori Infection. Helicobacter 2012; 17:163–175.
97. Erőss B, Farkas N, Vincze Á, et al. Helicobacter pylori infection reduces the risk of Barrett’s esophagus: A meta-analysis and systematic review. Helicobacter 2018; 23. Available at: https://onlinelibrary.wiley.com/doi/10.1111/hel.12504. Accessed 11 August 2023.
98. Rokkas T, Pistiolas D, Sechopoulos P, Robotis I, Margantinis G. Relationship Between Helicobacter pylori Infection and Esophageal Neoplasia: A Meta-analysis. Clin Gastroenterol Hepatol 2007; 5:1413–1417.
99. Sonnenberg A. Epidemiology of Helicobacter pylori. Aliment Pharmacol Ther 2022; 55. Available at: https://onlinelibrary.wiley.com/doi/10.1111/apt.16592. Accessed 13 August 2023.
100. Usui G, Sato H, Shinozaki T, et al. Association Between Helicobacter pylori Infection and Short-segment/Long-segment Barrett’s Esophagus in a Japanese Population: A Large Cross-Sectional Study. J Clin Gastroenterol 2020; 54:439–444.
101. Sugimoto M, Murata M, Mizuno H, et al. Endoscopic Reflux Esophagitis and Reflux-Related Symptoms after Helicobacter pylori Eradication Therapy: Meta-Analysis. J Clin Med 2020; 9:3007.
102. Nam SY, Choi IJ, Ryu KH, Kim BC, Kim CG, Nam B-H. Effect of Helicobacter pylori Infection and Its Eradication on Reflux Esophagitis and Reflux Symptoms. Am J Gastroenterol 2010; 105:2153–2162.
103. Zhao T, Liu F, Li Y. Effects of Helicobacter pylori eradication on esophageal motility, esophageal acid exposure, and gastroesophageal reflux disease symptoms. Front Cell Infect Microbiol 2023; 13. Available at: https://www.frontiersin.org/articles/10.3389/fcimb.2023.1082620/full. Accessed 15 October 2023.
104. Narang M, Puri AS, Sachdeva S, Singh J, Kumar A, Saran RK. Celiac disease and Helicobacter pylori infection in children: Is there any Association? J Gastroenterol Hepatol 2017; 32:1178–1182.
105. Amlashi FI, Norouzi Z, Sohrabi A, et al. A systematic review and meta-analysis for association of Helicobacter pylori colonization and celiac disease. PLOS ONE 2021; 16. Available at: https://dx.plos.org/10.1371/journal.pone.0241156. Accessed 11 August 2023.
106. Bayrak NA, Tutar E, Volkan B, et al. Helicobacter pylori infection in children with celiac disease: Multi‐center, cross‐sectional study. Helicobacter 2020; 25. Available at: https://onlinelibrary.wiley.com/doi/10.1111/hel.12691. Accessed 11 August 2023.
107. Bartels LE, Jepsen P, Christensen LA, Gerdes LU, Vilstrup H, Dahlerup JF. Diagnosis of Helicobacter Pylori Infection is Associated with Lower Prevalence and Subsequent Incidence of Crohn’s Disease. J Crohns Colitis 2016; 10:443–448.
108. Bartels LE, Dahlerup JF. Association of Helicobacter pylori and Crohn’s Disease Incidence: An Inversion Reaction? Dig Dis Sci 2017; 62:2217–2219.
109. Shah SC, Tepler A, Peek RM, Colombel J-F, Hirano I, Narula N. Association Between Helicobacter pylori Exposure and Decreased Odds of Eosinophilic Esophagitis—A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol 2019; 17:2185–2198.
110. Molina-Infante J, Gutierrez-Junquera C, Savarino E, et al. Helicobacter Pylori Infection Does Not Protect Against Eosinophilic Esophagitis: Results From a Large Multicenter Case-Control Study. Am J Gastroenterol 2018; 113:972–979.
111. Miller AK, Williams SM. Helicobacter pylori infection causes both protective and deleterious effects in human health and disease. Genes Immun 2021; 22:218–226.
112. Doheim MF, Altaweel AA, Elgendy MG, et al. Association between Helicobacter Pylori infection and stroke: a meta-analysis of 273,135 patients. J Neurol 2021; 268:3238–3248.
113. Sun J, Rangan P, Bhat SS, Liu L. A Meta‐Analysis of the Association between H elicobacter pylori Infection and Risk of Coronary Heart Disease from Published Prospective Studies. Helicobacter 2016; 21:11–23.
114. Lee S-H, Lee J-J, Kwon Y, Kim J-H, Sohn J-H. Clinical Implications of Associations between Headache and Gastrointestinal Disorders: A Study Using the Hallym Smart Clinical Data Warehouse. Front Neurol 2017; 8:526.
115. Su J. Association between Helicobacter pylori infection and migraine: A meta-analysis. World J Gastroenterol 2014; 20:14965–14972.
116. Blaser MJ, Chen Y, Reibman J. Does Helicobacter pylori protect against asthma and allergy? Gut 2008; 57:561–567.
117. Francesco F, Tortora A, Di Rienzo T, et al. Role of Helicobacter pylori infection on nutrition and metabolism. World J Gastroenterol 2014; 20:12809–12817.
118. Mansori K, Dehghanbanadaki H, Naderpour S, Rashti R, Moghaddam AB, Moradi Y. A systematic review and meta-analysis of the prevalence of Helicobacter pylori in patients with diabetes. Diabetes Metab Syndr Clin Res Rev 2020; 14:601–607.
119. Azami M, Baradaran HR, Dehghanbanadaki H, et al. Association of Helicobacter pylori infection with the risk of metabolic syndrome and insulin resistance: an updated systematic review and meta-analysis. Diabetol Metab Syndr 2021; 13:145.
120. Cho I, Blaser MJ, François F, et al. Helicobacter pylori and Overweight Status in the United States: Data from the Third National Health and Nutrition Examination Survey. Am J Epidemiol 2005; 162:579–584.
121. Kaptan K, Beyan C, Ural AU, et al. Helicobacter pylori—Is It a Novel Causative Agent in Vitamin B12 Deficiency? Arch Intern Med 2000; 160:1349.
122. Osmola M, Chapelle N, Vibet M-A, et al. Iron and Vitamin B12 Deficiency in Patients with Autoimmune Gastritis and Helicobacter pylori Gastritis: Results from a Prospective Multicenter Study. Dig Dis 2024; 42:145–153.
123. Baboueeflury B, Flury D, Schlegel M, Boggian K. Helicobacter pylori (Gastritis/Ulkus). Available at: https://kssg.guidelines.ch/guideline/593/de/1902. Accessed 18 July 2023.
124. Ford AC, Tsipotis E, Yuan Y, Leontiadis GI, Moayyedi P. Efficacy of Helicobacter pylori eradication therapy for functional dyspepsia: updated systematic review and meta-analysis. Gut 2022; 71:1967–1975.
125. Katz PO, Dunbar KB, Schnoll-Sussman FH, Greer KB, Yadlapati R, Spechler SJ. ACG Clinical Guideline for the Diagnosis and Management of Gastroesophageal Reflux Disease. Am J Gastroenterol 2022; 117:27–56.
126. Madisch A, Koop H, Miehlke S, Leers J, Lorenz P. S2k-Leitlinie Gastroösophageale Refluxkrankheit und eosinophile Ösophagitis der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) – März 2023 – AWMF-Registernummer: 021–013. Z Für Gastroenterol 2023; 61:862–933.
127. Rokkas T, Sechopoulos P, Pistiolas D, Margantinis G, Koukoulis G. Helicobacter pylori infection and gastric histology in first-degree relatives of gastric cancer patients: a meta-analysis: Eur J Gastroenterol Hepatol 2010; 22:1128–1133.
128. Parente F, Maconi G, Sangaletti O, et al. Prevalence of Helicobacter pylori infection and related gastroduodenal lesions in spouses of Helicobacter pylori positive patients with duodenal ulcer. Gut 1996; 39:629–633.
129. Vítor JMB, Vale FF. Alternative therapies for Helicobacter pylori: probiotics and phytomedicine. FEMS Immunol Med Microbiol 2011; 63:153–164.
130. Pourmasoumi M. The effect of synbiotics in improving Helicobacter pylori eradication_ A systematic review and meta-analysis. Complement Ther Med 2019;
131. Ayala G, Escobedo-Hinojosa WI. Exploring alternative treatments for Helicobacter pylori infection. 20.
132. Perri F, Pastore M, Clemente R, et al. Helicobacter pylori infection may undergo spontaneous eradication in children: a 2-year follow-up study. J Pediatr Gastroenterol Nutr 1998; 27:181–183.
133. Mera R. Long term follow up of patients treated for Helicobacter pylori infection. Gut 2005; 54:1536–1540.
134. Bair M-J, Wu M-S, Chang W-H, et al. Spontaneous Clearance of Helicobacter pylori Colonization in Patients with Partial Gastrectomy: Correlates with Operative Procedures and Duration After Operation. J Formos Med Assoc 2009; 108:13–19.
135. Malfertheiner P, Bazzoli F, Delchier J-C, et al. Helicobacter pylori eradication with a capsule containing bismuth subcitrate potassium, metronidazole, and tetracycline given with omeprazole versus clarithromycin-based triple therapy: a randomised, open-label, non-inferiority, phase 3 trial. The Lancet 2011; 377:905–913.
136. compendium.ch. Available at: https://compendium.ch/product/1373515-pylera-kaps-140-mg-125-mg-125-mg/mpro#MPro7000. Accessed 6 February 2024.
137. Tomita T, Fukuda Y, Tamura K, et al. Successful eradication of Helicobacter pylori prevents relapse of peptic ulcer disease. Aliment Pharmacol Ther 2002; 16:204–209.
138. Tulassay Z, Kryszewski A, Dite P, et al. One week of treatment with esomeprazole-based triple therapy eradicates Helicobacter pylori and heals patients with duodenal ulcer disease: Eur J Gastroenterol Hepatol 2001; 13:1457–1465.
139. Take S, Mizuno M, Ishiki K, et al. Reinfection rate of Helicobacter pylori after eradication treatment: a long-term prospective study in Japan. J Gastroenterol 2012; 47:641–646.
140. Knippig C, Arand F, Leodolter A, et al. Prevalence of H. pylori Infection in Family Members of H. pylori Positive Patients and its Influence on the Reinfection Rate after Successful Eradication Therapy: A Two-Years Follow-up. Z Für Gastroenterol 2002; 40:383–387.
141. Mitchell HM, Hu P, Chi Y, Chen MH, Li YY, Hazell SL. A low rate of reinfection following effective therapy against Helicobacter pylori in a developing nation (China). Gastroenterology 1998; 114:256–261.
142. Gisbert JP, Luna M, Gomez B, et al. Recurrence of Helicobacter pylori infection after several eradication therapies: long-term follow-up of 1000 patients. Aliment Pharmacol Ther 2006; 23:713–719.
143. Ford AC, Gurusamy KS, Delaney B, Forman D, Moayyedi P. Eradication therapy for peptic ulcer disease in Helicobacter pylori -positive people. Cochrane Database Syst Rev 2016; 2016. Available at: http://doi.wiley.com/10.1002/14651858.CD003840.pub5. Accessed 3 December 2023.
144. Ford AC, Yuan Y, Forman D, Hunt R, Moayyedi P. Helicobacter pylori eradication for the prevention of gastric neoplasia. Cochrane Database Syst Rev 2020; Available at: https://doi.wiley.com/10.1002/14651858.CD005583.pub3. Accessed 24 July 2024.
145. Krebsliga. Krebs in der Schweiz: wichtige Zahlen. 2023; Available at: https://www.krebsliga.ch/ueber-krebs/zahlen-fakten/-dl-/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf. Accessed 6 April 2024.
146. Li Z-X, Bronny K, Formichella L, et al. A multiserological line assay to potentially discriminate current from past Helicobacter pylori infection. Clin Microbiol Infect 2024; 30:114–121.
147. Bundesamt für Gesundheit (BAG). Analysenliste BAG. 2024; Available at: https://www.bag.admin.ch/dam/bag/de/dokumente/kuv-leistungen/leistungen-und-tarife/Analysenliste/gesamtliste_al_01012024.pdf.download.pdf/Analysenliste%20per%201.%20Januar%202024_def.pdf.
148. European Committee on Antimicrobial Susceptibility Testing. eucast: Clinical breakpoints and dosing of antibiotics. H. pylori EUCAST clinical breakpoint tables, v. 14.0, valid from 2024-01-01. Available at: https://www.eucast.org/clinical_breakpoints. Accessed 16 April 2024.
149. Kuipers EJ, Uyterlinde AM, Peña AS, et al. Increase of Helicobacter pylori-associated corpus gastritis during acid suppressive therapy: implications for long-term safety. Am J Gastroenterol 1995; 90:1401–1406.
150. Kuipers EJ, Lundell L, Klinkenberg-Knol EC, et al. Atrophic Gastritis and Helicobacter pylori Infection in Patients with Reflux Esophagitis Treated with Omeprazole or Fundoplication. N Engl J Med 1996; 334:1018–1022.
151. Chan FK, To K, Wu JC, et al. Eradication of Helicobacter pylori and risk of peptic ulcers in patients starting long-term treatment with non-steroidal anti-inflammatory drugs: a randomised trial. The Lancet 2002; 359:9–13.
152. Fallone CA, Moss SF, Malfertheiner P. Reconciliation of Recent Helicobacter pylori Treatment Guidelines in a Time of Increasing Resistance to Antibiotics. Gastroenterology 2019; 157:44–53.
153. Shiotani A, Lu H, Dore MP, Graham DY. Treating Helicobacter pylori effectively while minimizing misuse of antibiotics. Cleve Clin J Med 2017; 84:310–318.
154. Shiotani A, Roy P, Lu H, Graham DY. Helicobacter pylori diagnosis and therapy in the era of antimicrobial stewardship. Ther Adv Gastroenterol 2021; 14. Available at: http://journals.sagepub.com/doi/10.1177/17562848211064080. Accessed 11 October 2023.
155. Lee Y-C, Dore MP, Graham DY. Diagnosis and Treatment of Helicobacter pylori Infection. Annu Rev Med 2022; 73:183–195.
156. Röhss K, Lind T, Wilder-Smith C. Esomeprazole 40mg provides more effective intragastric acid control than lansoprazole 30mg, omeprazole 20mg, pantoprazole 40mg and rabeprazole 20mg in patients with gastro-oesophageal reflux symptoms. Eur J Clin Pharmacol 2004; 60:531–539.
157. Scott LJ, Dunn CJ, Mallarkey G, Sharpe M. Esomeprazole: A Review of its Use in the Management of Acid-Related Disorders. Drugs 2002; 62:1503–1538.
158. Hatlebakk JG, Katz PO, Camacho‐Lobato L, Castell DO. Proton pump inhibitors: better acid suppression when taken before a meal than without a meal. Aliment Pharmacol Ther 2000; 14:1267–1272.
PRAXIS
- Vol. 114
- Ausgabe 1
- Januar 2025





