- Komplikationen der intravesikalen BCG-Therapie
Die BCG-Instillation gehört zur Standardtherapie des oberflächlichen Urothelkarzinoms der Blase. Hierbei sind ernsthafte unerwünschte Nebenwirkungen insgesamt selten. Die Diagnose eines disseminierten BCG-Infektes kann vermutet werden, sobald nach Instillationen mindestens zwei Tage Fieber mit systemischen und/oder lokalen Organmanifestationen (ausgenommen urogenitale Beschwerden) unter Ausschluss anderer Ursachen bestehen und ein rasches Ansprechen auf eine tuberkulostatische Therapie zu beobachten ist. Ein direkter Erregernachweis ist nicht obligat, da oft nicht erfolgreich; häufiger gelingt der Nachweis von Granulomen. Eine BCG-Infektion soll mit Isoniazid, Rifampicin und Ethambutol für sechs Monate behandelt werden.
Einleitung
BCG-Instillationen gehören, nach der transurethralen Blasenresektion, zur Standardtherapie beim oberflächlichen Urothelkarzinom. Dafür wird intravesikal eine abgeschwächte Form eines Mycobacterium bovis-Stammes (Bacillus Calmette-Guérin) appliziert. Die BCG-Instillation wird als erste Wahl im non-muscle invasive bladder cancer (NMIBC) und bei carcinoma in-situ (CIS), entsprechend dem Staging Ta, Tis und T1, empfohlen. Fast 75% aller Blasentumore werden in diesen Frühstadien diagnostiziert. Dabei wird diese, in mehreren Zyklen verabreichte Therapie zur Prävention neuer Neoplasien sowie zur Progressionsverhinderung der bestehenden Tumorerkrankung eingesetzt.
Die Wirkung von BCG als Immuntherapie ist nicht vollständig geklärt. Die Immunantwort des Körpers auf das BCG basiert auf einer unspezifischen Stimulation des retikuloendothelialen Systems sowie Induktion einer lokalen Entzündungsreaktion mit Migration von Granulozyten, Makrophagen und T-Helferzellen. Ausserdem werden zahlreiche Zytokine ausgeschüttet. Hierbei dominiert die zelluläre Immunantwort, auf Basis einer induzierten Spättypreaktion IV, und korreliert mit dem Ausmass der Tumordestruktion. Eine direkte zytotoxische Aktivität des Mycobacteriums wurde lediglich in vitro beobachtet (1,2).
Erstmals 1921 als Vakzination gegen die Tuberkulose entwickelt, war der Einsatz vom Bacillus Calmette‐Guérin nie ganz frei von Kontroversen. In den 1970er Jahren wurden die antineoplastischen Eigenschaften als vielversprechend beworben, jedoch verlor BCG rasch wieder an Bedeutung, als seine Wirksamkeit im Einsatz gegen das invasive Urothelkarzinom widerlegt wurde. Dank Studien in Tiermodellen und der Immunologie entdeckte man jedoch den Einsatz gegen das nicht-muskelinvasive Urothelkarzinom. Es zeigte sich, dass hierfür gewisse Voraussetzungen gegeben sein müssen: eine gute Immunantwort der Patienten, eine genügend hohe BCG-Dosis sowie räumliche Nähe zu den entarteten (aber im frühen Stadium zahlenmässig immer noch limitierten) Zellen, damit eine Tumorzelldestruktion stattfinden kann (1).
Die ersten Behandlungspläne mit einem sechswöchigen Induktionszyklus und je dreiwöchigen Erhaltungszyklen wurden entwickelt und an Patienten mit rezidivierenden Blasenkarzinomen angewandt. Dabei wurde eine zwölffache Reduktion des Rezidivrisikos nachgewiesen. Später konnte auch ein verlängertes progressionsfreies Überleben unter dieser Therapie bestätigt werden (1,3).
Klinik und Komplikationen
Die BCG-Instillation ist meistens eine komplikationsarme Behandlung. Sie kann jedoch zu einer disseminierten Mykobakterieninfektion führen. Insgesamt sind ernsthafte Nebenwirkungen selten (< 5 %), hängen jedoch fast immer mit einer solchen Infektion zusammen.
Die häufigeren, leichteren Nebenwirkungen beschränken sich auf das urogenitale System und sind z.B. Zystitiden (91 %), makroskopische Hämaturie (1 %), Blasenkontrakturen (0,2 %), granulomatöse Prostatitiden (0,9 %) und Epididymorchitiden (0,4 %). Auch ein leichtgradiges Fieber, Malaise, Schüttelfrost und Arthralgien können für Stunden bis Tage nach Instillation anhalten. Diese stehen in Zusammenhang mit der induzierten Immunantwort, welche verantwortlich für die systemischen Symptome ist. Hautausschläge hingegen zählen zu den milden, allergischen und oft selbstlimitierenden Reaktionen auf die Instillationen (2,4,5).
Zu den disseminierten Mykobakterieninfektionen gehört der miliare pulmonale oder hepatische Befall, von der Häufigkeit mit je < 1 % aller disseminierten Fälle beschrieben, mit dem histopathologischen Bild einer granulomatösen Entzündung. Ebenfalls zu einer disseminierten Infektion gehörend sind Fieber unklaren Ursprungs (fever of unknown origin, FUO) oder Sepsis (2). Die gefürchtetste unerwünschte Nebenwirkung ist die BCG-Sepsis mit oder ohne Hypersensitivitätsreaktion (Fieber, Schüttelfrost, Hypotonie und progressiver Multiorganschaden), die mit einer Inzidenz von ca. 0,4 % oder 1:15‘000 Behandlungen auftreten kann (3).
Sehr viel seltener treten auch Spondylodiszitis und Gefässaneurysmen auf. Zu Spondylodiszitis gibt es in der Literatur mindestens 22 Fälle, wobei die Streuung der Erreger mutmasslich über den klappenlosen Batson-Venenplexus in die tiefen Becken- und Thoraxvenen verläuft. In ungefähr 20 Fällen sind in der Literatur mykotische Aneurysmata nach BCG-Instillation beschrieben worden. Der Ausbreitungsweg ist noch unklar. Es gibt Theorien über eine vaskuläre Streuung über die Vasa vasorum, lymphogen über die retroperitonealen Lymphknoten oder als fortlaufend ausbreitende Infektion von einer Spondylodiszitis oder einer Psoasabszedierung ausgehend (6).
Die schweren unerwünschten Nebenwirkungen hängen meist mit einem Eindringen der Mikroben nach einer traumatischen Katheterisierung zusammen. Daher wird empfohlen, die Instillationen nicht durchzuführen, falls zuvor ein lokaler Eingriff an der Blase, wie beispielsweise TUR-B oder traumatische Katheterisierung, in den letzten zwei
Wochen stattgefunden haben und auch nicht während einer floriden Zystitis oder bei einer makroskopischen Hämaturie (1,2,7).
Daneben gehört wohl aufgrund des Pathomechanismus auch eine unerkannte Immundefizienz zu den Risikofaktoren für eine Dissemination. Dies ist insbesondere bekannt aus der Pädiatrie, wobei nach BCG-Impfungen von Kindern und deren Angehörigen, aufgrund von zu jenem Zeitpunkt unbekannter, angeborener Immunschwäche, disseminierte Infekte aufgetreten sind. (8,9).
Abklärungsstrategie und Diagnose
Die Diagnose einer disseminierten BCG-Infektion kann durch Nachweis von M. bovis oder Granulomen ausserhalb der Blase bewiesen werden. Bei systemischen Symptomen sollten Proben von Sputum, Blut und sonstigen Geweben zur Suche nach Mykobakterien im mikroskopischen Direktnachweis, Kultur und PCR-Amplifikation entnommen werden. Im Urin ist eine Suche nach Mykobakterien nicht sinnvoll, da BCG noch lange nach Instillation nachweisbar sind. Urinuntersuchungen sollten jedoch zum Ausschluss der weitaus häufiger vorkommenden, bakteriellen Zystitis nach Instillationen verwendet werden (10,11). Zudem sollte eine erweiterte Suche nach Gewebebefall, durch den Nachweis von Granulomen, beispielsweise mit Computertomographien des Thorax und des Abdomens oder Biopsien von verdächtigem Gewebe, unternommen werden.
Die BCG-Bakterien direkt nachzuweisen, gelingt meistens nicht. Zahlen aus den USA und Europa zur Detektionsrate ähneln sich: der mikrobiologische Direktnachweis gelingt durchschnittlich nur in 27,5 % der Fälle, wobei der histopathologisch-bioptische Nachweis von Granulomen am häufigsten zielführend ist (12,13). Der direkte Erregernachweis steht im zeitlichen Zusammenhang zur Erstmanifestation einer Infektion: je später systemische Symptome auftreten, desto eher gelingt dies (4).
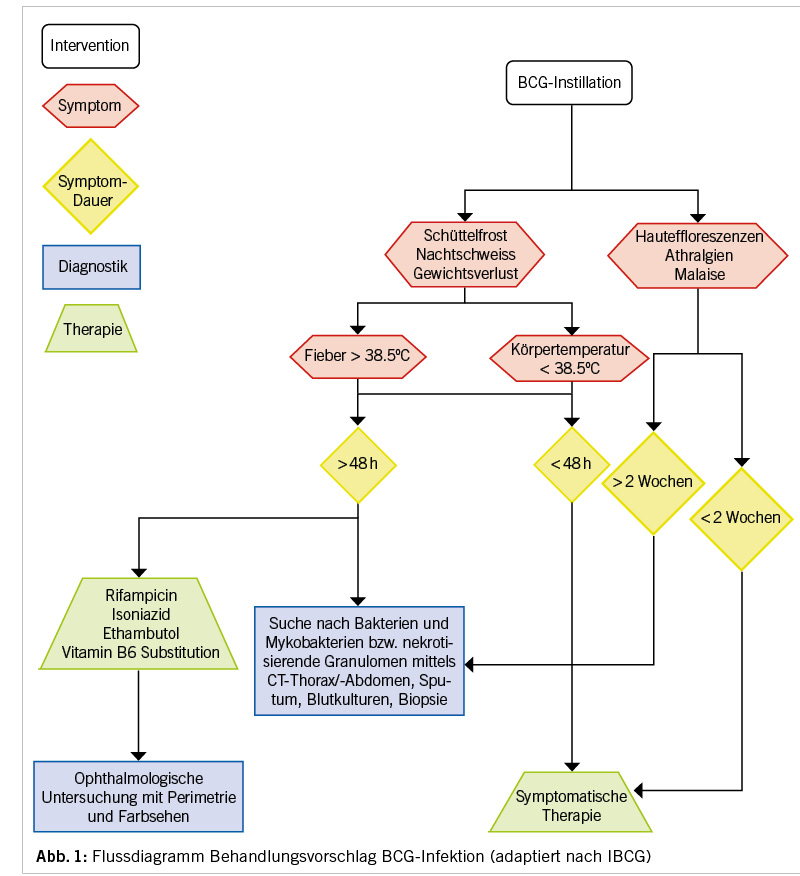
Es kann zwischen bewiesener und möglicher BCG-Infektion unterschieden werden. Allgemein akzeptierte Kriterien für die Diagnostik einer BCG-Infektion gibt es allerdings nicht. Die Schweizerische Gesellschaft für Urologie publiziert keine Empfehlungen. Die European Association of Urology empfiehlt (gestützt auf den Empfehlungen der International Bladder Cancer Group ICBG) bei persistierendem Fieber (d.h. > 38,5 °C für länger als 48 Stunden) die BCG-Instillationen abzubrechen. Zudem sollten Urin- und Blutkulturen auf Bakterien resp. Mykobakterien sowie ein Thorax-Röntgen durchgeführt und unverzüglich eine tuberkulostatische Therapie begonnen und ein infektiologisches Konsilium eingeholt werden (7,14). Ein Ansprechen des Patientenzustandes auf die tuberkulostatische Therapie tritt prompt auf und ist beweisend für die mutmassliche Infektion (5).
Wir empfehlen anstatt eines konventionellen Röntgenbildes des Thorax eine Computertomographie der Lunge. Die high-resolution Computertomographie der Lunge ist den Röntgenbildern nicht nur zum Ausschluss einer aktiven Lungentuberkulose überlegen, sondern auch zur Unterscheidung zwischen neuen und älteren, fibrotischen Läsionen (15,16). Die low-dose Computertomographie, mit vergleichbaren Strahlendosen wie Röntgenbilder, ist sensitiv genug, um aktive Lungeninfektionen darstellen zu können und so von inaktiven Tuberkulose-Läsionen zu unterscheiden (17,18). In Abbildung 1 (siehe oben) fassen wir unseren Behandlungsvorschlag zusammen.
Therapie
In jedem Fall sollte eine disseminierte BCG-Infektion in Betracht gezogen werden, falls jemals BCG-Instillationen durchgeführt wurden und sich der Patient mit einer unklaren Entzündung präsentiert. Die Behandlung sollte nicht durch die Erregersuche verzögert werden.
Es gibt keine Richtlinien zur Behandlung der BCG-Infektion. Grundsätzlich werden die gleichen tuberkulostatischen Medikamente wie für M. bovis verwendet. Wir empfehlen eine Dreifachtherapie mit Isoniazid, Rifampicin und Ethambutol über 6 Monate, da dabei Heilungsraten zwischen 80 – 90 % beschrieben sind. Gegen Pyrazinamid weist BCG eine natürliche Resistenz auf (2,12,13).
Von einer antibiotischen oder tuberkulostatischen Prophylaxe nach BCG-Instillationen, zur Vermeidung von Komplikationen, wird aufgrund Wirkungslosigkeit abgeraten (11,19).
Eine Graduierung zur Einschätzung des Schweregrades empfiehlt die ICBG anhand der Höhe und Dauer des Fiebers
(> 38,5 °C) (10). Als moderat gilt, wenn die Körpertemperatur nach einer Instillation < 38.5 °C beträgt und nicht länger als 48 Stunden anhält; dann soll der Patient nur symptomatisch behandelt werden (10). Bei systemischen Reaktionen, mit Auftreten von Fieber für länger als 48 Stunden, sollte dagegen direkt mit der tuberkulostatischen Therapie mit Isoniazid, Rifampicin und Ethambutol für sechs Monate begonnen werden. Eine empirische antibiotische Therapie, zur Abdeckung von gramnegativen Bakterien und Enterokokken, sollte auch in Betracht gezogen werden (7,14,20).
Bei Einsatz von Ethambutol wird vor oder unmittelbar nach Therapiebeginn eine ophthalmologische Untersuchung, mit Perimetrie und Farbsehen, zur Früherkennung einer Optikus-Neuritis durchgeführt und danach alle vier Wochen fortgesetzt bis Therapieende. Eine Vitamin-B6-Substitution sollte erfolgen, um der Neurotoxizität von Isoniazid entgegenzuwirken.
Bei Hypersensitivitätsreaktion (Hautausschläge, Malaise, Arthritiden) ohne Fieber werden je nach Schweregrad Antihistaminika und NSAR eingesetzt. Bei Persistenz der Hypersensitivitätsreaktion sollte eine tuberkulostatische Therapie, zusätzlich zu den o.g. Medikamenten, begonnen werden, da von einer BCG-Sepsis ausgegangen werden muss (3).
Das weitere Therapiemanagement erfordert Kontrollen von Blutbild, Nieren- und Leberfunktionsparametern, nach zwei und vier Wochen ab Therapiestart, und bei stabilen Werten eine Ausdehnung des Kontrollintervalls auf vier Wochen.
Häufig kommt es bei einer systemischen Streuung zu einer miliaren Aussaat in die Lungen, mit Erregernachweis in den Sputum-Proben. Es empfiehlt sich daher eine erste Sputumkontrolle auf Mykobakterien zwei Monate nach Therapiestart sowie bei Therapieende (21).
Fallbericht
Anamnese des Patienten
Ein 54-jähriger Patient wurde aufgrund einer unklaren B-Symptomatik zugewiesen. Er beschrieb Malaise, Kraftlosigkeit und Abgeschlagenheit, einen ungewollten Gewichtsverlust von vier Kilogramm in sechs Monaten und Fieber mit nächtlichem Schüttelfrost sowie übermässigem Schwitzen. Er befand sich unter dem vierten Erhaltungszyklus einer BCG-Therapie bei Urothelkarzinom der Blase. Der Induktionszyklus wurde zwei Jahre zuvor erfolgreich abgeschlossen und die Erhaltung zweimal jährlich fortgesetzt. Gegen Ende des vierten Erhaltungszyklus begannen die oben genannten Beschwerden, sodass die BCG-Dosierung auf zwei Drittel reduziert wurde. Bei Zunahme der Symptome wurde der Patient zur weiteren Abklärung überwiesen. Er war Raucher.
Weg zur Diagnose/Kommentar
Zu diesem Zeitpunkt bestand bereits der Verdacht auf eine disseminierte BCG-Infektion. Mit der nachfolgenden Diagnostik wurde versucht, dies zu beweisen und eine konsumierende, neoplastische Erkrankung auszuschliessen.
Befunde des Patienten
Status
54-jähriger afebriler, normotensiver, normokarder Patient in reduziertem Allgemeinzustand. Das aktuelle Körpergewicht lag bei 98 kg, sechs Monate zuvor lag das Körpergewicht bei 102 kg. In der klinischen Untersuchung zeigte sich ein feuchtes Integument ohne Splinter-Hämorrhagien, Osler-Knötchen oder Janeway-Läsionen. Enoral fand sich ein schlechter Zahnstatus, der restliche Status war unauffällig.
Mikrobiologische Befunde
Blutkulturen: aerobe und anaerob kein mikrobielles Wachstum.
Urinkultur: Mykobakterium tuberculosis-Komplex-DNA: nachweisbar; Mikroskopie: keine säurefesten Stäbchen nachweisbar; Kultur: Mykobakterium bovis BCG nachweisbar; Resistenzspektrum: Isoniazid low-level resistent, Pyrazinamid resistent, Rifampicin und Ethambutol sensibel.
Bildgebung
Röntgen-Thorax: Unauffällige Herzgrösse. Lungenzirkulation nicht pathologisch. Kein Pleuraerguss. Kein Infiltrat.
CT-Abdomen (im Rahmen der Tumornachsorge, 1 Monat nach Symptombeginn): Stationäre einfache kortikale Nierenzysten rechts. Keine malignomsuspekte Raumforderungen der Nieren noch der oberen ableitenden Harnwege. Soweit bei geringer Blasenfüllung beurteilbar sehr diskrete, nicht noduläre Blasenwandverdickung am linken Ostium. Kein Anhalt für Lymphknoten- oder Fernmetastasen im Untersuchungsvolumen.
Weg zur Diagnose/Kommentar
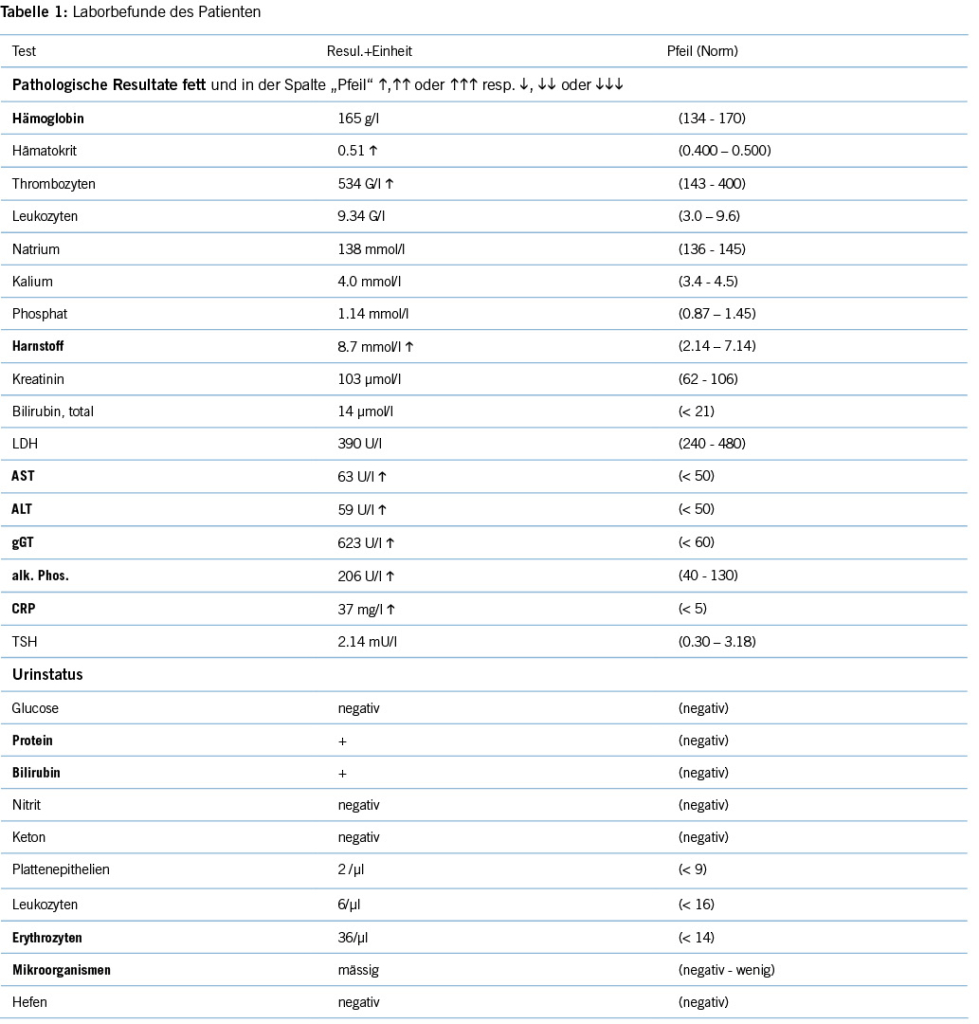
Laborchemisch zeigten sich eine Erhöhung der Transaminasen und der Gamma-Glutamyltransferase sowie der alkalischen Phosphatase. Das CRP war erhöht.
In der Mikrobiologie des Urins konnte mittels PCR Mycobacterium tuberculosis-Komplex DNA und schliesslich in der Kultur Mycobacterium bovis BCG nachgewiesen werden. Die Ergebnisse aus dem Urin wurden im Rahmen der BCG-Instillationen interpretiert, da die DNS auch Jahre nach der letzten Instillation noch nachweisbar sein kann; es zeigte sich kein Wachstum normaler Bakterien im Urin. Blutkulturen, Röntgen-Thorax und CT Abdomen waren nicht hinweisend auf eine disseminierte BCG-Infektion oder einen Tumor. Bei unklarer Sachlage wurde keine Therapie begonnen.
Weiterer Verlauf und ergänzende Abklärungen
Nach ungefähr drei Monaten entwickelte der Patient einen grünlich produktiven Husten, das Körpergewicht nahm fortlaufend auf minimal 92 kg ab und er beklagte auch neu Kopf- und Rückenschmerzen. Abends mass er jeweils Körpertemperaturen von um die 37,5 °C. Der Patient wurde angewiesen bei differentialdiagnostisch möglicher Lungentuberkulose eine FFP2-Maske zu tragen.
Serologie
• HAV-IgG/ positiv, HAV-IgM negativ | Anti-HBs positiv mit 120 IE/l [<10] | Hbs-Antigen negativ | Anti-Hbc-IgG/IgM positiv | HBV-DNS nicht nachweisbar | HCV-Screening negativ | HEV-IgG/IgM negativ |
• Keine Autoimmunhepatitis-typischen Autoantikörper (Aktin, glatte Muskulatur, Mitochondrien, M2, LKM1, LC1, SLA, GP210, SP100)
• Keine ANCA (MPO und PR3)
• Nachweis unspezifische ANA 1:640 [<1:320] mit AC-8, 9, 10 Muster
Mikrobiologische Befunde
• Sputum (1 von multiplen): Mikroskopie: keine säurefesten Stäbchen nachweisbar; Mykobakterium tuberculosis-Komplex-DNA: negativ; Kultur: Mykobakterium bovis BCG nachweisbar
Bildgebung
• Ultraschall Abdomen: Bis auf Lebersteatose unauffällig
• CT Thorax mit Kontrastmittel: vergrösserte Lymphknoten rechts hilär bis 12 mm, mehrere intrapulmonale Noduli bis max. 4mm
• Low-dose-CT Thorax (im Verlauf): Verglichen mit der Voruntersuchung: Stationäre zentral betonte Bronchialwandverdickung. Vorbestehend vereinzelte pulmonale Noduli beidseits. Kein Nachweis von Infiltraten.
Weg zur Diagnose/Kommentar
Nach mehrmaligen Versuchen gelang in einer Sputum-Probe schlussendlich der Nachweis von Mycobacterium bovis BCG. Die erste Computertomographie des Thorax mit Kontrastmittel fand Lymphknotenvergrösserungen hilär und intrapulmonale Noduli; die zweite low-dose Computertomographie vor Therapiebeginn detektierte Bronchialwandverdickungen und die bekannten, vereinzelten pulmonalen Noduli auf beiden Lungen. Die FFP2-Maskenpflicht wurde aufgrund fehlender aerogenen Übertragbarkeit der BCG-Infektion aufgehoben.
Therapie des Patienten
Der Patient wurde mit Isoniazid 300mg/Tag und Rifampicin 600mg/Tag, kombiniert mit Ethambutol 25mg/kg Körpergewicht pro Tag für zwei Monate, danach 15mg pro Kilogramm Körpergewicht sowie Vitamin B6 40mg/Tag behandelt. Initial wurden alle zwei Wochen Blutbild sowie Leber- und Nierenwerte kontrolliert, zudem wurden durchgehend alle vier Wochen der Vibrationssinn geprüft, zum Ausschluss einer Polyneuropathie unter Isoniazid trotz Vitamin B6-Gabe, sowie ophthalmologische Untersuchungen mit Perimetrie und Farbsehen unter Ethambutol zur Früherkennung einer Optikusneuritis durchgeführt. Es wurden zusätzlich nach acht Wochen und bei Therapieabschluss Sputumkulturen abgenommen, welche negativ blieben.
Es ist wichtig, dass die Therapie bei Verdacht auf BCG-Infekt nach Ausschluss anderer Ursachen sofort begonnen wird. Im vorliegenden Fall wurden die Kulturresultate aus Sputumproben abgewartet, da differentialdiagnostisch eine klassische Lungentuberkulose möglich war und diese, falls vorliegend, resistenzgerechte Therapie bedingt hätte. Erst als BCG im Sputum nachgewiesen wurde, wurde die Therapie begonnen.
Nach Vertiefung in die in diesen Artikel eingeflossene Literatur sind die Autoren der Ansicht, dass die Therapie bei diesem Patienten deutlich früher, wahrscheinlich schon vor oder spätestens kurz nach der Zuweisung, hätte begonnen werden sollen. Weder das Abwarten einer klaren Organbeteiligung (produktiver Husten), der Sputumresultate, noch der Resistenzprüfung war zwingend und hat zu einer erheblichen Therapieverzögerung geführt. Wir hoffen, mithilfe dieses Praxis-Falls unseren Kolleginnen und Kollegen ein besser informiertes Vorgehen in einer ähnlichen Situation ermöglichen zu können.
Oberarzt
Universitätsspital Zürich,
Klinik und Poliklinik für Innere Medizin
8091 Zürich
aresh.farokhnia@usz.ch
Es bestehen keine Interessenskonflikte.
Historie:
Manuskript eingereicht: 25.09.2023
Manuskript akzeptiert: 08.11.2023
1. Gandhi NM, Morales A, Lamm DL. Bacillus Calmette-Guérin immunotherapy for genitourinary cancer. BJU Int. 2013;112(3):288-297. doi:10.1111/j.1464-410X.2012.11754.x
2. Green DB, Kawashima A, Menias CO, et al. Complications of Intravesical BCG Immunotherapy for Bladder Cancer. Radiogr Rev Publ Radiol Soc N Am Inc. 2019;39(1):80-94.
3. Lamm DL. Efficacy and Safety of Bacille Calmette-Guérin Immunotherapy in Superficial Bladder Cancer. Clin Infect Dis. 2000;31(Supplement_3):S86-S90. doi:10.1086/314064
4. Gonzalez OY, Musher DM, Brar I, et al. Spectrum of bacille Calmette-Guérin (BCG) infection after intravesical BCG immunotherapy. Clin Infect Dis. 2003;36(2):140-148. doi:10.1086/344908
5. Marques M, Vazquez D, Sousa S, Mesquita G, Duarte M, Ferreira R. Disseminated Bacillus Calmette-Guérin (BCG) infection with pulmonary and renal involvement: A rare complication of BCG immunotherapy. A case report and narrative review. Pulmonology. 2020;26(6):346-352. doi:10.1016/j.pulmoe.2019.10.001
6. Kusakabe T, Endo K, Nakamura I, et al. Bacille Calmette-Guérin (BCG) spondylitis with adjacent mycotic aortic aneurysm after intravesical BCG therapy: a case report and literature review. BMC Infect Dis. 2018;18(1):290. doi:10.1186/s12879-018-3205-7
7. Witjes JA, Palou J, Soloway M, et al. Clinical Practice Recommendations for the Prevention and Management of Intravesical Therapy–Associated Adverse Events. Eur Urol Suppl. 2008;7(10):667-674. doi:10.1016/j.eursup.2008.08.001
8. To U, Kim J, Chia D. Case Report Disseminated BCG: Complications of Intravesical Bladder Cancer Treatment. Published online 2014. doi:10.1155/2014/362845
9. Bernatowska EA, Wolska-Kusnierz B, Pac M, et al. Disseminated bacillus Calmette-Guérin infection and immunodeficiency [14]. Emerg Infect Dis. 2007;13(5):799-801. doi:10.3201/eid1305.060865
10. Schaberg T, Bauer T, Brinkmann F, et al. S2k-Leitlinie: Tuberkulose im Erwachsenenalter: Eine Leitlinie zur Diagnostik und Therapie, einschließlich Chemoprävention und -prophylaxe des Deutschen Zentralkomitees zur Bekämpfung der Tuberkulose e.V. im Auftrag der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin e.V. Pneumologie. 2017;71(06):325-397. doi:10.1055/s-0043-105954
11. Pérez-Jacoiste Asín MA, Fernández-Ruiz M, López-Medrano F, et al. Bacillus Calmette-Guérin (BCG) infection following intravesical BCG administration as adjunctive therapy for bladder cancer: incidence, risk factors, and outcome in a single-institution series and review of the literature. Medicine (Baltimore). 2014;93(17):236-254. doi:10.1097/MD.0000000000000119
12. González-Del Vecchio M, Ruíz-Serrano MJ, Gijón P, et al. Differences between a probable and proven BCG infection following intravesical instillations: 16 years experience in a tertiary care hospital. Diagn Microbiol Infect Dis. 2016;85(3):338-343. doi:https://doi.org/10.1016/j.diagmicrobio.2016.04.006
13. Levi LI, Schlemmer F, de Castro N, et al. Bacillus Calmette-Guerin infection following intravesical instillation: Does the strain matter? Médecine Mal Infect. 2019;49(5):350-355. doi:https://doi.org/10.1016/j.medmal.2018.11.014
14. Babjuk M, Burger M, Compérat EM, et al. European Association of Urology Guidelines on Non-muscle-invasive Bladder Cancer (TaT1 and Carcinoma In Situ) – 2019 Update. Eur Urol. 2019;76(5):639-657. doi:10.1016/j.eururo.2019.08.016
15. Hatipoǧlu ON, Osma E, Manisali M, et al. High resolution computed tomographic findings in pulmonary tuberculosis. Thorax. 1996;51(4):397-402. doi:10.1136/thx.51.4.397
16. Skoura E, Zumla A, Bomanji J. Imaging in tuberculosis. Int J Infect Dis. 2015;32:87-93. doi:10.1016/j.ijid.2014.12.007
17. Martini K, Barth BK, Nguyen-Kim TDL, Baumueller S, Alkadhi H, Frauenfelder T. Evaluation of pulmonary nodules and infection on chest CT with radiation dose equivalent to chest radiography: Prospective intra-individual comparison study to standard dose CT. Eur J Radiol. 2016;85(2):360-365. doi:10.1016/j.ejrad.2015.11.036
18. He W, Chen BD, Lv Y, et al. Use of low-dose computed tomography to assess pulmonary tuberculosis among healthcare workers in a tuberculosis hospital. Infect Dis Poverty. 2017;6(1):68. doi:10.1186/s40249-017-0274-6
19. S3-Leitlinie Harnblasenkarzinom. Published online 2020:400.
20. Rischmann P, Desgrandchamps F, Malavaud B, Chopin DK. BCG Intravesical Instillations: Recommendations for Side-Effects Management. Eur Urol. 2000;37(Suppl. 1):33-36. doi:10.1159/000052381
21. World Health Organization. Regional Office for South-East Asia. Ending TB in the South-East Asia Region: Regional Strategic Plan 2016-2020. World Health Organization; 2016. Accessed July 27, 2022. https://apps.who.int/iris/handle/10665/205065
PRAXIS
- Vol. 113
- Ausgabe 2
- Februar 2024