- LDL-senkende Medikamente: Was steht 2023 zur Verfügung?
Herz-Kreislauf-Erkrankungen sind weltweit die häufigste Todesursache und fordern jedes Jahr schätzungsweise 17,9 Millionen Menschenleben. Es besteht ein dosisabhängiger Zusammenhang zwischen dem absoluten Ausmass der Exposition des Gefässsystems gegenüber Low-Density-Lipoprotein-Cholesterin (LDL) und dem Risiko einer atherosklerotischen Herz-Kreislauf-Erkrankung. Metaanalysen bestätigen die positiven Auswirkungen einer LDL-Reduktion.
Neben der Änderung des Lebensstils, die der Grundstein für die Primär- und Sekundärprävention bleibt, ist es pharmakologisch möglich, den LDL-Spiegel im Plasma zu senken. Dieser Beitrag beschreibt, wo wir, mehr als 30 Jahre nach den ersten therapeutisch genutzten Statinen, wir mit lipidsenkenden Medikamenten stehen.
Einleitung
Herz-Kreislauf-Erkrankungen sind weltweit die häufigste Todesursache und fordern jedes Jahr schätzungsweise 17,9 Millionen Menschenleben [1]. Die Framingham-Herz- Studie konnte bereits 1959 zeigen, dass ein erhöhter Cholesterinspiegel im Blut ein unabhängigere Risikofaktor für Herzerkrankungen darstellt [2]. Seitdem haben separate Metaanalysen von mehr als 200 prospektiven Mendelischen Randomisierungsstudien, prospektiven Kohortenstudien und randomisierten, kontrollierten Studien mit mehr als zwei Millionen Teilnehmenden und mehr als 150 000 kardiovaskulären Ereignissen eindeutig bewiesen, dass ein dosisabhängiger Zusammenhang zwischen dem absoluten Ausmass der Exposition des Gefässsystems gegenüber Low-Density-Lipoprotein-Cholesterin (LDL) und dem Risiko einer atherosklerotischen Herz-Kreislauf- Erkrankung besteht [3]. Die verschiedenen Metaanalysen bestätigen die positiven Auswirkungen einer LDL-Reduktion, da jede Senkung um 1 mmol/l mit einer signifikanten Verringerung des relativen Risikos für schwere vaskuläre und koronare Ereignisse um 22 % verbunden ist [4].
Neben der Änderung des Lebensstils, die ausführlich untersucht wurde und der Grundstein für die Primär- und Sekundärprävention bleibt, ist es durch verschiedene Mechanismen pharmakologisch möglich, den LDL-Spiegel im Plasma zu senken. Mehr als 30 Jahre nach den ersten therapeutisch genutzten Statinen stellt sich die Frage, wo wir mit den lipidsenkenden Medikamenten stehen.
Statine
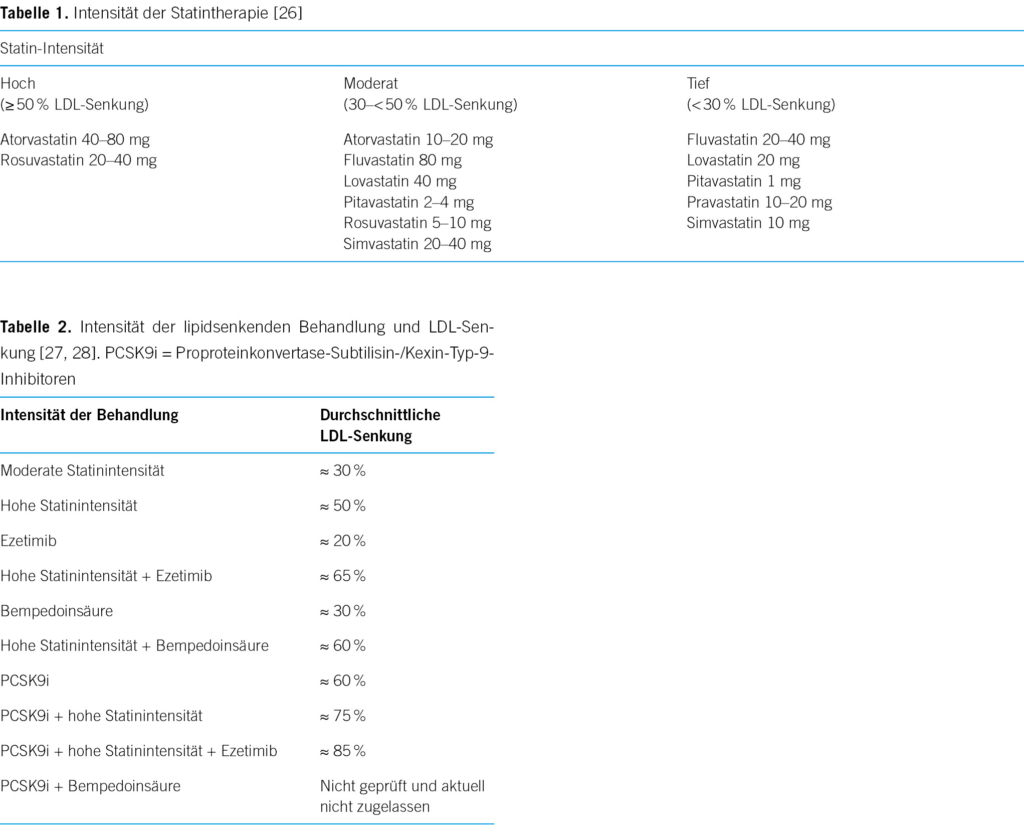
Statine hemmen die Hydroxymethylglutaryl-Coenzym-A-Reduktase, ein Enzym, das für die Synthese von Cholesterin in den Hepatozyten verantwortlich ist, und verursacht so eine Senkung des LDLs und des gesamten Cholesterins im Blut [5]. Die Reduktion des intrazellulären Cholesterins fördert die verstärkte Expression des LDL-Rezeptors an der Oberfläche der Hepatozyten, was wiederum zu einer erhöhten Aufnahme von LDL aus dem Blut und zur Senkung der Plasmakonzentration von LDL führt [6]. Auch wenn der Mechanismus noch nicht vollständig geklärt ist, senken Statine auch den Triglyceridspiegel in der Regel um 10–20 % gegenüber dem Ausgangswert [7]. Statin wird somit als erstes Medikament der Wahl bei Hochrisikopersonen mit Hypertriglyceridämie eingesetzt [6]. Statine, die den LDL-Cholesterinspiegel stärker senken (sogenannte high-Intensity statins; LDL-Senkung um 50 % oder mehr) reduzieren die Anzahl der kardiovaskulären Ereignisse in einem grösseren Ausmass als Statine mit einer geringeren LDL-Senkungsfähigkeit. Nur zwei Statine unter bestimmter Dosierung werden als high-intensity bezeichnet und deswegen weltweit am meistens verschrieben (Tabelle 1). Obwohl der Nutzen eindeutig belegt ist und langjährige klinische Erfahrungen zur Sicherheit und Verträglichkeit vorliegen, ist die Realität weiterhin unbefriedigend, da nur etwa 20 % der Personen mit sehr hohem/hohem Risiko den empfohlenen risikobestimmten LDL-C-Grenzwert mit einer Statinmonotherapie erreichen [8].
Trotz ihrer weit verbreiteten Anwendung stellen das Absetzen und die Malcompliance aufgrund von Nebenwirkungen (meistens Myalgien) nach wie vor eine grosse Herausforderung sowohl in der Primär- als auch in der Sekundärprävention dar. Die Prävalenz der Statinintoleranz ist ebenfalls äusserst umstritten, was zum Teil auf die Schwierigkeiten bei der Identifizierung und Diagnose zurückzuführen ist, insbesondere im Hinblick auf Muskelsymptome. Aus Beobachtungsstudien geht hervor, dass sie bei 10–15 % der Patientinnen und Patienten auftritt [9]. Unerwünschte Nebenwirkungen sind im Allgemeinen von der Statinklasse, der Dosierung, dem Alter, dem Geschlecht und der Komorbidität abhängig [10]. Zu den Strategien zur Behandlung von Statinunverträglichkeiten gehören die Reduktion der Statindosis, die Umstellung der Therapie auf eine andere Statinklasse, die Einnahme von Medikamenten im alternativen Tagesrhythmus und das Einsetzen von anderen lipidsenkenden Medikamenten [11].
Ezetimib
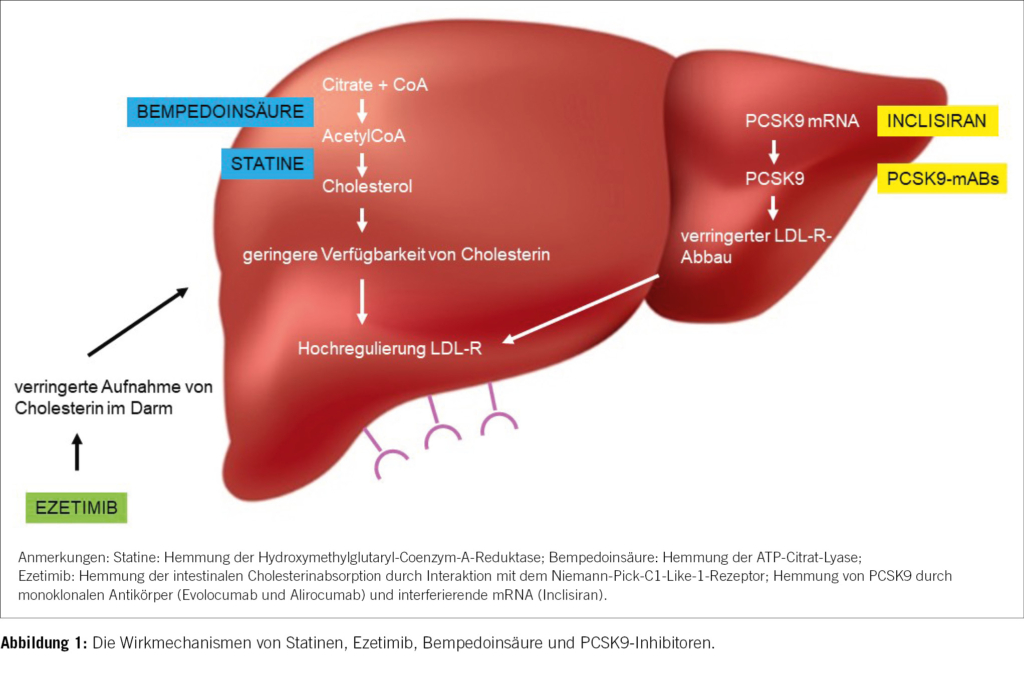
Ezetimib hemmt die intestinale Aufnahme von Cholesterin aus der Nahrung auf der Ebene des Dünndarms durch Interaktion mit dem Niemann-Pick-C1-Like-1-Rezeptor (Abb. 1), ohne die Absorption von fettlöslichen Nährstoffen zu beeinträchtigen. Ezetimib ist das bislang einzige Medikament aus der Klasse der selektiven Cholesterinabsorptionshemmer und ist seit 2002 in Europa zugelassen [12]. In klinischen Studien senkte eine Ezetimib-Monotherapie von 10 mg/Tag den LDL-Spiegel bei Personen mit Hypercholesterinämie um 15–22 % (Tabelle 2) [13]. Die Kombinationstherapie Statin/Ezetimib senkt nicht nur die LDL-Werte, sondern hat im Vergleich zur Statinmonotherapie auch eine signifikante und positive Wirkung auf die Insulinempfindlichkeit, das viszerale Fett und den Blutdruck [14]. Verglichen mit einem hochdosierten Statin allein stellt die Zugabe von Ezetimib zu einem niedrigdosierten Statin daher eine alternative Strategie dar, um nicht nur angemessene LDL-Cholesterinkonzentrationen zu erreichen, sondern auch, um die erforderliche Dosis der Statine zu reduzieren und gleichzeitig die mit Statinen verbundenen unerwünschten Wirkungen zu reduzieren. In der randomisierten, offenen, multizentrischen RACING-Studie erwies sich eine moderat intensive Statintherapie in Kombination mit Ezetimib in Bezug auf die Langzeitprognose bei Personen mit Herz-Kreislauf-Erkrankungen als ebenso wirksam wie eine hochintensive Statin-Monotherapie. Der Anteil derjenigen, die die Behandlung mit einem Statin mittlerer Intensität + Ezetimib im Vergleich zu einem Statin hoher Intensität wegen unerwünschter Wirkungen abgebrochen oder die Dosis reduziert haben, betrug 4,8 gegenüber 8,2 % (p < 0,001) [15].
Bempedoinsäure
Bempedoinsäure ist ein neuartiges kleines Molekül, das die Cholesterinsynthese hemmt, indem es die Wirkung der ATP-Citrat-Lyase hemmt (Abb. 1) [16]. Die CLEAR-Harmony-Studie hat 2230 Personen mit nachgewiesenen atherosklerotischen kardiovaskulären Erkrankung oder heterozygoter familiärer Hypercholesterinämie unter maximaler Statindosis rekrutiert, die zu Bempedoinsäure oder Placebo randomisiert wurden. Es zeigte sich ein signifikanter Unterschied im LDL-Spiegel von –16,5 % zum Ausgangswert. 1,8 % der Behandelten unter Bempedoinsäure erlitten während der Studie aufgrund einer Erhöhung des Harnsäurespiegels im Serum (Hemmung des renal-tubulären = Organo-Anion-Transporter-2 durch Bempedoinsäure) einen Gichtanfall [17]. Patientinnen und Patienten mit einer Vorgeschichte von bzw. Prädisposition für Gicht sollten somit eine Therapie mit Bempedoinsäure vermeiden. Unter eingeleiteter Therapie soll der Harnsäurespiegel regelmässig nachkontrolliert werden. In der Schweiz können seit dem 1. Dezember 2022 Rezepte ohne Kostengutsprache unter Einhaltung der aktuellen Limitatio des Bundesamts für Gesundheit (BAG)ausgestellt werden. Nilemdo® (180-mg-Tablette Bempedoinsäure) und Nustendi® (Kombipräparat, Tablette 180 mg Bempdoinsäure und 10 mg Ezetimib) werden nur vergütet, wenn zuvor über mindestens drei Monate mit der maximal verträglichen Dosierung einer intensivierten LDL-senkenden Therapie mit einem Statin in Kombination mit Ezetimib die LDL-Werte von ≥ 1,8 mmol/l in der sekundären Prävention bei Vorliegen einer bestätigten, klinisch manifesten atherosklerotisch kardiovaskulären Erkrankung nicht erreicht werden konnten. In der primären Prävention bei einer heterozygoten familiären Hypercholesterinämie muss das LDL-Wert ≥ 2,6 mmol/l liegen. Die Diagnose und Erstverordnung sowie regelmässige Kontrollen des Therapieerfolgs müssen durch eine Spezialistin/einen Spezialisten (Fachärztin/- arzt FMH der Angiologie, Diabetologie/Endokrinologie, Kardiologie, Nephrologie, Neurologie oder durch ausgewiesene Hypercholesterinämie-Expertinnen und -Experten) durchgeführt werden [18].
PCSK9-Inhibitoren
Proproteinkonvertase Subtilisin/Kexin-Typ-9 (PCSK9) wurde 2003 entdeckt und hat sich als wichtiger Regulator des Cholesterinstoffwechsels erwiesen [19]. Eine erhöhte Aktivität wird mit höheren LDL-Werten in Verbindung gebracht, da sie auf den Abbau von LDL-Rezeptoren gerichtet ist. Nachdem PCSK9 an die LDL-Rezeptoren auf der Hepatozytenoberfläche gebunden hat, werden die Rezeptoren gezielt lysosomal abgebaut. PCSK9 fördert also den Abbau von LDL-Rezeptoren und verringert dadurch die Clearance von LDL-Cholesterin aus dem Blutkreislauf [20]. Das Verständnis dieser grundlegenden Prinzipien des Cholesterinstoffwechsels führte zur Entwicklung von Medikamenten, die PCSK9 gezielt herunterregulieren (Abb. 1).
Monoklonale Antikörper gegen PCSK9 wurden entwickelt, und zwei von ihnen sind seit 2017 in der Schweiz zugelassen. Alirocumab (Praluent®) und Evolucumab (Repatha®) sind vollständig humanisierte monoklonale Antikörper, die in Abständen von 2 bis 4 Wochen subkutan injiziert werden und den Gesamt- und LDL-Cholesterinspiegel hochwirksam senken. Als Monotherapie oder in Kombination mit einem Statin senken sie den LDL-Cholesterinspiegel in der Regel um 60 bis 80 % (Tabelle 2). Die Wirkung hält an, solange die Behandlung fortgesetzt wird [21]. Die FOURIER- und ODYSSEY-Studien sind zwei randomisierte Kontrollstudien, in denen untersucht wurde, ob die monoklonalen PCSK9-Antikörper Evolocumab (FOURIER) bzw. Alirocumab (ODYSSEY) das Risiko eines kardiovaskulären Ereignisses bei Patientinnen und Patienten mit kardiovaskulären Erkrankungen vor dem Hintergrund einer Statintherapie verringern können. Die Ergebnisse beider Studien zeigten, dass beide Substanzen das Risiko für den primären Endpunkt (eine Kombination aus kardiovaskulären Ereignissen) senkten [22, 23].
Inclisiran (Levqio®) ist eine kleine interferierende mRNA, die die intrazelluläre hepatische Synthese von PCSK9 via Hemmung der Translation des PCSK9-Proteins verhindert. Dies führt zu einer verringerten Synthese von intrazellulärem PCSK9. Nach Verabreichung an Personen, die ein maximal verträgliches Statin erhalten, senkt Inclisiran den LDL-Cholesterinspiegel um weitere 50 % [24]. Die Ergebnisse der ORION-3-Studie wurden im Januar 2023 publiziert und liefern die bisher längste Sicherheitsnachbeobachtung in einer Inclisiran-Studie. Inclisiran führt als Ergänzung zur Statintherapie eine wirksame und anhaltende Senkung des LDLs herbei und wurde über vier Jahre hinweg gut vertragen [25]. Aufgrund seines von monoklonalen Antikörpern abweichenden Wirkmechanismus wird Inclisiran nur alle sechs Monate subkutan verabreicht. Levqio® ist in der Schweiz seit November 2021 zugelassen.
Wie für die Bempedoinsäure ist seit Dezember 2022 auch für das Verschreiben von PCSK9-Inhibitoren [18] keine Kostengutsprache mehr nötig.
Im Artikel verwendete Abkürzungen
BAG Bundesamt für Gesundheit
LDL Low-Density-Lipoprotein-Cholesterin
PCSK9 Proproteinkonvertase Subtilisin/Kexin-Typ-9
Klinik für Kardiologie
Inselspital Bern
Freiburgstrasse 18
3010 Bern
Schweiz
noe.corpataux@insel.ch
Historie
Manuskript akzeptiert: 21.02.2023
Interessenskonflikte
Noé Corpataux hat keine Interessenkonflikte. Konstantinos
Koskinas bezieht Referentenhonorare/Honorare von Amgen,
Sanofi, Daiichi Sankyo.
1. WHO. Cardiovascular diseases. Geneva; WHO: 2023. https:// www.who.int/health-topics/cardiovascular-diseases#tab= tab_1. 2023; letzter Zugriff: 27.02.2023
2. Dawber TR, Kannel WB, Revotskie N, Stokes J 3rd, Kagan A, Gordon T. Some factors associated with the development of coronary heart disease: six years’ follow-up experience in the Framingham study. Am J Public Health Nations Health. 1959. 49(10):1349–1356.
3. Ference BA, Ginsberg HN, Graham I, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2017.38(32):2459–2472.
4. Silverman MG, Ference BA, Im K, et al. Association Between Lowering LDL-C and Cardiovascular Risk Reduction Among Different Therapeutic Interventions: A Systematic Review and Meta-analysis. JAMA. 2016;316(12):1289–1297.
5. Stancu C, Sima A. Statins: mechanism of action and effects. J Cell Mol Med. 2001;5(4):378–387.
6. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111– 188.
7. Reiner Z. Managing the residual cardiovascular disease risk associated with HDL-cholesterol and triglycerides in statin-treated patients: a clinical update. Nutr Metab Cardiovasc Dis. 2013.23(9):799–807.
8. Ray KK, Molemans B, Schoonen WM, et al. EU-Wide Cross- Sectional Observational Study of Lipid-Modifying Therapy Use in Secondary and Primary Care: the DA VINCI study. Eur J Prev Cardiol. 2021. 28(11):1279–1289.
9. Banach M, Rizzo M, Toth PP, et al. Statin intolerance – an attempt at a unified definition. Position paper from an International Lipid Expert Panel. Arch Med Sci. 2015;11(1):1–23.
10. Ward NC, Watts GF, Eckel RH. Statin Toxicity. Circ Res. 2019; 124(2):328–350.
11. Raju SB, Varghese K, Madhu K. Management of statin intolerance. Indian J Endocrinol Metab. 2013;17(6):977–982.
12. Grundy SM, Stone NJ, Bailey AL, et al. 2018 AHA/ACC/AACVPR/ AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2019;73(24):e285–e350.
13. Phan BA, Dayspring TD, Toth PP. Ezetimibe therapy: mechanism of action and clinical update. Vasc Health Risk Manag. 2012;8:415–427.
14. Hong N, Lee YH, Tsujita K, et al. Comparison of the Effects of Ezetimibe-Statin Combination Therapy on Major Adverse Cardiovascular Events in Patients with and without Diabetes: A Meta-Analysis. Endocrinol Metab (Seoul). 2018;33(2):219– 227.
15. Kim BK, Hong SJ, Lee YJ, et al. Long-term efficacy and safety of moderate-intensity statin with ezetimibe combination therapy versus high-intensity statin monotherapy in patients with atherosclerotic cardiovascular disease (RACING): a randomised, open-label, non-inferiority trial. Lancet. 2022. 400(10349): 380–390.
16. Saeed A. Ballantyne CM. Bempedoic Acid (ETC-1002): A Current Review. Cardiol Clin. 2018;36(2):257–264.
17. Ray KK, Bays HE, Catapano AL, et al. Safety and Efficacy of Bempedoic Acid to Reduce LDL Cholesterol. N Engl J Med. 2019;380(11):1022–1032.
18. BAG – Bundesamt für Gesundheit. Spezialitätenliste. Bern: BAG: 2023. https://www.spezialitaetenliste.ch/ShowPrepara tions.aspx; letzter Zugriff: 27.02.2023.
19. Abifadel M, Varret M, Rabès JP, et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet. 2003;34(2):154–156.
20. Lagace TA. PCSK9 and LDLR degradation: regulatory mechanisms in circulation and in cells. Curr Opin Lipidol. 2014; 25(5):387–393.
21. Koren MJ, Sabatine MS, Giugliano RP, et al. Long-term Low- Density Lipoprotein Cholesterol-Lowering Efficacy, Persistence, and Safety of Evolocumab in Treatment of Hypercholesterolemia: Results Up to 4 Years From the Open-Label OSLER-1 Extension Study. JAMA Cardiol. 2017;2(6):598–607.
22. Schwartz GG, Steg PG, Szarek M, et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018;379(22):2097–2107.
23. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;376(18):1713–1722.
24. Ray KK, et al. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol. N Engl J Med. 2020;382(16):1507– 1519.
25. Ray KK, Wright RS, Kallend D, et al. Long-term efficacy and safety of inclisiran in patients with high cardiovascular risk and elevated LDL cholesterol (ORION-3): results from the 4-year open-label extension of the ORION-1 trial. Lancet Diabetes Endocrinol. 2023.
26. Stone NJ, Robinson JG, Lichtenstein AH, et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014. 63(25 Pt B):2889–934.
27. Ballantyne CM, Bays HE, Louie MJ, Smart J, Zhang Y, Ray KK. Factors Associated With Enhanced Low-Density Lipoprotein Cholesterol Lowering With Bempedoic Acid. J Am Heart Assoc. 2022;11(15):e024531.
28. McCaughey C, Ranganathan D, Kerins M, Murphy G, Murphy R. Dyslipidaemia management in the cardiac rehabilitation clinic of a tertiary referral centre: analysis of the impact of new ESC guidance on LDL-C target achievement. Ir J Med Sci. 2022; 191(6):2569–2577.
PRAXIS
- Vol. 112
- Ausgabe 11
- September 2023