- Leberzirrhose
Die Leberzirrhose, die ein Spätstadium diverser chronischer Lebererkrankungen darstellt, ist eine häufige Erkrankung mit hoher Morbidität und Mortalität. Die häufigsten Ursachen der Zirrhose in industrialisierten Ländern sind die alkoholbedingte Lebererkrankung, die nicht-alkoholische Fettlebererkrankung und chronische Virushepatitiden. Die Zirrhose wird oft spät diagnostiziert, da sie lange asymptomatisch verlaufen kann. Daher sind das Hepatopathie-Screening bei Risikopatientinnen und -patienten und die Fibrose-Surveillance mitunter mittels Ultraschalluntersuchung bei bestehender chronischer Hepatopathie essenziell. Zur Diagnosesicherung gehört eine Leberbiopsie. Bei optimaler Therapie ist die Zirrhose in manchen Fällen vermeidbar, in anderen potenziell reversibel. Im Stadium der dekompensierten Zirrhose, typischerweise gekennzeichnet durch Aszites, sterben Betroffene oft an rekurrierenden Infektionen oder dem hepatozellulärem Karzinom, sofern keine Heilung mittels Lebertransplantation möglich ist. Die Prävention und Behandlung der Komplikationen sowie die Evaluation einer Transplantation bedingen die Zusammenarbeit mit einem Zentrumspital.
Pathophysiologie
Die Begriff Leberzirrhose stammt aus dem Griechischen kírrosis, was so viel wie gelb-orange bedeutet und sich auf die narbige Oberfläche der zirrhotischen Leber bezieht. Die Zirrhose stellt eine fortgeschrittene Form der Leberfibrosierung dar. Ausgelöst durch unterschiedliche Ätiologien, die mit einer chronisch hepatischen Entzündung einhergehen, kommt es aufgrund der Aktivierung von Kupffer- und Sternzellen zur Fibrogenese und damit nachfolgend zur hepatozellulären Schädigung. Histologisch ist die Zirrhose charakterisiert durch diffuse noduläre Regeneration, fibröse Septen und eine gestörte zelluläre und vaskuläre Leberarchitektur. Zur portalen Hypertonie kann es kommen, weil sich der hepatische Flusswiderstand erhöht und die Leberdurchblutung gesteigert ist [1].
Mit zunehmendem Schweregrad der Zirrhose und der portalen Hypertonie kommt es unter anderem zu einer pathologisch erhöhten Darmpermeabilität, gesteigerten bakteriellen
Translokation und somit zur Zirkulation von Zytokinen und mikrobiellen Abbauprodukten. Die damit einhergehende systemische Inflammation führt zu einem erhöhten Komplikationsrisiko [2, 3].
Epidemiologie & Ätiologie
Die Zirrhose ist eine häufige und schwere Erkrankung, die jährlich weltweit zu mehr als 1 Million Todesfällen führt [4]. Pro 100 000 Einwohner weist die Zirrhose 560 Disability-Adjusted Life Years auf, was eine beträchtliche Summe der durch Tod oder krankheitsbedingte Behinderung verlorenen Lebensjahre darstellt [5]. Die häufigsten Ursachen der Zirrhose in industrialisierten Ländern sind die alkoholbedingte Lebererkrankung (ALD) [6], die an Prävalenz zunehmende nicht-alkoholische Fettlebererkrankung (NAFLD) (neuerdings wird auch der Terminus «metabolisch bedingte Fettlebererkrankung [MAFLD]» diskutiert [7]) und chronische Virushepatitiden Hepatitis B und C [8]. Weniger häufige Ätiologien sind angeborene Leberspeicherkrankheiten wie die Hämochromatose, ein Alpha-1-Antitrypsin-Mangel und Morbus Wilson sowie die Autoimmunhepatitis, primäre biliäre Cholangitis (PBS) und primäre sklerosierende Cholangitis (PSC) (Tabelle 1A).
Klinik und Krankheitsstadien
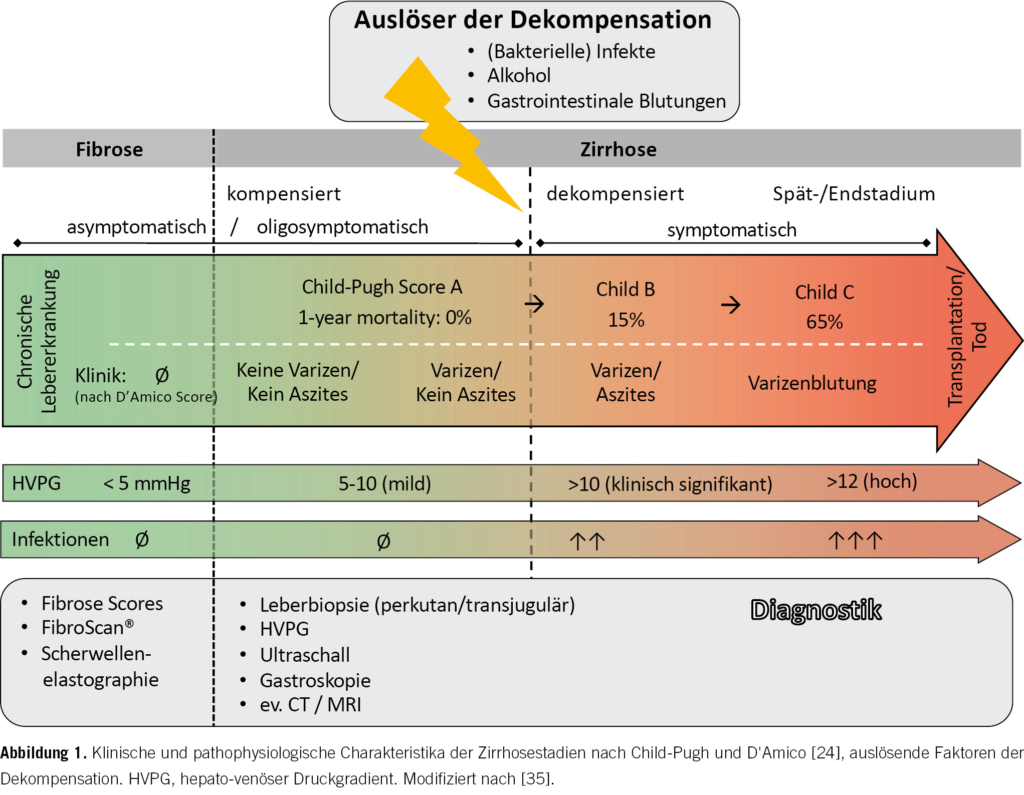
Klinisch liegt eine häufig lange währende asymptomatische Phase vor, genannt kompensierte Zirrhose, gefolgt von einer symptomatischen Phase, der dekompensierten Zirrhose, gekennzeichnet von Komplikationen der portalen Hypertonie [2]. Typische Zeichen der dekompensierten Zirrhose sind Ikterus, Splenomegalie, Aszites, Ösophagusvarizen, hepatische Enzephalopathie (HE) und Infektionen.
Der Übergang zur dekompensierten Zirrhose stellt meist einen schleichenden (progressiven) Prozess mit langsamer Entwicklung von Komplikationen dar, der nach neusten Erkenntnissen vom weniger häufigen akuten Beginn unterschieden werden sollte [9]. Die akut dekompensierte Zirrhose ist definiert als eine akute Verschlechterung resp. ein plötzliches Auftreten von Komplikationen, meist ausgelöst durch bakterielle Infektionen, schwere alkoholische Hepatitis, gastrointestinale Blutungen und toxische Enzephalopathie [10] (Abb. 1). Letztere Entität beinhaltet auch das akut-auf-chronische Leberversagen (ACLF), definiert als eine akute Dekompensation mit konsekutivem Organversagen, das eine hohe kurzfristige Sterblichkeit aufweist [11].
Lange galt die Leberzirrhose als irreversibles Endstadium chronischer Lebererkrankungen. Heute ist aber bekannt, dass die Krankheit einen dynamischen Prozess darstellt. Durch Behandlung der zugrunde liegenden Erkrankung konnte gezeigt werden, dass die Fibrose auch im Stadium der Zirrhose potenziell reversibel ist [12, 13].
Screening und Surveillance
Wegen des initial oft asymptomatischen Verlaufs bleibt die Leberzirrhose lange unerkannt. Es ist daher von grosser Bedeutung, Risikopopulationen auf Hepatopathien zu screenen und Patient_innen mit chronischen Lebererkrankungen langfristig zu überwachen, um einen Übergang zur Zirrhose frühzeitig zu entdecken.
Hepatopathie-Screening
Typische Risikofaktoren für ALD und NAFLD beinhalten übermässigen Alkoholkonsum, Adipositas, Typ-2-Diabetes mellitus bzw. das metabolische Syndrom. Sogenannte «Lifestyle-Modifikationen» sind daher ein essenzieller Therapieansatz. Intravenöser Drogenkonsum, Sexualverhalten mit erhöhtem Risiko und immunsuppressive Therapien gelten als Risikofaktoren für die chronischen Virushepatitiden B und C. Diese werden mittels serologischer Tests gesucht (Hepatitis B: HBsAg und HBcAk, Hepatitis C: HCV-Ak). Eine Transferrinsättigung > 45 % mit erhöhten Ferritinwerten kann auf eine Hämochromatose hinweisen.
Im Allgemeinen können in Risikopopulationen die Sonografie und die Blutanalyse (AST, ALT, GGT, AP, Bilirubin, Albumin, INR, Differenzialblutbild) wichtige Hinweise auf das Vorliegen einer Lebererkrankung liefern.
Surveillance der Fibrose und Zirrhose
Für Patient_innen mit bekannter chronischer Lebererkrankung stehen nicht-invasive Tests zur Verfügung, die der Abschätzung der Fibroseprogression dienen. In der hausärztlichen Praxis sind einfach zu berechnende Serum-Fibrose-Scores nützlich, z.B. der FIB-4-, der NAFLD-Fibrosis-Score oder der «AST to Platelet Ratio Index» (APRI) [14, 15, 16]. Dank ihres hohen negativ prädiktiven Werts können sie Patient_innen ohne Risiko für signifikante Fibrose identifizieren. Um die Steifigkeit der Leber zu messen, sind die transiente Elastografie (FibroScan®) und die Schwerwellenelastografie gut etabliert [15] (Abb. 1). Allerdings können die Messwerte durch Adipositas, Aszites, Kongestion, Cholestase oder Entzündung beeinflusst werden [15, 17]. Die Resultate sollten daher immer im klinischen Kontext und durch Fachärzte_innen interpretiert werden.
Diagnostik
Ziel der Diagnostik ist es, die Ätiologie der Zirrhose und das Ausmass der portalen Hypertonie zu bestimmen. Beides ist ausschlaggebend für die weitere Überwachung und Therapie.
Ultraschall
Sonografische Befunde können Hinweise für eine Leberzirrhose liefern: Eine höckrige Oberfläche, inhomogenes Parenchym und abgerundete Leberränder sind Anzeichen einer fortgeschrittenen Fibrose. Aszites, Splenomegalie und portosystemische Shunts weisen auf eine portale Hypertonie hin.
Ist die Diagnose Zirrhose einmal histologisch bestätigt, dient der Ultraschall der Früherkennung von Aszites, Portalvenenthrombose und des hepatozellulären Karzinoms (HCC). Sechsmonatliche Ultraschall-Kontrolluntersuchungen sind daher nach Diagnosestellung indiziert.
Leberbiopsie
Zur Sicherung der Diagnose einer Leberzirrhose bleibt die Biopsie zur histopathologischen Untersuchung von Lebergewebe der Goldstandard, wobei eine Leberbiopsie entweder perkutan oder transjugular durchgeführt werden kann. Das Risiko einer peritonealen Blutung bei der üblicherweise perkutan durchgeführten Biopsie ist gering (ca. 0,5–1 %) [18], jedoch unbedingt mit den Patient_innen abzuwägen. Beim Vorliegen einer schweren Koagulopathie oder Aszites ist von einer perkutanen Biopsie abzusehen. Alternativ besteht die Möglichkeit, via transjugulärem Zugang zur Lebervene die Leber zu punktieren, um so die Penetration der Leberkapsel zu vermeiden und das Blutungsrisiko zu minimieren. Zusätzlich wird hierbei der hepato-venöse Druckgradient (HVPG) gemessen, der eine signifikante portale Hypertonie feststellen kann (HVPG > 10 mmHg) [19] (Abb. 1).
Gastroskopie
Risikopatient_innen mit Leberzirrhose sollten mittels Gastroskopie auf das Vorliegen von Ösophagus- oder Fundusvarizen untersucht werden, um falls notwendig eine Behandlung zu beginnen. Bei sehr geringem Risiko von behandlungsbedürftigen Varizen (FibroScan®: < 20 kPa und Thrombozytenzahl: > 150 G/l [20]) kann zunächst auf ein Screening verzichten werden. Eine jährliche Kontrolle der Lebersteifigkeit und Thrombozytenzahl ist hingegen empfohlen. Im Fall von zunehmender Lebersteifigkeit und/oder sinkender Thrombozytenzahl ist eine Gastroskopie ratsam. Bei kompensierter Zirrhose ohne initialen Nachweis von Varizen, aber anhaltender Leberschädigung (z.B. aktiver Alkoholkonsum), sollten Gastroskopien im Abstand von zwei Jahren wiederholt werden. Bei Nachweis von kleinen Varizen und anhaltender Leberschädigung sind jährliche Endoskopien notwendig [21]. Bei hochgradigem Verdacht auf Zirrhose kann bereits vor der Biopsie eine Gastroskopie sinnvoll sein, denn höhergradige Varizen erfordern die Messung des HVPG im Rahmen einer transjugulären Biopsie (s.o.). Ein weiterer Befund der Gastroskopie kann die portal-hypertensive Gastropathie sein, hieraus ergibt sich allerdings keine unmittelbare therapeutische Konsequenz.
Prognose-Scores
Zirrhose-Scores basieren auf klinischen Parametern und ermöglichen eine einheitliche Einteilung der Schweregrade sowie die Prognose abzuschätzen. Die Child-Pugh-Klassifikation, die das 1-Jahres-Überleben prognostiziert, ist am weitesten verbreitet [22]. Der MELD-Score (Model of End-Stage Liver Disease) wurde entwickelt, um die Notwendigkeit einer Transplantation abzuschätzen und sagt die 3-Monats-Mortalität voraus [23]. D’Amico et al. [24] entwickelten eine Klassifizierung mit vier Stadien innerhalb des natürlichen Krankheitsverlaufes der Zirrhose, die jeweils unterschiedliche klinische Merkmale und Prognose aufweisen (Abb. 1).
Häufige Komplikationen und Therapie
Komplikationen treten typischerweise auf im Stadium der dekompensierten Leberzirrhose, was bei etwa 5 % der Patient_innen mit kompensierter Zirrhose jährlich geschieht [2]. Hospitalisationen, sinkende Lebensqualität und eine drastisch zunehmende Mortalität sind Folgen davon [24].
Nebst Auswirkungen auf die Leber selbst, sind multiple andere Organsysteme und Kompartimente von Komplikationen betroffen: u.a. Peritoneum (Aszites) Ösophagus und Magen (Varizen), Gehirn (hepatische Enzephalopathie), Immunsystem (rezidivierende Infektionen). Auch die Nieren, Lungen und das Herz können Schäden erleiden (Tabelle 1B).
Aszites
Zu den ersten und häufigsten Komplikationen gehört die Entstehung von Aszites. Durch pathologische bakterielle Translokation durch die Darmwand kann es bei Vorhandensein von Aszites zur spontan bakteriellen Peritonitis (SBP) kommen. Mittels Zellzahl, Differenzierung der Leukozyten, bakteriellen Kulturen, Albumin-Konzentration und ggf. zytologischer Untersuchung des Aszites kann dessen Ursache eruiert werden. Grosse Mengen Aszites sollten drainiert werden unter Substitution von Albumin (8 g/Liter punktierten Aszites). Bei kleineren Mengen Aszites und eventuell zusätzlich peripheren Ödemen lohnt sich eine diuretische Behandlung mit Spironolacton (Startdosis 100 mg/Tag mit Steigerung der Dosis um 100 mg alle 3 Tage bis maximal 400 mg/Tag bei [Ziel: 0,5 bis max. 1 kg Gewichtsreduktion/Tag; fehlendes Ansprechen: < 2 kg Gewichtsreduktion/Woche]). Unterstützend können zudem eine Salz- und Trinkmengenrestriktion sein (5–7 g Salz/Tag; 1,5–2 L Trinkmenge/Tag). In manchen Fällen kann eine Kombination mit Schleifendiuretika (z.B. Furosemid initial 40 mg/Tag oder Torasemid 10 mg/Tag) sinnvoll sein [25]. Bei refraktärem Aszites sollte die Anlage eines transjugulären, intrahepatischen, portosystemischen Shunts (TIPSS) evaluiert werden [26] und in palliativen Situationen kann die Anlage eines Dauerdrainagekatheters sinnvoll sein.
Gastro-ösophageale Varizen/Varizenblutung
Gastro-ösophageale Varizen entstehen bei portaler Hypertonie ausgehend von spontanen portosystemischen Shunts. Eine lebensbedrohliche Komplikation ist die Varizenblutung, weshalb bei grossen Varizen eine primärprophylaktische Therapie mit nicht-selektiven Betablockern (Carvedilol; initial 6,25 mg/Tag, bei guter Verträglichkeit nach 3 Tagen Steigerung auf 2 × 6,25 mg/Tag) evaluiert werden sollte. Im Fall der Varizenblutung muss eine sofortige Behandlung an einem Zentrumsspital erfolgen, da vasoaktive Medikamente (z.B. Octreotid, Terlipressin), eine endoskopische Varizenligatur, antibiotische Prophylaxe (Ceftriaxon) und die Evaluation eines «early» TIPSS indiziert sind [26].
Hepatische Enzephalopathie
Durch die gestörte Elimination von Proteinen aus dem portalvenösen Blut und der Akkumulation von Metaboliten wie Ammoniak kann es zu neuropsychiatrischen Veränderungen kommen, die HE genannt werden. Die Behandlung der HE sollte unter stationären Bedingungen erfolgen. Hierbei ist die Klärung der Ursache, eine intensive Überwachung und eine ausgebaute medikamentöse Therapie (z.B. Lactulose [10–20 g 2–4 ×/Tag mit Ziel von 2–3 weichen Stuhlgängen täglich, falls nicht peroral möglich 200–300 g per Einlauf] und Rifaximin [550 mg 2 ×/Tag]) benötigt. Bei rezidivierenden HE-Episoden profitieren die Patient_innen und Angehörigen von einer guten Instruktion zum Selbstmanagement.
Bakterielle Infektionen
Die erhöhte Anfälligkeit für Infektionen bei Leberzirrhose beruht auf einer geschwächten Immunantwort, welcher eine komplexen Pathophysiologie zugrunde liegt [27, 28]. Bakterielle Infektionen (SBP und Infektionen anderer Organe) benötigen eine resistenzgerechte intravenöse antibiotische Therapie.
Im Fall einer SBP, die sich anhand einer Neutrophilenzahl > 250/μl Aszites definiert, braucht es eine empirische Therapie mit Ceftriaxon (2 g/Tag) und Albuminsubstitution (1,5 g/kg Körpergewicht an Tag 1 und 1,0 g/kg an Tag 3) [26].
Infektionen machen über 50 % aller Hospitalisationen bei Zirrhosepatient_innen aus und gehen einher mit einer schlechten Langzeitprognose [24, 28].
Hepatorenales Syndrom (HRS)
Eine akute Niereninsuffizienz tritt bei Zirrhotikern häufig auf und ist in mehr als der Hälfte der Fälle prärenal bedingt, was primär eine Pausierung der Diuretika, Suche nach allfälliger Infektion und Behandlung mit Volumen (Albumin) erfordert. Seltener und meist nur bei fortgeschrittener Zirrhose tritt das HRS auf, dessen Pathophysiologie komplex, und das mit einer schlechten Prognose assoziiert ist. Die Diagnose bedingt u.a. das Vorhandensein einer portalen Hypertonie mit Aszites und den Ausschluss prä-, intra- und postrenaler Ursachen der Niereninsuffizienz, wozu eine differenzierte Urindiagnostik und Sonografie der Nieren erforderlich sind. Zum Management des HRS gehören Vasokonstriktoren (Terlipressin) und Albumininfusionen [26].
Hepatozelluläres Karzinom
Das Krebsrisiko bei Patient_innen mit Leberzirrhose ist signifikant erhöht. Am weitaus häufigsten ist das HCC, das jährlich bei 1–4 % der Zirrhosepatien_innen entsteht. Unbehandelt ist das mittlere Überleben neun Monate [2]. Zirrhosepatien_innen wird daher ein halbjährliches sonografisches HCC-Screening empfohlen. Zur Verbesserung der Sensitivität eignet sich zusätzlich die Messung des Alpha-Fetoproteins (AFP). Die spezifischen Therapieoptionen des HCC richten sich nach der Stadien-Klassifikation Barcelona Clinic Liver Cancer Group (BCLC) und sollten im Rahmen eines multidisziplinären Tumorboards diskutiert und festgelegt werden. Als Behandlung in frühen Krebsstadien kommen Tumorablation oder Resektion und die orthotope Lebertransplantation (OLT) in Frage. In fortgeschrittenen Stadien benötigen die Patient_Innen eine systemische Therapie [29]. Neuerdings zeigt auch die Immuntherapie gute Erfolge in der Behandlung des HCC [30].
Sarkopenie
Es ist nachgewiesen, dass Leberzirrhotiker durch Malnutrition relevante Einbussen an Muskelmasse und Funktion, genannt Sarkopenie, aufweisen [31]. Diese aggraviert sich in fortgeschrittenen Stadien der Zirrhose und ist verbunden mit einer erhöhten Mortalität [32]. Unter Umständen wird die Sarkopenie kaschiert durch einen adipösen Habitus. Daher sollte regelmässig der Liver frailty Index [33] bestimmt werden und bei V.a. Sarkopenie eine Bestimmung der Muskelmasse mittels CT sowie eine sportmedizinische Beratung und Therapie erfolgen. Zudem besteht bei Zirrhose auch ein erhöhtes Risiko für die Entwicklung von Osteopenie/Osteoporose, die nach Diagnosestellung ggf. eine fachgerechte Behandlung erfordert [31].
Splenomegalie
Als Folge der portalen Hypertonie kann es bei fortschreitender Zirrhose durch Blutrückstau zur Splenomegalie kommen. Hinweise dafür finden sich in der klinischen Untersuchung, der Sonografie und der differenzierten Blutuntersuchung in Form von Thrombo- oder Panzytopenie. Mittels Ultraschalluntersuchung kann die Milzgrösse bestimmt werden. Direkte Therapiemöglichkeiten bestehen keine.
Therapie
Das primäre Behandlungsziel der Zirrhose ist die Behandlung der zugrundliegenden Hepatopathie, um ein Fortschreiten der Zirrhose bzw. eine Dekompensation zu verhindern und teilweise sogar einen Rückgang der Fibrose zu erwirken. Dies beinhaltet z.B. das Sistieren von Alkoholkonsum, die Anwendung von Virostatika bei Virus-assoziierter Hepatitis, Immunsuppressiva bei Autoimmunhepatitis oder Aderlass bei Hämochromatose (Tabelle 1A). Noch immer gibt es keine zugelassenen Medikamente, die spezifisch zur Reduktion der Fibrose, unabhängig von der Ätiologie, beitragen, was ein wichtiger Bestandteil aktueller Forschungsprojekte ist.
Ebenso wichtig ist die symptomorientierte Behandlung der Komplikationen (s.o. und Tabelle 1B). Hierfür bedarf es nebst Fachärzt_innen eines interdisziplinären Teams: Ernährungs- und Physiotherapeut_innen sorgen für das Management von «Lifestyle-Modifikationen» (Gewichtsreduktion, ausgewogene, proteinreiche Ernährung [35 kcal/kg Körpergewicht; 1,2–1,5 g Protein/kg Körpergewicht], ggf. Salz- und Trinkmengenrestriktion bei Aszites [siehe oben]) und Vorbeugung von Sarkopenie durch Krafttraining [31]. Spezialisiertes Pflegepersonal trägt zu einer optimalen Patientenbegleitung bei (z.B. Screening-Untersuchungen, Schulung von Patien_innten und Selbstmanagement). Hierzu ist von der Schweizerischen Vereinigung für Hepatologie (SASL) eine durch Pflegeexpertinnen erstellte Broschüre zur Patientenschulung bei Leberzirrhose verfügbar (information-lebererkrankung@kssg.ch).
Schreitet die Zirrhose trotz optimaler therapeutischer Massnahmen fort, sollte bei Auftreten von Komplikationen oder spätestens nach dem ersten Dekompensationsereignis und/oder einem MELD-Score > 15 die Möglichkeit einer orthotopen Lebertransplantation als einzige kurative Behandlung evaluiert werden. Zur weiteren Evaluation bedarf es nach Einverständnis der Patient_innen frühzeitig einer Zuweisung an ein Transplantationszentrum. Wer für eine OLT qualifiziert, entscheidet letztendlich das Transplantationszentrum ; es ist eine ethisch komplexe Entscheidung, da die Anzahl an verfügbaren Organspendern doch sehr beschränkt ist und die Warteliste für die Lebertransplantation in der Schweiz jährlich länger wird [34]. Mithilfe des MELD-Scores wird regelmässig der aktuelle Schweregrad der Leberzirrhose abgeschätzt, was Einfluss auf die Rangfolge der Patientinnen und Patienten auf der Warteliste hat.
Im Artikel verwendete Abkürzungen
ACLF Akut-auf-chronisches Leberversagen
AFP Alpha-Fetoprotein
ALD Alkoholbedingte Lebererkrankung
ALT Alanin-Aminotransferase
AST Aspartat-Aminotransferase
AP Alkalische Phosphatase
GGT Gamma-Glutamyl-Transferase
HBV/HCV Hepatitis-B/C-Virus
HBsAg/HBcAk Hbs-Antigen/HBc-Antikörper
HCC Hepatozelluläres Karzinom
HE Hepatische Enzephalopathie
HRS Hepatorenales Syndrom
HVPG Hepato-venöser Druckgradient
INR International Normalized Ratio
MAFLD Metabolisch-bedingte Fettlebererkrankung
NAFLD Nicht-alkoholische Fettlebererkrankung
OLT Orthotope Lebertransplantation
PBS Primär biliäre Cholangitis
PSC Primär sklerosierende Cholangitis
SBP Spontan bakterielle Peritonitis
TIPSS Transjugulärer intrahepatischer portosystemischer Shunt
Leitende Ärztin
Departement Biomedizin, Universität Basel
und Universitäres Bauchzentrum Basel
Hebelstrasse 20, 4031 Basel
c.bernsmeier@unibas.ch
Historie
Manuskript eingereicht: 09.01.2023
Nach Revision angenommen: 13.02.2023
Förderung
Swiss National Science Foundation: Grant numbers 320030_189072.
Interessenskonflikte
Es bestehen keine Interessenskonflikte.
ORCID
Robert Brenig
https://orcid.org/0000-0001-9058-289X
Christine Bernsmeier
https://orcid.org/0000-0002-5558-0503
- Die Leberzirrhose ist eine systemische Erkrankung mit hoher Morbidität und Mortalität. Ein multidisziplinäres Behandlungskonzept ist daher vorteilhaft.
- Die Pathophysiologie umfasst die Fibrogenese, portale Hypertonie und systemische Inflammation. Komplikationen im fortgeschrittenen Stadium können verschiedenste Organe betreffen. V.a. Infektionen führen zur Dekompensation und erhöhen die Mortalität signifikant.
- Die histologische Diagnose der Zirrhose ist erforderlich zur bestmöglichen Patientenführung, Prävention und Therapie von Komplikationen wie Leberversagen und HCC.
- Bei früher und effektiver Therapie chronischer Lebererkrankungen ist die Prävention der Zirrhose möglich. In manchen Fällen kann die Zirrhose bei langfristiger effektiver Therapie der zugrunde liegenden Hepatopathie reversibel sein.
- In schweren Fällen mit progredientem Leberversagen und/oder HCC sollte eine Lebertransplantation als einzige kurative Therapieoption rechtzeitig evaluiert werden.
Lernfragen
1. Womit ist die dekompensierte Leberzirrhose typischerweise assoziiert?
a) Ikterus
b) Aszites
c) Hepatische Enzephalopathie
d) Infektionen
e) a) bis d) sind richtig
2. Zur Diagnosesicherung der Leberzirrhose benötigt man mitunter folgende Untersuchungen:
a) CT oder MRI und Gastroskopie
b) PET-CT
c) A, B & D sind richtig
d) Ultraschall, Fibroscan und Leberbiopsie
1. Tsochatzis EA, Bosch J, Burroughs AK: Liver cirrhosis. The Lancet. 2014;383:1749–1761.
2. D’Amico G, Morabito A, D’Amico M, et al. Clinical states of cirrhosis and competing risks. J Hepatol. 2018;68:563–576.
3. Bernsmeier C, van der Merwe S, Périanin A. Innate immune cells in cirrhosis. J Hepatol. 2020;73:186–201.
4. GBD 2019 Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Lond Engl. 2020;396:1204–1222.
5. Jepsen P, Younossi ZM. The global burden of cirrhosis: A review of disability-adjusted life-years lost and unmet needs. J Hepatol. 2021;75:S3–S13.
6. Crabb DW, Im GY, Szabo G, Mellinger JL, Lucey MR. Diagnosis and Treatment of Alcohol-Associated Liver Diseases: 2019 Practice Guidance From the American Association for the Study of Liver Diseases. Hepatol Baltim Md. 2020;71:306–333.
7. Eslam M, Sanyal AJ, George J, International Consensus Panel. MAFLD: A Consensus-Driven Proposed Nomenclature for Metabolic Associated Fatty Liver Disease. Gastroenterology. 2020;158:1999–2014.e1.
8. Asrani SK, Devarbhavi H, Eaton J, Kamath PS. Burden of liver diseases in the world. J Hepatol. 2019;70:151–171.
9. D’Amico G, Bernardi M, Angeli P. Towards a new definition of decompensated cirrhosis. J Hepatol. 2022;76:202–207.
10. Trebicka J, Fernandez J, Papp M, et al. PREDICT identifies precipitating events associated with the clinical course of acutely decompensated cirrhosis. J Hepatol. 2021;74:1097–1108.
11. Moreau R, Jalan R, Gines P, et al. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis. Gastroenterology. 2013;144: 1426–1437:1437.e1–e9.
12. Wanless IR, Nakashima E, Sherman M. Regression of human cirrhosis. Morphologic features and the genesis of incomplete septal cirrhosis. Arch Pathol Lab Med. 2000;124:1599–1607.
13. Lo RC, Kim H. Histopathological evaluation of liver fibrosis and cirrhosis regression. Clin Mol Hepatol. 2017;23:302–307.
14. Vilar-Gomez E, Chalasani N. Non-invasive assessment of non-alcoholic fatty liver disease: Clinical prediction rules and blood-based biomarkers. J Hepatol. 2018;68:305–315.
15. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015;63:237–264.
16. Segna D, Mendoza YP, Lange NF, Rodrigues SG, Berzigotti A. Non-invasive tools for compensated advanced chronic liver disease and portal hypertension after Baveno VII – an update. Dig Liver Dis. 2022. https://www.dldjournalonline.com/article/S1590-8658(22)00743-5/fulltext; letzter Zugriff: 08.02.2023.
17. Mendoza YP, Rodrigues SG, Delgado MG, et al. Inflammatory activity affects the accuracy of liver stiffness measurement by transient elastography but not by two-dimensional shear wave elastography in non-alcoholic fatty liver disease. Liver Int n/a; letzter Zugriff: 03.12.2021.
18. Seeff LB, Everson GT, Morgan TR, et al. Complication Rate of Percutaneous Liver Biopsies among Persons with Advanced Chronic Liver Disease in the HALT-C Trial. Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc. 2010;8:877–883.
19. Bosch J, Abraldes JG, Berzigotti A, García-Pagan JC. The clinical use of HVPG measurements in chronic liver disease. Nat Rev Gastroenterol Hepatol. 2009;6:573–582.
20. de Franchis R, Bosch J, Garcia-Tsao G, et al. Baveno VII – Renewing consensus in portal hypertension. J Hepatol. 2022;76:959–974.
21. Franchis R de. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015;63:743–752.
22. Pugh RN, Murray-Lyon IM, Dawson JL, Pietroni MC, Williams R. Transection of the oesophagus for bleeding oesophageal varices. Br J Surg. 1973;60:646–649.
23. Wiesner R, Edwards E, Freeman R, et al. Model for end-stage liver disease (MELD) and allocation of donor livers. Gastroenterology. 2003;124: 91–96.
24. D’Amico G, Garcia-Tsao G, Pagliaro L. Natural history and prognostic indicators of survival in cirrhosis: A systematic review of 118 studies. J Hepatol. 2006;44:217–231.
25. Aithal GP, Palaniyappan N, China L, et al. Guidelines on the management of ascites in cirrhosis. Gut. 2021;70:9–29.
26. Angeli P, Bernardi M, Villanueva C, et al. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018;69:406–460.
27. Wasmuth HE, Kunz D, Yagmur E, et al. Patients with acute on chronic liver failure display “sepsis-like” immune paralysis. J Hepatol. 2005;42:195–201.
28. Jalan R, Fernandez J, Wiest R, et al. Bacterial infections in cirrhosis: a position statement based on the EASL Special Conference 2013. J Hepatol. 2014;60:1310–1324.
29. Galle PR, Forner A, Llovet JM, et al. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol. 2018; 69:182–236.
30. Finn RS, Qin S, Ikeda M, et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med. 2020;382:1894–1905.
31. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on nutrition in chronic liver disease. J Hepatol. 2019;70:172–193.
32. Tantai X, Liu Y, Yeo YH, et al. Effect of sarcopenia on survival of patients with cirrhosis: A meta-analysis. J Hepatol. 2021.
33. Lai JC, Covinsky KE, McCulloch CE, Feng S. The Liver Frailty Index Improves Mortality Prediction of the Subjective Clinician Assessment in Patients With Cirrhosis. Am J Gastroenterol. 2018;113:235–242.
34. BAG B für G. Zahlen zur Spende und Transplantation von Organen in der Schweiz.
35. Brenig R, Bernsmeier C. Diagnostik und Therapie der Leberzirrhose. GastroMAG. 2022;14–17.
36. Strnad P, Mandorfer M, Choudhury G, et al. Fazirsiran for Liver Disease Associated with Alpha1-Antitrypsin Deficiency. N Engl J Med. 2022;387:514–524.
37. Campagna F, Montagnese S, Ridola L, et al. The animal naming test: An easy tool for the assessment of hepatic encephalopathy. Hepatology. 2017;66:198–208.
38. Bajaj JS, Thacker LR, Heuman DM, et al. The Stroop smartphone application is a short and valid method to screen for minimal hepatic encephalopathy. Hepatology. 2013;58:1122–1132.
39. Kircheis G, Wettstein M, Timmermann L, Schnitzler A, Häussinger D. Critical flicker frequency for quantification of low-grade hepatic encephalopathy. Hepatology. 2002;35:357–366.
PRAXIS
- Vol. 112
- Ausgabe 11
- September 2023