- Lipidmanagement in der Praxis
Die Behandlung von Hyperlipidämien erfolgt in Abhängigkeit des kardiovaskulären Risikos. In der Primärprävention erfolgt die Indikationsstellung zu einer Therapie unter Berücksichtigung des Lebenszeitrisikos für kardiovaskuläre Ereignisse. Primäres Therapieziel ist eine Reduktion des LDL-Cholesterins, wobei v.a. bei Personen mit Hypertriglycerdämien, kombinierten Hyperlipidämien und Typ-2-Diabetes das Apo B, das die Zahl aller atherogenen Lipoproteine reflektiert, das kardiovaskuläre Risiko besser einzuschätzen vermag und das LDL-C als wichtigsten Zielparameter ablöst. Die Basis der medikamentösen Behandlung stellen Statine dar. Bei Patientinnen und Patienten mit hohem bzw. sehr hohem kardiovaskulären Risiko können durch die Kombination mit Ezetimibe, PCSK9-Inhibitoren bzw. der PCSK9 siRNA Inclisiran und Bempedoinsäure das LDL-C bzw. die Zielwerte meistens erreicht werden, wobei bei der Verschreibung aktuell bestehende Limitationen beachtet werden müssen.
Bedeutung und Definition der Hyperlipidämie
Hyperlipidämien sind der bedeutendste behandelbare kardiovaskuläre Risikofaktor [1]. Sowohl LDL als auch triglyceridreiche Lipoproteine (v.a. VLDL) und deren Remnants sind atherogen [2]. Mit der bevorstehenden Verfügbarkeit von wirksamen Therapien rückt auch das Lipoprotein (a) als unabhängiger Risikofaktor vermehrt in den Focus [3]. Durch eine lipidsenkende Therapie kann die Morbidität und Mortalität kardiovaskulärer Erkrankungen deutlich reduziert werden. Hierfür stehen wirksame und sichere Behandlungsstrategien zur Verfügung, mehrere neue Präparate sind seit kurzem auf dem Markt.
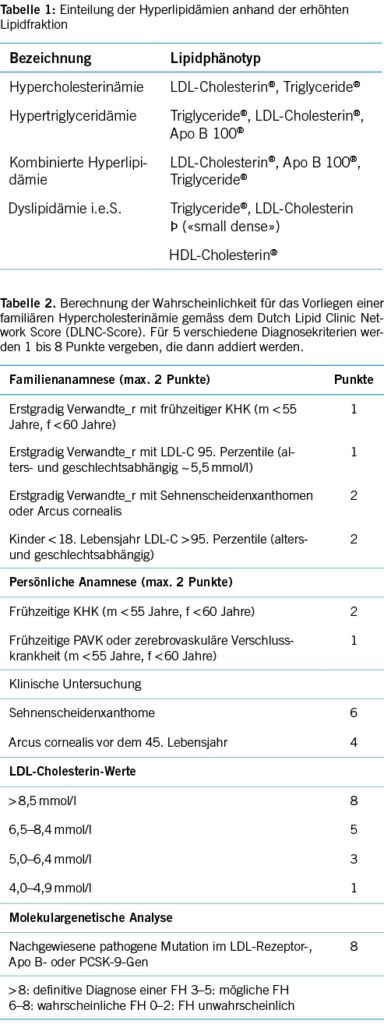
Anhand der jeweils erhöhten Lipidfraktion werden im Wesentlichen vier verschiedene Entitäten voneinander abgegrenzt (Tabelle 1).
Eine Sonderform stellt die heterozygote familiäre Hypercholesterinämie dar, die durch autosomal dominant vererbte Mutationen im LDL-Rezeptor-, Apo B- und PCSK9-Gen verursacht wird. Die Prävalenz weist grosse regionale Unterschiede auf, wird weltweit mit 1:313 angegeben, in der Schweiz mit 1:200 [4]. Die Dunkelziffer ist hoch, schätzungsweise wurde bei weniger als 10 % aller Betroffenen die korrekte Diagnose gestellt. Allein in der Schweiz ist von mehr als 30 000 undiagnostizierten Patient_innen auszugehen. Als Hilfsmittel für die Diagnosestellung steht der Dutch Lipid Clinic Network Score (kurz DLNC-Score) zur Verfügung [5]. Hierbei werden für fünf verschiedene Diagnosekriterien 1 bis 8 Punkte vergeben, deren Addition die Wahrscheinlichkeit für das Vorliegen einer familiären Hypercholesterinämie widerspiegelt (Tabelle 2).
Das kardiovaskuläre Risiko steigt bekannterweise in Abhängigkeit der kumulativen LDL-Exposition [6]. Die heterozygote familiäre Hypercholesterinämie ist daher mit einem deutlich höheren kardiovaskulären Risiko behaftet als in den gängigen Risikorechnern kalkuliert. Dies gilt insbesondere für junge Patient_innen. So kommt es unbehandelt bei jedem zweiten männlichen Patienten bis zum 50. Lebensjahr zum Auftreten einer klinisch manifesten kardiovaskulären Erkrankung [7]. Eine frühzeitige medikamentöse Lipidsenkung ist also unbedingt erforderlich und führt zu einer signifikanten Risikoreduktion. Eindrücklich kann eine primärpräventive Statintherapie das Herzinfarkt-Risiko erkrankter Patient_innen auf jenes nicht Betroffener reduzieren. Neben einer adäquaten Behandlung der Betroffenen ist auch ein klinisches und genetisches Screening der Familienangehörigen unabdingbar.
Diagnostik der Hyperlipidämien
Atheroskleroseimaging zur Risikostratifizierung
Therapie der Hypercholesterinämie

Verstärken lässt sich die cholesterinsenkende Wirkung durch die additive Gabe von Ezetrol, das die intestinale Cholesterinresorption hemmt und so zu einer zusätzlichen Cholesterinsenkung um etwa 20 % führt. Ezetimibe in Kombination mit Statinen reduziert das kardiovaskuläre Risiko, und die Kombination von Ezetimibe mit einem moderat LDL-C-senkenden Statin ist diesbezüglich mit einem potenten Statin vergleichbar [26, 27, 28].
Die Wirkung der PCSK9-Inhibitoren beruht auf einer Hemmung des Enzyms PCSK9 (Proproteinkonvertase Subtilisin Kexin Typ 9). Dieses bindet an der Oberfläche von Hepatozyten an LDL-Rezeptoren und fördert so deren Abbau in den Lysosomen. Die PCSK9-Inhibitoren sind monoklonale Ak und binden selektiv an zirkulierendes PSCK9 und erhöhen so die LDL-Rezeptoraktivität und die hepatische LDL-Aufnahme. Dies resultiert in einer LDL-C-Senkung von 50–60 %. Der Effekt ist additiv zu der Wirkung von Statinen und Ezetrol, eine Kombinationstherapie mit beiden ist möglich und sinnvoll. Die Gabe von Evolocumab und Alirocumab reduziert bei mit potenten Statinen behandelten Patient_innen mit hohem kardiovaskulärem Risiko, vorwiegend mit bekannter KHK, kardiovaskuläre Ereignisse, und neue Resultate suggerieren einen sogenannten «legacy effect» bei frühzeitigem Therapiebeginn [29, 30, 31]. Die aktuelle Limitatio der Spezialitätenliste des BAG (01/2023) erlaubt in der Schweiz den Einsatz, wenn mit einer Kombinationstherapie aus Statin und Ezetimibe in maximal tolerierter Dosis über mindestens drei Monate keine Senkung des LDL-Cholesterins unter 1,8 mmol/l (klinische ASCVD) bzw. unter 2,6 mmol/l (heterozygote Familiäre Hypercholesterinämie) gelang. Diagnose, Erstverordnung und Kontrollen müssen durch «Spezialist_innen» erfolgen, zudem muss der Nachweis über eine Senkung des LDL-Cholesterins über 50 % bzw. < 1,4 mmol/l erbracht werden. Zu den häufigsten unerwünschten Wirkungen gehören lokale Reaktionen an der Injektionsstelle.
Inclisiran ist eine synthetisch hergestellte, kurze, doppelsträngige small interfering RNA (siRNA), die durch RNA-Interferenz die Translation und somit die Synthese des Proteins PCSK9 in der Leber hemmt, die PCSK9-Spiegel um ca. 60 % reduziert und so, analog der Wirkung der PCSK9-Inhibitoren, zu einer verbesserten Funktion der LDL-Rezeptoren und einer ca. 45–50-prozentigen LDL-C-Senkung führt [32, 33, 34]. Die selektive Aufnahme des Wirkstoffes in die Hepatozyten wird durch Konjugation der siRNA mit N-Acetylgalactosamin erhöht (Drug Targeting). Daten aus kardiovaskulären Endpunktstudien liegen bislang noch nicht vor.
Bei dem Wirkstoff Bempedoinsäure handelt es sich um ein Prodrug, das in der Leber aktiviert wird (durch ACSVL1 = Very Long-Chain Acyl-CoA Synthetase, zu Bempedoyl-CoA) und dort die Cholesterinsynthese durch kompetitive Hemmung der ATP-Citrat-Lyase vermindert [35, 36]. Da die Behandlung, wahrscheinlich durch verminderte renale Harnsäureexkretion, zu einem Anstieg der Harnsäure führt und so mit einem erhöhten Risiko für das Auftreten einer Gicht einhergeht, ist von einer Anwendung bei Patient_innen mit bekannter Urikopathie abzuraten. Das Präparat Nilemdo® (180 mg), das seit Ende 2020 in der Schweiz zugelassen ist, wird in Form einer Filmtablette einmal täglich mahlzeitenunabhängig eingenommen. Auch ein Kombinationspräparat mit Ezetrol ist verfügbar (Nustendi®: Bempedoinsäure + Ezetimibe 180/10). In Studien konnte eine Senkung des LDL-Cholesterins um 18 % erreicht werden, durch Kombination mit Ezetrol gelang eine bis zu 38-prozentige Senkung. Kombinationsbehandlungen mit einem Statin sind möglich. Die aktuell veröffentlichte Clear-Outcomes-Studie hat eine kardiovaskuläre Risikoreduktion durch Bempedoinsäure bestätigt [44].
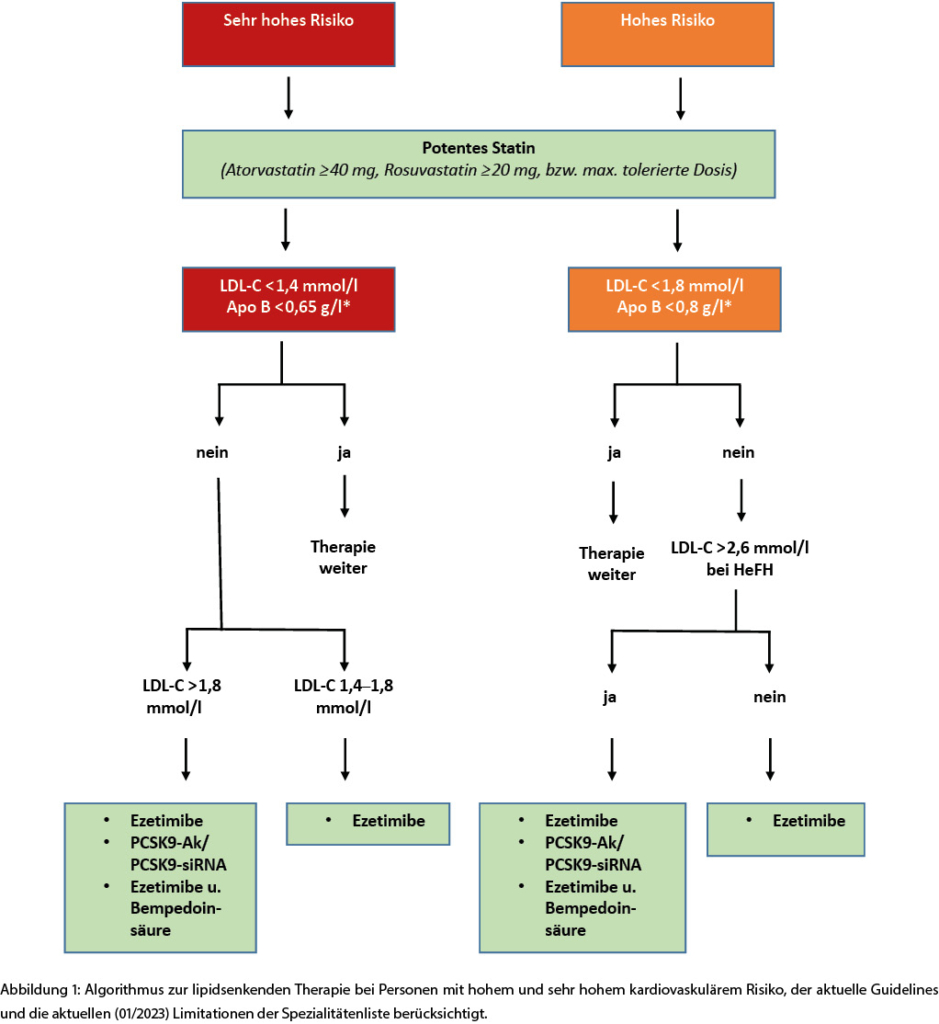
Abbildung 1 zeigt einen Algorithmus zur lipidsenkenden Therapie bei Personen mit hohem und sehr hohem kardiovaskulärem Risiko, der die aktuellen Guidelines und Limitationen (01/2023) der Spezialitätenliste berücksichtigt.
Therapie der Hypertriglyceridämien
Fibrate sind eine Wirkstoffgruppe, die durch Bindung an den intrazellulären Peroxisom-Proliferator-aktivierten Rezeptor Alpha zu einer gesteigerten Lipolyse von triglyceridreichen Lipoproteinen führen und so vor allem eine Reduktion der Triglyceride bewirken (20–40 %), ohne dass jedoch die Anzahl der zirkulierenden atherogenen Lipoproteine reduziert wird. Eingesetzt werden Fibrate aufgrund des fehlenden Nachweises eines signifikanten Effekts auf kardiovaskuläre Ereignisse nicht zur kardiovaskulären Prävention, sondern zur Senkung der Triglyceride respektive der Verhinderung einer Chylomikronämie [40].
Icosapentethyl ist eine modifizierte Form der Eicosapentaensäure (EPA), einer Fischöl-Omega-3-Fettsäure, deren Wirkmechanismus noch nicht vollständig geklärt ist; unter anderem spielt die Stimulation der Betaoxidation, die Reduktion des mikrosomalen Triglycerid-Transferproteins und eine Synthesehemmung von Cholesterin, Fettsäuren und Triglyceriden eine Rolle. Bei Patient_innen mit einer Hypertriglyceridämie unter Statintherapie und hohem kardiovaskulärem Risiko konnte eine deutliche kardiovaskuläre Risikoreduktion nachgewiesen werden [41, 42]. Da dieser kardiovaskuläre Nutzen mit anderen Fischölderivaten nicht nachweisbar ist, scheint der hohe Gehalt an EPA bedeutend [43].

Oberärztin Endokrinologie
Spital Grabs
Spitalstrasse 44
9472 Grabs
barbara.dehos@srrws.ch
Historie
Manuskript akzeptiert: 15.02.2023
Interessenskonflikte
Es bestehen keine Interessenskonflikte.
1. Yusuf S, Joseph P, Rangarajan S, et al. Modifiable risk factors, cardiovascular
disease, and mortality in 155 722 individuals from 21 high-income,
middle-income, and low-income countries (PURE): a prospective cohort
study. Lancet. 2020 Mar 7;395(10226):795-808.
2. Rosenson RS, Hegele RA, Gotto AM Integrated Measure for Atherogenic
Lipoproteins in the Modern Era. JJ Am Coll Cardiol. 2016;67:202–204.
3. Kronenberg F, Mora S, Stroes ESG, Lipoprotein(a) in atherosclerotic cardiovascular
disease and aortic stenosis: a European Atherosclerosis Society
consensus statement. Eur Heart J. 2022;43:3925–3946.
4. Beheshti SO, Madsen CM, Varbo A, Nordestgaard BG Worldwide Prevalence
of Familial Hypercholesterolemia: Meta-Analyses of 11 Million Subjects.
J Am Coll Cardiol 2020;75:2553–2566.
5. Watts GF, Gidding S, Wierzbicki AS, et al. Integrated guidance on the care
of familial hypercholesterolemia from the International FH Foundation. J
Clin Lipidol. 2014;8:148–172.
6. Brandts J, Ray KK. Familial Hypercholesterolemia: JACC Focus Seminar
4/4. J Am Coll Cardiol. 2021;78:1831–1843.
7. Nordestgaard BG, Chapman MJ, Humphries SE, et al. Familial hypercholesterolaemia
is underdiagnosed and undertreated in the general population:
guidance for clinicians to prevent coronary heart disease: consensus
statement of the European Atherosclerosis Society. Eur Heart J.
2013;34:3478–3490a.
8. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the
management of dyslipidaemias: lipid modification to reduce cardiovascular
risk. Eur Heart J. 2020;41:111–188.
9. Langlois MR, Nordestgaard BG, Langsted A, et al. Quantifying atherogenic
lipoproteins for lipid-lowering strategies: consensus-based recommendations
from EAS and EFLM. Clin Chem Lab Med. 2020;58:496–517.
10. Johannesen CDL, Mortensen MB, Langsted A, Nordestgaard BG. Apolipoprotein
B and Non-HDL Cholesterol Better Reflect Residual Risk Than LDL Cholesterol
in Statin-Treated Patients. J Am Coll Cardiol. 2021;77:1439–1450.
11. Marston NA, Giugliano RP, Melloni GEM, et al. Association of Apolipoprotein
B-Containing Lipoproteins and Risk of Myocardial Infarction in Individuals
With and Without Atherosclerosis: Distinguishing Between Particle
Concentration, Type, and Content. JAMA Cardiol. 2021.
12. Sturm AC, Knowles JW, Gidding SS, et al. Clinical Genetic Testing for Familial
Hypercholesterolemia: JACC Scientific Expert Panel. J Am Coll Cardiol.
2018;72:662–680.
13. Mortensen MB, Fuster V, Muntendam P, et al. Negative Risk Markers for
Cardiovascular Events in the Elderly. J Am Coll Cardiol. 2019;74:1–11.
14. Blaha MJ, Blankstein R, Nasir K. Coronary Artery Calcium Scores of Zero
and Establishing the Concept of Negative Risk Factors. J Am Coll Cardiol.
2019;74:12–14.
15. Lowenstern A, Alexander KP, Hill CL, et al. Age-Related Differences in the
Noninvasive Evaluation for Possible Coronary Artery Disease: Insights From
the Prospective Multicenter Imaging Study for Evaluation of Chest Pain
(PROMISE) Trial. JAMA Cardiol 2019.
16. Ference BA, Ginsberg HN, Graham I, et al. Low-density lipoproteins cause
atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic,
and clinical studies. A consensus statement from the European
Atherosclerosis Society Consensus Panel. Eur Heart J. 2017.
17. Visseren FLJ, Mach F, Smulders YM, et al. 2021 ESC Guidelines on cardiovascular
disease prevention in clinical practice. Eur Heart J. 2021;ehab484.
18. AGLA: Prävention der Atherosklerose 2022 (deutsch). PDF. 2022. https://
www.agla.ch/de/shop/product /pravention-der-atherosklerose-2022-
deutsch-pdf-agla.
19. U-prevent. https://u-prevent.com/; letzter Zugriff: 12.02.2023.
20. Estruch R, Ros E, Salas-Salvadó J, et al. Primary Prevention of Cardiovascular
Disease with a Mediterranean Diet Supplemented with Extra-Virgin
Olive Oil or Nuts. N Engl J Med. 2018;378:e34.
21. Delgado-Lista J, Alcala-Diaz JF, Torres-Peña JD, et al. Long-term secondary prevention
of cardiovascular disease with a Mediterranean diet and a low-fat diet
(CORDIOPREV): a randomised controlled trial. Lancet. 2022;399:1876–1885.
22. Cholesterol Treatment Trialists’ (CTT) Collaboration, Fulcher J, O’Connell R,
et al. Efficacy and safety of LDL-lowering therapy among men and women:
meta-analysis of individual data from 174,000 participants in 27 randomised
trials. Lancet. 2015;385:1397–1405.
23. Cholesterol Treatment Trialists’ (CTT) Collaborators, Mihaylova B, Emberson
J, et al. The effects of lowering LDL cholesterol with statin therapy in
people at low risk of vascular disease: meta-analysis of individual data from
27 randomised trials. Lancet. 2012;380:581–590.
24. Cholesterol Treatment Trialists’ (CTT) Collaboration, Baigent C, Blackwell L,
et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a
meta-analysis of data from 170,000 participants in 26 randomised trials.
Lancet. 2010;376:1670–1681.
25. Bytyçi I, Penson PE, Mikhailidis DP, et al. Prevalence of statin intolerance:
a meta-analysis. Eur Heart J. 2022 Sep 7;43(34):3213–3223.
26. Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimibe Added to Statin Therapy
after Acute Coronary Syndromes. N Engl J Med. 2015;372:2387–2397.
27. Ouchi Y, Sasaki J, Arai H, et al. Ezetimibe Lipid-Lowering Trial on Prevention
of Atherosclerotic Cardiovascular Disease in 75 or Older (EWTOPIA
75): A Randomized, Controlled Trial. Circulation. 2019;140:992–1003.
PRAXIS
- Vol. 112
- Ausgabe 13
- Dezember 2023





