- Medikamentös induzierte Nebenniereninsuffizienz
Einleitung
Pathophysiologie
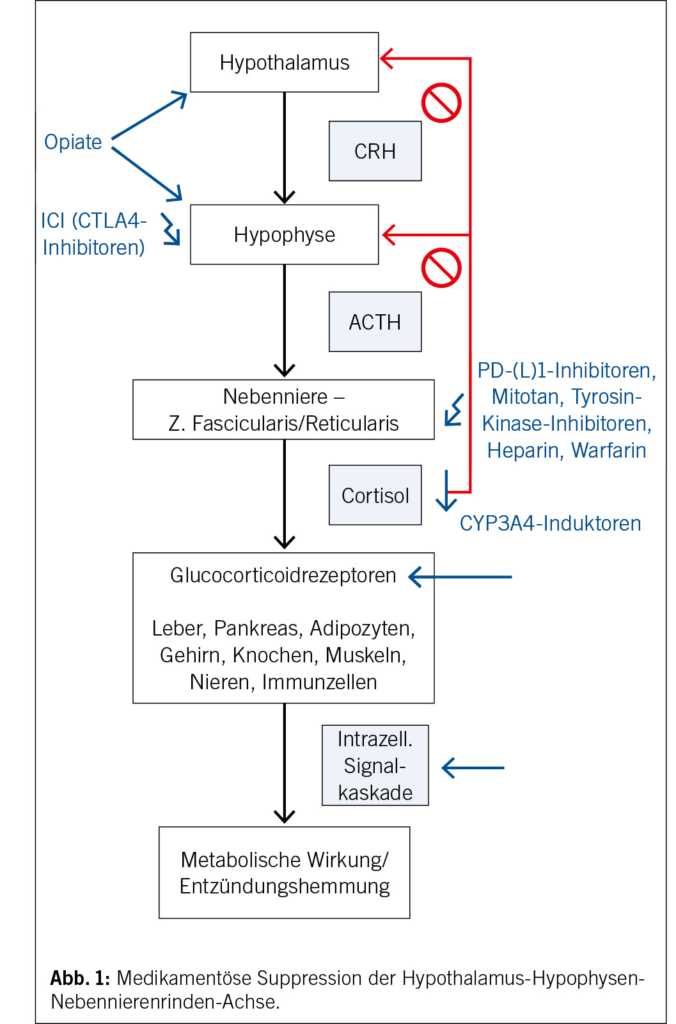
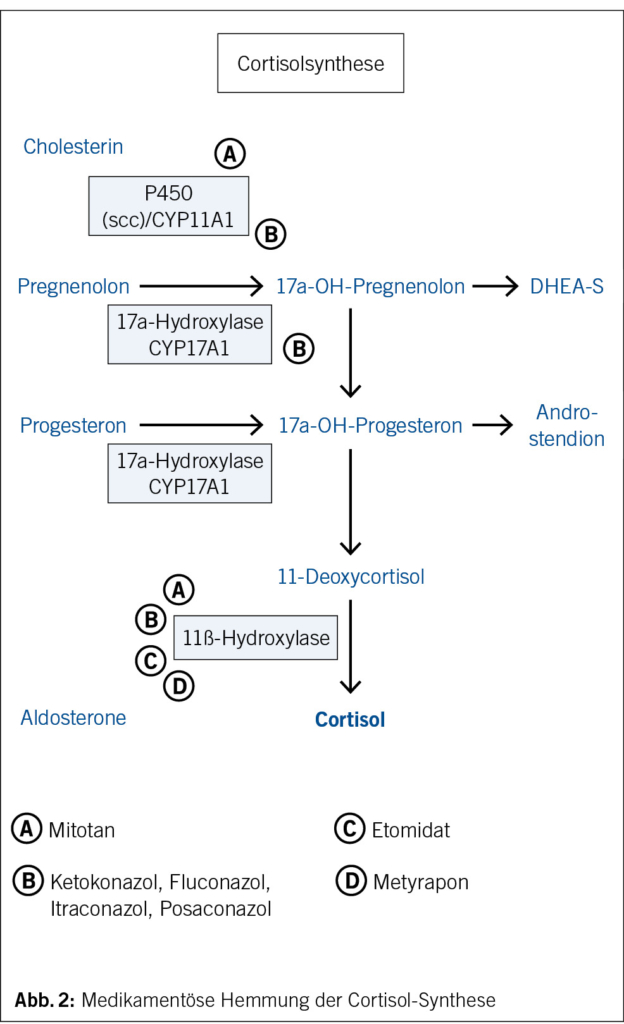
Die HHN-Achse wird zentral von Stressfaktoren und Tageslicht stimuliert und durch ein negatives Feedback bei Anstieg der Cortisolproduktion supprimiert (Abb. 1). Eine medikamentös induzierte Nebenniereninsuffizienz (NNI) kann auf hypothalamisch-hypophysärer Ebene, durch direkte Medikamenteneffekte auf die Nebennieren oder durch Interferenz mit den Glucocorticoidrezeptoren entstehen (1). Eine direkte Schädigung der Nebennierenrinde, z. B. durch eine Autoimmunreaktion (unter ICI gegen PD-1/PD-L1), Hämorrhagie (unter Heparin, Warfarin, Tyrosin-Kinase-Inhibitoren) oder Zytotoxizität (Mitotan), kann zu einer primären NNI führen. Ebenso kann die Cortisolsynthese auf enzymatischer Ebene durch verschiedene Medikamente, unter anderem Azole (Ketonazol, Itraconazol, Fluconazol, Posaconazol), gehemmt werden (Abb. 2). Andere Substanzen (z. B. Mifepriston) können die Glucocorticoidrezeptoren oder die GC-abhängige Gentranskription (Chlorpromazin und Imipramin) blockieren. Ein vermehrter Cortisolmetabolismus durch Induktoren des CYP3A4s (z. B. Phenobarbital, Rifampicin, Phenytoin, Carbamazepin …) kann zudem zu einer Reduktion des zirkulierenden Cortisols führen. Bei einer zentralen NNI hingegen wird die Sekretion vom Corticotropin-Releasing-Hormon (CRH) und adrenocorticotropen Hormon (ACTH) in Hypothalamus und Hypophyse supprimiert, was im Verlauf zu einer Atrophie der Nebennierenrinde und somit zu einer verminderten Produktion von GC und Androgenen (Dehydroepiandrosteronsulfat oder DHEAS) führt. Diese kann im Rahmen einer immunvermittelten Hypophysitis unter ICI (vor allem Anti-CTLA4) durch die inhibitorische Wirkung von Opiaten auf die CRH- und ACTH-Sekretion sowie, am häufigsten, durch die Stimulation des negativen Feedbacks durch supraphysiologische Dosen exogener GC oder GC-ähnlicher Medikamente (Megestrolacetat) auftreten (2, 3).
Epidemiologie
In einer retrospektiven Studie, basierend auf Daten des FDA-Adverse-Event-Reporting-System (FAERS), wurden 56 Medikamente aufgelistet, welche mit einer iatrogenen NNI assoziiert sind (4). Die häufigste Ursache stellen die synthetische GC dar. In einer dänischen Populationsstudie beträgt die jährliche Prävalenz der Patienten mit einer Verordnung für GC ca. 3 %, wobei diese bei älteren Personen (> 80 Jahren) bei 10 % liegt (5). Hierunter wird das Risiko für die Entwicklung einer sekundären NNI bei peroralen Präparaten, gemäss einer holländischen Metaanalyse, auf bis zu 48,7 % geschätzt (6). Ebenso werden ICI zunehmend als Ursache einer sekundären NNI beschrieben. Zwischen 2015 und 2020 wurden, gemäss retrospektiven Daten der FDA, bis zu 1/3 der selbst berichteten iatrogenen NNI mit ICI assoziiert (4). Die immunvermittelte Hypophysitis tritt bei bis zu 5 % der Patienten unter CTLA-4-Inhibitoren und bis zu 8 % unter Kombinationstherapie mit PD-(L)1-Inhibitoren auf (7). Die primäre NNI nach autoimmuner Adrenalitis kommt bei < 1 % der Patienten unter PD-(L)1-Inhibitoren und bis zu 4–8 % unter Kombinationstherapien vor (8). Opiate sind eine weitere bedeutende Ursache, insbesondere in den USA, wo zwischen 2019 und 2020 bis 11.9 % der Erwachsenen eine Verschreibung dafür erhielten (9). Unter chronischem Opiatgebrauch wird das Risiko für die Entwicklung einer sekundären NNI auf bis zu 15–24 % geschätzt (10).
Glucocorticoide
Glucocorticoide werden seit den 1950er-Jahren dank ihrer immunmodulatorischen Wirkung für autoimmune, entzündliche, onkologische oder immunologische Erkrankungen sowie bei transplantierten Patienten in unterschiedlicher Darreichungsform angewendet. Leider sind auch die damit assoziierten Nebenwirkungen nicht vernachlässigbar. Bereits bei einer täglichen Therapie mit 20–30 mg Cortisol-äquipotenten Präparaten besteht bei einer Langzeitanwendung ein erhöhtes Risiko für die Entwicklung von Diabetes mellitus Typ 2, Osteoporose mit pathologischen Frakturen, arterieller Hypertonie, Infektionen, gastrointestinalen Erkrankungen (z. B. Ulkusleiden), thromboembolischen Ereignissen und einer erhöhter Gesamtmortalität (11). Zudem besitzen alle Glucocorticoidpräparate das Potenzial, entweder durch systemische Gabe oder durch systemische Resorption nach First-Pass-Effekt, die HHN-Achse zu supprimieren. Nach dem Absetzen der GC erholt sich die Hypophysenfunktion als Erstes, während die vollständige Erholung der Nebennierenfunktion mehrere Monate bis Jahre dauern kann. Das Risiko der Entstehung einer sekundären NNI ist von diversen Einflussfaktoren abhängig, welche vor Verschreibung von Glucocorticoiden berücksichtigt werden sollten (12).
Risikofaktoren
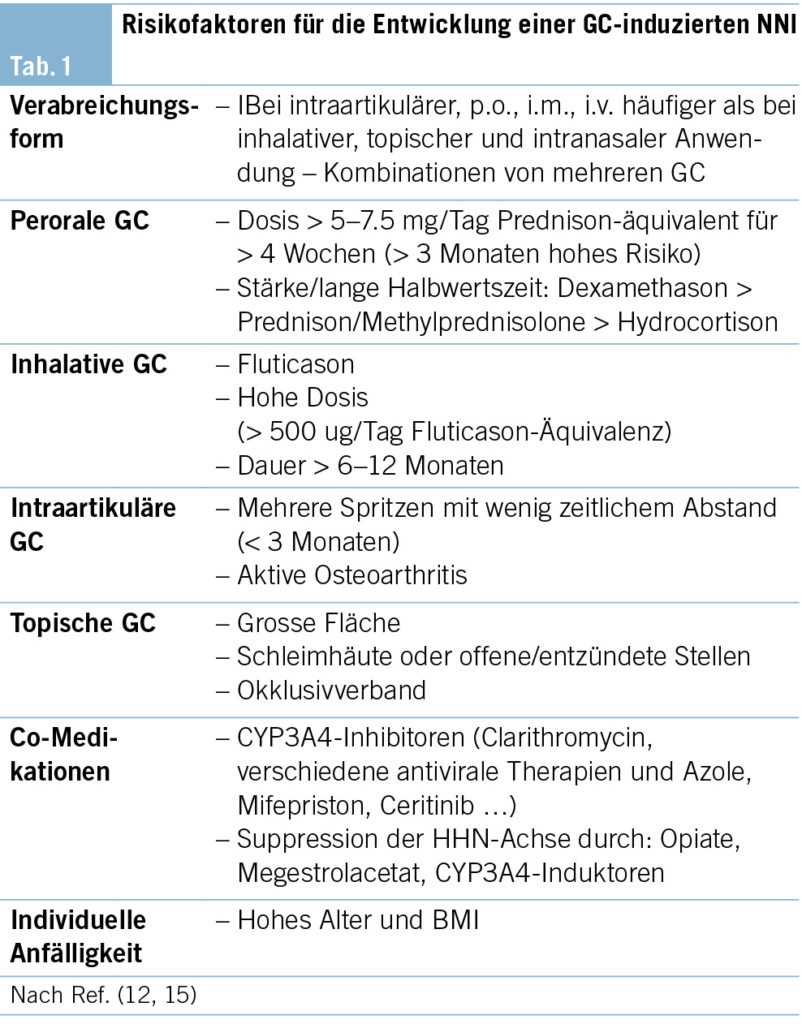
Das höchste Risiko für die Entwicklung einer NNI nach exogenen GC besteht unter peroraler oder intraartikulärer Gabe mit einer Prävalenz von ca. 49 % und 52 % (Tab.1). Mittels inhalativer, topischer und intranasaler Präparate liegt diese allerdings unter 10 % (6). Bei peroraler Therapie ist das Risiko von der Frequenz der Gaben (erhöhtes Risiko bei mehreren/abendlichen Gaben) (13) und der Gesamtexposition (Dosis > 5–7.5 mg/Tag Prednison-äquivalent, Dauer länger als vier Wochen und höhere Stärke/Halbwertzeit) abhängig. Unter inhalativen Glucocorticoiden konnte ein hohes Risiko unter Fluticason (aufgrund der längeren Halbwertszeit und hoher Rezeptoraffinität), hohen Dosen (> 500 ug/Tag Fluticason-äquivalent) und bei einer Dauer von länger als sechs Monaten (bei mittlerer/hoher Dosis bzw. zwölf Monaten mit jeder Dosis) gezeigt werden. Nach wiederholten intraartikulären Injektionen oder bei aktiver Osteoarthritis (aufgrund der erhöhten Durchblutung und somit der erhöhten systemischen Absorption) ist ebenso das Risiko für eine NNI erhöht. Für topische Präparate besteht ein erhöhtes Risiko insbesondere bei Applikation auf eine grosse Hautfläche, Schleimhäute oder offene/entzündete Stellen. Unabhängig von den verordneten Präparaten können die Patienten eine unterschiedliche Anfälligkeit für eine sekundäre NNI entwickeln (12). Adipöse oder ältere Patienten sowie Patienten mit cushingoiden Zügen nach GC-Therapie oder nach bereits stattgehabter Addison-Krise sind besonders gefährdet (14). Des Weiteren können bestimmte Medikamente (z. B. CYP3A4-Inhibitoren) durch die Erhöhung der systemischen GC-Exposition oder andere Substanzen mit supprimierender Wirkung auf die HHN-Achse (z. B. Opiate, Megestrolacetat, CYP3A4- Induktoren …) die Cortisolkonzentrationen beeinflussen und somit eine sekundäre NNI begünstigen (12).
Management – neue Empfehlungen
2024 wurde die erste offizielle Richtlinie zum Management (Tapering, Diagnose und Therapie) der GC-induzierten NNI von der European Society of Endocrinology and Endocrine Society publiziert (14). Obwohl die Evidenz, auf der die Empfehlungen beruhen, überraschend schwach ist und viele Studien laborchemische Endpunkte bzw. Surrogatmarker und selten klinische Endpunkte untersucht haben, stellt die Richtlinie ein wichtiges, neues Instrument für alle Ärzte, die GC anwenden, dar. Eine Zusammenfassung der wichtigsten Punkte wird im Anhang 1 dargestellt.
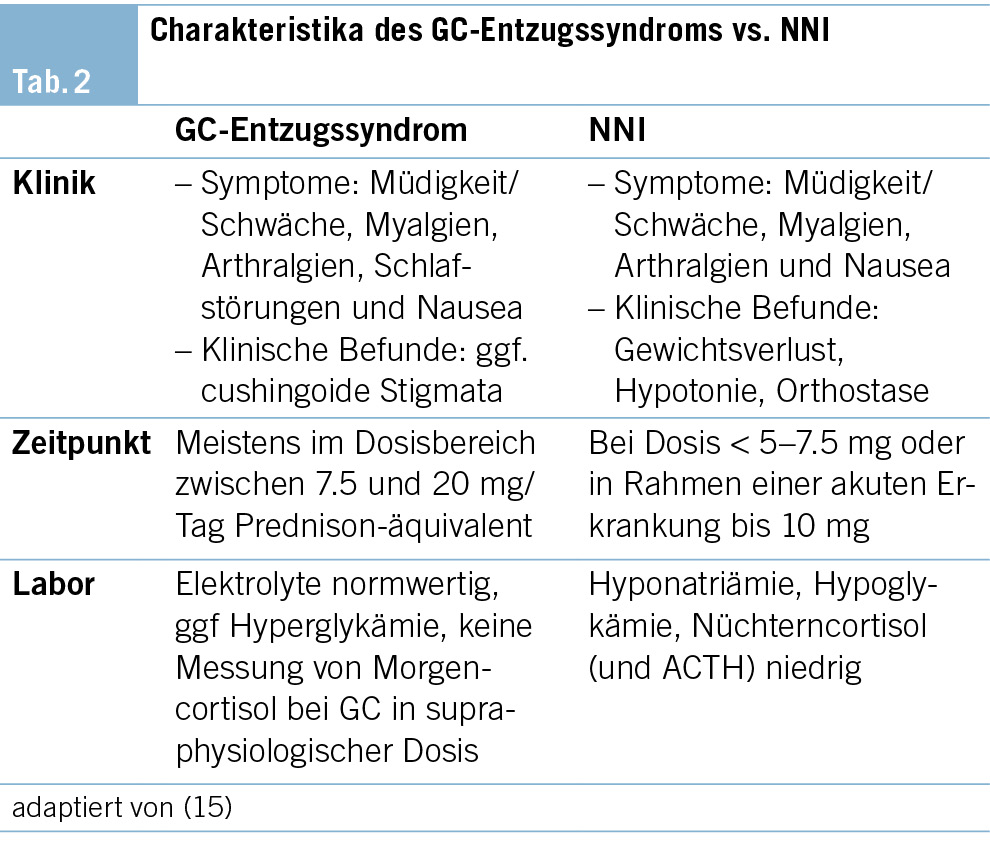
Bezüglich des Taperings wird vor allem auf die Wichtigkeit regelmässiger klinischer Kontrollen hinsichtlich des Auftretens von GC-Entzugssymptomen und deren Abgrenzung von einer Nebenniereninsuffizienz (Tab. 2) hingewiesen. Ein exaktes «Ausschleichschema» hat sich bis dato nicht etabliert, da diesbezüglich noch Vergleichsstudien fehlen, und dieses in Abhängigkeit der Risikofaktoren individualisiert werden sollte. Nach Erreichen der physiologischen Äquivalenzdosis werden in den Leitlinien allerdings zwei Vorgehensmöglichkeiten vorgeschlagen. Zum einen das Fortführen des Taperings in Mg-Schritten, zum anderen die Bestimmung des Nüchterncortisols zur Evaluation der endogenen Cortisolsekretion nach Erreichen einer Äquivalenzdosis von max. 20–30 mg Cortisol (5–7.5 mg Prednison). Obwohl kein optimaler Cut-off zwischen pathologischen und physiologischen Cortisolwerten besteht, wurde anhand der aktuellen Studienlage ein morgens nüchtern um 8 Uhr bestimmter Serumcortisolwert von 300 nmol/l vorgeschlagen, dessen Überschreiten ein sicheres Absetzen einer GC-Therapie erlaubt. Mit der Bestimmung müssen interferierende Faktoren, bspw. ein veränderter zirkadianer Rhythmus, Medikamente (orale Östrogene), besondere Situationen, die Einfluss auf die Gesamtcortisolbestimmung haben (Schwangerschaft, Leberzirrhose etc.), berücksichtigt werden. Eine aktuell laufende schweizerische multizentrische randomisierte und placebokontrollierte Studie (TOASST) wird künftig ebenso mehr Informationen bzgl. der Sicherheit eines abrupten Therapiestopps liefern können (15). Im Fall eines Taperings ohne biochemische Bestätigung der Erholung der HHN-Achse wird in den Leitlinien zudem der Einsatz einer peroralen/parenteralen Steroidstressprophylaxe in Stresssituationen oder bei klinischem V.a. Addison-Krise empfohlen. Die Durchführung eines ACTH-Stimulationstests ist nicht routinemässig empfohlen und besonderen Situationen vorbehalten.
Immuncheckpoint-Inhibitoren
Seit ihrer ersten Zulassung in 2011 werden die ICI als Monotherapie oder in Kombination für die systemische Behandlung von mindestens 17 verschiedenen Tumorarten eingesetzt. Diese monoklonalen Antikörper blockieren die Immun-Checkpoints (CTLA-4 und PD-1) auf den T-Lymphozyten, welche die Proliferation dieser Zellen regulieren und den Körper vor möglichen Autoimmunreaktionen schützen, wenn die T-Lymphozyten von den eigenen Zellen aktiviert werden. Die Tumoren können das Immunsystem umgehen, indem sie die Immun-Checkpoints aktivieren und die Aktivität der T-Lymphozyten hemmen. Durch ICI werden diese inhibitorische Regulationsmechanismen blockiert, was neben der gewünschten Aktivierung der antitumoralen Immunantwort zu vermehrten immunvermittelten Reaktionen als Nebenwirkung führen kann (16). Bis zu 60 % der Patienten unter kombinierter ICI-Therapie können davon betroffen sein und immunvermittelte Reaktionen in multiplen Organen (Gastrointestinaltrakt, endokrines System, Leber, Haut, Lunge, Zentralnervensystem, Nieren, Augen und Knochenmark) entwickeln. Immunvermittelte Endokrinopathien treten bei bis zu 10–20 % der Patienten unter ICI auf. Diese sind, im Gegensatz zu den restlichen Manifestationen, auch unter immunsupprimierender Therapie irreversibel und benötigen eine lebenslange Hormonsubstitution. Am häufigsten werden Thyreoiditiden und Hypophysitiden beobachtet. Seltener können auch eine primäre NNI als Folge einer Adrenalitis und eigentlich jede bekannte endokrine Autoimmunerkrankung auftreten (17). Zur vorzeitigen Erkennung einer ICI-induzierten primären oder sekundären NNI wird eine Kontrolle des Nüchterncortisols sowie des TSH inklusive fT4 vor jedem Therapiezyklus bis 12 Wochen nach Therapieabschluss empfohlen (16, 18).
Hypophysitis (sekundäre NNI)
Die Pathogenese der ICI-induzierten Hypophysitis ist noch nicht vollständig verstanden. In einer Studie mit Tiermodell (19) wurde als Hypothese eine immunologische Typ- II-Reaktion beschrieben, wobei es zur Infiltration der Hypophyse durch Lymphozyten und Bildung von Antikörper gegen thyreotrope, corticotrope und gonadotrope Zellen, welche CTLA-4-Antigen exprimieren, kommt. Dies würde die bedeutend höhere Inzidenz unter CTLA-4- gegenüber PD(L)-1-Inhibitoren erklären (20). Die Hypophysitis betrifft häufiger Männer als Frauen und manifestiert sich durchschnittlich neun Wochen nach Therapiestart, kann allerdings bis zu mehrere Monate nach abgeschlossener Therapie auftreten. Die Symptome entstehen durch einen Kompressionseffekt (Kopfschmerzen, Nausea, Sehstörungen) oder die ausbleibende Hormonproduktion (NNI, Hypogonadismus, Hypothyreose). Die laktotrope und somatotrope Achse ist selten betroffen. Bei klinischem Verdacht kann die Diagnose durch die Bestimmung der hypophysären Hormone und Elektrolyte erfolgen (Tab. 3). Ebenso ist eine zerebrale Bildgebung mittels MRI, vor allem bei Kompressionssymptomen, sinnvoll. Die Therapie besteht aus der entsprechenden Hormonsubstitution (CAVE: bei gleichzeitiger NNI und sekundärer Hypothyreose muss die GC-Substitution vor der Schilddrüsensubstitution begonnen werden). Bei Kompressionsbeschwerden soll initial eine hoch dosierte GC-Therapie (1–2 mg/kgKG Prednisolon) während 1–2 Wochen mit konsekutiv raschem Tapering und Umstellung auf Hydrocortison verabreicht werden, um einen schnellen abschwellenden Effekt zu erzielen. Eine Pausierung der ICI bis zur Verbesserung der Symptomatik soll ebenso evaluiert werden (16).
Adrenalitis (primäre NNI)
Patienten unter monoklonalen PD-(L)1-Inhibitoren oder Kombinationstherapie können in seltenen Fällen eine autoimmune Adrenalitis, z. T. mit Nachweis von Anti-21-Hydroxylase-Antikörpern, entwickeln. Diese tritt vermehrt bei Frauen und durchschnittlich 16 Wochen nach Therapiebeginn auf. Die Symptome sind zumeist, ähnlich anderer Formen der primären NNI, schwerwiegend und mit einer erhöhten Mortalität im Rahmen einer möglichen Addison-Krise verbunden. Die Diagnosestellung erfolgt vor allem klinisch, wobei die Messung eines tiefen Serumcortisols um 8 Uhr bei erhöhtem ACTH sowie niedrigem Aldosteron und erhöhtem Renin die Diagnose bestätigt und eine Hyponatriämie, Hypoglykämie und Hyperkaliämie hinweisend sind. Eine initial hoch dosierte parenterale Hydrocortisonsubstitution (wie bei Addison-Krise) ist in den meisten Fällen notwendig und kann im Verlauf auf eine Erhaltungsdosis von 15–25 mg Hydrocortison und Fludrocortison 0.05–0.1 mg/Tag p.o. umgestellt werden (Tab. 3) (18).
Opiate
Trotz der häufigen Anwendung von Opiaten werden die damit verbundenen endokrinen Nebenwirkungen weiterhin selten und oft zu spät erkannt. Da die Klinik mit den Symptomen einer Opiatüberdosierung verwechselt werden kann, wird die opiatinduzierte Nebenniereninsuffizienz (OI-NNI) nur bei ca. 10 % der Patienten korrekt diagnostiziert (21). Das Risiko für eine OI-NNI steigt mit der Dauer und der Dosis der Opiate an. In einer amerikanischen Querschnittsstudie wurde eine sekundäre NNI ab einer Dosis von > 20 MME (Mg-Morphin-äquivalent) beobachtet, sodass ein regelmässiges klinisches Screening bei Patienten unter > 20 MME empfohlen wird (22). Gemäss der aktuellen Datenlage besteht noch kein Konsensus hinsichtlich eines einheitlichen diagnostischen Vorgehens. In mehreren Übersichtsartikeln wurden die Messung des Serumcortisols nüchtern um 8 Uhr und ggf. DHEAS sowie bei unklaren Befunden die Durchführung eines ACTH-Stimulationstests (gleiche Cut-offs wie für die GC-induzierte NNI) vorgeschlagen (23). Ein Insulintoleranztest als Goldstandard kann alternativ in Betracht gezogen werden, wird allerdings aufgrund der limitierten Verfügbarkeit und möglichen Nebenwirkungen selten angewandt. Sollte sich die Diagnose bestätigen und der Patient dazu passende Symptome aufweisen, kann eine Substitution mit Hydrocortison p.o. 15–25 mg/Tag unter regelmässiger klinischer Kontrolle etabliert werden. Ebenso soll die Reduktion bzw. das Sistieren der Opiattherapie angestrebt werden, da die NNI hierunter im Verlauf reversibel sein kann (24). Die durchschnittliche Zeit bis zur vollständigen Erholung der HHN-Achse ist allerdings bis dato unbekannt (25).
Abkürzungen
ACTH Adrenocorticotropes Hormon
CRH Corticotropin-releasing hormon
CTLA-4 Cytotoxic T-lymphocyte-associated Protein 4
DHEAS Dehydroepiandrosteronsulfat
FAERS Food and Drugs Administration Adverse-Event-Reporting-System
GC Glucocorticoide
HHN-Achse Hypothalamus-Hypophysen-Nebennierenrinden-Achse
ICI Immuncheckpoint-Inhibitoren
NNI Nebenniereninsuffizienz
OI Opiatinduziert
PD-1 Programmed death-protein 1
PD-L1 Programmed death-protein ligand 1
Historie
Manuskript eingegangen: 26.11.2024
Angenommen nach Revision: 27.02.2025
Klinik für Endokrinologie, Diabetologie,
Osteologie und Stoffwechselerkrankungen
HOCH Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
stefan.bilz@h-och.ch
Klinik für Endokrinologie, Diabetologie,
Osteologie und Stoffwechselerkrankungen
HOCH Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
• Multiple Medikamente können die Funktion der Hypophyse/Hypothalamus/Nebennieren, aber auch die Cortisol-Konzentration und seine zelluläre Wirkung beeinflussen, die häufigste medikamentöse Ursache einer NNI stellen exogene Glucocorticoide dar.
• Nach Erreichen einer Tagesdosis von 7.5–5 mg Prednisonäquivalent kann die Therapie mg-weise ausgeschlichen werden oder eine Messung des Serumcortisols morgens um 8:00 h erfolgen. Bei einem Wert > 300 nmol/l kann die Therapie gestoppt werden. Eine Steroidstressprophylaxe ist bei allen Patienten nach/unter niedrigdosierter GC-Therapie ohne biochemischen Nachweis einer adäquaten Cortisolproduktion sinnvoll.
• ICI Anti CTLA-4 verursachen am Häufigsten eine sekundäre NNI durch eine Hypophysitis, wohingegen Anti PD(L)-1 für eine primäre NNI bei Adrenalitis verantwortlich sind. Diese können sich 9–16 Wochen nach Therapiestart manifestieren und sind irreversibel.
• Bei einer Opiat-Therapie sollte ab einer Dosis > 20 MME ein regelmässiges Screening auf Symptome einer NNI erfolgen. Eine Substitutionstherapie ist häufig nur vorübergehend notwendig da die NNI nach Sistieren der Opiattherapie reversibel ist.
1. Martin-Grace J, Tomkins M, O’Reilly MW, Sherlock M. Iatrogenic adrenal insufficiency in adults. Nat Rev Endocrinol. 2024;20:209-227.
2. Bornstein SR. Predisposing factors for adrenal insufficiency. N Engl J Med. 2009;360:2328-39.
3. Fischli S. Nebenniereninsuffizienz. Swiss Medical Forum. 2016;16:993–1003.
4. Raschi E, Fusaroli M, Massari F et al. The Changing Face of Drug-induced Adrenal Insufficiency in the Food and Drug Administration Adverse Event Reporting System. J Clin Endocrinol Metab. 2022;107:e3107-e3114.
5. Laugesen K, Jørgensen JOL, Sørensen HT, Petersen I. Systemic glucocorticoid use in Denmark: a population-based prevalence study. BMJ Open. 2017;7:e015237.
6. Broersen LH, Pereira AM, Jørgensen JO, Dekkers OM. Adrenal Insufficiency in Corticosteroids Use: Systematic Review and Meta-Analysis. J Clin Endocrinol Metab 2015;100:2171-2180.
7. Ramos-Casals M, Brahmer JR, Callahan MK, et al. Immune-related adverse events of checkpoint inhibitors. Nat Rev Dis Primers. 2020;6:38.
8. Shi Y, Shen M, Zheng X, Yang T. Immune Checkpoint Inhibitor-Induced Adrenalitis and Primary Adrenal Insufficiency: Systematic Review and Optimal Management. Endocr Pract. 2021;27:165-169.
9. Zajacova A, Grol-Prokopczyk H, Limani M, Schwarz C, Gilron I. Prevalence and correlates of prescription opioid use among US adults, 2019-2020. PLoS One. 2023;18:e0282536.
10. de Vries F, Bruin M, Lobatto DJ, Dekkers OM, Schoones JW, van Furth WR, Pereira AM, Karavitaki N, Biermasz NR, Zamanipoor Najafabadi AH. Opioids and Their Endocrine Effects: A Systematic Review and Meta-analysis. J Clin Endocrinol Metab. 2020;105:1020–29.
11. Wilson JC, Sarsour K, Gale S, Pethö-Schramm A, Jick SS, Meier CR. Incidence and Risk of Glucocorticoid-Associated Adverse Effects in Patients With Rheumatoid Arthritis. Arthritis Care Res (Hoboken). 2019;71:498-511.
12. Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ. 2021;374:n1936.
13. Borresen SW, Klose M, Glintborg D, Watt T, Andersen MS, Feldt-Rasmussen U. Approach to the Patient With Glucocorticoid-induced Adrenal Insufficiency. J Clin Endocrinol Metab. 2022;107:2065-2076.
14. Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: Diagnosis and Therapy of Glucocorticoid-induced Adrenal Insufficiency. J Clin Endocrinol Metab. 2024;109:1657-1683.
15. Komminoth M, Donath MY, Hepprich M, et al. Glucocorticoid withdrawal and glucocorticoid-induced adrenal insufficiency: Study protocol of the randomized controlled «TOASST” (Taper Of Abrupt Steroid STop) multicenter trial. PLoS One. 2023;18:e0281585.
16. Wright JJ, Powers AC, Johnson DB. Endocrine toxicities of immune checkpoint inhibitors. Nat Rev Endocrinol. 202;17:389-399.
17. Del Rivero J, Cordes LM, Klubo-Gwiezdzinska J, Madan RA, Nieman LK, Gulley JL. Endocrine-Related Adverse Events Related to Immune Checkpoint Inhibitors: Proposed Algorithms for Management. Oncologist. 2020;25:290-300.
18. Elshimy G, Raj R, Akturk HK, et al. Immune Checkpoint Inhibitors Related Endocrine Adverse Events (Internet). South Dartmouth (MA); Endotext (Updated 2022 Jan 21). Verfügbar unter: https://www-ncbi-nlm-nih-gov.kb.ezproxy1.sg.ch/books/NBK577214/
19. Iwama S, De Remigis A, Callahan MK, Slovin SF, Wolchok JD, Caturegli P. Pituitary expression of CTLA-4 mediates hypophysitis secondary to administration of CTLA-4 blocking antibody. Sci Transl Med. 2014;6:230ra45.
20. Barroso-Sousa R, Barry WT, Garrido-Castro AC, Hodi FS, Min L, Krop IE, Tolaney SM. Incidence of Endocrine Dysfunction Following the Use of Different Immune Checkpoint Inhibitor Regimens: A Systematic Review and Meta-analysis. JAMA Oncol. 2018;4:173-182.
21. Li, T.; Donegan, D.; Hooten, W.; Bancos, I. Clinical Presentation and Outcomes of Opioid-Induced Adrenal Insufficiency. Endocr. Pract. 2020;26:1291–1297.
22. Li T, Cunningham JL, Gilliam WP, Loukianova L, Donegan DM, Bancos I. Prevalence of Opioid-Induced Adrenal Insufficiency in Patients Taking Chronic Opioids. J Clin Endocrinol Metab. 2020;105:e3766–75.
23. Patel E, Ben-Shlomo A. Opioid-induced adrenal insufficiency: diagnostic and management considerations. Front Endocrinol (Lausanne). 2024;14:1280603.
24. Donegan, D.; Bancos, I. Opioid-Induced Adrenal Insufficiency. Mayo Clin. Proc. 2018;93: 937–944.
25. Coluzzi F, LeQuang JAK, Sciacchitano S, Scerpa MS, Rocco M, Pergolizzi J. A Closer Look at Opioid-Induced Adrenal Insufficiency: A Narrative Review. Int J Mol Sci. 2023;24:4575.
PRAXIS
- Vol. 114
- Ausgabe 4
- April 2025