- Muskelschwäche nach intravenöser Eisensubstitution
Nachdem eine junge Patientin eine intravenöse Eisensubstitution bei schwerer symptomatischer Eisenmangelanämie erhalten hatte, wurde eine schwere Hypophosphatämie mit begleitend leichtgradiger Muskelschwäche diagnostiziert. Bei renalem Phosphatverlust und erhöhtem Fibroblast Growth Factor 23 (FGF23) im Serum wurde die Diagnose einer Hypophosphatämie nach Verabreichung von Eisencarboxymaltose (Ferinject®) gestellt. Durch Hochregulation von FGF23 wird die renale Phosphatrückresorption gehemmt und die Aktivierung von Vitamin-D reduziert, wodurch die intestinale Phosphataufnahme weiter vermindert wird. Die Symptome einer Hypophosphatämie können nach erfolgter Eisensubstitution maskiert sein.
Schlüsselwörter: Eiseninfusion, Hypophosphatämie, Muskelschwäche, Fibroblast Growth Factor 23
Anamnese und Befunde
Eine 29-jährige, bislang gesunde Frau ohne vorbestehende Dauermedikation stellte sich mit ausgeprägter Schwäche, Müdigkeit und Belastungsdyspnoe seit einigen Wochen auf der Notfallstation vor. Die Diagnose einer schweren Eisenmangelanämie mit einem Hämoglobin (Hb) von 68 g/l (Normwert 120–160 g/L) wurde gestellt (Tab. 1), es erfolgte eine intravenöse (i. v.) Substitution mit 1000 mg Eisencarboxymaltose (Ferinject®).
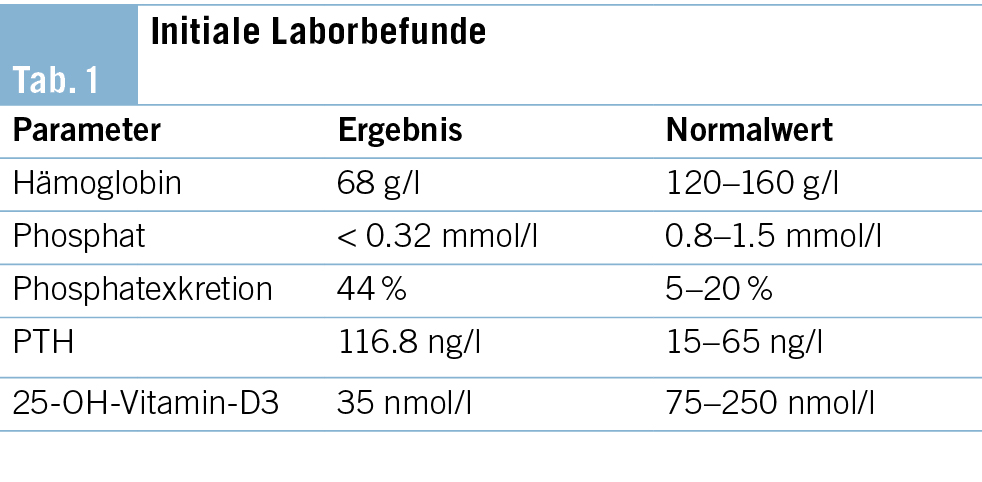
In der ersten Verlaufskontrolle nach drei Wochen berichtete die Patientin über ein gesteigertes Wohlbefinden sowie verringerte Müdigkeit. Das Hb stieg auf 108 g/l. Auffallend war jedoch ein Serumphosphat unterhalb der Nachweisgrenze (< 0.32 mmol/l, Normwert 0.8–1.5 mmol/l). Eine leichtgradige beinbetonte Muskelschwäche wurde auf Nachfrage beklagt. Wir vermuteten eine Maskierung der Symptome einer schweren Hypophosphatämie bei kurzfristig gebesserten Anämiebeschwerden.
Die renale Phosphatexkretion war mit 44 % (Normwert 5–20 %, bei Hypophosphatämie < 5 %) deutlich erhöht. Zudem lag ein Vitamin-D-Mangel vor, und das Parathormon (PTH) und der Fibroblast Growth Factor 23 (FGF23) waren erhöht.
Differenzialdiagnostische Überlegungen
Eine Hypophosphatämie kann verschiedene Ursachen haben. Entstehen kann sie beispielsweise durch eine verminderte intestinale Aufnahme, eine erhöhte renale Ausscheidung oder durch einen Phosphat-Shift von extra- nach intrazellulär – letzteres bei stimulierter Glykolyse im Rahmen eines Refeeding-Syndroms oder einer respiratorischen Alkalose (1). Ebenso ist eine Hypophosphatämie bei Nierenersatzverfahren möglich (2).
Eine verminderte intestinale Phosphataufnahme war bei unserer Patientin denkbar, da sie phasenweise nur eine Mahlzeit pro Tag einnahm. Zudem kann ein Vitamin-D-Mangel, welcher auch bei unserer Patientin bestand, zusätzlich eine verminderte intestinale Phosphataufnahme bewirken (1).
Fastenperioden führen jedoch selten zu einer solch schweren isolierten Hypophosphatämie (1). Auch die übrigen unauffälligen Elektrolyte und die normwertigen Spiegel von Vitamin B12, Albumin und Folsäure bei unserer Patientin sprachen gegen das Vorliegen einer relevanten Mangelernährung.
Bei erhöhter Phosphatexkretion im Urin dachten wir differenzialdiagnostisch an einen renalen Phosphatverlust. Ein Hyperparathyreoidismus, welcher bei unserer Patientin vorlag, sorgt für eine verminderte renale Phosphatrückresorption und führt somit zu einer erhöhten renalen Phosphatausscheidung. Bei stets normwertigem Serumcalcium war ein primärer Hyperparathyreoidismus jedoch wenig wahrscheinlich. Wir werteten deshalb das erhöhte PTH am ehesten im Rahmen eines sekundären Hyperparathyreoidismus als Folge des Vitamin-D-Mangels. Eine weitere Differenzialdiagnose für einen erhöhten renalen Phosphatverlust bei erhöhtem FGF23 ist eine unerwünschte Arzneimittelwirkung nach I.-v.-Eisensubstitution (3–5).
Weitere Abklärungsschritte und Verlauf
Aufgrund der milden Symptomatik entschieden wir uns, trotz der schweren Hypophosphatämie, für eine orale Substitution mit Reducto®-spezial (Kaliumdihydrogenphosphat und Natriummonohydrogenphosphat-Dihydrat, insgesamt 3.6 g Phosphat täglich). Infolge einer allergischen Hautreaktion mussten wir auf Kaliumphosphat 1 molar B. Braun®-Ampullen zur oralen Einnahme wechseln. Darunter konnte über mehrere Wochen eine schrittweise Erhöhung des Serumphosphates erreicht und die Phosphatsubstitution stufenweise reduziert werden. Begleitend erfolgte eine orale Vitamin-D-Substitution.
Nach insgesamt sechs Wochen zeigte sich das Serumphosphat unter gestoppter oraler Phosphateinnahme anhaltend im Normbereich. Anamnestisch war bereits wenige Tage nach Therapiebeginn keine Muskelschwäche mehr auszumachen.
Sechs Monate später präsentierte sich die Patientin erneut mit einer Eisenmangelanämie bei einem Hb von 79 g/l trotz hochdosierter oraler Eisensubstitution. Eine gynäkologische Blutungsquelle bei Uterus myomatosus wurde vermutet. Wir entschieden uns für eine erneute Eiseninfusion. Bei Status nach Hypophosphatämie nach Eisencarboxymaltose verabreichten wir nun 1000 mg Eisenisomaltose (Monofer®).
Der Hb-Wert stieg im Verlauf auf 100 g/l an. Laborchemisch war in den Tagen danach erneut eine moderate Hypophosphatämie (Phosphat minimal 0.43 mmol/l) zu sehen, klinisch mit leichter Muskelschwäche einhergehend. Es erfolgte eine passagere orale Phosphatsubstitution (Tab. 2).
Diagnose
Wir stellten die Diagnose einer schweren Hypophosphatämie als unerwünschte Arzneimittelwirkung nach intravenöser Eisensubstitution. Passend dazu liess sich nach der Verabreichung von Eisencarboxymaltose (Ferinject®) eine neue Hypophosphatämie detektieren. Zudem fand sich eine deutliche FGF23-Erhöhung im Serum sowie eine erhöhte renale Phosphatexkretion. Die erhöhte FGF23-Konzentration im Blut hemmte die tubuläre Phosphatrückresorption und führte somit zu einer erhöhten renalen Phosphatausscheidung (3, 6). Der zugrunde liegende Mechanismus für den Anstieg von FGF23 konnte bislang nicht vollständig geklärt werden. Wolf et al. vermuten, dass Eisenpräparate den FGF23-Abbau durch Osteozyten hemmen und somit mehr aktives FGF23 anfällt (6).
Eine erhöhte FGF23-Konzentration führt auch zu einer verminderten Umwandlung von 25-OH-Vitamin-D in 1.25-OH-Vitamin-D (Calcitriol). Ein Vitamin-D-Mangel seinerseits vermindert die intestinale Calciumresorption, wodurch es zu einer erhöhten Freisetzung von PTH kommt (3). PTH reduziert die renale und ein Calcitriol-Mangel die intestinale Phosphatresorption. So wird die Hypophosphatämie weiter verstärkt (1).
Kommentar
Die Häufigkeit einer Hypophosphatämie nach Eisensubstitution variiert je nach Präparat.
Wolf et al. beobachteten, dass es bei Eisencarboxymaltose etwa 9-mal häufiger zu einer schweren Hypophosphatämie (Serum-Phosphat ≤ 1 mg/dl [entspricht 0.32 mmol/l, Anmerkung Autorin]) kommt verglichen zu Eisenisomaltose (7).
Schaefer et al. beschrieben ein bis zu 20-fach erhöhtes Risiko für eine Hypophosphatämie durch Eisencarboxymaltose verglichen zu Eisenisomaltose. In derselben Studie wurden schwere Hypophosphatämien nur in der Gruppe mit Eisencarboxymaltose verzeichnet (8).
Unsere Patientin erhielt initial 1000 mg Eisencarboxymaltose (Ferinject®). Das Serumphosphat lag am Tag der Verabreichung im Normbereich. Drei Wochen später zeigte sich ein schwerer Phosphatmangel.
Auch nach Verabreichung von 1000 mg Eisenisomaltose (Monofer®) trat eine substitutionsbedürftige Hypophosphatämie auf. Dies verdeutlicht, dass es auch beim Einsatz von Eisenisomaltose zu einer Hypophosphatämie kommen kann, trotz geringeren Risikos.
Eine Hypophosphatämie kann bereits nach einmaliger Eiseninfusion auftreten (8). Die Patientinnen und Patienten sollten vorgängig über die Symptome eines Phosphatmangels aufgeklärt werden. Diese umfassen Muskelschwäche, Schluckstörungen, gastrointestinale Beschwerden (Ileus) sowie Atemnot als Ausdruck einer Herz- oder Ateminsuffizienz. Neurologisch sind Parästhesien, eine verstärkte Reizbarkeit und Verwirrtheit beschrieben. Bei länger andauernden Hypophosphatämien kann auch der Mineral- und Knochenhaushalt gestört sein (1, 8).
Dieses Fallbeispiel zeigt, dass auch bei leichtgradiger Symptomatik eine schwere Hypophosphatämie vorliegen kann. Hierbei ist eine zusätzliche Beschwerdemaskierung durch die Korrektur eines Eisenmangels möglich. Therapeutisch sollte bei leichten Symptomen primär eine orale Phosphatsubstitution erfolgen, ein begleitender Vitamin-D-Mangel muss berücksichtigt und ebenfalls ausgeglichen werden.
Abkürzungen
FGF23 Fibroblast Growth Factor 23
Hb Hämoglobin
i. v. Intravenös
PTH Parathormon
Klinik für Allgemeine Innere Medizin/Hausarztmedizin und Notfallmedizin
Kantonsspital St. Gallen
Laura.Giezendanner@kssg.ch
Klinik für Allgemeine Innere Medizin/Hausarztmedizin
und Notfallmedizin, Kantonsspital St. Gallen
Rorschacherstrasse 95,
9007 St. Gallen
Oberärztin mbF
Klinik für Allgemeine Innere Medizin/Hausarztmedizin und Notfallmedizin
Kantonsspital St. Gallen
Die Autorinnen haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Gaasbeek A, Meinders AE. Hypophosphatemia: an update on its etiology and treatment. Am J Med 2005;118:1094–101. https://doi.org/10.1016/j.amjmed.2005.02.014.
2. Broman M, Carlsson O, Friberg H, Wieslander A, Godaly G. Phosphate-containing dialysis solution prevents hypophosphatemia during continuous renal replacement therapy. Acta Anaesthesiol Scand 2011;55:39–45. https://doi.org/10.1111/j.1399-6576.2010.02338.x.
3. Schaefer B, Tobiasch M, Wagner S, Glodny B, Tilg H, Wolf M, et al. Hypophosphatemia after intravenous iron therapy: Comprehensive review of clinical findings and recommendations for management. Bone 2022;154:116202. https://doi.org/10.1016/j.bone.2021.116202.
4. Wolf M, Chertow GM, Macdougall IC, Kaper R, Krop J, Strauss W. Randomized trial of intravenous iron-induced hypophosphatemia. JCI Insight 2018;3:e124486. https://doi.org/10.1172/jci.insight.124486.
5. Schaefer B, Meindl E, Wagner S, Tilg H, Zoller H. Intravenous iron supplementation therapy. Mol Aspects Med 2020;75:100862. https://doi.org/10.1016/j.mam.2020.100862.
6. Wolf M, Koch TA, Bregman DB. Effects of iron deficiency anemia and its treatment on fibroblast growth factor 23 and phosphate homeostasis in women: FGF23 IN IRON DEFICIENCY. J Bone Miner Res 2013;28:1793–803. https://doi.org/10.1002/jbmr.1923.
7. Wolf M, Rubin J, Achebe M, Econs MJ, Peacock M, Imel EA, et al. Effects of Iron Isomaltoside vs Ferric Carboxymaltose on Hypophosphatemia in Iron-Deficiency Anemia: Two Randomized Clinical Trials. JAMA 2020;323:432. https://doi.org/10.1001/jama.2019.22450.
8. Schaefer B, Würtinger P, Finkenstedt A, Braithwaite V, Viveiros A, Effenberger M, et al. Choice of High-Dose Intravenous Iron Preparation Determines Hypophosphatemia Risk. PLOS ONE 2016;11:e0167146. https://doi.org/10.1371/journal.pone.0167146.
9. Hardy S, Vandemergel X. Intravenous Iron Administration and Hypophosphatemia in Clinical Practice. Int J Rheumatol 2015;2015:1–6. https://doi.org/10.1155/2015/468675.
PRAXIS
- Vol. 113
- Ausgabe 9
- Oktober 2024







