- Neue und etablierte multimodale Therapiestrategien beim fortgeschrittenen Rektumkarzinom
Lokal fortgeschrittene Rektumkarzinome haben ein hohes Lokalrezidivrisiko, das durch eine multimodale Therapie gesenkt werden kann. Die neoadjuvante Radiotherapie oder Radiochemotherapie hat sich etabliert. Dennoch konnte eine Verbesserung des Gesamtüberlebens hierdurch nicht erreicht werden. Der Nutzen einer adjuvanten Chemotherapie nach neoadjuvanter Radio- oder Radiochemotherapie ist nach wie vor unklar. Aktuell untersuchen Studien die total neoadjuvante Therapie mit unterschiedlichen Sequenzen von Radiotherapie und Chemotherapie, gefolgt von einer Rektumresektion. Hierbei zeigen sich hohe pathologische Komplettremissionen bis zu 28 % sowie eine Verbesserung des krankheitsfreien und metastasenfreien Überlebens. Unter Studienbedingungen kann bei klinischer Komplettremission ein «Watch & Wait» mit engmaschiger Nachsorge und Operation ausschliesslich bei einem lokalen Wiederauftreten des Tumors in Erwägung gezogen werden.
Geschichtlicher Rückblick
Die Behandlung des Rektumkarzinoms hat sich über die vergangenen drei Jahrhunderte dramatisch verändert. Während die Krankheit bis ins 18. Jahrhundert als unheilbar galt, liegt das 5-Jahres-Überleben heute bei über 70 % [1].
Die erste erfolgreiche Rektumresektion wird Jacques LisFranc anfangs des 19. Jahrhunderts zugeschrieben. LisFranc bat die Patientinnen und Patienten, sich nach vorne zu bücken, evertierte das Rektum, resezierte unterhalb der Umschlagsfalte und amputierte das Rektum ohne Anästhesie oder Blutstillung [2].
Später ermöglichten die Anästhesie und Asepsis neue Techniken. Kocher und Kraske entfernten 1874 das Rektum über eine komplette oder partielle Sakrektomie von dorsal [3, 4, 5]. Die perioperative Mortalität in der Zeit vor 1900 betrug über 20 % bei einer Rezidivrate um die 80 % [6]. Im 20. Jahrhundert entwickelte Sir William Ernest Miles die abdominoperineale Rektumamputation (APR) unter Entfernung des gesamten Rektums mit Analkanal und des Lymphabflussgebiets en bloc [7]. Nach Fortschritten in der Bluttransfusion konnte eine Mortalität von 9 % bei einer Rezidivrate von 30 % erreicht werden [8].
Die erste Schliessmuskel-erhaltende Operation wurde 1948 von Dixon beschrieben und in den 1970er Jahren von Parks weiterentwickelt [4, 9]. Nach wie vor zeigten sich hohe lokale Rezidivraten. Über ein Viertel der resezierten Präparate wies positive seitliche Schnittränder auf, und folglich entwickelte sich in 85 % dieser Fälle ein Lokalrezidiv im Becken [10]. Richard Heald entwickelte später eine Resektionstechnik, welche die embryologischen Hüllfaszien des Beckens respektierte. Er entfernte den Tumor mit Mesorektum en bloc bis auf Höhe des Levatormuskels und bezeichnete dieses Verfahren als totale mesorektale Exzision (TME). Dies führte zu deutlich weniger tumorbefallenen seitlichen Schnitträndern und entsprechend zu einer geringeren lokalen Rezidivrate von 4 % beim lokal begrenzten Rektumkarzinom. Das krankheitsfreie Überleben betrug nach fünf Jahren 80 % [11, 12]. Die TME verdrängte somit die radikale APR zunehmend und revolutionierte die Rektumchirurgie.
Multimodale Therapie beim fortgeschrittenen Rektumkarzinom
Das Rektumkarzinom gilt als lokal fortgeschritten bei wandüberschreitendem Wachstum und/oder bei Befall der Lymphknoten. Dabei infiltrieren T3-Karzinome das Mesorektum und T4-Tumoren überschreiten die embryonalen Hüllfaszien oder infiltrieren Nachbarorgane. Das Ausmass der Wandüberschreitung und die Detektion von Lymphknotenmetastasen gelingt mittels Magnetresonanztomografie (MRT) präzise. In der MRT lassen sich T3-Tumoren anhand des Ausmasses der mesorektalen Infiltration (T3a > 1 mm, b 1–5 mm, c 5–15 mm und d > 15 mm) weiter unterteilen. Die Grenzen des Mesorektums werden als zirkumferentieller Resektionsrand (CRM) bezeichnet. Reicht der Tumor bis 1 mm oder näher an den CRM heran oder überschreitet diesen (CRM+), besteht ein hohes Risiko für ein lokales Rezidiv bei einer alleinigen Rektumresektion. In historischen Kohorten betrug das Lokalrezidivrisiko bei nodal negativen, lokal fortgeschrittenen Tumoren 25–30 % und bei nodal metastasierten Tumoren bis 50 % [13]. Um dieses hohe Rezidivrisiko zu senken, wurden zur Behandlung der lokal fortgeschrittenen Rektumkarzinome multimodale Therapiekonzepte entwickelt.
Daher wurde in den 1980er-Jahren nach der chirurgischen Resektion die adjuvante Radiotherapie (RT) mit oder ohne Chemotherapie (CT) eingesetzt, um die onkologischen Ergebnisse zu verbessern [14]. Die postoperative RT galt 1990 als Standardbehandlung beim lokal fortgeschrittenen Rektumkarzinom [13].
Die neoadjuvante Radio(chemo)-Therapie
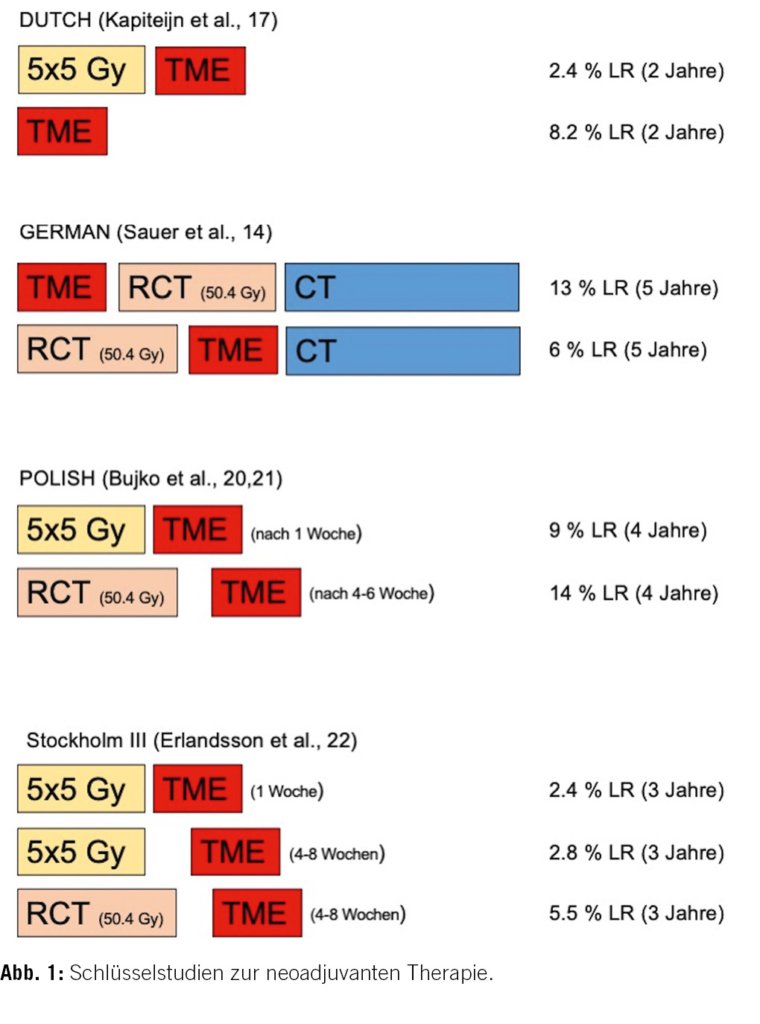
In den späten 1990er-Jahren wiesen mehrere Studien weniger Therapieversagen bei präoperativer RT im Vergleich zur alleinigen Chirurgie nach (Abb. 1) [15, 16]. Die sogenannte DUTCH-Studie zeigte, dass die Ergänzung einer präoperativen Kurzzeit-RT (5 × 5 Gray) vor einer TME bei cT1–3 Karzinomen die Rate an Lokalrezidiven nach zwei Jahren deutlich reduziert (2,4 % vs. 8.2 %, p < 0,001) [17]. Nach zehn Jahren lag die Lokalrezidivrate mit Bestrahlung bei 5 % und ohne Bestrahlung bei 11 % (p < 0,001). Das 10-Jahres-krankheitsfreie Überleben lag bei 40 vs. 50 %, p = 0,03), im Gesamtüberleben hingegen konnte kein Unterschied aufgezeigt werden [18].
Angesichts der überlegenen präoperativen RT und in der Annahme, dass eine zusätzliche CT einen weiteren Vorteil bewirkt [19], verglichen Sauer et al. präoperative versus postoperative RCT (über 6 Wochen) bei Personen mit T3/T4 oder N+. Die 5-Jahres-Gesamtüberlebensrate war vergleichbar bei 76 bzw. 74 % (p = 0,08), während die kumulative 5-Jahres-Lokalrezidivrate bei Personen mit einer präoperativen RCT mit 6 versus 13 % (p < 0,01) deutlich tiefer war. Zusätzlich zeigte sich eine deutlich bessere Verträglichkeit der präoperativen Therapie. Höhergradige akut toxische Wirkungen traten bei 27 % in der präoperativen und bei 40 % in der postoperativen Behandlungsgruppe auf (p < 0,01) [14].
Bujko verglich die präoperative Kurzzeit-RT mit TME nach einer Woche gegenüber der präoperativen RCT mit Operation nach 4–8 Wochen. Hierbei fand sich zugunsten der RCT eine höhere Rate an pathologischer Komplettremission (pCR) (16 vs. 1 %) und eine tiefere Inzidenz an Tumorinfiltration am CRM (4 % vs. 13 %, p = 0,017). Allerdings zeigte sich kein Unterschied bezüglich Sphinktererhalt (58 % vs. 61 %), 4-Jahres-Lokalrezidiv (14 % vs. 9 %) und dem 4-Jahres-krankheitsfreien-Überleben (56 % vs. 58 %). Obwohl die akute Toxizität bei der RCT höher war (18 % vs. 3 %, p < 0,001), konnte kein Unterschied bei den postoperativen Komplikationen nachgewiesen werden [20, 21].
Die Konzepte der Kurzzeit-RT und der RCT unterscheiden sich insbesondere dadurch, dass bei der Kurzzeit-RT nach einem kurzen Intervall von nur einer Woche die Rektumresektion erfolgt, bei der präoperativen RCT hingegen erst nach 4–8 Wochen.
Die randomisierte Stockholm-III-Studie von 2017 untersuchte das Intervall zwischen RT und Operation. Verglichen wurden Kurzzeit-RT und TME nach einer Woche versus Kurzzeit-RT und TME nach 4–8 Wochen versus RCT und TME nach 4–8 Wochen. Bei kumulativer Inzidenz des Lokalrezidivs (2,4, 2,8 und 5,5 %, p = 0,48), dem Auftreten von postoperativen Komplikationen, dem Nachweis von Fernmetastasen und im Gesamtüberleben konnten keine Unterschiede nachgewiesen werden. Nach einem längeren Intervall fand sich nach der Kurzzeit-RT eine höhere pCR (10,4 %) als nach RCT (2,2 %) oder direkter Operation nach Kurzzeit-RT (0,3 %) [22].
Es waren diese Schlüsselstudien, die schliesslich zu einem Paradigmenwechsel von der post- zur präoperativen RT führten. Trotz Verringerung der Lokalrezidivraten durch die neoadjuvante Therapie bleibt das Auftreten von metachronen Fernmetasten problematisch. Bis heute konnte keine Verbesserung im Gesamtüberlebens gezeigt werden, weder mit der RCT noch mit der RT. In den aktuellen deutschen Leitlinien werden beide Behandlungsmöglichkeiten ohne Präferenz empfohlen [23].
Adjuvante Chemotherapie nach präoperativer R(C)T
Während die adjuvante CT nach Rektumresektion ohne präoperative Behandlung gesichert ist, kann nach erfolgter neoadjuvanter RT oder RCT auf Grundlage der vorhandenen Datenlage keine Empfehlung für oder gegen eine adjuvante CT abgegeben werden [23].
In der Meta-Analyse von Breugom et al. wurden Daten von 1196 Personen mit Rektumkarzinom im Stadium II/III mit TME nach neoadjuvanter RCT untersucht. Es wurden keine signifikanten Unterschiede im Gesamtüberleben gefunden zwischen Personen, die eine adjuvante CT erhielten und jenen, welche beobachtet wurden (HR 0,97, p = 0,775) [24]. Sowohl krankheitsfreies Überleben wie Rezidivraten konnten nicht verbessert werden (HR 0,91, p = 0,23 resp. HR 0,94, p = 0,52).
Die adjuvante CT nach präoperativer Behandlung ist heutzutage in Analogie zum Kolonkarzinom in einigen Ländern Standard, wird aber kontrovers diskutiert [25].
Totale neoadjuvante Therapie (TNT) und W&W-Strategie
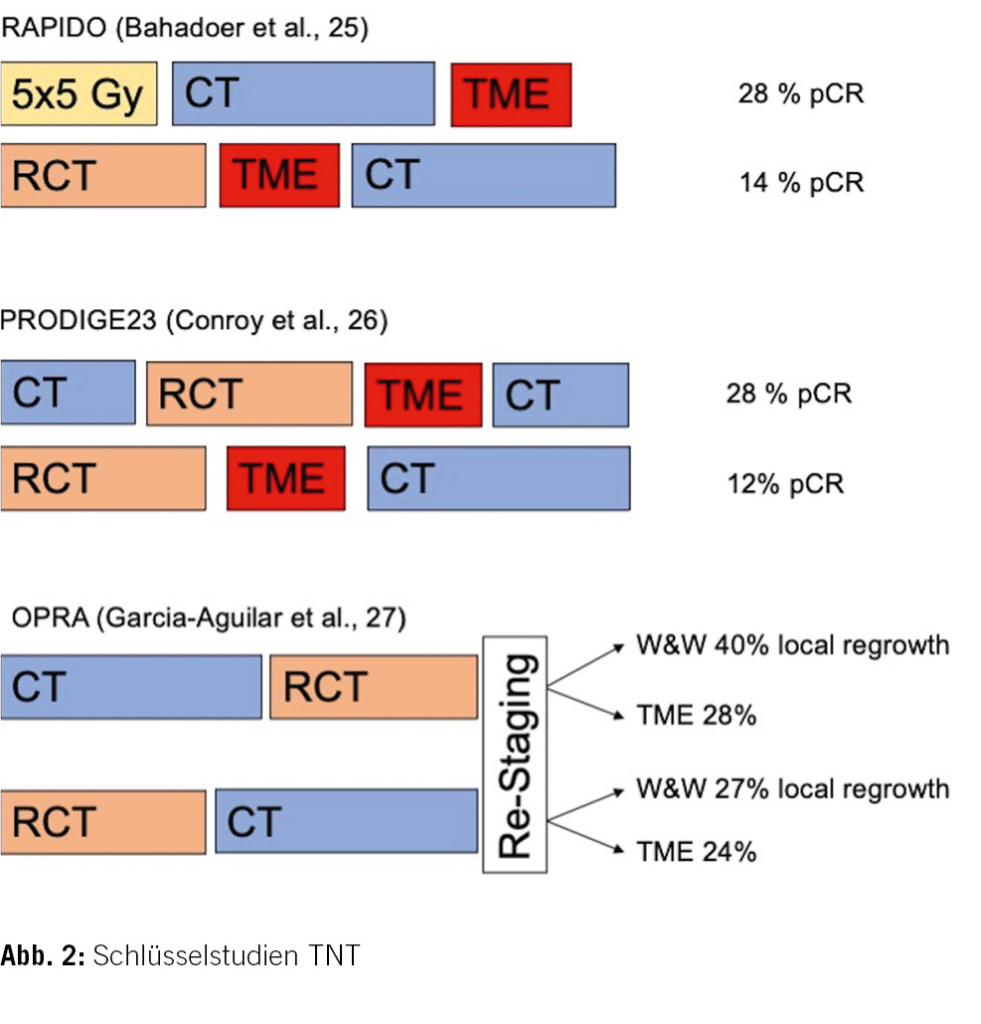
Ein Erklärungsversuch für den fehlenden Nachweis eines Überlebensvorteils mit adjuvanter Therapie könnte der hohe Anteil an Personen sein, die gar nicht erst einer adjuvanten Therapie zugeführt werden können. Dies, weil sie patientenseits abgelehnt wird oder auf Grund einer chirurgischen oder auch nicht-chirurgischen Komplikation mit andauernder Rekonvaleszenz. In diesem Kontext wurde bei der totalen neoadjuvanten Therapie (TNT) die Sequenz der multimodalen Behandlung angepasst. Wie die Stockholm-III-Studie [22] gezeigt hat, ist die Verzögerung der Operation auch nach einer Kurzzeit-RT möglich und gewährleistet somit ein Zeitfenster für eine präoperative CT. Die randomisierte RAPIDO-Studie untersuchte 920 Personen mit cT4a oder cT4b und High-risk-Kriterien (extramurale Veneninvasion (EMVI+), cN2, CRM+). Verglichen wurden die Sequenzen präoperative Kurzzeit-RT, CT und TME versus präoperative RCT, TME und adjuvante CT. Die Studie zeigte einen signifikanten Unterschied bezüglich der pCR: Nach TNT erfolgte Letztere bei 28 % der Teilnehmenden, nach Standardbehandlung nur bei 14 % (p < 0,001). Ferner konnte erstmalig auch ein niedriges kumulatives Risiko eines Therapieversagens in der TNT-Gruppe beobachtet werden (24 % in der TNT-Gruppe und 30 % in der Standardgruppe (HR 0,75, p = 0,019). welches hauptsächlich auf eine niedrigere kumulative Wahrscheinlichkeit von Fernmetastasen nach drei Jahren zurückgeführt werden konnte (TNT-Gruppe 20 % und in der Standardgruppe 27 % (HR 0,69, p = 0,0048)). Schwerwiegende Nebenwirkungen traten vergleichbar häufig in 38 % und 34 % der Fälle auf. Das Gesamtüberleben zeigte sich hingegen nicht unterschiedlich (p = 0,59). Die 3-Jahres-Überlebensrate betrug 89 % in beiden Gruppen [25].
In der PRODIGE23-Studie wurde die Sequenz umgekehrt. Es erfolgte zunächst die Chemotherapie, gefolgt von der RCT. 461 Personen mit TNM cT3 oder cT4 M0 wurden in die experimentelle oder in die Standardgruppe randomisiert. In der experimentellen Gruppe erfolgte eine neoadjuvante CT, gefolgt von einer RCT für fünf Wochen und TME sowie einer adjuvanten Therapie für drei Monate. In der Standardgruppe erfolgte eine RCT, gefolgt von der TME und einer adjuvanten CT für sechs Monate. In dieser Studie hatten 28 % der Teilnehmenden in der Gruppe mit neoadjuvanter CT eine pCR, während in der Standardgruppe nur 12 % eine pCR aufweisen (p < 0,01). Überdies betrug das krankheitsfeie Überleben nach drei Jahren 76 % in der experimentellen Gruppe und 69 % in der Standardgruppe (HR 0,69, p = 0,034). Des Weiteren zeigte sich ausserdem eine Verbesserung des metastasenfreien Überlebens nach drei Jahren: in der experimentellen Gruppe bei 79 % der Teilnehmenden und in der Standardgruppe bei 72 % (HR 0,64, p = 0,017). Schwerwiegende unerwünschte Ereignisse traten bei 27 % der Teilnehmenden in der experimentellen Gruppe und bei 22 % der Standardgruppe auf (p = 0,167). Für das Gesamtüberleben zeigte sich auch in dieser Studie knapp kein Unterschied (91 vs. 89 %, p = 0,08) [26].
Die beiden Studien unterscheiden sich insofern, als dass bei der RAPIDO-Studie nur sehr fortgeschrittene Tumoren eingeschlossen wurden, in der PRODIGE23-Studie alle Patientinnen und Patienten mit T3- und T4-Tumoren. Im Gegensatz zu zahlreichen vorgängigen Studien konnte in beiden Studien neben besseren pCR-Raten auch eine Verbesserung des krankheitsfeien und metastasenfreien Überlebens gezeigt werden.
Das ausgezeichnete Überleben von Patientinnen und Patienten mit pCR nach einer neoadjuvanten Therapie und die erhebliche Morbidität nach Operation stellt den zusätzlichen Nutzen einer TME bei klinisch kompletter Remission (cCR) in Frage. Deshalb wurde die Wirksamkeit einer «Watch-and-Wait»-Strategie (W&W) mit Organerhaltung bei Personen mit cCR zum zentralen Thema. In der OPRA-Studie [27] wurden Erkrankte mit Stadium II oder III im Sinn einer TNT mit einer Induktions-CT, gefolgt von einer RCT, versus RCT gefolgt von einer Konsolidierungs-CT randomisiert verglichen. Nach TNT erfolgte ein Re-Staging mit Computertomografie und MRT und je nach Tumoransprechen eine TME oder eine W&W. Das 3-Jahres-krankheitsfreie-Überleben war in beiden Gruppen 76 %. Auch die Rate an Lokalrezidiv-freiem Überleben und das Gesamtüberleben war nach drei Jahren nicht unterschiedlich. Nach Re-Staging wurde bei 28 % der Patientinnen und Patienten nach Induktions-CT und bei 24 % der Teilnehmenden nach Konsolidierungs-CT aufgrund einer nicht kompletten klinischen Remission die TME empfohlen. Von den übrigen Personen, die mittels W&W verfolgt wurden, entwickelten 40 % der Induktions-CT-Gruppe und 27 % der Konsolidierungs-CT-Gruppe während des Follow-ups ein erneutes Wachsen des lokalen Tumors («local regrowth»). In der Intention-to-treat-Analyse lag der Anteil an Personen, die sich nach drei Jahren keiner TME unterziehen mussten, bei 41 % in der Induktionsgruppe und bei 53 % in der Konsolidierungsgruppe (p = 0,01). Interessanterweise war das krankheitsfreie Überleben bei Patienten, die bei nicht vollständiger Remission eine TME erhielten, gleich wie bei denjenigen, bei denen nach initialem W&W bei Local Regrowth eine TME durchgeführt wurde (p = 0,5) (Abb. 2) [27].
Bereits von der heute als Standard geltenden Therapie des fortgeschrittenen Rektumkarzinoms mit RCT gefolgt von einer TME im Intervall ist bekannt, dass eine pCR mit einer sehr guten Prognose vergesellschaftet ist. Mehrere Studien zeigen, dass bei einer pCR sowohl das Gesamtüberleben als auch das krankheitsfreie Überleben besser ist als wenn sich noch Resttumor im Präparat findet [28]. In einer Studie mit Stadium-II/III-Patientinnen und -Patienten, welche eine neoadjuvante RCT und TME erhalten haben, zeigte sich bei 14 % eine pCR [28]. Das 5-Jahres-krankheitsfreie-Überleben der Personen mit pCR war mit 92 % bei einem Gesamtüberleben von 95 % exzellent [28]. Es gibt verschiedene Studien, die einen direkten Zusammenhang zwischen einer längeren Wartezeit vor der Operation und der Rate an pCR zeigen [29]. Dies gilt jedoch nur für Personen, die nach einer RCT oder RT eine gute Remission zeigen. Patientinnen und Patienten mit einem schlechten oder keinem Ansprechen auf die neoadjuvante RT profitieren nicht von einem längeren Intervall bis zur Operation. Die Studie von Deidda et al. zeigte, dass in diesem Kollektiv eine Wartezeit von über acht Wochen mit einem schlechteren 5-Jahres-Gesamtüberleben assoziiert war (67,5 vs. 80,3 %, p < 0,01). Personen, die nicht gut auf eine RCT ansprechen, sollten frühzeitig nach Abschluss der RCT identifiziert und ohne Verzögerung operiert werden [29].
Bereits vor Einführung des TNT-Konzepts gab es Überlegungen, Patientinnen und Patienten mit einer cCR nicht zu operieren, sondern den Verlauf engmaschig zu verfolgen. Für die Beurteilung des Therapieansprechens sind der rektale Palpationsbefund, der endoskopische Befund und das Becken MRT ausschlaggebend.
In einer Beobachtungsstudie aus Maastricht zeigte sich bei W&W mit kompletter Remission nach RCT in 23 % ein local regrowth innerhalb von 14 Monaten. Diese Tumoren wurden im Verlauf mittels TME (69 %) oder lokaler Exzision (31 %) operiert. Nach zwei Jahren waren 98 % der Teilnehmenden ohne Lokalrezidiv, 92 % ohne Metastasen, und das krankheitsfreie Überleben betrug 90 % respektive das Gesamtüberleben 98 % [30].
Ausblick
Auf Grund der aktuellen Datenlage ist bei fortgeschrittenem Rektumkarzinom, insbesondere bei Vorliegen von Risikofaktoren für ein lokales Rezidiv (distaler Tumor, cT3c/d, N+, CRM+, EMVI+) die TNT-Strategie sicherlich attraktiv. Es ergeben sich dennoch ungelöste Fragen. Eine Schwierigkeit bleibt die Einschätzung der cCR. Hier müssen Erfahrungen gesammelt werden, damit eine Evidenz erarbeitet werden kann, um mit hoher Zuverlässigkeit das komplette Therapieansprechen einschätzen zu können. Obwohl in der OPRA-Studie die Mehrheit der Patientinnen und Patienten nach TNT nicht primär operiert wurde, zeigte sich bei denjenigen, die eine TME erhielten, in der histologischen Untersuchung eine pCR bei nahezu 10 %. Dies demonstriert die schwierige Beurteilung [27]. Im Weiteren setzt das W&W eine hohe Patientencompliance für die aufwendige und engmaschige Nachsorge voraus. So sind beispielsweise im ersten Jahr dreimonatliche Kontrollen mit MRT und Endoskopie vorgesehen, im zweiten Jahr zumindest alle sechs Monate.
Eine laufende multizentrische Studie untersucht die Fragestellung, ob eine RCT, gefolgt von einer Konsolidierungs-CT, gegenüber einer Kurzzeit-RT, gefolgt von einer Konsolidierungs-CT, Vorteile in Bezug auf die Möglichkeit des Organerhalts mit sich bringt (ACO/ARO/AIO-18.1).
Die aktuellen deutschen Leitlinien sehen ein TNT-Konzept mit W&W daher nur im Rahmen von Studien vor. Die neuen multimodalen Therapiekonzepte bringen grosse Veränderungen mit sich in der Behandlung des lokal fortgeschrittenen Rektumkarzinoms. Die differenzierte Indikationsstellung für eines der multimodalen Konzepte auf Grund individueller Risikofaktoren gewinnt an Bedeutung, erhöht aber auch die Komplexität der Behandlung. Für die Patientinnen und Patienten bedeutet die multimoerdale Therapie auch eine sehr lange Therapiephase, welche sich je nach Sequenz über ein halbes Jahr hinzieht. Der mit zunehmender Möglichkeit zum Organerhalt verbundene Rückgang an Rektumkarzinomoperationen erhöht die Dringlichkeit der Konzentrierung dieser komplexen Operationen in spezialisierten Zentren, um die chirurgische Expertise zu sichern.
Im Artikel verwendete Abkürzungen
APR Abdominoperineale Resektion
cCR Klinische Komplettremission
CRM+ Positive Circumferential Resection Margin
CT Chemotherapie
EMVI Extramural Vascular Invasion
HR Hazard Ratio
pCR Pathologische Komplettremission
RCT Radiochemotherapie
TME Totale mesorektale Exzision
TNT Totale neoadjuvante Therapie
W&W Watch and Wait
Clarunis – Universitäres Bauchzentrum, Basel
Postfach
4002 Basel
Historie
Manuskript eingereicht: 19.11.2022
Nach Revision angenommen: 06.01.2023
Interessenskonflikte
Es bestehen keine Interessenskonflikte.
ORCID
Christian C. Steinemann
https://orcid.org/0000-0003-4111-2909
Fiorenzo Angehrn
https://orcid.org/0000-0002-5450-3100
Fabio Nocera
https://orcid.org/0000-0003-3370-9406
Key Messages
Die multimodale Therapie in Form einer neoadjuvanten Radiotherapie oder Radiochemotherapie hat sich beim fortgeschrittenen Rektumkarzinom etabliert und senkt das Risiko eines Lokalrezidivs.
Gegenwärtig werden unterschiedliche Sequenzen der totalen neoadjuvanten Therapie untersucht, bei der neben der Strahlentherapie auch die Chemotherapie vor einer Operation erfolgt.
Unter totaler neoadjuvanter Therapie zeigen sich sehr hohe komplette Remissionsraten, welche in individuellen Fällen «Watch & Wait» mit Verzicht auf eine Operation ermöglichen.
Die Therapie des lokal fortgeschrittenen Rektumkarzinoms ist zunehmend komplex und sollte in spezialisierten Zentren erfolgen.
Lernfragen
1. Das 5-Jahres-Überleben des Rektumkarzinoms (Durchschnitt über alle Tumorstadien) liegt heutzutage bei
(Einfachantwort):
a) 50 %
b) 60 %
c) 70 %
d) 80 %
2. Die totale mesorektale Exzision beinhaltet (Mehrfachantwort):
a) Tumor
b) Mesorektum
c) Mesorektale Lymphknoten
d) Analkanal
3. Die neoadjuvante Therapie beim Rektumkarzinom …
(Einfachantwort)
a) … verbessert das Gesamtüberleben.
b) … verringert die Rate an Lokalrezidiven.
c) … umfasst immer eine Chemotherapie neben der
Radiotherapie.
d) … ist bei nodal negativen T2-Tumoren indiziert.
4. Welche Aussagen sind richtig (Mehrfachantwort)?
a) Die TNT (totale neoadjuvante Therapie) beim Rektumkarzinom verbessert das Gesamtüberleben.
b) Patientinnen und Patienten, die nicht gut auf eine RCT ansprechen, sollten frühzeitig nach Abschluss der RCT identifiziert und operiert werden.
c) Für die Beurteilung des Therapieansprechens sind der rektale Palpationsbefund, der endoskopische Befund und das Becken-MRT nötig.
d) Die Nachsorge bei der TNT beinhaltet im ersten Jahr dreimonatliche Kontrollen mit MRT und Endoskopie, im zweiten Jahr zumindest alle sechs Monate.
1. Araghi M, Arnold M, Rutherford MJ, Guren MG, Cabasag CJ, Bardot A, et al. Colon and rectal cancer survival in seven high-income countries 2010–2014: variation by age and stage at diagnosis (the ICBP SURVMARK-2 project). Gut. 2021;70(1): 114–26. DOI: 10.1136/gutjnl-2020-320625.
2. Gilbersten VA. Contributions of William Ernest Miles to Surgery of the rectum for cancer. Dis Colon Rectum. 1964;7:375–80. DOI: 10.1007/BF02616845.
3. Graney MJ, Graney CM. Colorectal surgery from antiguity to the modern era. Dis Colon Rectum. 1980;23(6):432–41. DOI: 10.1007/BF02586797.
4. Lange MM, Rutten HJ, van de Velde CJH. One hundred years of curative surgery for rectal cancer: 1908–2008. Eur J Surg Oncol. 2009;35(5):456–63. DOI: 10.1016/j.ejso.2008.09.012.
5. Classic articles in colonic and rectal surgery. Paul Kraske 1851–1930. Extirpation of high carcinomas of the large bowel. Dis Colon Rectum. 1984;27(7):499–503.
6. Galler AS, Petrelli NJ, Shakamuri SP. Rectal cancer surgery: a brief history. Surg Oncol. 2011;20(4):223–30. DOI: 10.1016/j.suronc.2010.01.001.
7. Miles WE. A method of performing abdomino-perineal excision for carcinoma of the rectum and of the terminal portion of the pelvic colon (1908). CA Cancer J Clin. 1971;21(6):361–4. DOI: 10.3322/canjclin.21.6.361.
8. Ruo L, Guillem J. G. Major 20th-century advancements in the management of rectal cancer. Dis Colon Rectum .1999;42(5): 563–78. DOI: 10.1007/BF02234129.
9. Dixon CF, Lichtman AL. Anterior Resection for Malignant Lesions of the Upper Part of the Rectum and Lower Part of the Sigmoid. Ann Surg. 1948;128(3):425–42.DOI: 10.1097/00000658-194809000-00009.
10. Quirke P, Durdey P, Dixon MF, Williams NS. Local recurrence of rectal adenocarcinoma due to inadequate surgical resection. Histopathological study of lateral tumour spread and surgical excision. Lancet. 1986;2(8514):996–9. DOI: 10.1016/s0140-6736(86)92612-7.
11. Heald RJ, Ryall RD. Recurrence and survival after total mesorectal excision for rectal cancer. Lancet. 1986;1(8496):1479–82. DOI: 10.1016/s0140-6736(86)91510-2.
12. Heald RJ, Moran BJ, Ryall RD, Sexton R, MacFarlane JK. Rectal cancer: the Basingstoke experience of total mesorectal excision, 1978–1997. Arch Surg. 1998;133(8):894–9. DOI: 10.1001/archsurg.133.8.894.
13. NIH consensus conference. Adjuvant therapy for patients with colon and rectal cancer. JAMA. 1990;264(11):1444–50.
14. Sauer R, Becker H, Hohenberger W, Rödel C, Wittekind C, Fietkau R, et al., Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med. 2004;351(17):1731–40. DOI: 10.1056/NEJMoa040694.
PRAXIS
- Vol. 112
- Ausgabe 11
- September 2023