- Nicht-alkoholische Fettleber: Neuer Name, aber die Herausforderung bleibt
Aufgrund von Volkskrankheiten mit steigenden Patientenzahlen, wie etwa dem metabolischen Syndrom, werden metabolische Lebererkrankungen zu den häufigsten Lebererkrankungen der Zukunft. Im Artikel werden wesentliche Neuerungen erläutert, darunter die Nomenklaturänderung von nicht-alkoholischer Fettlebererkrankung zu metabolischer Dysfunktion-assoziierter steatotischer Lebererkrankung.
Schlüsselwörter: MASLD, NAFLD, Metabolisches Syndrom, Fibrose, Zirrhose
Die neuen Definitionen: Nicht-alkoholische Fettlebererkrankung (NAFLD) wird zu metabolische Dysfunktion-assoziierte steatotische Lebererkrankung (MASLD)
Im Sommer 2023 gaben internationale Lebergesellschaften – einschliesslich der European Association for the Study of the Liver (EASL) – das Ergebnis eines Delphi-Prozesses zur Änderung der NAFLD-Nomenklatur bekannt. Diese Überarbeitung erfolgte, um diagnostische Kriterien anhand leicht messbarer Parameter zu standardisieren und somit Heterogenität zu minimieren sowie potenziell stigmatisierende Begriffe aus der Nomenklatur zu eliminieren (1).
Überbegriff der neuen Nomenklatur ist die «steatotische Lebererkrankung» (Engl. «Steatotic Liver Disease» [SLD]). Eine SLD liegt vor, wenn eine Steatose in ≥5 % der Hepatozyten nachgewiesen werden kann. SLD umfasst als Überbegriff verschiedene Ursachen der Lebersteatose, die in Untergruppen genauer klassifiziert werden (Abb. 1).
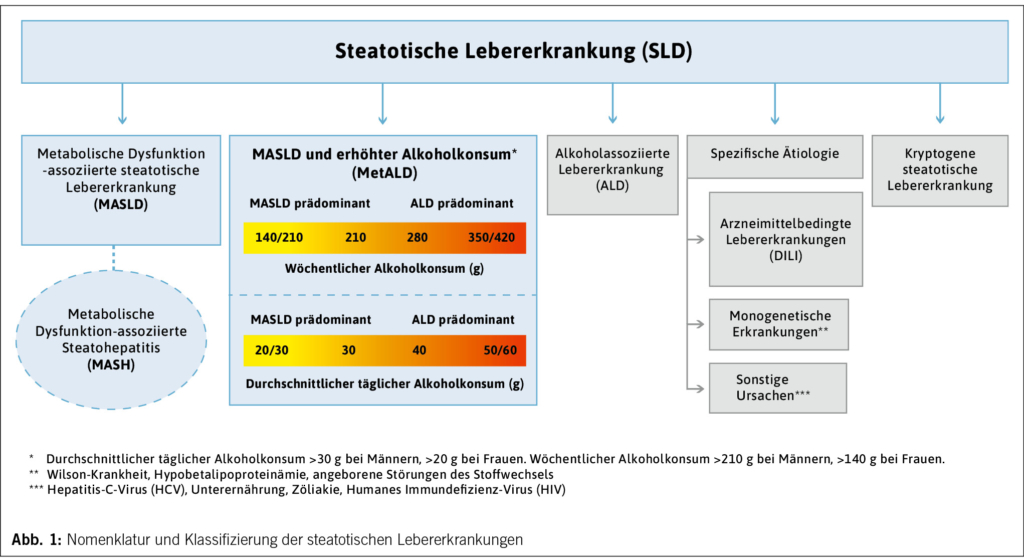
Die nicht-alkoholische Fettlebererkrankung (NAFLD) wird zu metabolische Dysfunktion-assoziierte steatotische Lebererkrankung (Engl. «Metabolic Dysfunction-associated Steatotic Liver Disease» [MASLD]) umbenannt (2). MASLD ist definiert als das Vorliegen einer Lebersteatose von mindestens 5 % in Kombination mit mindestens einem kardiometabolischen Risikofaktor (kmRF). Gemäss aktuellem Kenntnisstand können NAFLD und MASLD weitestgehend synonym verwendet werden und erfassen ein ähnliches Patientenkollektiv (3). Bei Vorliegen von entzündlicher Aktivität spricht man nun von einer metabolischen Dysfunktion-assoziierten Steatohepatitis (Engl. «Metabolic Dysfunction-associated Steatohepatitis» [MASH]).
Zudem wurde ein neues Krankheitsbild definiert, welches bis jetzt wenig Aufmerksamkeit erhielt. Diese neue Entität, MetALD, umfasst Patienten, welche die diagnostischen Kriterien für MASLD erfüllen und zudem relevante Alkoholmengen konsumieren (durchschnittlich >30g/Tag bei Männern, >20g/Tag bei Frauen). Diese Gruppe umfasst ein dynamisches Spektrum zwischen MASLD, wo der Krankheitsverlauf massgeblich bestimmt wird durch kmRF und Alkohol-bezogener Lebererkrankung (Engl. «Alcohol-associated Liver Disease» [ALD]), wo Alkoholkonsum der treibende Faktor ist. Das Risiko für eine schwere Lebererkrankung ist bei gleichzeitigem Vorliegen von kmRF und relevantem Alkoholkonsum stark erhöht (4). Bisher wurde dieser Tatsache durch die strikte Trennung von NAFLD und ALD kaum Rechnung getragen. Es ist davon auszugehen, dass MetALD Betroffene von gezielten klinischen Studien und der Sensibilisierung des Versorgungssystems profitieren werden. Weiterhin bestehen bleibt das Krankheitsbild der ALD. Hierbei steht der Alkoholkonsum im Vordergrund, und es liegen keine kmRF vor (Tab. 1).

Wenn auch nach Ausschluss von kmRF und seltenerer Ursachen (z.B. Wilson-Krankheit, Hypobetalipoproteinämie, vgl. Abb. 1) keine spezifische Ätiologie identifiziert werden kann, wird die Erkrankung als kryptogene steatotische Lebererkrankung (Engl. «Cryptogenic SLD») klassifiziert. Besonders in pädiatrischen Populationen ist es dabei wichtig, bei Fehlen eindeutiger kmRF andere mögliche Ursachen auszuschliessen. So sollte bei Verdacht auf eine Stoffwechselerkrankung insbesondere auch eine Untersuchung auf LAL-D (Lysosomale saure Lipase-Defizienz) in Betracht gezogen werden, da es sich um eine seltene, aber fatale und behandelbare Erkrankung handelt. In Fällen, in denen die Behandelnden eine Stoffwechselerkrankung ohne zunächst eindeutiges Vorliegen von kmRF vermuten, wird empfohlen, weitere Untersuchungen (z.B. Oral Glucose Tolerance Test, OGTT) durchzuführen und den Begriff «mögliche MASLD» zu verwenden (1).
Progression der MASLD: Von einfacher Steatose zur Steatohepatitis, Fibrose und Zirrhose, Dekompensation bis zum hepatozellulärem Karzinom (HCC)
MASLD beinhaltet ein weites Spektrum an Schweregraden (Abb. 2). Eine Insulinresistenz von Fett- und Lebergewebe, welche v.a. bei Typ 2 Diabetes mellitus (T2DM) und metabolischem Syndrom vorliegt, bedingt eine gestörte Homöostase des Glukose- und Fettsäurestoffwechsels. Hierdurch werden in Hepatozyten vermehrt Triglyceride synthetisiert und eingelagert. Durch mitochondriale Dysfunktion entstehen toxische reaktive Sauerstoffradikale (ROS). Die resultierende Entzündung, sog. Steatohepatitis, wird durch Aktivierung von hepatischen Makrophagen (Kupfferzellen) und systemischen Entzündungsmediatoren vermittelt. Im Zusammenhang mit MASLD spricht man hier von einer metabolischen Dysfunktion-assoziierten Steatohepatitis (MASH).
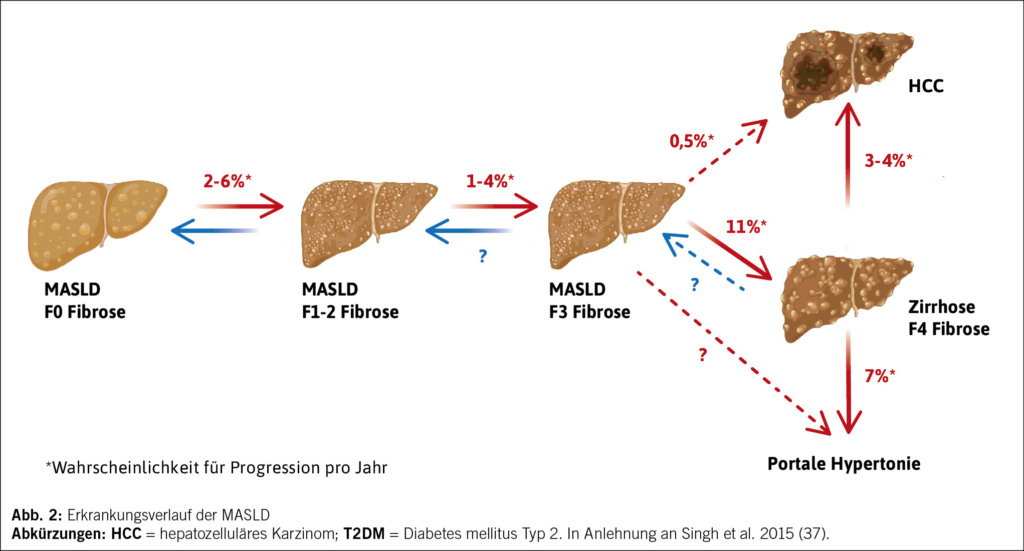
Es kommt zum Untergang von Lebergewebe und einer Dysregulation verschiedener Zellpopulationen. Endotheliale Zellen der Lebersinusoide verändern ihre Konfiguration (z.B. Verlust von Fenestrae, Kontraktion), was den hepatischen Blutfluss und Gewebefunktionen (z.B. Entgiftung und Verstoffwechselung) beeinträchtigt. Hepatische Sternzellen werden zu Myofibroblasten aktiviert. Dies führt zu einer gesteigerten Produktion von extrazellulärer Matrix mit zunehmender Fibrose. Einen kritischen Punkt stellt die Entwicklung einer signifikanten Fibrose (≥F3) dar, da dies mit erhöhter Mortalität assoziiert ist.
Mechanische und hämodynamische Veränderungen führen zu portaler Hypertonie, die das Risiko für hepatische Dekompensation mit Ikterus, Aszites, Ösophagusvarizenblutung oder hepatischer Enzephalopathie erhöht und mit einer schlechten Prognose einhergeht. Bei Vorliegen einer fortgeschrittenen Leberfibrose (F3-Fibrose) und Leberzirrhose (F4-Fibrose) besteht zudem ein hohes Risiko für ein hepatozelluläres Karzinom (HCC). Im Gegensatz zu anderen Lebererkrankungen wie viralen Hepatitiden oder ALD, bei denen ein HCC meist erst in späteren Stadien auftritt, kann bei MASLD bereits in früheren Fibrosestadien ein HCC entstehen (vgl. Abb. 2) (5, 6). Das Risiko für ein HCC steigt jedoch mit zunehmender Fibrose und insbesondere bei Vorliegen einer Zirrhose signifikant an.
Fortgeschrittene Fibrose und Zirrhose bei MASLD sind reversibel
Fibrose ist als dynamischer Prozess zu verstehen, der auch in fortgeschrittenen Stadien zumindest teilweise reversibel ist. Voraussetzung für eine Regression der Fibrose ist die Abwesenheit leberschädigender Faktoren. Im Kontext von MASLD sind dies insbesondere kmRF, jedoch auch zusätzliche Stressoren wie Alkohol. Kürzlich wurde nachgewiesen, dass eine Regression der Zirrhose mit einer Verbesserung der Prognose bei MASLD assoziiert ist (7). Somit stellt Fibroseregression ein wichtiges therapeutisches Ziel bei MASLD dar.
MASLD ist eine Herausforderung für die kommenden Jahrzehnte
In der Schweiz waren 2020 etwa zwei Mio. Personen (rund 23 % der Bevölkerung) von MASLD betroffen (8). Insgesamt variiert die Prävalenz in Europa zwischen 20 % und 30 % (Stand 2019) (9). Nur ein geringer Anteil dieser Personen entwickelt eine schwere Lebererkrankung. Aufgrund der grossen Anzahl Betroffener ist dennoch die absolute Zahl derer, die eine Leberzirrhose oder ein HCC bei MASLD entwickeln, sehr hoch und steigend. Durch Fortschritte, vor allem bei der Behandlung der Hepatitis C (10), wird MASLD zukünftig eine zentrale Bedeutung unter den Lebererkrankungen haben. Aufgrund der hohen MASLD-Prävalenz sind zudem viele transplantierte Lebern von Steatose betroffen (11).
Evidenz-basierte Tests und Algorithmen sollten zur Diagnose und Risikostratifizierung eingesetzt werden
Evidenz-basierte Ansätze zur Diagnostik und Risikostratifizierung sind aufgrund der hohen Anzahl Betroffener unabdingbar. Im klinischen Alltag dient häufig der abdominelle Ultraschall zur Diagnose einer Steatose. Der hepato-renale Index vergleicht die Echogenität von Nierenparenchym und Leber. Eine relativ «hellere» Leber und abgeschwächte Gefässzeichnung weisen auf relevante Steatose hin. Weiterhin ist der controlled attenuation parameter (CAP; FibroScan®) ein verbreitetes, günstiges Verfahren zur Diagnose der MASLD (Grenzwert ≥275 dB/m). Magnetresonanz-basierte Methoden (v.a. MRI-PDFF) sind genauer, aber aufwendiger und werden daher in dieser Indikation selten klinisch eingesetzt. CAP und MRI-PDFF erlauben eine quantitative Bestimmung der Steatose. Ein direkter prognostischer Wert der Steatosequantifizierung konnte bisher nicht belegt werden. Da man jedoch annimmt, dass eine Reduktion der Steatose zur einer Reduktion von entzündlicher Aktivität führt, kann CAP in der klinischen Praxis eingesetzt werden, um eine Tendenz des Verlaufs abzuschätzen. In klinischen Studien dient die eine Reduktion der Steatose, gemessen mittels MRI-PDFF, als akzeptierter Endpunkt.
Erhöhte Transaminasen können eine klinische Einschätzung bezüglich Vorliegen einer Steatohepatitis erlauben, eine Biopsie ist jedoch für die Diagnose nötig. Unbedingt zu beachten ist, dass Transaminasen für die Einschätzung des Fibrosegrades ungeeignet sind. Normwertige Transaminasen schliessen eine Zirrhose nicht aus. Stattdessen sollten einfache Tests wie der Fibrosis-4-Score (FIB-4; Link) und der NAFLD-Fibrosis-Score (NFS; Link) angewandt werden. Diese bieten sich als wertvolle Screening-Tools besonders in der allgemeinmedizinischen Praxis an, sind leicht anwendbar und kosteneffizient.
Gemäss aktuellen EASL sowie deutschen Leitlinien sollte bei Personen mit erhöhten Werten (z.B. FIB-4 ≥1,30) eine erweiterte Diagnostik mittels Elastographie (z.B. FibroScan®) durchgeführt werden (12, 13). Bei der klinischen Einschätzung sollten neben nicht invasiven Tests Faktoren, die eine schwerwiegende MASLD begünstigen, wie kmRF, postmenopausaler Hormonstatus (14), Alkoholkonsum und das Vorliegen anderer Lebererkrankungen (z.B. virale Hepatitis B) einbezogen werden.
Gewichtsreduktion ist eine effektive Therapie und kann Fibrose verbessern
Therapie der ersten Wahl sind Lebensstiländerungen mit Gewichtsreduktion, Ernährungsumstellung und Alkoholabstinenz (14). Hausärzte spielen dabei eine enorm wichtige Rolle in der Motivation und Unterstützung der Patienten. Eine Gewichtsreduktion ≥10 % durch 12-monatige Diät und erhöhte körperliche Aktivität führen zu einer Fibroseregression (16). Empfohlen wird daher eine schrittweise Gewichtsreduktion von 5–10 % bei Übergewicht und 3–5 % bei Normalgewicht unter Vermeidung von Sarkopenie (Muskelschwund). Sarkopenie ist mit einer schlechteren Prognose bei Lebererkrankungen assoziiert.
Hinsichtlich Ernährung ist eine mediterrane Kost mit pflanzlichen Proteinen, weissem Fleisch, ballaststoffreichen Nahrungsmitteln und Nüssen zu bevorzugen (17, 18). Rotes Fleisch und gesättigte Fettsäuren sollten reduziert werden. Die WHO empfiehlt zudem eine Zuckeraufnahme von <50 g/Tag.
Der häufig verwendete Tafelzucker ist ein Disaccharid, das aus Glukose und Fruktose besteht. Insbesondere eine erhöhte Zufuhr von Fruktose (isoliert oder als Bestandteil des Disaccharids Kristallzucker) führt im Vergleich zu Glukose zu einer ungünstigen intrahepatischen Stoffwechsellage mit vermehrter Steatose. Daher sind mit Zucker oder Fruktose gesüsste Getränke zu meiden. Zudem ist komplette Alkoholabstinenz bei MASLD essenziell, da bereits geringe Mengen das Risiko für schwere Lebererkrankungen erhöhen. Kaffeekonsum hingegen hat einen positiven Einfluss auf die Erkrankung.
In der Schweiz ist bariatrische/metabolische Chirurgie (BMC) nicht für MASLD, aber für metabolische Komorbiditäten zugelassen (19). Insgesamt stellt BMC eine wirksame Therapie bei sorgfältig ausgewählten Patienten dar. 84 % der adipösen Patienten wiesen 5 Jahre nach BMC keine entzündliche Aktivität mehr auf, und die Fibrose verbesserte sich bei 70 % (20). Jedoch kann es auch bei Patienten mit präoperativ normaler Leberfunktion bei unerkannter portaler Hypertension postoperativ zu einer Verschlechterung der Leberfunktion und zu Komplikationen kommen, sodass hier eine sorgfältige Evaluation nötig ist (21). Weitere mögliche Risiken sind rascher Gewichtsverlust mit Malnutrition und Sarkopenie sowie ein erhöhter Alkoholkonsum (sog. addiction shift) (22).
Aktuell sind in Europa und der Schweiz keine spezifischen Therapien zugelassen
In der Schweiz und im deutschsprachigen Raum ist bisher kein Medikament zur Behandlung der MASLD zugelassen. Die konsequente Behandlung von kmRF ist essenziell, da sich dies positiv auf MASLD auswirken kann und eine erhöhte Mortalität in frühen Erkrankungsstadien insbesondere durch kardiovaskuläre Ereignisse bedingt ist.
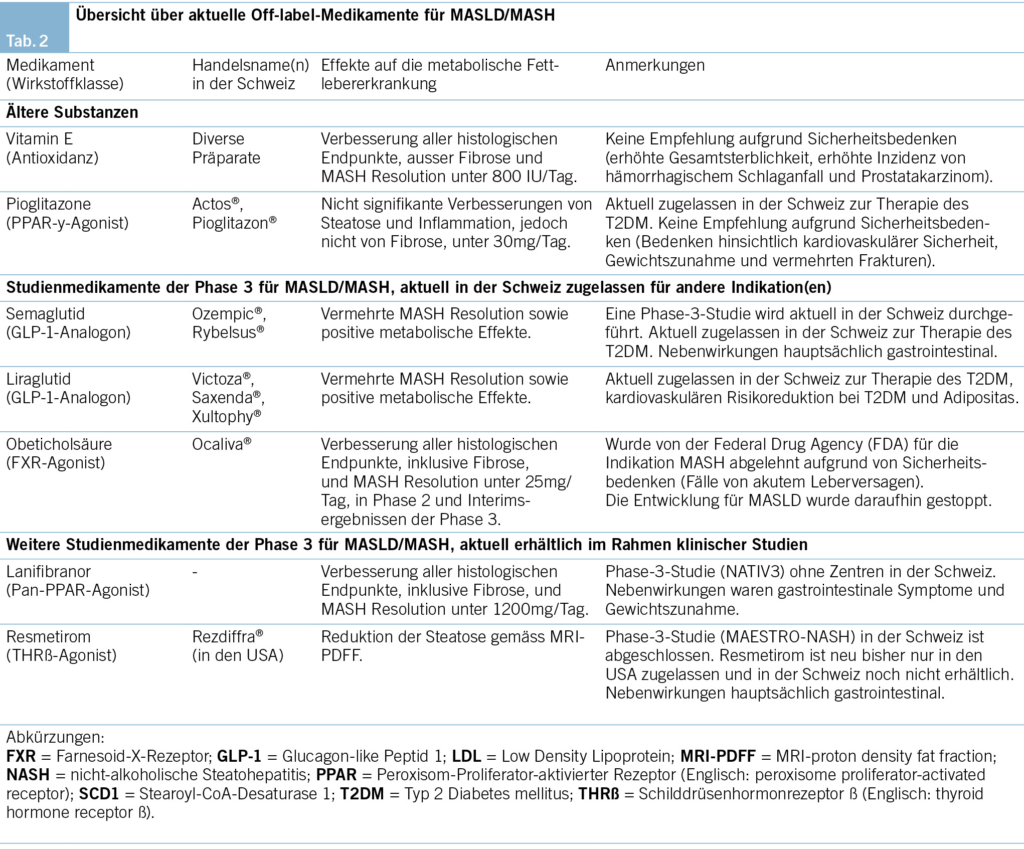
Die GLP-1-Analoga Semaglutid und Liraglutid, die in der Schweiz für T2DM bzw. Adipositas zugelassen sind, haben in Studien positive Ergebnisse bei MASH gezeigt. Eine Studie mit Semaglutid zeigte im Vergleich zu Placebo eine häufigere Remission der Entzündung und 13 % Gewichtsverlust in der Hochdosisgruppe (23). Die LEAN-Studie zeigte eine vermehrte Steatohepatitis-Resolution und geringere Fibroseverschlechterung unter Liraglutid (24). Retrospektive Daten weisen bei Patienten mit T2DM und Zirrhose auf eine geringere Rate hepatischer Dekompensation unter GLP-1-Analoga hin (25).
Vitamin E und Pioglitazon, die in den EASL-NAFLD-Leitlinien 2016 erwähnt werden (26), sind gemäss deutscher Leitlinie nicht empfohlen (11). Die PIVENS-Studie (27) zeigte eine Verbesserung der Steatohepatitis unter Vitamin E. Andere Studien brachten jedoch hohe Dosen von Vitamin E mit einem erhöhten Risiko für Mortalität, Schlaganfall und Prostatakrebs in Verbindung. Pioglitazon führte in Studien bei Personen mit MASH (mit und ohne T2DM) zu einer Verbesserung der entzündlichen Aktivität und Steatose sowie Resolution der Steatohepatitis. Es besteht jedoch ein erhöhtes Risiko für Gewichtszunahme, Verschlechterung einer Herzinsuffizienz sowie Frakturen (28).
Resmetirom, selektiver Agonist des Schilddrüsenhormon- rezeptors-β (THR-β), erreichte in einer Phase-2- und -3-Studie eine Reduktion der Steatohepatitis sowie Leberfibrose (29–32). Seit Kurzem ist Resmetirom für die Behandlung der MASH in den USA zugelassen. In der Schweiz ist das Präparat aktuell nicht verfügbar, und es ist unklar, ob eine Zulassung auf dem europäischen bzw. dem Schweizer Markt erfolgen wird (Tab. 2).
Fibroseregression in klinischen Studien
Regression der Fibrose ist aufgrund der oben genannten prognostischen Bedeutung ein wichtiges therapeutisches Ziel in der Behandlung der MASLD. Obeticholsäure (OCA), ein FXR-Agonist und Gallensäureanalogon, zeigte in Studien eine positive Wirkung hinsichtlich Fibroseregression (33). Allerdings wurde OCA kürzlich von der FDA für die MASLD-Therapie abgelehnt aufgrund von Sicherheitsbedenken, im Zusammenhang mit Fällen von akutem Leberversagen. Der Pan-PPAR-Agonist Lanifibranor, der derzeit nur in Studien erhältlich ist, wirkt auf alle drei Isoformen des nuklearen PPA-Rezeptors. In der Phase-2-NATIVE-Studie verbesserte Lanifibranor die Fibrose bei etwa der Hälfte der Patienten in der Hochdosisgruppe (1200 mg/Tag) im Vergleich zu 30 % in der Placebogruppe, mit weiteren Verbesserungen bei anderen histologischen Indikatoren, einschliesslich Resolution der Steatohepatitis (34). Weitere Medikamente, für welche bisher ein Effekt auf Fibrose nachgewiesen werden konnte, sind die FGF21-Analoga Pegozafermin und Efruxifermin. In der Phase-2-ENLIVEN-Studie zeigte sich unter Pegozafermin (44 mg QW) eine Reduktion der Fibrose bei 26 % der Teilnehmenden gegenüber 2 % unter Placebo (35). Efruxifermin führte zu einer Fibrosereduktion in 39 % der Teilnehmer gegenüber 20 % unter Placebo (36).
Abkürzungen:
FXR = Farnesoid-X-Rezeptor; GLP-1 = Glucagon-like Peptid 1; LDL = Low Density Lipoprotein; MRI-PDFF = MRI-proton density fat fraction; NASH = nicht-alkoholische Steatohepatitis; PPAR = Peroxisom-Proliferator-aktivierter Rezeptor (Englisch: peroxisome proliferator-activated receptor); SCD1 = Stearoyl-CoA-Desaturase 1; T2DM = Typ 2 Diabetes mellitus; THRß = Schilddrüsenhormonrezeptor ß (Englisch: thyroid hormone receptor ß).
Inselspital, Universitätsspital Bern
Universitätsklinik für Viszerale Chirurgie und Medizin, UVCM
Hepatologie
Freiburgstrasse
3010 Bern
vana_miroslav@hotmail.com
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
• NAFLD wird zu MASLD, definiert durch Lebersteatose (≥ 5 %) und mindestens einen kardiometabolischen Risikofaktor. NASH wird zu MASH.
• Risikopatienten mit metabolischen Störungen regelmässig mittels validierter Scores (z.B. FIB-4, NFS) auf Fibrose screenen.
• 5–10 % Gewichtsreduktion (3–5 % bei Normgewicht) durch Diät und Sport verbessert Inflammation und Fibrose. Mediterrane Diät mit Alkoholkarenz und Zucker <50 g/Tag (einschliesslich Getränke!).
• Bisher sind in der Schweiz und Europa keine Medikamente für die MASLD-Therapie zugelassen. GLP1-Analoga sollten bei bestehender Indikation (Diabetes, Adipositas) eingesetzt werden, da sie die MASLD verbessern.
• Medikamente, die Fibrose verbessern, sind bisher in der Schweiz und Europa nur in Studien erhältlich. In den USA wurde kürzlich Resmetirom zugelassen für die Therapie der MASH.
1. Rinella ME, Lazarus JV, Ratziu V, Francque SM, u. a. A multi-society Delphi consensus statement on new fatty liver disease nomenclature. Hepatol Baltim Md. 24. Juni 2023;
2. Berg, T., Messer, E. Änderungen zur Nomenklatur für Fettlebererkrankungen. Gastro-News 10, 24–27 (2023). https://doi.org/10.1007/s15036-023-3307-y
3. Song SJ, Lai JCT, Wong GLH, Wong VWS, u. a. Can we use old NAFLD data under the new MASLD definition? J Hepatol. 2. August 2023;S0168-8278(23)05000-6.
4. Israelsen M, Torp N, Johansen S, Thiele M, u. a. MetALD: new opportunities to understand the role of alcohol in steatotic liver disease. Lancet Gastroenterol Hepatol. Oktober 2023;8(10):866–8.
5. Parola M, Pinzani M. Liver fibrosis: Pathophysiology, pathogenetic targets and clinical issues. Mol Aspects Med. 1. Februar 2019;65:37–55.
6. Makri E, Goulas A, Polyzos SA. Epidemiology, Pathogenesis, Diagnosis and Emerging Treatment of Nonalcoholic Fatty Liver Disease. Arch Med Res. 1. Januar 2021;52(1):25–37.
7. Sanyal AJ, Anstee QM, Trauner M, Lawitz EJ, u. a. Cirrhosis regression is associated with improved clinical outcomes in patients with nonalcoholic steatohepatitis. Hepatol Baltim Md. 18. Oktober 2021;
8. Goossens N, Bellentani S, Cerny A, Dufour JF, u. a. Nonalcoholic fatty liver disease burden – Switzerland 2018–2030. Swiss Med Wkly (Internet). 17. Dezember 2019;(51). Verfügbar unter: https://smw.ch/article/doi/smw.2019.20152
9. Younossi Z, Tacke F, Arrese M, Chander Sharma B, u. a. Global Perspectives on Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis. Hepatology. 2019;69(6):2672–82.
10. Heim M. Hepatitis C ist heilbar: eine Erfolgsgeschichte der biomedizinischen Forschung. Swiss Med Forum. 30. März 2022;(2022/13-14):214–6.
11. Tien C, Remulla D, Kwon Y, Emamaullee J. Contemporary strategies to assess and manage liver donor steatosis: a review. Curr Opin Organ Transplant. 1. Oktober 2021;26(5):474–81.
12. Roeb E, Canbay A, Bantel H, Bojunga J, u. a. Aktualisierte S2k-Leitlinie nicht-alkoholische Fettlebererkrankung der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) – April 2022 – AWMF-Registernummer: 021–025. Z Für Gastroenterol. September 2022;60(09):1346–421.
13. Berzigotti A, Tsochatzis E, Boursier J, Castera L, u. a. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis – 2021 update. J Hepatol. 1. September 2021;75(3):659–89.
14. Balakrishnan M, Patel P, Dunn-Valadez S, Dao C, u. a. Women Have a Lower Risk of Nonalcoholic Fatty Liver Disease but a Higher Risk of Progression vs Men: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 1. Januar 2021;19(1):61-71.e15.
15. Francque SM, Marchesini G, Kautz A, Walmsley M, u. a. Non-alcoholic fatty liver disease: A patient guideline. JHEP Rep Innov Hepatol. Oktober 2021;3(5):100322.
16. Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, Torres-Gonzalez A, u. a. Weight Loss Through Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis. Gastroenterology. 1. August 2015;149(2):367-378.e5.
17. Vuille-Lessard É, Lange N, Riebensahm C, Dufour JF, u. a. Dietary Interventions in Liver Diseases: Focus on MAFLD and Cirrhosis. Curr Hepatol Rep (Internet). 19. April 2021; Verfügbar unter: https://doi.org/10.1007/s11901-021-00563-z
18. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on nutrition in chronic liver disease. J Hepatol. Januar 2019;70(1):172–93.
19. SMOB, Swiss Society for the Study of Morbid Obesity and Metabolic Disorders. Richtlinien zur operativen Behandlung von Übergewicht (Internet). 2021. Verfügbar unter: https://www.smob.ch/de/component/jdownloads/?task=download.send&id=116&catid=2&m=0&Itemid=101
20. Lassailly G, Caiazzo R, Ntandja-Wandji LC, Gnemmi V, u. a. Bariatric Surgery Provides Long-term Resolution of Nonalcoholic Steatohepatitis and Regression of Fibrosis. Gastroenterology. Oktober 2020;159(4):1290-1301.e5.
21. Reverter E, Cirera I, Albillos A, Debernardi-Venon W, u. a. The prognostic role of hepatic venous pressure gradient in cirrhotic patients undergoing elective extrahepatic surgery. J Hepatol (Internet). 19. Juli 2019; Verfügbar unter: http://www.sciencedirect.com/science/article/pii/S0168827819304155
22. Mendoza YP, Becchetti C, Watt KD, Berzigotti A. Risks and Rewards of Bariatric Surgery in Advanced Chronic Liver Diseases. Semin Liver Dis (Internet). 9. Juli 2021; Verfügbar unter: http://www.thieme-connect.de/DOI/DOI?10.1055/s-0041-1731705
23. Newsome PN, Buchholtz K, Cusi K, Linder M, u. a. A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis. N Engl J Med. 25. März 2021;384(12):1113–24.
24. Armstrong MJ, Gaunt P, Aithal GP, Barton D, u. a. Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. The Lancet. 13. Februar 2016;387(10019):679–90.
25. Simon TG, Patorno E, Schneeweiss S. Glucose-Like Peptide-1 Receptor Agonists and Hepatic Decompensation Events in Patients With Cirrhosis and Diabetes. Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc. 10. Juli 2021;S1542-3565(21)00724-2.
26. EASL–EASD–EASO. EASL–EASD–EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 1. Juni 2016;64(6):1388–402.
27. Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, u. a. Pioglitazone, Vitamin E, or Placebo for Nonalcoholic Steatohepatitis. N Engl J Med. 6. Mai 2010;362(18):1675–85.
28. Lange NF, Graf V, Caussy C, Dufour JF. PPAR-Targeted Therapies in the Treatment of Non-Alcoholic Fatty Liver Disease in Diabetic Patients. Int J Mol Sci. 13. April 2022;23(8).
29. Harrison SA, Bashir MR, Guy CD, Zhou R, u. a. Resmetirom (MGL-3196) for the treatment of non-alcoholic steatohepatitis: a multicentre, randomised, double-blind, placebo-controlled, phase 2 trial. The Lancet. 30. November 2019;394(10213):2012–24.
30. Harrison SA, Bashir M, Moussa SE, McCarty K, u. a. Effects of Resmetirom on Noninvasive Endpoints in a 36-Week Phase 2 Active Treatment Extension Study in Patients With NASH. Hepatol Commun. 2021;5(4):573–88.
31. Harrison SA, Taub R, Neff GW, Lucas KJ, u. a. Resmetirom for nonalcoholic fatty liver disease: a randomized, double-blind, placebo-controlled phase 3 trial. Nat Med. 16. Oktober 2023;
32. Harrison SA, et al A Phase 3, Randomized, Controlled Trial of Resmetirom in NASH with Liver Fibrosis. N Engl J Med. 2024 Feb 8
33. Neuschwander-Tetri BA, Loomba R, Sanyal AJ, Lavine JE, u. a. Farnesoid X nuclear receptor ligand obeticholic acid for non-cirrhotic, non-alcoholic steatohepatitis (FLINT): a multicentre, randomised, placebo-controlled trial. The Lancet. 14. März 2015;385(9972):956–65.
34. Francque S, Szabo G, Abdelmalek MF, Byrne CD, u. a. Nonalcoholic steatohepatitis: the role of peroxisome proliferator-activated receptors. Nat Rev Gastroenterol Hepatol. Januar 2021;18(1):24–39.
35. Loomba R, Sanyal AJ, Kowdley KV, Bhatt DL, u. a. Randomized, Controlled Trial of the FGF21 Analogue Pegozafermin in NASH. N Engl J Med. 14. September 2023;389(11):998–1008.
36. Harrison SA, Frias JP, Neff G, Abrams GA, u. a. Safety and efficacy of once-weekly efruxifermin versus placebo in non-alcoholic steatohepatitis (HARMONY): a multicentre, randomised, double-blind, placebo-controlled, phase 2b trial. Lancet Gastroenterol Hepatol. Dezember 2023;8(12):1080–93.
37. Singh S, Allen AM, Wang Z, Prokop LJ, u. a. Fibrosis Progression in Nonalcoholic Fatty Liver vs Nonalcoholic Steatohepatitis: A Systematic Review and Meta-analysis of Paired-Biopsy Studies. Clin Gastroenterol Hepatol. April 2015;13(4):643-654.e9.
PRAXIS
- Vol. 114
- Ausgabe 1
- Januar 2025





