- REM-Schlaf-Verhaltensstörung – mehr als eine einfache Parasomnie
Einführung
Der Traumschlaf oder Rapid-Eye-Movement-Schlaf (REM-Schlaf), benannt nach schnellen horizontalen Augenbewegungen, ist ein wesentlicher Bestandteil des Nachtschlafes. Die durchschnittliche Schlafdauer bei Erwachsenen liegt bei 7,5 bis 8 Stunden und gliedert sich in 90-minütige Schlafzyklen. Der Tiefschlaf dominiert die erste Hälfte des Nachtschlafes und ist entscheidend für Regeneration und Regulation von Körperfunktionen, während der REM-Schlaf die zweite Hälfte dominiert und für Gedächtniskonsolidierung und emotionale Regulation wichtig ist (1–4).
Verhaltensauffälligkeiten in diesen Schlafstadien werden als Parasomnien bezeichnet. Im Tiefschlaf können Schlafwandeln sowie Nachtschreck auftreten, als NREM-Parasomnien bezeichnet, im REM-Schlaf kann es zur REM-Schlaf-Verhaltensstörung (RBD) mit dem Ausagieren von Träumen kommen. Normalerweise schützt die Muskelhypotonie im REM-Schlaf vor unwillkürlichen Bewegungen, diese wird durch ein noradrenerges und serotonerges System im Gehirn reguliert. Bei RBD ist diese Regulation gestört, was oft mit neurodegenerativen Erkrankungen wie Parkinson zusammenhängt, aber auch ein symptomatisches Auslösen durch Antidepressiva mit serotonergem oder noradrenergem Wirkmechanismus (u.a. SSRI, SNRI) erklären kann.
Äthiopathogenese und Formen der RBD
Die REM-Schlaf-Verhaltensstörung (RBD) wurde 1986 erstmalig von Carlos Schenck und Mark Mahowald beschrieben:
Deren vier über 50-jährige Patienten erlebten lebhafte, emotionale Träume und führten diese im Schlaf aus, was zu Verletzungen führte. Ihre Träume beinhalteten aggressive Szenarien und waren gut erinnerlich. Diese Erstbeschreibung ist typisch und weiterhin gültig (5).
Bei einer isolierten RBD (iRBD) tritt die Störung ohne erkennbare zentrale Nervensystemerkrankung auf. Heute weiss man, dass es sich um ein frühes Stadium einer Alpha-Synukleinopathie handelt, also einer Gruppe neurodegenerativer Erkrankungen, zu denen die Parkinson-Krankheit (PD), die Demenz mit Lewy-Körpern (DLB) und die Multisystematrophie (MSA) gehören (6).
Die sekundäre RBD kann als Symptom einer schon manifesten Alpha-Synukleinopathie oder anderen neurologischen Erkrankungen auftreten. Beispiele hierfür sind Autoimmunerkrankungen des zentralen Nervensystems (ZNS) wie die Narkolepsie (7), die Multiple Sklerose (8) oder auch das seltene Anti-IgLON5-Syndrom (9). Auch läsionelle Affektionen des zentralen Nervensystems, wie sie im Rahmen eines Schlaganfalls, einer Hirnblutung oder infektiösen Erkrankung auftreten, kommen als Ursache infrage (10, 11).
Die symptomatische Form der RBD kann im Rahmen von Alkoholintoxikation oder -entzug sowie unter Barbituraten und Benzodiazepinen auftreten. Ein Auslösen durch Antidepressiva mit serotonerger oder noradrenerger Wirkung ist ebenfalls häufig. Unklar ist, ob die antidepressive Medikation die Entwicklung einer beginnenden, noch subklinischen, isolierten REM-Schlaf-Verhaltensstörung beschleunigen oder diese sogar auslösen kann (12).
Eine Unterkategorie der symptomatischen Form stellt die Pseudo-RBD im Rahmen einer obstruktiven Schlafapnoe (OSA) dar. Ursächlich konnte ein Zusammenhang mit Entsättigungen und den resultierenden Arousal-Reaktionen gezeigt werden. Diese führen im REM-Schlaf durch dessen Diskontinuität durch Arousal und damit gestörter Muskelhypotonie zum Ausagieren der Träume (13, 14).
Viele Patient/-innen weisen eine gemischte Ätiologie, d.h. mehrere Ursachen der RBD auf. Auch nach Korrektur der RBD-provozierenden Faktoren (OSA, Medikamente etc.) zeigen sie weiterhin eine RBD-Symptomatik, sodass mindestens anteilig eine neurodegenerative Ursache der Symptomatik angenommen werden muss.
Die isolierte RBD (iRBD)
Epidemiologie der iRBD
Die Prävalenz der iRBD liegt bei 0.4–0.5 % der erwachsenen Bevölkerung und steigt auf 1–2 % bei den über 60-Jährigen an (15, 16). 80 % der Betroffenen sind Männer, was durch die mildere und somit seltener diagnostizierte Symptomatik bei Frauen erklärt werden kann (17, 18). Bei sekundären Formen der RBD, z. B. bei manifesten Alpha-Synukleinopathien, ist die Geschlechterverteilung ähnlich.
Klinische Manifestation der iRBD
Das Ausagieren von Trauminhalten ist das Leitsymptom der iRBD. Typische Träume beinhalten Angriffssituationen, in denen der Patient oder die Patientin sich selbst oder andere verteidigt, oft gegen unbekannte Menschen oder Tiere wie Hunde, Schlangen oder Löwen. Sportliche Aktivitäten wie Fussball oder Boxen können ebenfalls geträumt und ausgelebt werden (17). Diese Bewegungen können zu Verletzungen führen, beispielsweise durch Kollisionen mit Möbeln oder durch Greifen nach dem Bettpartner im Traum.
Verletzungen sind oft der Anlass für eine ärztliche Konsultation. Begleitend zur iRBD können Symptome wie reduzierte Geruchswahrnehmung und Konstipationsneigung auftreten. Subtile extrapyramidale Symptome wie eine Hypomimie oder reduzierte Geschwindigkeit alternierender Bewegungen können früh manifest werden und durch gezielte Untersuchung (TAP-Test) identifiziert werden. Zusätzlich können bereits früh neuropsychiatrische Auffälligkeiten wie Apathie, Ängstlichkeit oder depressive Symptome bestehen (19).
Äthiopathogenese der iRBD
Grundlage des neurodegenerativen Prozesses der iRBD ist die Aggregatbildung von Alpha-Synuklein zu sogenannten Lewy bodies (Abb. 1), was zu Funktionsverlust und im Verlauf Untergang der betroffenen Nervenzellen führt (20). Der Auslöser und Grund der Aggregatbildung dieses ursprünglich funktionellen intrazellulären, vesikulären Transportproteins sind nicht bekannt (16).
Die im Rahmen der frühen Entwicklung zur Alpha-Synukleinopathie auftretende zeitgleiche Beteiligung des enterischen Nervensystems und des Riechhirns bis zu 10 Jahre vor der iRBD-Symptomatik führte zur Dual-Hit Hypothese (21):
Zum einen kommt es ausgehend vom Riechhirn im Verlauf zu einer Ausbreitung der Lewy bodies über die Temporallappen und Basalganglien und später auch auf den Neokortex; zum anderen kommt es aufsteigend vom enterischen, vegetativen Nervenplexus zu einer Beteiligung des Hirnstamms mit dem typischen Auftreten von RBD-Symptomen. Diese Ausbreitungsdynamik im zentralen Nervensystem wurde bereits 2003 von Braak et al. beschrieben und publiziert(22) (Abb. 1).
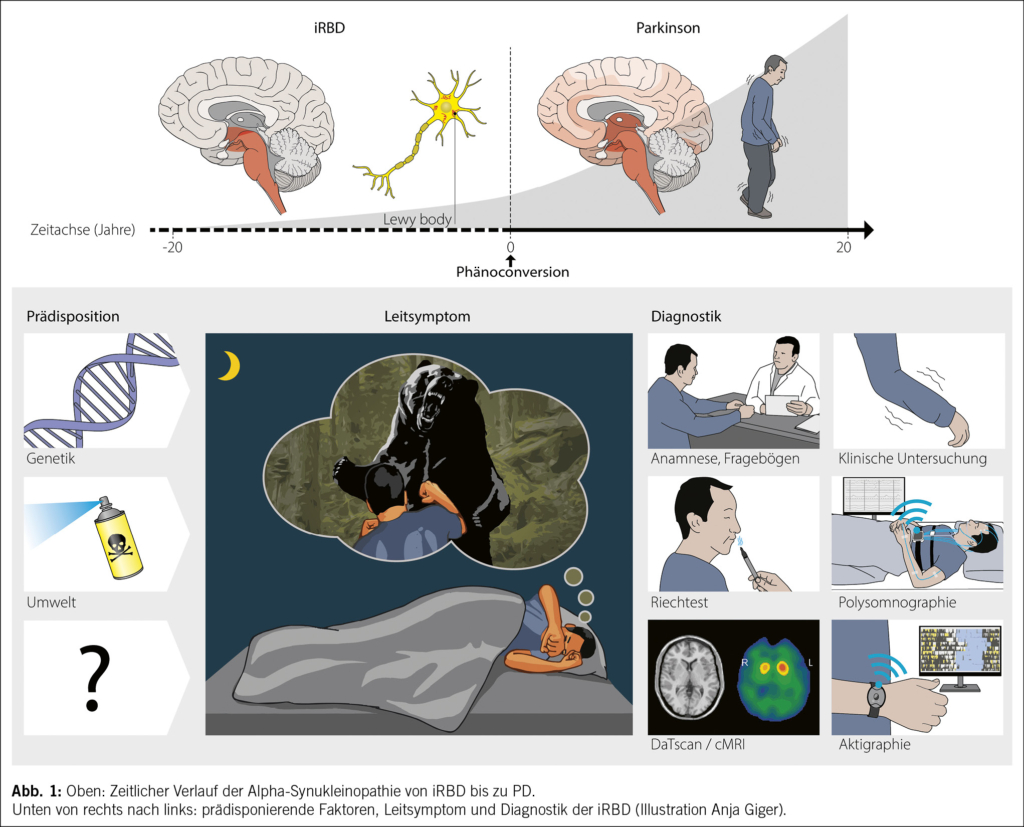
Verlauf der isolierten REM-Schlaf-Verhaltensstörung (iRBD)
Longitudinale Studien zeigen, dass Patient/-innen mit iRBD ein jährliches Risiko von 6.3 % haben, eine manifeste Alpha-Synukleinopathie (PD, DLB, MSA) zu entwickeln (19). Bei gleichzeitig eingeschränkter Riechleistung und subtilen motorischen Symptomen steigt dieses Risiko auf 15.5 % pro Jahr (6).
Eine internationale Analyse ergab eine Konversionsrate von 73.5 % nach 12 Jahren ab Diagnosestellung (19). Einige wenige Patient/-innen bleiben auch nach 20 Jahren im Stadium der iRBD mit nur leichten motorischen Symptomen, die nicht die Diagnosekriterien einer manifesten Alpha-Synukleinopathie erfüllen. Die Faktoren, die zu einem langsamen Krankheitsverlauf beitragen, sind noch unbekannt und Gegenstand aktueller Forschung (23).
Diagnostische Abklärung und Differenzialdiagnostik
Die Abklärung einer möglichen iRBD ist wichtig aufgrund des nächtlichen Verletzungsrisikos durch Ausagieren von Träumen und weil es sich um das Frühstadium einer neurodegenerativen Erkrankung handelt.
Die meisten Patient/-innen suchen ihren Arzt erstmalig nach eingetretener Eigen- oder Fremdverletzung auf. Zu diesem Zeitpunkt bestehen die Symptome in der Regel bereits einige Jahre. Validierte Fragebögen wie der REM Sleep Behavior Disorder Screening Questionnaire aus Marburg (RBDSQ [24]) oder die Einzelfrage des Innsbrucker RBD- Inventars (25): «Treten oder schlagen Sie im Schlaf um sich, weil Sie im Traum das Gefühl haben, Sie müssten sich verteidigen?» wie auch die Einzelfrage der internationalen RBD Study Group (26): «Hat man Ihnen jemals gesagt oder vermuten Sie selber, dass Sie Ihre Träume ausagieren, wenn Sie schlafen (z. B. Boxübungen ausführen, mit den Armen um sich schlagen, Laufbewegungen machen etc.)?» erlauben ein gutes Screening bei RBD-Verdacht.
Bei einem positiven Screening ist eine Zuweisung in ein neurologisch-schlafmedizinisches Zentrum empfohlen. Die fachspezifische Anamnese ist wichtig zur differenzialdiagnostischen und ätiologischen Einordnung der RBD-verdächtigen Symptome:
Das vorwiegende Auftreten der Symptome in der zweiten Nachthälfte deutet auf die Assoziation mit REM-Schlaf und damit RBD hin. Im Falle des Auftretens in der ersten Nachthälfte ist eine Assoziation mit Tiefschlaf im Sinne einer NREM-Parasomnie wahrscheinlicher. Stereotype Bewegungen während des Schlafes weisen auf eine schlafgebundene, hypermotorische Epilepsie (SHE) hin (27).
RBD-Symptome im zeitlichen Zusammenhang mit der Einnahme von Noxen oder Antidepressiva oder klinische Symptome einer Schlafapnoe weisen in Richtung einer symptomatischen Form der RBD (14, 28, 29).
Das Fehlen solcher Hinweise bei ansonsten typischen Symptomen spricht für eine iRBD. Die klinische Untersuchung spielt eine wichtige Rolle, um den klinischen Status quo zu bestimmen.
Klinisch besonders relevante Aspekte:
Extrapyramidale Symptome wie Tremor, Rigor und Hypokinese (Unified Parkinson’s Disease Rating Scale [UPDRS]) (30) können bereits in sehr leichter Ausprägung vorliegen.
Kognitive Defizite können klinisch und mithilfe des MoCA® (31), vegetative Prodromal-Symptomatik wie orthostatische Hypotonie und Konstipation sollten mittels Schellong-Test und klinisch-anamnestisch evaluiert werden.
Eine Hyposmie empfehlen wir mittels Riechtestung, z. B. mit Sniffin’ Sticks®, zu objektivieren.
Der apparative Goldstandard zur Schlafuntersuchung ist die Video-Polysomnographie (vPSG) mit dem Ziel, eine iRBD von einer häufigen OSA-induzierten, symptomatischen RBD abzugrenzen, aber auch, die Differenzialdiagnosen der Non-REM-Schlaf Parasomnien und der schlafgebundenen Epilepsie abzuklären.
Mittels der vPSG können das neurophysiologische Korrelat der iRBD: «REM-Schlaf ohne Muskelatonie» und komplexe Handlungen während des REM-Schlafes, obligate Diagnosekriterien der International Classification of Sleep Disorders 3 (Tab. 1, [32]) nachgewiesen werden. Bei Verdacht auf eine sekundäre Ursache der RBD mit der Frage nach vaskulären oder entzündlichen Veränderungen im Hirnstamm ist eine zerebrale MRT erforderlich.


Die nuklearmedizinische Dopamintransporter-Szintigraphie (DaTSCAN®) ist ein funktionelles bildgebendes Verfahren (33). Im Stadium der iRBD kann bereits eine signifikante Verminderung der Dopamintransporteraktivität im Bereich des Nucleus caudatus und des Putamen als Korrelat des neurodegenerativen Prozesses vorliegen (34). Bei deutlich pathologischen Befunden kann der Verdacht auf eine bevorstehende Phänokonversion zu einer manifesten Alpha-Synukleinopathie resultieren (34). In der Schweiz wird diese Untersuchung im Rahmen einer iRBD-Abklärung derzeit nicht von den Krankenkassen übernommen.
Die Durchführung einer 14-tägigen Aktigraphie kann sowohl bei der Erstuntersuchung als auch im Verlauf zusätzliche relevante Informationen über die Schlaf-Wach-Verteilung, die zirkadiane Amplitude und die Stabilität dieser Parameter von Tag zu Tag liefern. Bei regelmässiger Wiederholung können Veränderungen dieser Parameter im Langzeitverlauf Hinweise auf eine beginnende motorische Beeinträchtigung geben (35).
Klinische Verlaufskontrollen empfehlen wir einmal jährlich inklusive der Wiederholung des spezifischen extrapyramidal-motorischen Tests (UPDRS III [30]).
Ein DaTSCAN® oder ein FDG-PET, beides spezifische funktionelle bildgebende Verfahren, können ein Fortschreiten der Alpha-Synukleinopathie dokumentieren (36). Sie sind jedoch nicht Bestandteil der klinischen Routine. Zukünftig werden weitere Technologien in Form von tragbaren Beschleunigungsmessern, Druckmatten, Smartphones, Tablets und darin integrierte Algorithmen zur Bewegungs- und Schlafanalyse eingesetzt werden, um iRBD zu identifizieren, zu dokumentieren und im Langzeitverlauf zu beobachten (37).
Behandlung
Die Behandlung einer RBD ist wichtig, um Verletzungen zu vermeiden. Eine sichere Bettumgebung mit Kissen und Entfernung gefährlicher Gegenstände sind empfohlen. Im Fall einer symptomatischen RBD sollten auslösende Faktoren wie auslösende Medikamente abgesetzt werden und eine relevante Schlafapnoe behandelt werden. Sollte eine sekundäre, noch unbekannte Ursache vorliegen, muss diese entsprechend abgeklärt und behandelt werden.
Bei anhaltenden Symptomen, nach Korrektur aller potenziell symptomatischen Auslöser und in Abwesenheit einer sekundären Ursache muss von einer neurodegenerativen Ursache (iRBD) ausgegangen werden und eine medikamentöse Behandlung begonnen werden:
Zwei Präparate stehen zur symptomatischen Behandlung der iRBD zur Verfügung: Clonazepam und Melatonin. Beide reduzieren die Häufigkeit und Intensität der Symptome. Clonazepam (0.5–1 mg) wirkt sofort, kann aber Nebenwirkungen wie erhöhte nächtliche Sturzgefahr und Tagesschläfrigkeit haben (38). Melatonin wirkt nach 3–4 Wochen nach regelmässiger Einnahme 1 Stunde vor dem Zubettgehen und hat ein günstiges Nebenwirkungsprofil (39). Die Behandlung beginnt in der Regel mit 2 mg und kann bis 10 mg gesteigert werden.
Eine randomisierte Studie aus 2022 verglich Clonazepam mit Melatonin bei iRBD-Patient/-innen: Clonazepam zeigte bessere Symptomkontrolle, aber der Wirkungseintritt von Melatonin könnte aufgrund der Studiendauer von 4 Wochen nur unvollständig erfasst worden sein. Ein Therapieversuch mit Melatonin ist aufgrund des vorteilhaften Nebenwirkungsprofils gerechtfertigt und empfohlen.
Eine kausale Therapie zur Verlangsamung des neurodegenerativen Prozesses gibt es bisher nicht. In der Parkinson-Forschung (PASADENA-Studie) werden Immuntherapien untersucht, die sich derzeit in den Phasen 1 und 2 befinden (40, 41). Erste Wirksamkeitsuntersuchungen zeigen eine Reduktion des Alpha-Synukleins im Serum und Post-hoc- Analysen eine Verlangsamung der Zunahme der motorischen Symptome.
Ausblick
Der Einsatz neuer technischer Methoden zur Diagnostik und Langzeitbeobachtung der iRBD wird zunehmend wichtiger. Im Fokus der Forschung sind Technologien zur frühzeitigen Erkennung motorischer Symptome durch Messung der Bewegung und Aktivität wie Beschleunigungs- und Aktivitätsmessgeräte, die auch im Sport- und Freizeitbereich verwendet werden (Smart-Tracker [37, 42]). Smartphone-basierte Stimmanalysen können ebenfalls zukünftig zur Frühdetektion der für Parkinson typischen reduzierten Stimmmodulation beitragen (43). Diese neuen Technologien können helfen, ideale Biomarker zu identifizieren, die den Krankheitsverlauf und das Konversionsrisiko abbilden (6). Die Kenntnis dieser Biomarker kann in Zukunft gezielt beitragen, den Einsatz krankheitsmodulierender Therapien zu ermöglichen, die das Auftreten von Parkinson, Multisystematrophie oder Demenz mit Lewy-Körpern verzögern oder sogar verhindern können.
Abkürzungen
DaTScan® Dopamintransporter-Szintigraphie
DLB Demenz mit Lewy bodies
FDG-PET Fluoro-Desoxyglukose-Positronen-Emissions Tomographie
iRBD Isolated REM Sleep Behavior Disorder / Isolierte REM-Schlaf-Verhaltensstörung
MoCA® Montreal Cognitive Assessment / Montrealer kognitiver Bewertungstest
MSA Multisystematrophie
RBD REM Sleep Behavior Disorder / REM-Schlaf-Verhaltensstörung
REM Rapid-Eye-Movement schnelle Augenbewegung
SNRI Serotonin Noradrenaline Reuptake Inhibitors / Serotonin-Noradrenalin-Wiederaufnahme-Hemmer
SSRI Selective Serotonin Reuptake Inhibitors / Selektive Serotonin-Wiederaufnahme-Hemmer
UPDRS Unified Parkinson’s Disease Rating Scale
vPSG Video-Polysomnographie
Historie
Manuskript eingereicht: 10.09.2024
Angenommen nach Revision: 17.12.2024
Universitätsklinik für Neurologie
Schlaf-Wach-Epilepsie Zentrum
Inselspital
3010 Bern, Schweiz
carolin.schaefer@insel.ch
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
Die isolierte REM-Schlaf-Verhaltensstörung (iRBD) ist nicht nur eine Parasomnie, sondern auch ein frühes Stadium einer Alpha-Synukleinopathie, zu der die Parkinson-Erkrankung, Lewy-Body-Demenz und Multisystematrophie gehören. Lebhafte Träume und deren Ausagieren sind die Leitsymptome der iRBD.
Bei Verdacht auf RBD sollte eine neurologisch-schlafmedizinische Abklärung erfolgen. Die klinische Untersuchung umfasst die Suche nach Frühsymptomen einer Alpha-Synukleinopathie, einschließlich Riechverlust, orthostatischer Hypotonie und Obstipation.
Eine Video-Polysomnographie ist obligatorisch, um eine iRBD von der symptomatischen RBD durch eine Schlafapnoe auszuschliessen und die fehlende Muskelatonie und Bewegungen im Schlaf zu dokumentieren.
Die symptomatische Behandlung der iRBD erfolgt mit Clonazepam und Melatonin, um Verletzungsrisiken zu reduzieren.
Das Ziel der Forschung ist die Identifizierung von Biomarkern des Krankheitsverlaufs und der Konversion der iRBD zur Alpha-Synukleinopathie. Neue Technologien können helfen, den Krankheitsverlauf zu dokumentieren und Risikopatienten zu identifizieren.
Eine krankheitsmodulierende Therapie ist noch nicht verfügbar, eine solche kann zukünftig das Fortschreiten der Krankheit bremsen und die Lebensqualität der Patienten verbessern.
1. Fan M, Sun D, Zhou T, Heianza Y, Lv J, Li L, et al. Sleep patterns, genetic susceptibility, and incident cardiovascular disease: A prospective study of 385 292 UK biobank participants. Eur Heart J. 2020;41(11):1182–9.
2. Van Cauter E, Copinschi G. Interrelationships between growth hormone and sleep. Vol. 10, Growth Hormone and IGF Research. Churchill Livingstone; 2000. p. S57–62.
3. Van Cauter E, Spiegel K, Tasali E, Leproult R. Metabolic consequences of sleep and sleep loss. Sleep Med. 2008 Sep;9(SUPPL. 1).
4. Diekelmann S, Born J. The memory function of sleep. 2010;11. Available from: www.nature.com/reviews/neuro
5. Schenck CH, Bundlie SR, Ettinger MG, Mahowald MW. Chronic Behavioral Disorders of Human REM Sleep: A New Category of Parasomnia. Sleep. 1986;9(2):293–308.
6. Miglis MG, Adler CH, Antelmi E, Arnaldi D, Baldelli L, Boeve BF, et al. Biomarkers of conversion to a-synucleinopathy in isolated rapid-eye-movement sleep behaviour disorder. Lancet Neurol. 2021 Aug 1;20(8):671–84.
7. Mathis J, Hess CW, Bassetti C. Isolated mediotegmental lesion causing narcolepsy and rapid eye movement sleep behaviour disorder: A case evidencing a common pathway in narcolepsy and rapid eye movement sleep behaviour disorder. J Neurol Neurosurg Psychiatry. 2007;78(4):427–9.
8. Plazzi G, Montagna P. Remitting REM sleep behavior disorder as the initial sign of multiple sclerosis. Sleep Med. 2002;3(5):437–9.
9. Sabater L, Gaig C, Gelpi E, Bataller L, Lewerenz J, Torres-Vega E, et al. A novel non-rapid-eye movement and rapid-eye-movement parasomnia with sleep breathing disorder associated with antibodies to IgLON5: A case series, characterisation of the antigen, and post-mortem study. Lancet Neurol. 2014;13(6):575–86.
10. Iranzo A. The REM sleep circuit and how its impairment leads to REM sleep behavior disorder. Vol. 373, Cell and Tissue Research. Springer Verlag; 2018. p. 245–66.
11. Bassetti CL, Bargiotas P. REM Sleep Behavior Disorder: A Unique Window into Dreaming, the Violent Brain and Early Mechanisms of Neurodegeneration. Front Neurol Neurosci. 2017;41:104–16.
12. Postuma RB, Gagnon J-F, Tuineaig M, Bertrand J-A, Latreille V, Desjardins C, et al. Antidepressants and REM Sleep Behavior Disorder: Isolated Side Effect or Neurodegenerative Signal? Sleep. 2013 Nov 1;36(11):1579–85.
13. Iranzo A, Santamaria J. Severe obstructive sleep apnea/hypopnea mimicking REM sleep behavior disorder. Sleep. 2005 Feb 1;28(2):203–6.
14. Schaefer C, Kunz D, Bes F. Melatonin effects in REM sleep behavior disorder associated with Obstructive Sleep Apnea Syndrome: A case series. Curr Alzheimer Res. 2017;14(10).
15. Haba-Rubio J, Frauscher B, Marques-Vidal P, Toriel J, Tobback N, Andries D, et al. Prevalence and determinants of rapid eye movement sleep behavior disorder in the general population. Sleep. 2018 Feb 1;41(2).
16. Bobela W, Aebischer P, Schneider BL. Alpha-synuclein as a mediator in the interplay between aging and Parkinson’s disease. Vol. 5, Biomolecules. MDPI AG; 2015. p. 2675–700.
17. Fernández-Arcos A, Iranzo A, Serradell M, Gaig C, Santamaria J. The Clinical Phenotype of Idiopathic Rapid Eye Movement Sleep Behavior Disorder at Presentation: A Study in 203 Consecutive Patients. Sleep. 2016 Jan 1;39(1):121–32.
18. Poryazova R, Oberholzer M, Baumann CR, Bassetti CL. REM sleep behavior disorder in parkinson’s disease: A questionnaire-based survey. J Clin Sleep Med. 2013;9(1):55–9.
19. Postuma RB, Iranzo A, Hu M, Högl B, Boeve BF, Manni R, et al. Risk and predictors of dementia and parkinsonism in idiopathic REM sleep behaviour disorder: A multicentre study. Brain [Internet]. 2019 Mar 1 [cited 2020 May 29];142(3):744–59. Available from: https://pubmed.ncbi.nlm.nih.gov/30789229/
20. Boeve BF, Silber MH, Saper CB, Ferman TJ, Dickson DW, Parisi JE, et al. Pathophysiology of REM sleep behaviour disorder and relevance to neurodegenerative disease. Brain. 2007;130(11):2770–88.
21. Hawkes CH, Del Tredici K, Braak H. Parkinson’s disease: The dual hit theory revisited. Ann N Y Acad Sci. 2009;1170:615–22.
22. Braak H, Tredici K Del, Rüb U, De Vos RAI, Jansen Steur ENH, Braak E. Staging of brain pathology related to sporadic Parkinson’s disease. Vol. 24, Neurobiology of Aging. 2003.
23. Iranzo A, Stefani A, Serradell M, Martí MJ, Lomeña F, Mahlknecht P, et al. Characterization of patients with longstanding idiopathic REM sleep behavior disorder. Neurology [Internet]. 2017 Jul 18 [cited 2022 Sep 4];89(3):242–8. Available from: https://pubmed.ncbi.nlm.nih.gov/28615430/
24. Stiasny-Kolster K, Mayer G, Schäfer S, Möller JC, Heinzel-Gutenbrunner M, Oertel WH. The REM sleep behavior disorder screening questionnaire – A new diagnostic instrument. Mov Disord. 2007 Dec;22(16):2386–93.
25. Frauscher B, Ehrmann L, Zamarian L, Auer F, Mitterling T, Gabelia D, et al. Validation of the Innsbruck REM sleep behavior disorder inventory. Mov Disord [Internet]. 2012 Nov [cited 2022 Sep 12];27(13):1673–8. Available from: https://pubmed.ncbi.nlm.nih.gov/23192924/
26. Postuma RB, Arnulf I, Hogl B, Iranzo A, Miyamoto T, Dauvilliers Y, et al. A single-question screen for rapid eye movement sleep behavior disorder: A multicenter validation study. Mov Disord. 2012 Jun;27(7):913–6.
27. Loddo G, Baldassarri L, Bisulli F, Cirignotta F, Provini F, Licchetta L, et al. Seizures with paroxysmal arousals in sleep-related hypermotor epilepsy ( SHE ): Dissecting epilepsy from NREM parasomnias. 2020;(February):2194–202.
28. McCarter SJ, St. Louis EK, Sandness DJ, Arndt KA, Erickson MK, Tabatabai GM, et al. Antidepressants increase REM sleep muscle tone in patients with and without REM sleep behavior disorder. Sleep. 2015 Jun 1;38(6):907–17.
29. Iranzo A, Santamaria J. Severe obstructive sleep apnea/hypopnea mimicking REM sleep behavior disorder. Sleep [Internet]. 2005 Feb 1 [cited 2023 Jan 16];28(2):203–6. Available from: https://pubmed.ncbi.nlm.nih.gov/16171244/
30. Fahn S, Elton RL UPM. Unified Parkinson’s disease rating scale. In: Recent developments in Parkinson’s disease, Vol 2. 1987. p. 153–163, 293–304.
31. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc [Internet]. 2005 [cited 2023 Feb 9];53(4):695–9. Available from: https://pubmed.ncbi.nlm.nih.gov/15817019/
32. International Classification of Sleep Disorders-Third Edition (ICSD-3). In: ICSD-3. 3rd editio. American Academy of Sleep Medicine (AASM); 2014.
33. Antonini A, Benti R, De Notaris R, Tesei S, Zecchinelli A, Sacilotto G, et al. 123I-Ioflupane/SPECT binding to striatal dopamine transporter (DAT) uptake in patients with Parkinson’s disease, multiple system atrophy, and progressive supranuclear palsy. Neurol Sci. 2003 Oct;24(3):149–50.
34. Iranzo A, Valldeoriola F, Molinuevo JL, Serradell M, Santamaria J, Tolosa E, et al. Serial dopamine transporter imaging of nigrostriatal function in patients with idiopathic rapid-eye-movement sleep behaviour disorder: a prospective study. 2011; Available from: www.thelancet.com/
35. Feng H, Chen L, Liu Y, Chen X, Wang J, Yu MWM, et al. Rest-Activity Pattern Alterations in Idiopathic REM Sleep Behavior Disorder. Ann Neurol [Internet]. 2020 Oct 1 [cited 2021 Jan 21];88(4):817–29. Available from: https://pubmed.ncbi.nlm.nih.gov/32691442/
36. Bourgouin PA, Rahayel S, Gaubert M, Arnaldi D, Hu M, Heidbreder A, et al. Neuroimaging of Rapid Eye Movement Sleep Behavior Disorder. In: International Review of Neurobiology. Academic Press Inc.; 2019. p. 185–210.
37. Gnarra O, Wulf MA, Schäfer C, Nef T, Bassetti CLA. Rapid eye movement sleep behavior disorder: a narrative review from a technological perspective. Sleep. 2023;46(6):1–9.
38. McGrane IR, Leung JG, St. Louis EK, Boeve BF. Melatonin therapy for REM sleep behavior disorder: A critical review of evidence. Vol. 16, Sleep Medicine. Elsevier; 2015. p. 19–26.
39. Kunz D, Bes F. Melatonin as a Therapy in REM Sleep Behavior Disorder Patients: An Open-Labeled Pilot Study on the Possible Influence of Melatonin on REM-Sleep Regulation. 1999.
40. Pagano G, Taylor KI, Anzures Cabrera J, Simuni T, Marek K, Postuma RB, et al. Prasinezumab slows motor progression in rapidly progressing early-stage Parkinson’s disease. Nat Med. 2024;30(4):1096–103.
41. Pagano G, Boess FG, Taylor KI, Ricci B, Mollenhauer B, Poewe W, et al. A Phase II Study to Evaluate the Safety and Efficacy of Prasinezumab in Early Parkinson’s Disease (PASADENA): Rationale, Design, and Baseline Data. Front Neurol [Internet]. 2021 Oct 1 [cited 2022 May 5];12. Available from: https://pubmed.ncbi.nlm.nih.gov/34659081/
42. Del Din S, Elshehabi M, Galna B, Hobert MA, Warmerdam E, Suenkel U, et al. Gait analysis with wearables predicts conversion to parkinson disease. Ann Neurol. 2019;86(3):357–67.
43. Arora S, Baig F, Lo C, Barber TR, Lawton MA, Zhan A, et al. Smartphone motor testing to distinguish idiopathic REM sleep behavior disorder, controls, and PD. Neurology [Internet]. 2018 Oct 16 [cited 2022 Mar 15];91(16):e1528–38. Available from: https://n.neurology.org/content/91/16/e1528
PRAXIS
- Vol. 114
- Ausgabe 2
- Februar 2025