- Revaskularisierung der asymptomatischen Carotisstenose – sinnvoll oder obsolet?
Die Empfehlungen zur operativen im Vergleich zur konservativen Therapie der asymptomatischen Carotisstenose (ACS) basieren auf prospektiv randomisierten Studien, die teilweise vor mehreren Jahrzehnten durchgeführt wurden. Seitdem hat sich das «best medical treatment» (BMT) für die konservative Therapie arteriosklerotischer Patientinnen und Patienten jedoch relevant weiterentwickelt. Aufgrund der damit verbundenen Risikoreduktion für neurologische Komplikationen bei Vorliegen einer ACS wird die operative Therapie zunehmend in Frage gestellt. Durch die Identifikation von klinischen und bildmorphologischen Risikoparametern konnten Subgruppen identifiziert werden, die jedoch weiterhin von einer invasiven Therapie vermehrt profitieren könnten. Die multidisziplinäre Therapieentscheidung bedarf folglich einer zunehmend patientenindividualisierten Herangehensweise.
Einleitung
Ab einem Stenosegrad von 50 % wird eine extrakranielle Stenose der Arteria carotis interna (ACI) als signifikant angesehen. Bei fehlendem ipsilateralem ischämischem Schlaganfall oder vorübergehender (transitorisch-)ischämischer Attacke (TIA) in den letzten sechs Monaten gilt sie als asymptomatische Carotisstenose (ACS) [1, 2]. Die Prävalenz einer mindestens 50 %-igen ACS in der Gesamtbevölkerung liegt bei 2 % und steigt mit zunehmendem Lebensalter deutlich an [1, 3]. In der Schweiz leben schätzungsweise ca. 100 000 Menschen mit einer signifikanten ACS.
Die meisten ischämischen Schlaganfälle sind die Folge einer arterio-arteriellen Embolie, seltener liegt eine hämodynamische Minderperfusion als Ursache vor [4]. Eine Carotisstenose ist für 15 % aller ischämischen Schlaganfälle verantwortlich [2]. Bei ca. 16 000 Schlaganfällen pro Jahr in der Schweiz sind somit ca. 2400 auf eine signifikante ACI-Stenose zurückzuführen [5].
Populations-basierte Screening-Untersuchungen konnten zeigen, dass das männliche Geschlecht, ein aktiver Nikotinabusus, ein zunehmendes Lebensalter sowie zusätzliche Gefässerkrankungen in der Anamnese mit einer > 50 %igen ACS assoziiert sind [2].
In der Regel wird eine ACS als Zufallsbefund diagnostiziert. Ein generelles Screening wird aufgrund der niedrigen Prävalenz und des relativ geringen Schlaganfallrisikos nicht empfohlen [1, 2, 6, 7].
In randomisiert kontrollierten Studien (RCT) wurde die operative Revaskularisierung der ACS mit der konservativen Behandlung, dem sogenannten «Best medical treatment» (BMT), verglichen. Hierbei schnitt die Carotisendarteriektomie (CEA) durchweg besser ab. Jedoch sind die Studienergebnisse mehrere Jahrzehnte alt [8, 9]. Seither ist die Wahrscheinlichkeit, aufgrund einer ACS einen ipsilateralen Schlaganfall zu erleiden, infolge des verbesserten BMT stetig gesunken und wird heute auf etwa 1 % pro Jahr geschätzt [2]. Die Empfehlungen in den mehr als 20 verschiedenen internationalen Leitlinien sind daher sehr unterschiedlich [10]. Es stellt sich damit die Frage, ob die operative oder interventionelle Revaskularisierung der ACS noch sinnvoll oder aufgrund der verbesserten BMT obsolet ist.
Ziel dieses Reviews ist, ein Update zu aktuellen Diagnostik- und Therapiemöglichkeiten sowie zur individuellen Risikobewertung und Indikationsstellung darzustellen. Zusätzlich wird ein Ausblick auf zukünftige Entwicklungen gegeben.
Diagnostik
Bei einer Carotisstenose handelt es sich in der Regel um einen Zufallsbefund im Rahmen einer körperlichen Untersuchung, bei der ein Strömungsgeräusch über den Halsschlagadern detektiert wurde, oder durch eine Ultraschalluntersuchung, die im Rahmen der Umfelddiagnostik anderer atherosklerotischer Erkrankungen wie einer koronaren Herzerkrankung oder einer peripheren arteriellen Verschlusskrankheit durchgeführt wird. Im Fall einer neu diagnostizierten Carotisstenose sollte eine fachärztliche neurologische Untersuchung durchgeführt werden. Daneben sollten systematisch alle kardiovaskulären Risikofaktoren erfasst, leitliniengerecht behandelt und nach anderen kardiovaskulären Erkrankungen gesucht werden [2, 11].
Aufgrund der niedrigen Kosten und der guten Zugänglichkeit ist die Duplexsonografie (DUS) die bevorzugte Methode in der Bildgebung und wird daher weit verbreitet eingesetzt [1, 2]. Die Einstufung des Stenosegrads mittels DUS erfolgt anhand etablierter Kriterien, u.a. der Flussgeschwindigkeit [1, 12, 13].
Der Stenosegrad sollte zur Diagnosesicherung anschliessend immer in einer zweiten unabhängigen Modalität entweder mittels Computertomografie-Angiografie (CTA) oder Magnetresonanztomografie-Angiografie (MRT) bestätigt werden [1, 2, 14]. Diese ermöglicht zusätzlich einen Informationsgewinn über den Aortenbogen, die Stenose-Morphologie sowie die extra- und intrakranielle Zirkulation (Abb. 1). Eine rein diagnostische invasive digitale Subtraktionsangiografie (DSA) sollte nur noch in Kombination mit einer Behandlung durchgeführt werden.
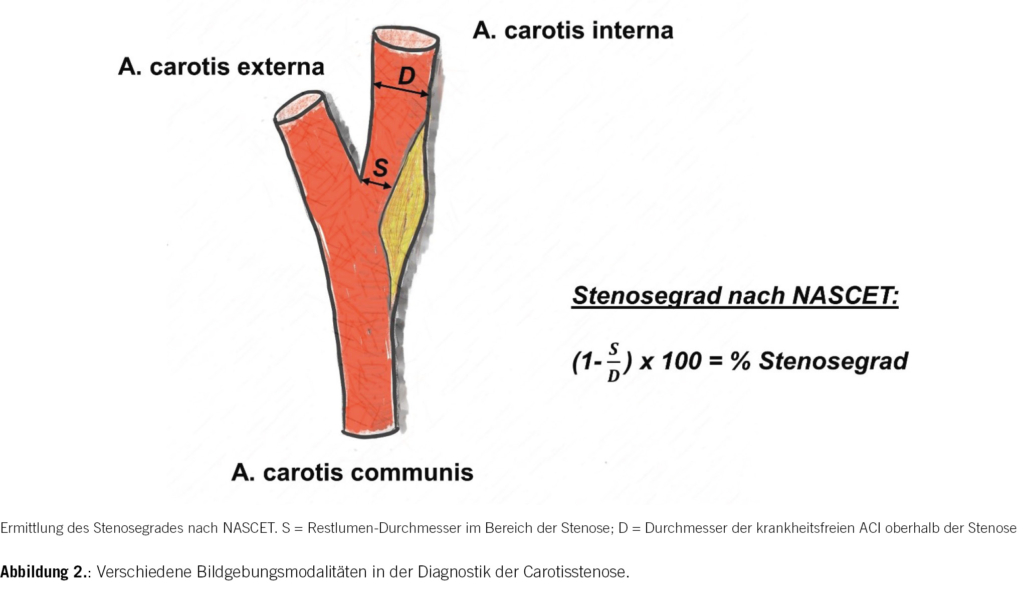
Bei der Bestimmung des Stenosegrads in der CTA hat sich die Einteilung nach NASCET (North American Symptomatic Carotid Endarterectomy Trial) durchgesetzt (Abb. 2). Er berechnet sich aus 1 minus dem Quotienten aus dem Restlumen-Durchmesser im Bereich der Stenose (S, Zähler) und dem Durchmesser der krankheitsfreien ACI oberhalb der Stenose (D, Nenner): (1–S/D) × 100 = % Stenosegrad [1, 15].
Therapie
Best medical treatment – Medikamentöse Behandlung
Die Basis jeglicher Therapie ist die sog. best medical treatment (BMT). Es handelt sich hierbei um eine Sekundärprophylaxe. Sie umfasst nach den neuesten Leitlinien der European Society for Vascular Surgery (ESVS) eine gesunde Ernährung, eine strikte Nikotinkarenz und körperliche Aktivität. Zudem wird die tägliche Einnahme von niedrig dosiertem Aspirin (100 mg) empfohlen. Alternativ kann bei Intoleranz Clopidogrel erwogen werden. Zusätzlich empfiehlt sich die Einnahme eines Statins mit oder ohne Ezetimib. In Fällen einer Statin-Unverträglichkeit kann nun auch ein PCSK9-Inhibitor in Erwägung gezogen werden. Die antihypertensive Therapie strebt einen Zielblutdruck von < 130/80 mmHg an. Bei Diabetikern ist eine strikte Blutzucker-Einstellung notwendig [1].
Operations-/Interventionsmethoden
An revaskularisierenden Verfahren stehen generell drei Optionen zur Verfügung. Die klassische offene Carotisendarteriektomie (CEA), das Carotis-Stenting (CAS) oder das neuere Hybridverfahren, die sogenannte «Transcarotid Artery Revascularization» (TCAR). Letztere ist jedoch in der Schweiz aufgrund einer noch nicht abschliessenden Klärung in Bezug auf die neue Medizinprodukteverordnung momentan nicht verfügbar.
Carotisendarteriektomie
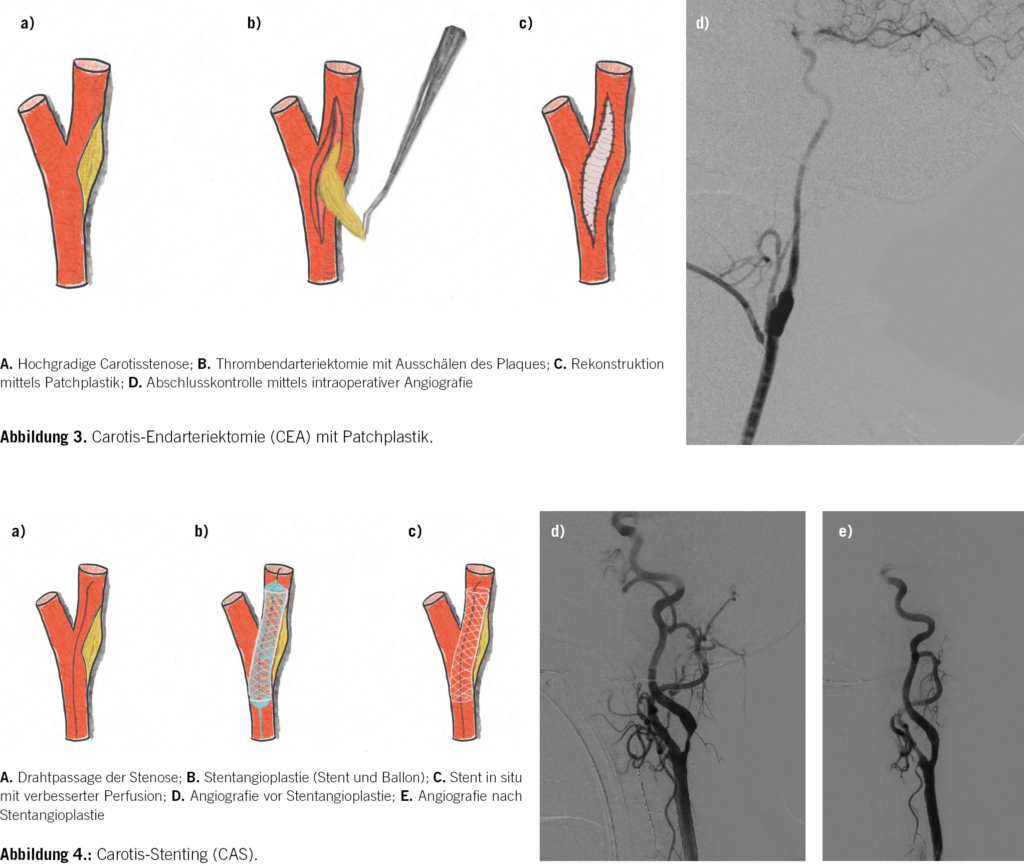
Bei der klassischen Carotisendarteriektomie (CEA) wird der atherosklerotische Plaque über einen offen-chirurgischen Zugang am Hals nach Ausklemmen der Carotisbifurkation und Längseröffnen (Arteriotomie) des Gefässes ausgeschält (Thrombendarteriektomie). Der Verschluss erfolgt mittels Patchplastik (alloplastisch oder xenogen) (Abb. 3). Bei der Eversionsendarteriektomie als alternative Operationsstrategie wird die ACI von der Carotisbifurkation abgetrennt und das Innere der ACI nach aussen gestülpt (Eversion). Hierdurch kann der Plaque entfernt werden. Anschliessend wird die Arterie wieder zurück gestülpt und erneut mit der Bifurkation vernäht, wodurch der Einsatz von Fremdmaterial vermieden werden kann. Ein Direktverschluss der Arteriotomie ohne Patch oder Eversion wird nicht empfohlen, da hier höhere Raten an perioperativen Schlaganfällen, Thrombosen, Re-Stenosen und ipsilateralen Schlaganfällen im Verlauf beobachtet wurden [1, 16].
Die CEA wurde aufgrund von zwei wichtigen Studien, die vor mehreren Jahrzehnten durchgeführt wurden, lange Zeit als der bevorzugte Standard in der Behandlung von Carotisstenosen angesehen.
In der multizentrischen, randomisiert kontrollierten Studie «Asymptomatic Carotid Atherosclerosis» (ACAS) aus dem Jahr 1995 wurde die CEA mit alleinigem BMT verglichen. Dabei konnte anhand von knapp 1700 Personen (CEA n = 825 und BMT n = 834) gezeigt werden, dass nach fünf Jahren das relative Risiko (RR) für einen ipsilateralen Schlaganfall nach CEA im Vergleich zu BMT allein um über 50 % gesenkt werden konnte. Die kombinierte perioperative Schlaganfall- und Todesrate betrug 2,3 %. Es ergab sich eine Number needed to treat (NNT), um einen Schlaganfall in fünf Jahren zu verhindern, von 17 [8].
Bei dem «Asymptomatic Carotid Surgery Trial» (ACST), dessen 5-Jahres-Daten 2004 publiziert wurden, wurde ebenfalls CEA gegen BMT bei 3120 Personen mit einer behandlungsbedürftigen ACS verglichen. Die kombinierte perioperative Schlaganfall- und Todesrate betrug 2,8 %. Die relative Risiko Reduktion für einen ipsilateralen Schlaganfall nach CEA betrug ebenfalls über 50, und die NNT lag bei 19 [9]. Die 10-Jahres-Daten zeigten, dass insgesamt pro 100 Personen, die mittels CEA behandelt wurden, neun Schlaganfälle verhindert werden konnten. Dabei wurden jedoch drei perioperative Schlaganfälle bzw. Todesfälle in Kauf genommen. Bei 88 Personen ergab sich kein Effekt [17]. Damit muss auch gesagt werden, dass mehr als 90 % der Teilnehmenden nicht von einer Operation profitiert haben.
Carotis-Stenting
Alternativ kann auch ein Carotis-Stenting (CAS) erfolgen, wobei der Stent über einen transfemoralen oder transradialen/-brachialen Zugang eingebracht und die Stenose zusätzlich dilatiert wird (Abb. 4) [1]. Beim CAS sollte zusätzlich ein endovaskuläres Protektionssystem verwendet werden, um intraoperative Schlaganfälle zu vermeiden [1, 2, 18]. Denn in der Regel muss bei diesem Verfahren der Aortenbogen passiert werden, was potenziell die intraoperative Schlaganfallrate erhöhen kann. Starke Verkalkungen gelten als eine Kontraindikation für ein CAS, da hierbei eine hohe Versagensrate beobachtet wurde [1, 19]. Peri-interventionell sollte vor der Inflation des Ballons intravenös Atropin oder Glycopyrrolat verabreicht werden, um eine arterielle Hypotonie, Bradykardie oder Asystolie zu vermeiden [1, 20, 21].
Vergleich CEA und CAS
Eine Reihe von Studien wurde durchgeführt, die die CEA als den Goldstandard in der Behandlung der Stenose der ACI mit dem CAS verglichen. Bei zwei RCTs wurden dabei nur asymptomatische Patientinnen und Patienten eingeschlossen. Zum einen die ACT-1-Studie (Randomized Trial of Stent vs. Surgery for Asymptomatic Carotid Stenosis), die zwischen 2005 und 2013 insgesamt 1453 Personen randomisierte, und die ACST-2-Studie (Second Asymptomatic Carotid Surgery Trial), die zwischen 2008–2020 3625 Teilnehmende mit ACS einschloss. Diese konnten zeigen, dass das perioperative Risiko für einen Schlaganfall oder Tod im kurzfristigen [ACT-1 2,9 % (CAS) vs. 1,7 % (CEA), p = 0,33 und ACST2 3,7 % (CAS) vs. 2,7 % (CEA), p = 0,12) sowie im langfristigen Verlauf nicht signifikant unterschiedlich ist (ACT-1 3,8 % (CAS) vs. 3,3 % (CEA) und ACST2 5,3 % (CAS) vs. 4,5 % (CEA)] [18, 22]. Durchweg fiel das Risiko für einen ipsilateralen Schlaganfall jedoch bei der CEA geringer aus, wohingegen höhere Raten an Myokardinfarkt bei der CEA beobachtet wurden [1, 18, 22].
Weitere wichtige Prozedur-assoziierte Komplikationen beinhalten neben dem perioperativen Schlaganfall und Tod das Hyperperfusionssyndrom, das nach der CEA in 1 % und nach dem CAS in 3 % der Fälle auftritt [1, 23, 24]. Durch die verbesserte Perfusion kann es zu einem vasogenen Hirnödem kommen, das zu einer intrakraniellen Hirnblutung führen kann. In der Regel tritt dies innerhalb der erst zwölf Stunden postoperativ auf, kann aber auch noch vier Wochen später auftreten [1, 25, 26]. Symptome beinhalten Kopfschmerzen, Verwirrtheit, Krampfanfälle, Bluthochdruck, Bewusstseinsstörungen, Übelkeit und Erbrechen bis hin zu einem neurologischen Defizit. Entscheidend ist es, den Blutdruck schnell zu senken, eine CT-Untersuchung durchzuführen und im Fall eines Ödems ggf. eine neurochirurgische Entlastung durchzuführen.
Hirnnervenverletzungen, wie z.B. eine Affektion des Nervus hypoglossus mit Zungendeviation oder des Nervus laryngeus recurrens mit Stimmlippenparese und konsekutiver Heiserkeit treten nach der CEA häufiger auf (5,4 % vs. 0,5 %), wobei sich diese in über 80 % der Fälle im Lauf eines Jahres zurückbilden [1, 27, 28].
Eine Re-Stenose tritt nach dem CAS hingegen häufiger auf (4–11 % vs. 2–8 %) [1, 29, 30, 31, 32].
Ein RCT, der CAS mit BMT allein vergleicht, wurde bis dato nicht durchgeführt.
Hybridverfahren – Transcarotid Artery Revascularization
Im letzten Jahrzehnt hat sich ein Hybridverfahren als Alternative zu den beiden herkömmlichen Methoden entwickelt, die sogenannte Transcarotid Artery Revascularization (TCAR). Insbesondere in den USA hat sich diese Methode rasant verbreitet. Hierbei wird mittels offen-chirurgischem Zugang die Arteria carotis communis (ACC) freigelegt und antegrad punktiert. Anschliesssend wird extrakorporal ein Kurzschluss (Shunt) zur perkutan punktierten Vena femoralis etabliert. Nach Ausklemmen der ACC wird durch das entstandene arterio-venöse Druckgefälle eine Flussumkehr erreicht und somit das Risiko einer cerebralen Embolie aus dem Aortenbogen minimiert. TCAR wurde bisher nur in einarmigen Studien ohne direkten Vergleich zu CEA, CAS oder BMT allein untersucht. Die Resultate der 2015 veröffentlichten ROADSTER-Studie (Safety and Efficacy Study for Reverse Flow Used During Carotid Artery Stenting Procedure) zeigte eine perioperative Schlaganfallrate von 1,4 % und eine kombinierte Schlaganfall-, Todesfall- und Myokardinfarktrate von 3,5 % [33]. Zwar sind die bisherigen Ergebnisse vergleichbar mit denen der CEA und CAS. Trotzdem sind weitere umfangreichere und idealerweise RCTs mit Langzeit-Follow-up erforderlich, um den Effekt von TCAR bei der Behandlung von ACS abschliessend zu beurteilen.
Risikobewertung/Indikationsstellung
Im Verlauf der vergangenen Jahrzehnte hat das BMT eine deutliche Verbesserung und Weiterentwicklung erfahren und ist mit der teilweise uneinheitlichen Definition aus den früheren Studien nur noch bedingt vergleichbar. So umfasste dieses in ACAS nur die Gabe von Aspirin bzw. eine «Diskussion» von Risikofaktoren [8]. Bei ACST konnte hingegen über den Beobachtungszeitraum hinweg von Anfang der 90er bis in die 2000er Jahre hinein ein mehr als 30 %-iger Anstieg an Patientinnen und Patienten mit adäquater antihypertensiver Therapie verzeichnet werden. Noch deutlicher fiel der Anstieg bei der Lipid-senkenden-Therapie aus, der sowohl in der CEA-Gruppe als auch in der CAS-Gruppe um mehr als 70 % anstieg [17, 34]. Durch eine breite Anwendung und Verbesserung der Medikamentenklassen konnte das jährliche Risiko eines ipsilateralen Schlaganfalls durch eine ACS vermutlich von über 2 % (wie in ACAS und ACST) auf etwa 1 % pro Jahr gesenkt werden [35].
Es stellt sich daher die Frage, ob das perioperative Risiko einer invasiven Behandlung im Vergleich zum alleinigen modernen BMT überhaupt noch vertretbar ist. Einen wichtigen Aspekt stellt dabei neben der Risikoreduktion durch ein BMT die signifikante Verbesserung der Ergebnisse der CEA in den letzten Jahrzehnten dar. Dies konnte in einem 2015 publizierten Review von sechs RCTs mit 4431 CEAs und 47 Registerstudien mit 204 622 CEAs nachgewiesen werden. Die Autoren folgerten, dass neue Richtwerte für die Durchführung von CEAs etabliert werden sollten. So sollten die behandelnden Spitäler maximale kombinierte Schlaganfall- und Todesfallraten von 1,2 % und isolierte Todesfallraten von 0,4 % nicht überschreiten [36].
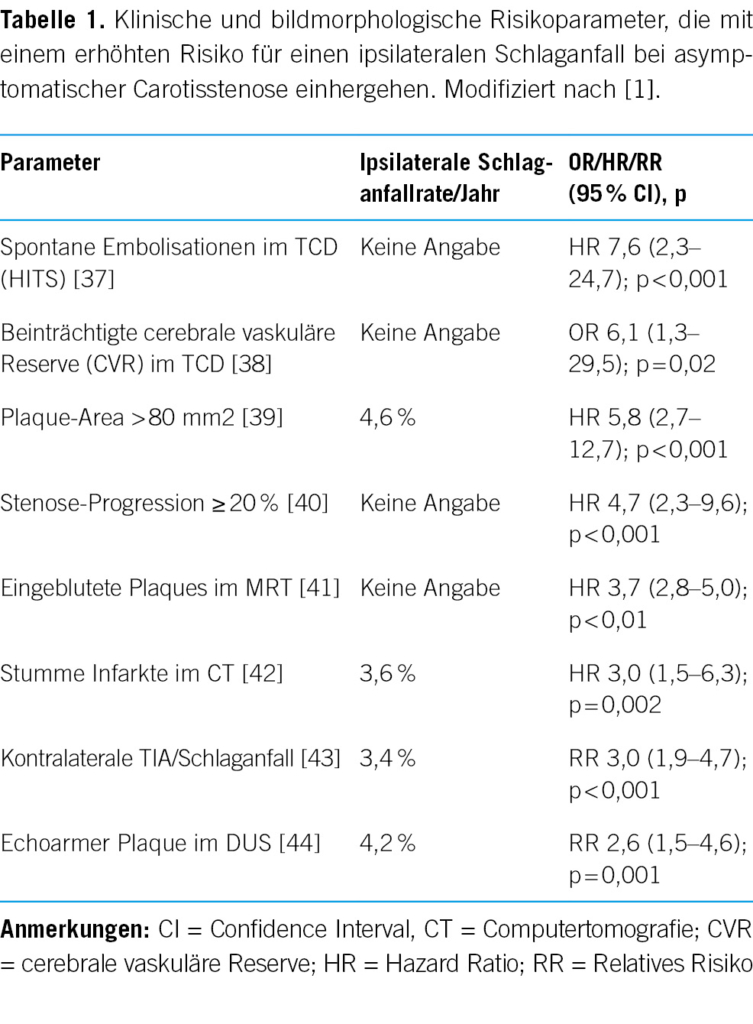
Neben der Untersuchung des perioperativen Risikos hat man sich in den letzten Jahren darauf konzentriert, ACS-Kranke mit einem erhöhten Risiko für einen ipsilateralen Schlaganfall zu identifizieren, die von einer Revaskularisierung profitieren würden [1, 2, 34]. Es wurden eine Reihe von klinischen und bildmorphologischen Risikoparametern identifiziert, die mit einer erhöhten Rate an ipsilateralen Schlaganfällen vergesellschaftet sind (Tabelle 1). Hier sind insbesondere stumme spontane Embolisationen im transkraniellen Doppler (TCD), sogenannte HITS (high-intensity transient signals) zu nennen, die mit einem fast 8-fach erhöhten Risiko einhergehen (HR 7,6 (2,3–24,7); p < 0,001) [1, 37]. Ein um 6-fach erhöhtes Risiko liegt bei einer mittels TCD gemessenen beeinträchtigten cerebralen vaskulären Reserve (OR 6,1 (1,3–29,5); p = 0,02) [1, 38] sowie bei grossen Plaques mit einer Fläche von > 80 mm2 vor (HR 5,8 (2,7–12,7); p < 0,001) [1, 39].
Kommt es zu einer Stenoseprogression von >20 % unter BMT, ist dies mit einem fast 5-fach erhöhten Risiko für einen ipsilateralen Schlaganfall verbunden (HR 4,7 (2,3–9,6); p < 0,001) [1, 40]. Eingeblutete atherosklerotische Plaques («intraplaque haemorrhage») im MRT sind mit einem fast 4-fach erhöhten Risiko verbunden (HR 3,7 (2,8–5,0); p < 0,01) [1, 41].
Des Weiteren gelten stumme Infarkte im kranialen CT (HR 3,0 (1,5–6,3); p = 0,002), eine kontralaterale TIA oder ein Schlaganfall (RR 3,0 (1,9–4,7); p < 0,001) sowie echoarme Plaques im Ultraschall (RR 2,6 (1,5–4,6); p = 0,001) als Risikoparameter [1, 42, 43, 44].
Diese Erkenntnisse haben Einzug in die aktuellen Leitlinien gehalten. Die deutsche S3-Leitlinie von 2020 empfiehlt analog zur europäischen Leitlinie von 2023, dass bei 60–99 %iger asymptomatischer Stenose eine CEA erwogen werden sollte, wenn mindestens ein klinischer oder bildgebender Risikoparameter vorliegt. Als Alternative kann unter gleichen Voraussetzungen ein CAS erwogen werden [1, 2].
Zusammenfassend zeigt sich bei der Behandlung der asymptomatischen Stenose auf Grund der guten Ergebnisse des BMT ein klarer Trend zur individualisierten Therapiestrategie.
Volume-Outcome-Relation
In einer Meta-Analyse aus den USA konnte anhand von 25 Studien mit 900 000 CEAs gezeigt werden, dass Zentren mit höherem Volumen signifikant bessere Ergebnisse bei der CEA erzielen [1, 22]. Der Schwellenwert in dieser Analyse lag bei 79 CEAs pro Zentrum und Jahr. Eine weitere Studie aus England mit 18 248 CEAs zeigte ein vergleichbares Ergebnis, wobei der Schwellenwert bereits bei 35 CEAs pro Spital lag [1, 45]. Der beobachtete Unterschied in den beiden Schwellenwerten liegt wahrscheinlich an dem deutlich höheren Anteil asymptomatischer Personen in den USA, während in England ein deutlich höherer Prozentsatz symptomatischer Personen behandelt wurde. Letztere haben ein deutlich höheres perioperatives Schlaganfallrisiko [1].
In vergleichbaren Untersuchungen für CAS konnte ebenfalls eine Volumen-Outcome-Relation nachgewiesen werden. So konnten z.B. Hung und Kollegen in ihrer Analyse zeigen, dass Spitäler mit einem niedrigen CAS-Volumen (< 20 CAS/Jahr) eine statistisch signifikant höhere 30-Tage-Schlaganfallrate pro Jahr aufwiesen als Spitäler mit einem Volumen von mehr als 20 CAS-Fällen/Jahr (HR 1,5; 95 % CI 1,06–2,12, p = 0,023) [1, 46].
Die deutsche S3-Leitlinie fordert bereits, dass CEAs nur in Spitälern mit mehr 20 Fällen pro Jahr und CAS nur in Spitälern mit mehr als 10 Fällen pro Jahr durchgeführt werden sollten [2].
Grenzwerte für Spitäler oder einzelne Operateure/Interventionalisten existieren bisher in der Schweiz nicht. Derzeit wird aber im Rahmen der hochspezialisierten Medizin (HSM) geprüft, ob solche Schwellenwerte eingeführt werden sollen und welche systemischen Veränderungen dafür erforderlich sind.
Multidisziplinäre Teambesprechung
Wie bereits im Kanton Zürich gesetzlich vorgeschrieben, wird die Indikationsstellung zur Revaskularisierung von Carotisstenosen zunehmend im Rahmen von multidisziplinären Team-Besprechungen (MDT) gefordert [47]. Diese sollten u.a. Expertise aus Fächern wie Neurologie, Neuroangiologie, Neuroradiologie, Angiologie und Gefässchirurgie beinhalten. Diese Empfehlung findet sich analog in der Leitlinie der ESVS von 2023, der European Stroke Organisation (ESO) von 2021 und der deutschen S3-Leitlinie von 2020 [1, 2, 48]. Die Zeit bis zu diesen Besprechungen sollte dabei keine unnötigen Verzögerungen verursachen, weshalb dringende Indikationsstellungen durch Ad-hoc-Sitzungen getroffen werden können [1]. Ein Vorteil neben den verschiedenen Kompetenzen ist die objektive fachärztliche Beurteilung des Interventions- bzw. Operationsergebnisses durch Dritte. Beispielsweise zeigte das deutsche ProCAS-Stent-Register, dass eine unabhängige neurologische Beurteilung höhere Raten vorübergehender (8,2 % vs. 5,1 %) oder dauerhafter neurologischer Defizite (3,3 % vs. 0,9 %) beobachtete, als wenn diese durch den/die Interventionalisten/in selbst dokumentiert wurden [1, 49].
Ausblick
Eine abschliessende Klärung, ob eine operativ bzw. interventionelle Revaskularisierung sinnvoll ist oder eine medikamentöse Therapie allein ausreicht, bedarf weiterer Klärung.
Als Ausblick werden die Ergebnisse der aktuell laufenden CREST-2-Studie (Carotid Revascularization and Medical Management for Asymptomatic Carotid Stenosis Trial) erwartet [50]. Hierbei handelt es sich um zwei getrennte Studien: Die eine vergleicht die CEA + BMT mit der BMT allein. Die andere untersucht CAS + BMT vs. BMT allein. Es sollen 2480 Personen aus 132 Zentren vor allem in Nordamerika eingeschlossen werden. Die Rekrutierung läuft bereits seit Ende 2014.
Eine weitere Studie, bei der die Rekrutierung noch nicht angefangen hat, ist der ACTRIS trail (Endarterectomy Combined With Optimal Medical Therapy (OMT = BMT) vs. OMT Alone in Patients With Asymptomatic Severe Atherosclerotic Carotid Artery Stenosis at Higher than-average Risk of Ipsilateral Stroke). In diesem sollen 700 Personen mit oben genannten Hoch-Risiko-Merkmalen in die beiden Therapiearme CEA + BMT vs. BMT randomisiert werden.
Randomisierte Studien zum Vergleich von TCAR und der CEA, CAS oder BMT allein wurden bisher noch nicht durchgeführt, wären jedoch wünschenswert.
Im Artikel verwendete Abkürzungen
CT Computertomografie
ACAS Asymptomatic Carotid Atherosclerosis
ACI Arteria carotis interna
ACS Asymptomatische Carotisstenose
ACST Asymptomatic Carotid Surgery Trial
BMT Best Medical Treatment
CAS Carotis-Stenting
CEA Carotis-Endarteriektomie
CTA Computertomografie-Angiografie
DUS Duplexsonografie
ESVS European Society of Vascular Surgery
HITS High-Intensity Transient Signal
HR Hazard Ratio
HSM Hochspezialisierte Medizin
MDT Multidisziplinäre Teambesprechung
MRT Magnetresonanztomografie-Angiografie
NASCET North American Symptomatic Carotid Endarterectomy Trial
NNT Numbers Needed to Treat
OR Odds Ratio
RCT Randomisiert kontrollierte Studie
RR Relative Risk
TCAR Transcarotid Artery Revascularization
TCD Transkranielle Dopplersonografie
TIA Transitorisch-ischämische Attacke
Klinik für Gefässchirurgie
Universitätsspital Zürich
Rämistr. 100
8091 Zürich
Schweiz
benedikt.reutersberg@gmail.com
Historie
Manuskript akzeptiert: 27.02.2023
Interessenskonflikte
Es bestehen keine Interessenskonflikte.
Nach dem aktuellen Kenntnisstand ist die operative bzw. interventionelle Revaskularisierung einer asymptomatischen, 60–99-prozentigen Carotisstenose nicht obsolet, sondern bei Patientinnen und Patieten mit spezifischen klinischen und morphologischen Risikoparametern weiterhin sinnvoll.
Die bestmögliche medikamentöse Therapie (BMT) ist dabei die Basis, sie hat sich in den letzten Dekaden signifikant weiterentwickelt.
Parallel dazu haben sich auch die Ergebnisse der Revaskularisierung verbessert.
Sowohl bei der CEA als auch bei CAS besteht ein direkter Zusammenhang zwischen Fallzahl und Behandlungsergebnis (Volume-Outcome-Relation).
Patientinnen und Patienten sollten daher in Zentren mit multi-disziplinärer neurovaskulärer und gefässmedizinischer Expertise vorgestellt werden.
Die Abschätzung des individuellen Risikos und die Indikation zur Revaskularisierung sollte im Rahmen multidisziplinärer Teambesprechungen erfolgen.
Lernfragen
1. Welche Therapie sollte bei einem 65-jährigen Patienten mit Erstdiagnose einer hochgradigen (70 %) asymptomatischen Carotisstenose primär durchgeführt werden? (Einfachantwort)
a) Carotis-Endarteriektomie (CEA)
b) Carotis-Stenting (CAS)
c) Best Medical Treatment (BMT)
d) Transcarotidales Stenting (TCAR)
2. Welche Therapiemöglichkeiten bestehen bei einem 65-jährigen Patienten mit bekannter hochgradiger (70 %) asymptomatischer Stenose, der neben einer Progression unter BMT weitere Risikoparameter wie HITS im TCD und einen eingebluteten hämorraghischen Plaque im MRT aufweist? Zusätzlich zeigt sich ein stark atheromatöser Aortenbogen. (Mehrfachantwort)
a) Carotis-Endarteriektomie (CEA)
b) Carotis-Stenting (CAS)
c) Transcarotidales Stenting (TCAR)
d) Kein Eingriff, da Patient weitere Behandlungen ablehnt und daher fortführen des BMT
3. Wie sollte bei einem Patienten mit progredienter duplexsonografischer 60-prozentiger asymptomatischer Stenose der A. carotis interna unter BMT verfahren werden? (Mehrfachantwort)
a) Prüfen, ob das Best Medical Treatment vollumfänglich ausgeschöpft ist
b) Vorstellung in einem Zentrum mit neurovaskulärer und gefässmedizinischer Expertise
c) Wiederholung der Duplexsonografie sowie Durchführung einer erweiterten Bildgebung wie CTA oder MRA
d) Abklärung spezifischen klinischer und morphologischen Risikoparameter zur Evaluation einer Eingriffsindikation
1. Naylor R, Rantner B, Ancetti S, et al. Editor’s Choice – European Society for Vascular Surgery (ESVS) 2023 Clinical Practice Guidelines on the Management of Atherosclerotic Carotid and Vertebral Artery Disease. Eur J Vasc Endovasc Surg Off J Eur Soc Vasc Surg. 2023;65:7–111.
2. Eckstein H-H. S3-Leitlinie zur «Diagnostik, Therapie und Nachsorge der extracraniellen Carotisstenose». Gefässchirurgie. 2020;17:495–496.
3. de Weerd M, Greving JP, Hedblad B, et al. Prevalence of Asymptomatic Carotid Artery Stenosis in the General Population: An Individual Participant Data Meta-Analysis. Stroke. 2010;41:1294–1297.
4. Mechtouff L, Rascle L, Crespy V, Canet-Soulas E, Nighoghossian N, Millon A. A narrative review of the pathophysiology of ischemic stroke in carotid plaques: a distinction versus a compromise between hemodynamic and embolic mechanism. Ann Transl Med. 2021;9:1208–1208.
5. Meyer K, Simmet A, Arnold M, Mattle H, Nedeltchev K. Stroke events, and case fatalities in Switzerland based on hospital statistics and cause of death statistics. Swiss Med Wkly. 2009;139:65–69.
6. Guirguis-Blake JM, Webber EM, Coppola EL. Screening for Asymptomatic Carotid Artery Stenosis in the General Population: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA. 2021;325:487–489.
7. Düppers P, Reutersberg B, Pourhassan S, Zimmermann A. Atherosklerose-Screening der karotidalen und peripheren Arterien. Gefässchirurgie. 2020. http://link.springer.com/10.1007/s00772-020-00622-7; letzter Zugriff: 09.03.2023.
8. Walker MD, Marler JR, Goldstein M, et al. Endarterectomy for Asymptomatic Carotid Artery Stenosis. JAMA. 1995;273:1421–1428.
9. Halliday A, Mansfield A, Marro J, et al. Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: randomised controlled trial. Lancet Lond Engl. 2004;363:1491–502.
10. Paraskevas KI, Mikhailidis DP, Antignani PL, et al. Comparison of Recent Practice Guidelines for the Management of Patients With Asymptomatic Carotid Stenosis. Angiology. 2022;73:903–910.
11. AGLA Risikorechner. https://www.agla.ch/de/rechner-und-tools/agla-risikorechner; letzter Zugriff: 27.02.2023.
12. Arning C, Widder B, Reutern GM von, Stiegler H, Görtler M. Ultraschallkriterien zur Graduierung von Stenosen der A. carotis interna – Revision der DEGUM-Kriterien und Transfer in NASCET-Stenosierungsgrade. Ultraschall Med – Eur J Ultrasound. 2010;31:251–257.
13. Schäberle W. Sonographische Graduierung von Karotisstenosen: Einflussgrößen auf die hämodynamische Stenosegraduierung. Gefässchirurgie. 2020;25:91–104.
14. Wardlaw JM, Chappell FM, Stevenson M, et al. Accurate, practical and cost-effective assessment of carotid stenosis in the UK. Health Technol Assess Winch Engl. 2006;10:iii–iv, ix–x, 1–182.
15. North American Symptomatic Carotid Endarterectomy Trial Collaborators, Barnett HJM, Taylor DW, et al. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis. N Engl J Med. 1991;325:445–453.
16. Paraskevas KI, Robertson V, Saratzis AN, Naylor AR. Editor’s Choice – An Updated Systematic Review and Meta-analysis of Outcomes Following Eversion vs. Conventional Carotid Endarterectomy in Randomised Controlled Trials and Observational Studies. Eur J Vasc Endovasc Surg Off J Eur Soc Vasc Surg. 2018;55:465–473.
17. Halliday A, Harrison M, Hayter E, et al. 10-year stroke prevention after successful carotid endarterectomy for asymptomatic stenosis (ACST-1): a multicentre randomised trial. 2010;376:11.
18. Rosenfield K, Matsumura JS, Chaturvedi S, et al. Randomized Trial of Stent versus Surgery for Asymptomatic Carotid Stenosis. N Engl J Med. 2016;374:1011–1020.
19. Kokkosis AA, Macdonald S, Jim J, Shah R, Schneider PA. Assessing the suitability of the carotid bifurcation for stenting: Anatomic and morphologic considerations. J Vasc Surg. 2021;74:2087–9205.
20. Gupta R, Horowitz M, Jovin TG. Hemodynamic instability after carotid artery angioplasty and stent placement: a review of the literature. Neurosurg Focus. 2005;18:e6.
21. Trocciola SM, Chaer RA, Lin SC, et al. Analysis of parameters associated with hypotension requiring vasopressor support after carotid angioplasty and stenting. J Vasc Surg. 2006;43:714–720.
22. Halliday A, Bulbulia R, Bonati LH, et al. Second asymptomatic carotid surgery trial (ACST-2): a randomised comparison of carotid artery stenting versus carotid endarterectomy. The Lancet. 2021;398:1065–1073.
23. Naylor AR, Evans J, Thompson MM, et al. Seizures after carotid endarterectomy: hyperperfusion, dysautoregulation or hypertensive encephalopathy? Eur J Vasc Endovasc Surg Off J Eur Soc Vasc Surg. 2003;26:39–44.
24. Abou-Chebl A, Reginelli J, Bajzer CT, Yadav JS. Intensive treatment of hypertension decreases the risk of hyperperfusion and intracerebral hemorrhage following carotid artery stenting. Catheter Cardiovasc Interv Off J Soc Card Angiogr Interv. 2007;69:690–696.
25. Kirchoff-Torres KF, Bakradze E. Cerebral Hyperperfusion Syndrome After Carotid Revascularization and Acute Ischemic Stroke. Curr Pain Headache Rep. 2018;22:24.
26. Huibers AE, Westerink J, de Vries EE, et al. Editor’s Choice – Cerebral Hyperperfusion Syndrome After Carotid Artery Stenting: A Systematic Review and Meta-analysis. Eur J Vasc Endovasc Surg Off J Eur Soc Vasc Surg. 2018;56:322–333.
27. Batchelder AJ, Saratzis A, Ross Naylor A. Editor’s Choice – Overview of Primary and Secondary Analyses From 20 Randomised Controlled Trials Comparing Carotid Artery Stenting With Carotid Endarterectomy. Eur J Vasc Endovasc Surg Off J Eur Soc Vasc Surg. 2019;58:479–493.
28. Hye RJ, Mackey A, Hill MD, et al. Incidence, outcomes, and effect on quality of life of cranial nerve injury in the Carotid Revascularization Endarterectomy versus Stenting Trial. J Vasc Surg. 2015;61:1208–1214.
29. Kumar R, Batchelder A, Saratzis A, et al. Restenosis after Carotid Interventions and Its Relationship with Recurrent Ipsilateral Stroke: A Systematic Review and Meta-analysis. Eur J Vasc Endovasc Surg Off J Eur Soc Vasc Surg. 2017;53:766–775.
30. Xin W-Q, Li M-Q, Li K, et al. Systematic and Comprehensive Comparison of Incidence of Restenosis Between Carotid Endarterectomy and Carotid Artery Stenting in Patients with Atherosclerotic Carotid Stenosis. World Neurosurg. 2019;125:74–86.
31. Li Y, Yang J-J, Zhu S-H, Xu B, Wang L. Long-term efficacy and safety of carotid artery stenting versus endarterectomy: A meta-analysis of randomized controlled trials. PloS One. 2017;12:e0180804.
32. Jung J-M, Choi J-Y, Kim HJ, Suh S-I, Seo W-K. Long term durability and outcomes of carotid stenting and carotid endarterectomy. J Neurointerventional Surg. 2017;9:750–755.
33. Kwolek CJ, Jaff MR, Leal JI, et al. Results of the ROADSTER multicenter trial of transcarotid stenting with dynamic flow reversal. J Vasc Surg. 2015;62:1227–1234.e1.
34. Kim HW, Regenhardt RW, D’Amato SA, et al. Asymptomatic carotid artery stenosis: a summary of current state of evidence for revascularization and emerging high-risk features. J NeuroInterventional Surg. 2022;neurintsurg-2022-018732.
35. Naylor AR. Time to rethink management strategies in asymptomatic carotid artery disease. Nat Rev Cardiol. 2011;9:116–124.
36. Munster AB, Franchini AJ, Qureshi MI, Thapar A, Davies AH. Temporal trends in safety of carotid endarterectomy in asymptomatic patients: Systematic review. Neurology. 2015;85:365–372.
37. Markus HS, King A, Shipley M, et al. Asymptomatic embolisation for prediction of stroke in the Asymptomatic Carotid Emboli Study (ACES): a prospective observational study. Lancet Neurol. 2010;9:663–671.
38. King A, Serena J, Bornstein NM, Markus HS, ACES Investigators. Does impaired cerebrovascular reactivity predict stroke risk in asymptomatic carotid stenosis? A prospective substudy of the asymptomatic carotid emboli study. Stroke. 2011;42:1550–1555.
39. Nicolaides AN, Kakkos SK, Kyriacou E, et al. Asymptomatic internal carotid artery stenosis and cerebrovascular risk stratification. J Vasc Surg. 2010;52:1486–1496.e5.
40. Hirt LS. Progression rate and ipsilateral neurological events in asymptomatic carotid stenosis. Stroke. 2014;45:702–706.
41. Gupta A, Baradaran H, Schweitzer AD, et al. Carotid plaque MRI and stroke risk: a systematic review and meta-analysis. Stroke. 2013;44:3071–3077.
42. Kakkos SK, Sabetai M, Tegos T, et al. Silent embolic infarcts on computed tomography brain scans and risk of ipsilateral hemispheric events in patients with asymptomatic internal carotid artery stenosis. J Vasc Surg. 2009;49:902–909.
43. Nicolaides AN, Kakkos SK, Griffin M, et al. Severity of asymptomatic carotid stenosis and risk of ipsilateral hemispheric ischaemic events: results from the ACSRS study. Eur J Vasc Endovasc Surg Off J Eur Soc Vasc Surg. 2005;30:275–284.
44. Gupta A, Kesavabhotla K, Baradaran H, et al. Plaque echolucency and stroke risk in asymptomatic carotid stenosis: a systematic review and meta-analysis. Stroke. 2015;46:91–97.
45. Holt PJE, Poloniecki JD, Loftus IM, Thompson MM. The relationship between hospital case volume and outcome from carotid endartectomy in England from 2000 to 2005. Eur J Vasc Endovasc Surg Off J Eur Soc Vasc Surg. 2007;34:646–654.
46. Hung C-S, Yeh C-F, Lin M-S, et al. Impact of hospital volume on long-term neurological outcome in patients undergoing carotid artery stenting. Catheter Cardiovasc Interv Off J Soc Card Angiogr Interv. 2017;89:1242–1249.
47. Zürcher Spitalplanung 2023 – Beilage zum Versorgungsbericht. https://bit.ly/41XSfPi; letzter Zugriff: 09.03.2023.
48. Bonati LH, Kakkos S, Berkefeld J, et al. European Stroke Organisation guideline on endarterectomy and stenting for carotid artery stenosis. Eur Stroke J. 2021;6:I–XLVII.
49. Theiss W, Hermanek P, Mathias K, et al. Pro-CAS: a prospective registry of carotid angioplasty and stenting. Stroke. 2004;35:2134–2139.
50. Howard VJ, Meschia JF, Lal BK, et al. Carotid Revascularization and Medical Management for Asymptomatic Carotid Stenosis: Protocol of the CREST-2 Clinical Trials. Int J Stroke Off J Int Stroke Soc. 2017;12:770–778.
PRAXIS
- Vol. 112
- Ausgabe 11
- September 2023