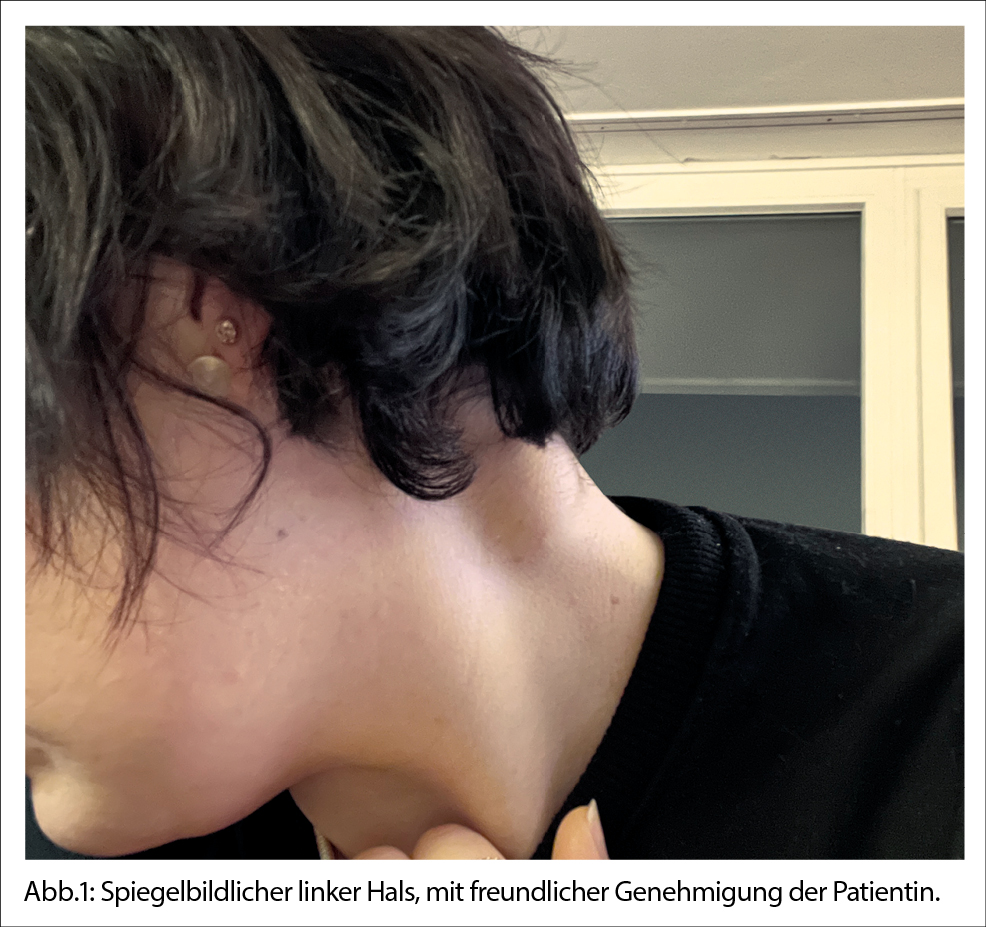
- Schwellung am Hals
Zusammenfassung: Es präsentierte sich eine 30-jährige Patientin mit einer 1 × 3 cm grossen Lymphknotenschwellung cervical links, welche seit bereits drei Wochen bestand. Die Abklärung mittels Lymphknotenexzision ergab eine Metastase eines malignen Melanoms, wobei der Primärtumor nicht gefunden wurde. Die Guidelines empfehlen eine Neck-Dissection und eine adjuvante System- oder Immuntherapie. Die Patientin entschied sich für die Immuntherapie mit Pembrolizumab und war ein Jahr später tumorfrei.
Schlüsselwörter: Lymphadenopathie, malignes Melanom, Immuntherapie, Pembrolizumab, Neck-Dissection
Präsentation
Eine 30-jährige Patientin stellte sich in der hausärztlichen Sprechstunde vor, da sie seit etwa drei Wochen eine schmerzhafte Schwellung am linken Hals bemerkt hatte. Sie verneinte jegliche Begleitsymptome wie Fieber, Schüttelfrost oder eine Gewichtsabnahme. Sie fühlte sich gut und hatte kein Krankheitsgefühl zu beklagen. Die gebürtige Costa Ricanerin (bis vor zwei Jahren lebte sie dort) war erst seit einem Jahr in der Schweiz wohnhaft, vorher lebte sie noch ein Jahr in den USA. Die letzte Impfung (Covid-19) war vor vier Monaten gewesen. Sie hatte sich vor 14 Tagen bei der Entsorgung von Konservendosen eine Schnittwunde zugezogen, diese hatte sich lokal jedoch nicht entzündet.
Klinisch zeigte sich links am Hals eine etwa 1 × 3 cm grosse, indolente, prallelastische Masse dorsal des Musculus sternocleidomastoideus. Nuchal, submental oder axillär waren keine vergrösserten Lymphknoten zu ertasten. Die Patientin verneinte jegliche Atemnot; es war kein Stridor zu hören.
Selbst mittels erweiterter Anamnese ergab sich kein dringender Hinweis auf die Ursache. Sie war in einer stabilen Partnerschaft und war in den letzten drei Monaten nicht mehr verreist.
Wir vereinbarten am Ende der ersten Konsultation, mit weiteren diagnostischen Abklärungen noch zuzuwarten. Drei Wochen später kam die Patientin zur erneuten Kontrolle. Die Schwellung am Hals wäre noch grösser geworden. Die Patientin berichtete, dass sie einen kleinen Hund zu Hause habe, kein näherer Kontakt zu Katzen. Das angefertigte Differentialblutbild war unauffällig.
Diagnostik
Zur weiteren Abklärung führten wir eine Sonographie durch, welche einen vergrösserten Lymphknoten von 1,7 × 1,4 ×0,7 cm mit deutlich hypoechogener, fraglich zystischer Binnenstruktur zeigte. Im Anschluss an die Sonographie wurde zur Histologiegewinnung eine Feinnadelpunktion durchgeführt. Das Resultat ergab Zellen einer «spindelzelligen Proliferation unklarer Dignität».
Dieses Zwischenresultat führte zur Indikation einer chirurgischen kompletten Lymphadenektomie. Ein präoperatives MRI von Hals und Thorax bestätigte die singuläre Lymphknotenschwellung. Nebenbefundlich wurde eine zystische Milzparenchymläsion beschrieben, die zur Echinococcusserologie führte. Die Lymphknotenexzision erfolgte unmittelbar im Anschluss. Die mikrobiologische Testung auf Mycobacterium tuberculosis fiel negativ aus. Die histologische Diagnose lautete: «Lymphknotenmetastase eines ausgedehnten, nekrotischen malignen Melanoms». Fachärztlich-dermatologisch fanden sich keine atypischen Naevi oder auffallende Pigmentläsionen. Auch die Untersuchung von Anogenitalregion sowie enoraler und konjunktivaler Mucosa blieben ohne Hinweis auf den Primarius. Die Patientin wurde auch HNO-ärztlich und ophthalmologisch untersucht, auch hier fand sich kein Hinweis auf einen Primarius. Ein Uvea-Melanom würde in den meisten Fällen in die Leber metastasieren.
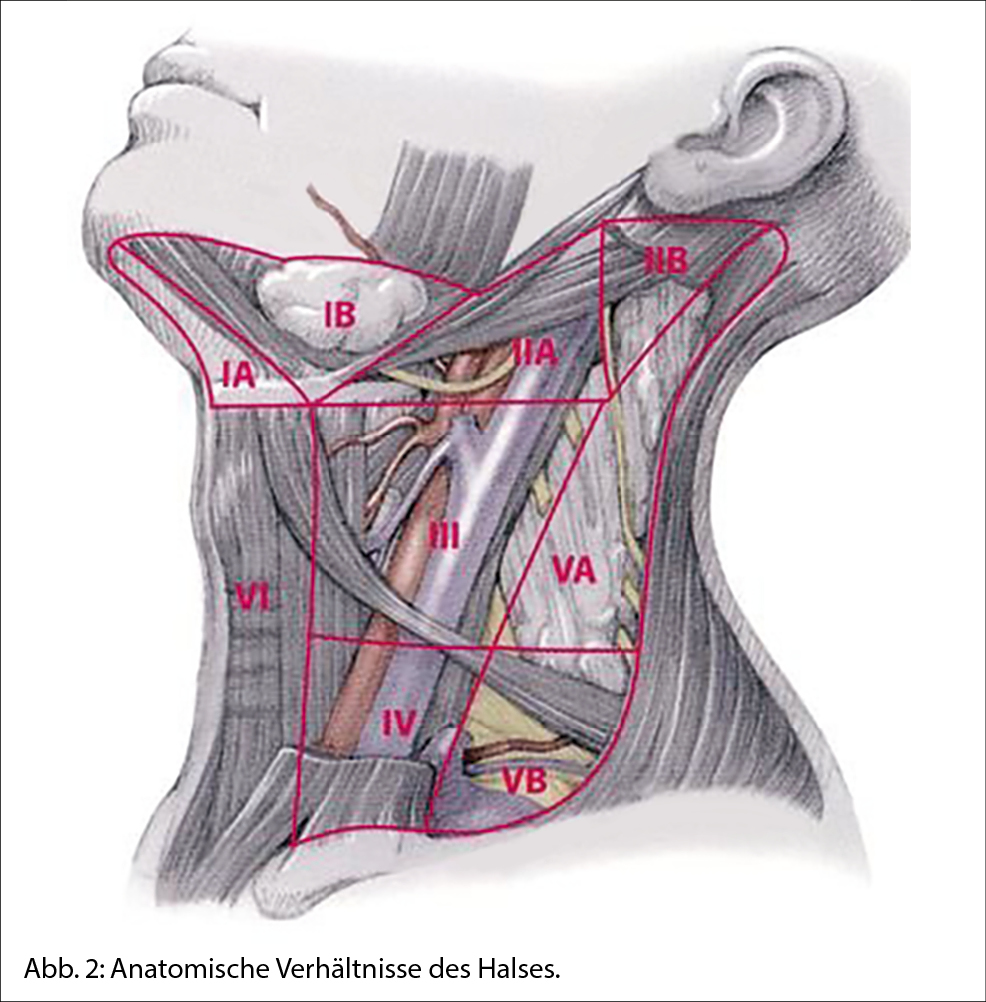
Zum weiteren Staging wurde ein MRI des Neurokraniums und ein Ganzkörper-PET/CT durchgeführt. Ersteres war unauffällig, das PET/CT zeigte eine singuläre hypermetabole subkutane Verdichtung (postoperativ) zervikal links im Übergang der Level IIa/Va. Bildmorphologisch konnte diesbezüglich nicht sicher zwischen postoperativen Veränderungen und einer residuellen Lymphknotenmetastase differenziert werden.
Somit lautete die abschliessende Diagnose: Malignes Melanom Lymphknoten zervikal links cT0, cN1b, cMO UICC Stadium IIIb. Die ergänzende Familienanamnese in Bezug auf Melanome war negativ. Eine spontane Regression des Primärtumors wird in der Literatur im einstelligen Prozentsatz beschrieben (1, 2).
Im Tumorboard wurden die therapeutischen Optionen besprochen: Aufgrund des klinischen Lymphknotenbefalls bestand ein Tumorstadium IIIb, dahingehend bestand gemäss internationalen Guidelines (deutsche S3-Leitlinie, europäische ESMO-Leitlinie, US-amerikanische NCCN-Leitlinie) die Indikation zur (modifizierten) einseitigen Lymphadenektomie (= Neck-Dissection) (3). Nach Lymphadenektomie ist im Stadium IIIb zusätzlich eine adjuvante Systemtherapie für ein Jahr empfohlen. Je nach BRAF-Status wird, um das Rezidivrisiko zu senken, eine adjuvante Immuntherapie mit einem Immuncheckpointhemmer oder alternativ (nur bei BRAF-mutiertem Melanom) eine zielgerichtete Therapie mit Dabrafenib oder Trametinib empfohlen.
Der Patientin wurde die Fertilitätssprechstunde nahegelegt, da unter besagter adjuvanter Systemtherapie eine doppelte Kontrazeption zu beachten ist und zudem die Kinderplanung der Patientin nicht abgeschlossen war.
Therapie
Die modifizierte Neck-Dissection links mit Ausräumen der Kompartimente II, III und V erfolgte zeitnah. Makroskopisch wie mikroskopisch waren die elf exzidierten Lymphknoten unauffällig. Die Patientin hatte im Anschluss als einzige Komplikation eine Hypästhesie im Bereich des Operationsgebiets.
Eine BRAF-V600E-Mutation konnte in der Aufbereitung des Gewebes nachgewiesen werden. Die Patientin wurde im Sinne eines «shared decision making» ausführlich über die Therapieoptionen aufgeklärt: Immuncheckpointinhibitor (ICI) (Pembrolizumab) versus BRAF-Hemmer (Dabrafenib) kombiniert mit Mitogen-aktiviertem Proteinkinasekinase (MEK)-Hemmer (Trametinib). Beide Therapien senken bekanntermassen das Rezidivrisiko, eine direkte Vergleichsstudie zwischen den beiden Behandlungsschemata existiert jedoch nicht.
Die ICI-Therapie mit Pembrolizumab wird intravenös als Kurzinfusion von 200 mg alle drei Wochen oder 400 mg alle sechs Wochen verabreicht im Rahmen einer ambulanten Therapie. Autoimmune Nebenwirkungen im Sinne einer Überstimulation sind möglich. Insbesondere können Exantheme, Xerosis cutis, Pruritus, Colitis mit Diarrhoe, Schmerzen, Hämatochezie, Autoimmunhepatitis, hormonelle Störungen mit Auftreten einer Hypo- oder Hyperthyreose, Hypophysitis mit Ausfall der entsprechenden Hormone, selten Diabetes mellitus, Pneumonitis mit Husten, Arthritiden vorkommen. Selten können andere autoimmune Nebenwirkungen wie Autoimmunentzündung von Herz, Nieren und Nerven auftreten. Falls eine autoimmune Nebenwirkung auftritt, ist eine rasche onkologische Beurteilung nötig und möglicherweise eine Steroidtherapie zu starten.
Die perorale Therapie mit BRAF- und MEK-Hemmern kann als Nebenwirkung Xerosis cutis, Hyperkeratose, Haarausall, Papillome, Kopfschmerzen, Fieber, Muskel- oder Gelenkschmerzen, Fatigue sowie gastrointestinale Symptome wie Nausea, Vomitus, Diarrhoe haben. Auch Augenbeschwerden wie verändertes Sehen, vermehrte Infektionen oder vermehrtes Auftreten von malignen Hauttumoren wurden beschrieben (3).
Zur möglichen Fertilitätsminderung beim Menschen gibt es bei allen Therapieformen nur begrenzt Daten. Nach Einholen der Kostengutsprache konnte mit der in diesem Fall gewählten Pembrolizumab-Therapie begonnen werden.
Ein Jahr später wurde die Therapie beendet. Die PET-CT-Bildgebung nach Abschluss der Behandlung ergab weiterhin keine neuen Metastasen oder Hinweis auf einen Primärtumor.
Diskussion
In der Hausarztpraxis sind geschwollene Lymphknoten ein regelmässiger Konsultationsgrund. Das individuelle Procedere ist breit gefächert. Von aktivem Zuwarten über laborchemische Untersuchungen bis zur chirurgischen Exzision. In welchem Falle man welchen Pfad einschlagen sollte, erfordert vorgängige Überlegungen der wahrscheinlichsten Differentialdiagnosen gemäss Anamnese und klinisch-sonographischem Befund.
Es gilt primär zu unterscheiden, ob eine Region betroffen sind oder ≥ 2. Im ersten Fall kann drei bis vier Wochen beobachtet werden und bei Persistenz die Abklärung eingeleitet werden. Als Basisdiagnostik empfiehlt sich ein Differentialblutbild und ein HIV-Test. Die Lymphknotensonographie kann bereits Aufschluss geben. Zur Zelldifferenzierung ist die komplette Exzision zielführender als eine Feinnadelpunktion. Das CT des Thorax sollte bei jungen Menschen nur mit klarer Indikation gestellt werden. Ist nach diesen Schritten die Diagnose weiterhin unklar, kann eine schrittweise Serologie auf Erreger wie CMV, EBV sowie Toxoplasmose, Bartonellen, Syphilis und ggf. Tularämie abgenommen werden (4).
Die Diagnose bei der beschriebenen Patientin war für die Behandelnden wie für die Patientin gleichermassen überraschend.
Im Besonderen war in beschriebenem Fall ein Augenmerk auf die Immuntherapie zu legen, welche bei Patientinnen im gebärfähigen Alter mit Kinderwunsch eine vorgängige Aufklärung in einer Fertilitätssprechstunde über Möglichkeiten und Risiken der Therapie bedarf. Gemäss Arzneimittelinformation von Pembrolizumab liegen keinerlei klinischen Daten zur Auswirkung auf die Fertilität vor. In tierexperimentellen Studien hatte sich gezeigt, dass die Unterbrechung des PD-L1-Signalwegs die notwendige immunologische Toleranz gegenüber dem Fetus aufheben kann und dadurch zu einer Zunahme von Aborten führt. Diese Ergebnisse deuten darauf hin, dass die Verabreichung von Pembrolizumab während der Schwangerschaft fetale Schäden und damit auch vermehrt Fehl- oder Totgeburten hervorrufen könnte (5).
Hintergrund
Die spontane Rückbildung eines Tumors wurde definiert als eine klinische und histologische Diagnose von Malignität, wobei eine therapeutische Beeinflussung zur Regression fehlt oder unzureichend ist; ein klinischer Nachweis der Rückbildung vorhanden ist; eine signifikante Nachbeobachtungszeit gegeben ist und falls möglich, eine histologische Untersuchung von Gewebestellen, wo Regression stattgefunden hat. Damit nicht zu verwechseln ist die Heilung respektive das komplette Tumorverschwinden. Die spontane Rückbildung kann als komplette oder partielle Regression beschrieben werden.
Die partielle Rückbildung eines primären Melanoms geschieht in 10–35 % der Fälle. Einige Arbeiten belegen eine partielle Regression als ungünstiger prognostischer Faktor, aber die meisten Belege deuten darauf hin, dass dies kaum Auswirkungen auf das Metastasierungsrisiko hat. Der Nachweis einer spontanen Regression einer metastasierten Erkrankung ist beschrieben als nur 0,23 % und einer verbesserten 5-Jahresüberlebensrate von 50 % versus 15,7 % bei anderen Melanomen im Stadium IV (6). Melanome sind wahrscheinlich Tumore, die sich häufiger spontan zurückbilden im Vergleich zu anderen Tumoren, ausgenommen Nierenzellkarzinome und Neuroblastome. Approximativ 4–6 % der metastasierten Melanome präsentieren sich mit einem unbekannten Primärtumor. Als Grund dafür nimmt man an, dass der Primärtumor nicht gefunden werden kann oder dieser sich spontan zurückgebildet hat. Eine alternative Theorie beschreibt das Hervorkommen des Melanoms aus capsulären Naevi der Lymphknoten.
Die spontane Regression passiert bei beiden Geschlechtern und in allen Altersklassen gleichermassen. Die komplette spontane Regression eines primären Melanoms hat eine Ratio von 2:1 für männlich:weiblich. Am häufigsten bilden sich die cutanen oder subcutanen Ablagerungen zurück, gefolgt von Lymphknotenbeteiligung.
Die signifikantesten Faktoren, welche zu einer Tumorrückbildung führen, sind ein operatives Trauma, eine Infektion oder immunologische Faktoren. Dass nach einer Bestrahlung einer Metastase eine vom bestrahlten Ort entfernte Metastase sich ebenfalls zurückbildet, wurde in mehreren Fällen berichtet. Andere, weniger gut belegte Faktoren, welche mit der spontanen Rückbildung eines metastasierten Melanoms in Verbindung gebracht wurden, sind Bluttransfusionen, BCG- und Tollwutimpfungen, endokrine Faktoren wie Schwangerschaft oder deren Abbruch, zahlreiche alternative Therapien, Diabetes, Nephrolihiasis, Prostatahypertrophie und peptische Ulcera.
Man vermutet, dass die Stimulation des Immunsystems durch verschiedene Ursachen die natürliche Abwehr von Tumoren erhöht. Die Koexistenz von progressiven und regressiven Arealen im gleichen Tumor lässt vermuten, dass das lokale «Mikroenvironment» stark involviert ist in der komplizierten Balance zwischen tumor-attackierender Host Immunantwort und der Möglichkeit des Tumors, diese zu umgehen. Die Evidenz dafür kommt hauptsächlich aus immunologischen Studien über primäre Melanome (7).
Historie
Manuskript eingereicht: 25.01.2024
Angenommen nach Revision: 19.02.2024
Gesundheitszentrum Fricktal
Spital Rheinfelden
Klinik für Innere Medizin
Riburgerstrasse 12
4310 Rheinfelden
benita.janisch@gzf.ch
Gesundheitszentrum Fricktal
Spital Rheinfelden
Klinik für Innere Medizin
Riburgerstrasse 12
4310 Rheinfelden
Es bestehen keine Interessenkonflikte.
- Lymphadenopathien sind häufig und abklärungsbedürftig, wenn eine Lymphknotenregion betroffen ist und die Schwellung > 3-4 Wochen besteht. Oft ist es sinnvoller, a priori eine Lymphknotenexzision zur Diagnostik der Feinnadelpunktion (FNP) vorzuziehen, da nicht immer eine Aussage zur Ätiologie nach FNP gemacht werden kann. Melanome können sich spontan zurückbilden, sodass bei ca. 5% von Lymphknotenmetastasen mit Nachweis von Melanomzellen kein Primarius gefunden werden kann.
1. Garbe C et al. (2003) Melanozytäre Naevi und malignes Melanom. In: Kerl H et al. (Hrsg) Histopathologie der Haut. Springer Verlag, Berlin Heidelberg New York, S. 629-649
2. https://www.altmeyers.org/de/dermatologie/melanom-unbekannter-primartumor-14584
3. https://register.awmf.org/assets/guidelines/032-024OLl_S3_Melanom-Diagnostik-Therapie-Nachsorge_2020-08.pdf
4. https://medstandards.com/view/standard/83368?search=lymphknoten&highlighted=Lymphknoten%2BLymphknoten-Palpation%2BLymphknoten-Sonographie
5. https://compendium.ch/product/1346803-keytruda-inf-konz-100-mg-4ml/mpro
6. Vennegaard Kalialis L, Drzewiecki KT, Klyver H. Spontaneous regression of metastases from melanoma: review oft the literature. Melanoma research. 2009;19:275-282
7. Bramhall RJ, Mahady K, Peach AHS. Spontaneous regression of metastatic melanoma- Clinical evidence oft he abscopal effect. EJSO.2014;40;34-41.
PRAXIS
- Vol. 113
- Ausgabe 4
- April 2024