- Seltene Diagnose für einen Patienten mit Schulterschmerzen: reifes Teratom des Mediastinums
Dank gewissenhafter Abklärung in der hausärztlichen Sprechstunde und Zuweisung zu einer zielführenden Diagnostik konnte der gutartige Thoraxtumor einer kurativen Resektion zugeführt werden. Obwohl die radiologischen und laborchemischen Untersuchungen die gutartige Entität eines reifen Teratoms bei einem jungen, postpubertalen Mann hochwahrscheinlich machten, ist die Klinik meist unspezifisch und erlaubt keine Zuordnung, sodass auch hier die histo-pathologische Aufarbeitung und Resektion zwingend notwendig waren. Dies, um die diagnostische Sicherheit über die Dignität zu erhalten und die leitlinien- und zeitgerechte Therapie zu ermöglichen.
Schlüsselwörter: Benigner Lungentumor, Teratom, Keimzelltumor, interdisziplinäre Zusammenarbeit, leitliniengerechte Therapie
A Rare Diagnosis for a Patient with Shoulder Pain – Mature Teratoma of the Mediastinum
Thanks to a conscientious work-up in the general practitioner‘s office and referral to goal-directed diagnostics, the benign thoracic tumor could be submitted to curative resection. Although the radiological and laboratory examinations made the benign entity of a mature teratoma in a young, postpubertal male highly probable, the clinic is usually nonspecific and makes classification difficult, so that a histo-pathological work-up and resection were mandatory in this case in order to obtain diagnostic certainty about the dignity and to allow for timely therapy according to the guidelines.
Keywords: Benign lung tumor, teratoma, germ cell tumor, interdisciplinary collaboration, guideline-based therapy
Fallvorstellung
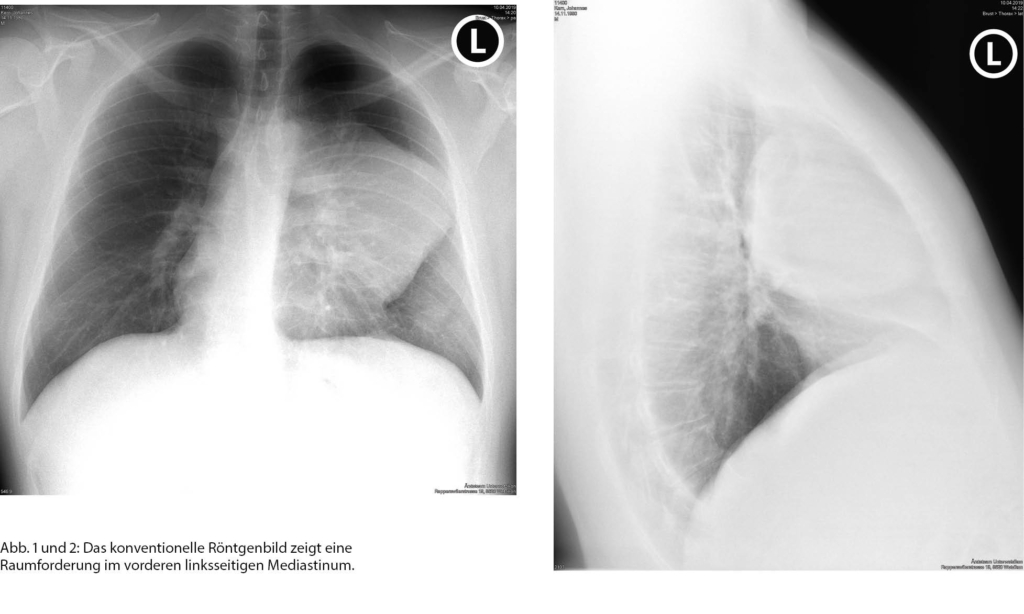
Ein 39-jähriger, nichtrauchender Mann mit einer 2-wöchigen Anamnese von zunächst in den Nacken ausstrahlenden Schulterschmerzen und im Verlauf sich verlagernder Schmerzprojektion in den vorderen oberen Brustbereich links sowie leichter Einschränkung bei vertieftem Atmen wurde initial hausärztlich abgeklärt. Bei klinisch gutem Allgemeinzustand zeigten sich auskultatorisch wenig Rasselgeräusche im linken Unterfeld und im konventionellen Thorax-Röntgenbild (Abb. 1 und 2) eine grosse Raumforderung im vorderen, linksseitigen Mediastinum. Laborchemisch fanden sich ein leicht erhöhtes CRP (33 mg/l) ohne Leukozytose sowie eine leicht erhöhte Blutsenkung.
In diesem Fall konnte bereits aus der Tumorlokalisation im vorderen Mediastinum die radiologische Differenzialdiagnose in diesem Bereich auf die 5T: teratoma, thymoma, thyroidea, terrible lymphoma, tortuous vessels) eingegrenzt werden (Tabelle 1).
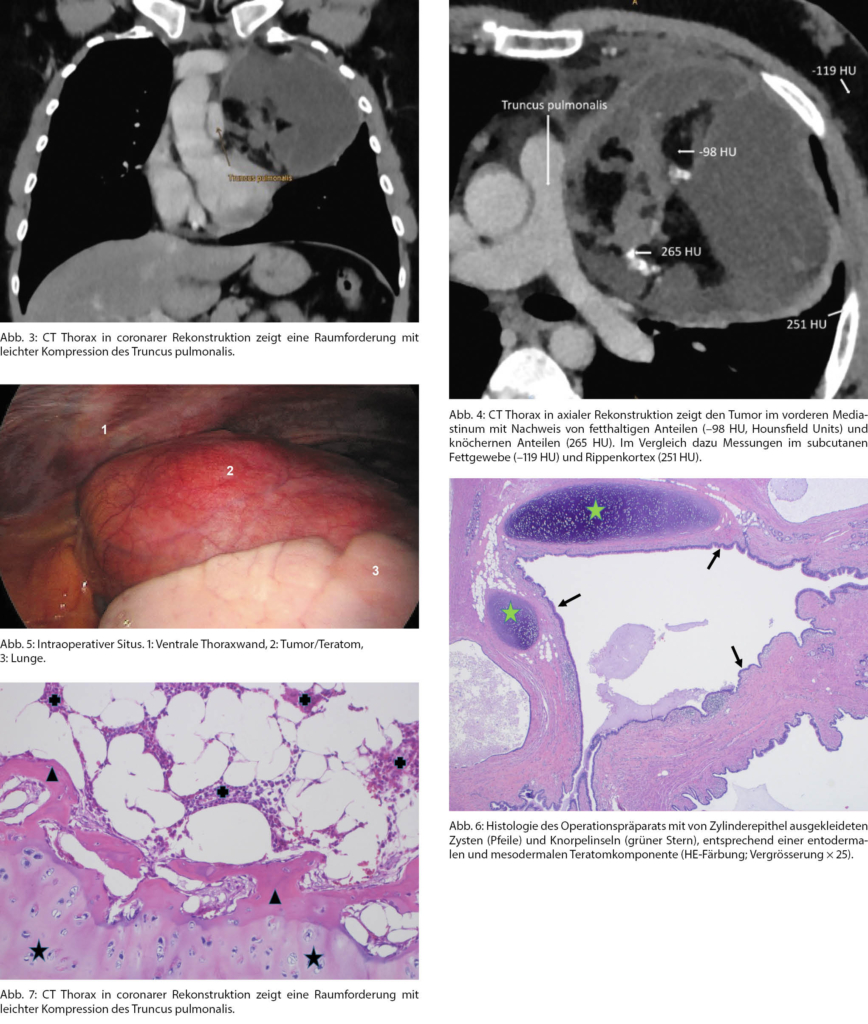
Durch den Pneumologen wurde zudem sonografisch die normale Zwerchfellbeweglichkeit und lungenfunktionell die leichte Restriktion ausgewiesen. Im CT Thorax (Abb. 3 und 4) fand sich ein Tumor mit elf Zentimetern Durchmesser im vorderen oberen und linksseitigen Mediastinum ohne Hinweis auf Infiltration, ohne Lymphadenopathie, Arrosion der Rippen oder Osteolysen, jedoch mit Nachweis von Fettanteilen und Verknöcherungen. In der Zusammenschau der Befunde wurde der Verdacht auf ein Teratom gestellt. Das Labor ergab weiterhin leicht erhöhte Entzündungsparameter, aber Normwerte für die Tumormarker Beta-HCG und das Alpha-Fetoprotein.
Nach Zuweisung an die Thoraxchirurgie wurde mittels anterolateraler Thorakotomie links eine Tumorektomie (Abb. 5) mit R0-Resektion durchgeführt und histologisch Keimblätter bestätigt (Abb. 6 und 7). Gemäss Tumorboardbeschluss erfolgte die klinische und CT-Verlaufskontrolle nach sechs Monaten. Dort zeigte sich klinisch die Remission der thorakalen Beschwerden und eine Verbesserung der respiratorischen Einschränkung. Computertomografisch fand sich ein regelrechter postoperativer Situs ohne Hinweise für ein Lokalrezidiv oder Metastasen.
Diskussion
Teratom
Das Teratom als häufigster Keimzelltumor und verantwortlich für 7–9 % der Mediastinaltumoren ist im Kindesalter meist gutartig. Die Symptomatik ist meist unspezifisch und bleibt durch das langsame Wachstum oft lange aus. Unspezifische Symptome sind thorakale Schmerzen, Husten, Dyspnoe oder Heiserkeit, wobei ein Drittel der Patientinnen und Patienten asymptomatisch bleibt. Weitere Symptomatik kann sich aufgrund des Grössenwachstums als obere Einflusstauung, Horner-Symptomatik oder Pneumothorax manifestieren. Bei Tumorruptur finden sich teils Pleuraergüsse, eine akute Mediastinitis, ein Empyem oder eine Perikardtamponade. Im Fall einer Fistelbildung mit der Trachea können gar Teratombestandteile (Haare, Talgmaterial) abgehustet werden. Auch Pankreasgewebe ist oft enthalten und kann über einen Hyperinsulinismus eine Hypoglykämie bewirken. Die Tumormarker sind nicht erhöht [2]. Die radiologischen Eigenschaften erlauben oft eine zuverlässige präoperative Diagnose. Eine Resektion sollte aufgrund des potenziellen Entartungsrisikos und der möglichen Beeinträchtigung naheliegender Strukturen immer erfolgen. Obwohl reife Teratome (ausdifferenzierte Gewebselemente) in der Regel benigne sind, können diese gerade bei erwachsenen Männern (bei Frauen 95 % reife Teratome, bei Männern häufiger unreife Teratome) entarten und metastasieren. Eine histologische Untersuchung ist zur Unterscheidung zwischen reaktiven, gutartigen und reifen Teratomen versus unreifen Teratomen mit Metastasierungspotenzial unerlässlich. Es besteht eine altersabhängige Wahrscheinlichkeit der Dignität, und auch wenn im Kindesalter meist noch benigne Befunde auftreten, kann postpubertal eine Malignität vorliegen und im Erwachsenenalter muss auch eine Metastasierung ausgeschlossen werden.
Teratome enthalten Gewebe aus mindestens zwei Keimblättern (Ekto-, Meso- oder Endoderm) und die reifen Teratome ausdifferenziertes Gewebe (Haut, Hautanhangsgebilde, Bronchial- oder Gastrointestinalschleimhaut, Hirngewebe, glatte Muskulatur, Fettgewebe, Pankreasgewebe). Unreife Teratome enthalten unreifes Gewebe. Ein monodermales Teratom (Dermoidzyste) ist selten.
Immunhistochemisch sind embryonale Stammzellmarker (z.B. OCT3/4 (octamer binding transcription factor), SALL4 (Sal-like protein 4), LIN28 (Lin-28 homolog A) negativ, wobei je nach Gewebe typische Immunmarker vorhanden sein können.
Unterschiede zu den anderen Keimzelltumoren sind: das zeitliche Auftreten sowohl prä- als auch postpubertal, die Tatsache, dass auch postpubertale Frauen betroffen sein können, der fehlende Nachweis des bei Keimelltumoren häufig gefundenen Isochromosoms 12p und die Möglichkeit einer kurativen Resektion bei Vorliegen eines reifen Teratoms.
Gemäss S3-Leitlinie [3] ist bei histologisch eindeutig reifem Teratom und normwertigen Serumtumormarkern die Resektion, bei erhöhten Tumormarkern jedoch analog zu den gonadalen Keimzelltumoren die Cisplatin-basierte Polychemotherapie mit folgender Residualtumorresektion (RTR) indiziert.
Primordiale Keimzellen
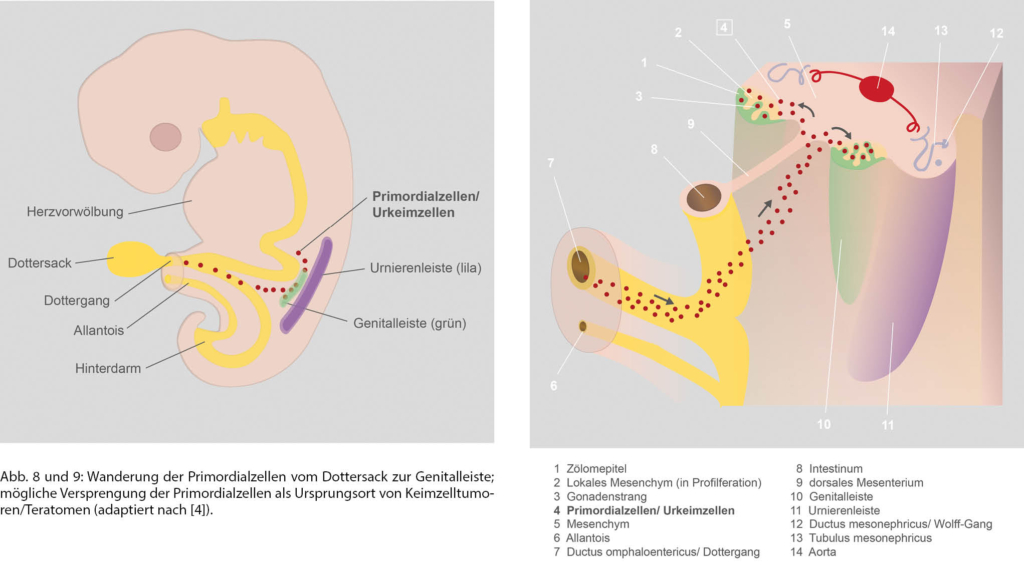
Primordialzellen (= PGC primordial germ cells, Urkeimzellen) sind die Vorläufer der Keimzellen (= Gameten, Geschlechtszellen, Spermien oder Eizellen). Unter Abfaltung des Embryos sowie chemotaktischer Reize wandern sie amöboid von der Dottersackwand über die Gastrointestinalwand und das dorsale Mesenterium zur Genitalleiste [4]. Die Genitalleisten entwickeln sich zu Keimdrüsen/Gonaden (Hoden, Ovar). Teratome entstehen in der 4.–6. Woche der Embryogenese im Mediastinum, aber auch in anderen Lokalisationen durch versprengte Primordialzellen auf ihrem Weg aus dem Dottersack (Abb. 8 und 9).
Keimzelltumoren
Entsprechend der Wanderung der Primordialzellen finden sich Keimzelltumoren [5] ausserhalb der Gonaden am häufigsten im Mediastinum und sind zu etwa einem Fünftel für Mediastinaltumoren verantwortlich [2]. Histologisch werden Seminome (ausgehend von Spermatogonien: Stammzellen im Keimepithel des Hodens) von den nicht-seminomatösen Keimzelltumoren (Embryonales Karzinom, Teratom, Dottersacktumor, Chrorionkarzinom: hier häufig Mischformen) unterschieden. Bei Männern manifestieren sich Keimzelltumoren zu 95 % in den Hoden und circa 5 % extragonadal. Gemäss Leitlinien [3] unterscheiden sich Seminome und Nichtseminome wesentlich im Risikoprofil, der Therapie sowie der Nachsorge, und wichtige prognostische Faktoren konnten detektiert werden. Die konsequente Einhaltung der stadiengerechten Therapiekonzepte verspricht eine bis 90 %-ige Heilungschance. Eine Assoziation mediastinaler Keimzelltumoren mit somatischen Karzinomen und des mediastinalen Dottersacktumors mit hämatologischen Neoplasien (z.B. Myelodysplasien, Leukämien) ist zudem bekannt.
Die anatomische und altersabhängige Zuordnung kann die Differenzialdiagnose erheblich eingrenzen (z.B. präpubertale Kinder: mediastinale Teratome und Dottersacktumoren. Postpubertale Frauen: meist gutartige reife Teratome. Postpubertale Männer: gonadale Keimzelltumoren).
Auch eine immunhistochemische Subtypisierung wird der Pathologe zur korrekten Zuordnung und zum Staging der Keimzelltumoren vornehmen, was relevanten Einfluss auf die leitliniengerechte Behandlung und Prognose hat.
Benigne Thorax- und Lungentumoren
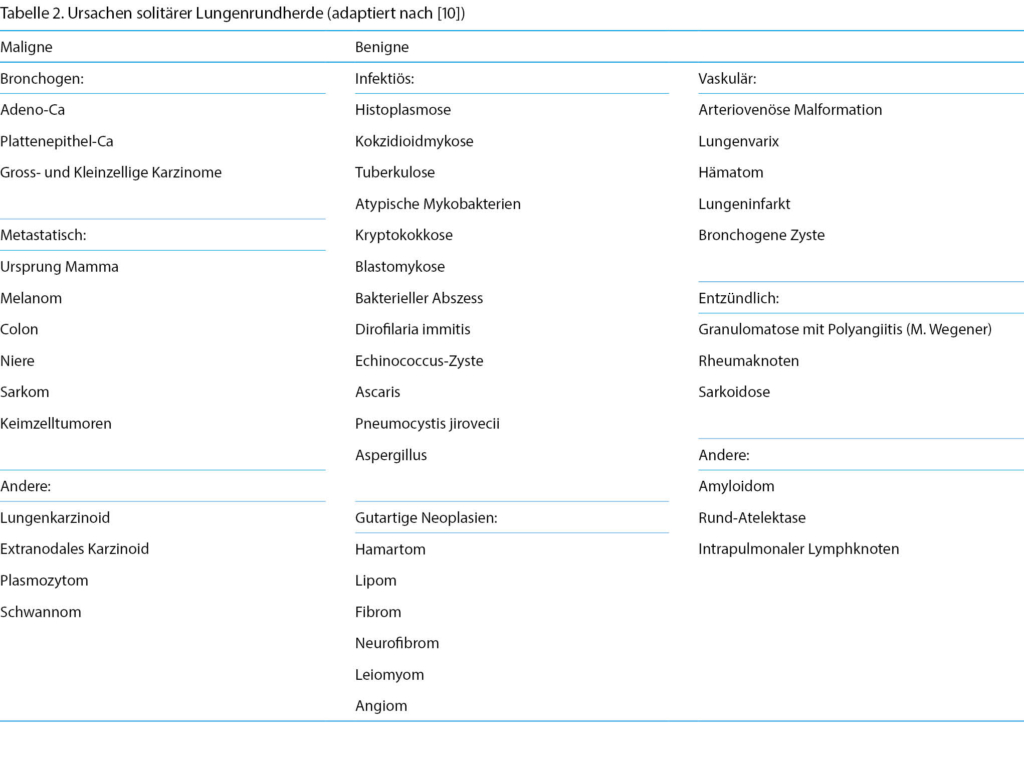
Unter den meist radiologisch/zufallsbefundlich entdeckten Lungenrundherden finden sich nach Resektion und pathologischer Aufarbeitung ca. 50 % gutartige Befunde. Die inzidentellen Lungenrundherde (Röntgen, CT) sind oft wenig symptomatisch. Radiologisch benigne, aber keineswegs verlässliche Zeichen sind die glatte Oberfläche, eine Stielbildung, ein erhöhter Kalkanteil, ein Fettgewebsanteil, ein stabiler Verlauf über die Zeit sowie das Fehlen von Retraktion, Spikulae, Gefässnachweis oder dickwandigen Zysten.
Unter den Karzinomen aber hat das Lungenkarzinom [6] mittlerweile die höchste Mortalität [7], wobei auch Nie-Raucher (< 100 Zigaretten auf Lebenszeit) zu rund 25 % betroffen sind. Entsprechend bedürfen solide und subsolide, solitäre (Tabelle 2) oder multiple Lungenrundherde mindestens ab sechs Millimeter im Durchmesser [8] gemäss Risikoeinschätzung einer mindestens leitliniengerechten Beobachtung oder histologischen Sicherung [9].
Als Differenzialdiagnose zum Bronchuskarzinom muss an eine pulmonale Metastase, eine chronische Pneumonie oder auch einen benignen Lungentumor gedacht werden. Benigne Lungentumoren gehen von Bronchien oder Lungenparenchym aus, und es fehlt eine Destruktion, Invasion oder Metastasierung [5, 11]. Unter den eigentlichen Lungentumoren sind die benignen leider selten und nur für zirca 1–3 % verantwortlich.
Histologisch erfolgt die Einteilung der benignen Lungentumoren nach dem Ursprungsgewebe (epithelial: Papillome, Adenome. Mesenchymal: v.a. Chondrome. Mischformen und nicht zuordenbare Tumoren), wovon das Hamartom am häufigsten ist. Diagnostisch ist die minimalinvasive Thoraxchirurgie das Mittel der Wahl. Ein abweichendes Vorgehen ist nur bei Grössenkonstanz über zwei Jahre, sehr kleinem Durchmesser und sichergestellter Verlaufsbeobachtung mittels CT Thorax gerechtfertigt.
Bezüglich Procedere wird entschieden über eine Kontrolluntersuchung versus Resektion (interventionell, thorakoskopisch, chirurgisch offen). Obwohl zystische Läsionen radiologisch eher benignen Befunden entsprechen, muss beachtet werden, dass auch Tumoren und Lymphome zystisch degenerieren können (z.B. Thymom, M. Hodgkin/ Lymphome, Keimzelltumoren, neurogene Tumoren, mediastinale Lymphknotenmetastasen).
Generell stellt die seltene Entität eines gutartigen Lungentumors eine nicht weniger grosse Herausforderung dar hinsichtlich Abgrenzung zu malignen Befunden und bezüglich Behandlungsmanagement. Allein schon ein Grössenwachstum mit Kompression oder Verlagerungen benachbarter Strukturen kann eine diagnostische und ggf. kurative Resektion notwendig machen.
FMH Pneumologie und FMH Allg. Innere Medizin
Zürcher RehaZentren Klinik Wald
Faltigbergstrasse 7, 8636 Wald
patrick.heeb@zhreha.ch
Es bestehen keine Interessenskonflikte.
Historie
Manuskript eingereicht: 05.12.2021
Nach Revision angenommen: 14.02.2023
Ethische Richtlinien
Die Publikation erfolgt mit dem Einverständnis des Patienten.
ORCID
Patrick Heeb
https://orcid.org/0000-0003-2034-8939
Corina Dommann-Scherrer
https://orcid.org/0000-0002-8262-1155
Das Wichtigste für die Hausarzt-Praxis
Dank der gewissenhaften Abklärung bereits in der hausärztlichen Sprechstunde und der Zuweisung zu einer zielführenden Diagnostik konnte der in diesem Fall gutartige Thoraxtumor einer kurativen Resektion zugeführt werden.
Obwohl in diesem Fall die radiologischen und laborchemischen Untersuchungen die gutartige Entität eines reifen Teratoms bei einem jungen, postpubertalen Mann hochwahrscheinlich machten, ist die Klinik meist unspezifisch und erlaubt keine Zuordnung, sodass auch hier die histopathologische Aufarbeitung und Resektion zwingend notwendig waren. Dies, um die diagnostische Sicherheit über die Dignität zu erhalten und die leitlinien- und zeitgerechte Therapie zu ermöglichen.
1. Wormanns D. Thoraxdiagnostik. Stuttgart; Thieme: 2017, 189.
2. Bremmer F, Ströbel P. Mediastinale Keimzelltumoren. Pathologe. 2016; 37(5):441–448.
3. S3-Leitlinie Diagnostik, Therapie und Nachsorge der Keimzelltumoren des Hodens. https://www.awmf.org/uploads/tx_sz leitlinien/043-049OLl_S3_Keimzelltumoren-Hoden-Diagno stik-Therapie-Nachsorge_2020–03.pdf
4. Online Embryologiekurs für Studierende der Medizin. https:// www.embryology.ch/allemand/ugenital/diffmorpho01.html#; Universitäten Fribourg, Lausanne, Bern; 2021. letzter Zugriff: 19.02.2023.
5. Mason RC, Murray JF, Nadel JA, Gotway M. Murray. Nadel’s Textbook of Respiratory Medicine (Kindle-Positionen1307 62-130763). Elsevier Health Sciences, Kapitel 56.
6. Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol. 2015;10(9):1243–1260.
7. Grippi, MA. Fishman›s Pulmonary Diseases and Disorders, 5th edition. New York; McGraw-Hill Education: 2015. (Kindle-Version), Grippi, Kap. 108.
8. MacMahon H, Naidich DP, Goo JM, et al. Guidelines for Management of Incidental Pulmonary Nodules Detected on CT Images: From the Fleischner Society 2017. Radiology. 2017; 284(1):228–243.
9. S3-Leitlinie Lungenkarzinom (Langversion 1.0 Februar 2018). Available from: https://www.awmf.org/uploads/tx_szleitlinien/ 020-007OL_l_S3_Lungenkarzinom_2018-03.pdf
10. UpToDate, Diagnostic evaluation of the incidental pulmonary nodule, April 2021.
11. Borczuk AC. Benign tumors and tumorlike conditions of the lung. Arch Pathol Lab Med. 2008;132(7):1133–1148.
PRAXIS
- Vol. 112
- Ausgabe 9
- Juli 2023