- Seltene Nebenwirkung der thyreostatischen Therapie
Wir berichten über eine Patientin mit Morbus Basedow, welche wegen typischen Nebenwirkungen auf Carbimazol auf eine Behandlung mit Propylthiouracil umgestellt wurde. Nach 14 Monaten Behandlung mit Propylthiouracil entwickelte sie eine kutane limitierte ANCA-assoziierte Vaskulitis, was eine seltene Nebenwirkung darstellt. Das sofortige Absetzen von Propylthiouracil und eine topische antientzündliche Behandlung führten zur vollständigen Rückbildung der Hautläsionen.
Schlüsselwörter: Hyperthyreose, Morbus Basedow, Carbimazol, Propylthiouracil, ANCA-assoziierte Vaskulitis
Hintergrund
Carbimazol (CMZ) ist die Erstlinientherapie der meisten Patienten mit Morbus Basedow. Propylthiouracil (PTU) wird häufig im ersten Trimenon der Schwangerschaft und bei Nebenwirkungen auf CMZ eingesetzt. Zu den schweren, aber selteneren Nebenwirkungen gehört unter anderem das Auftreten von einer Antineutrophilen zytoplasmatischen Antikörper (ANCA)-assoziierten Vaskulitis. Sie ist klinisch einer primären ANCA-Vaskulitis sehr ähnlich, hat aber meist einen weniger schwerwiegenden Verlauf. Das frühe Absetzen von PTU ist nebst dem Screening auf systemische Manifestationen therapeutisch und prognostisch essenziell. Sowohl für Endokrinolog/-innen, aber auch für die in die Weiterbetreuung involvierten Hausärzt/-innen und Internist/-innen ist das Wissen über seltene Nebenwirkungen von Thyreostatika entscheidend.
Fallvorstellung
Eine 51-jährige Frau präsentierte sich mit Hitzewallungen, Haarausfall, Nervosität, Zittern und Konzentrationsschwäche. Nach der initialen Verdachtsdiagnose eines klimakterischen Syndroms zeigte die hausärztliche Labordiagnostik eine manifeste Hyperthyreose mit einem supprimierten TSH von < 0.001 mlU/l (Referenzbereich 0.35–4,94 mlU/l) und erhöhtem fT4 von 21.4 pmol/l (Referenzbereich 9.01– 19.05 pmol/l) und fT3 von 10.5 pmol/l (Referenzbereich 2.43–6.0 pmol/l). Die ergänzend bestimmten Autoantikörper (TRAK 21.55 U/l, Referenzbereich: < 1.75 U/l) waren diagnostisch für das Vorliegen eines Morbus Basedow (Tab. 1). Klinisch begann der Hausarzt mit 35 mg Carbimazol (CMZ, Neo-Mercazole®) täglich, entschied sich gegen eine zusätzliche symptomatische Behandlung mit einem nicht selektiven Betablocker und wies die Patientin für eine ergänzende Schilddrüsensonographie den endokrinologischen Kollegen zu.
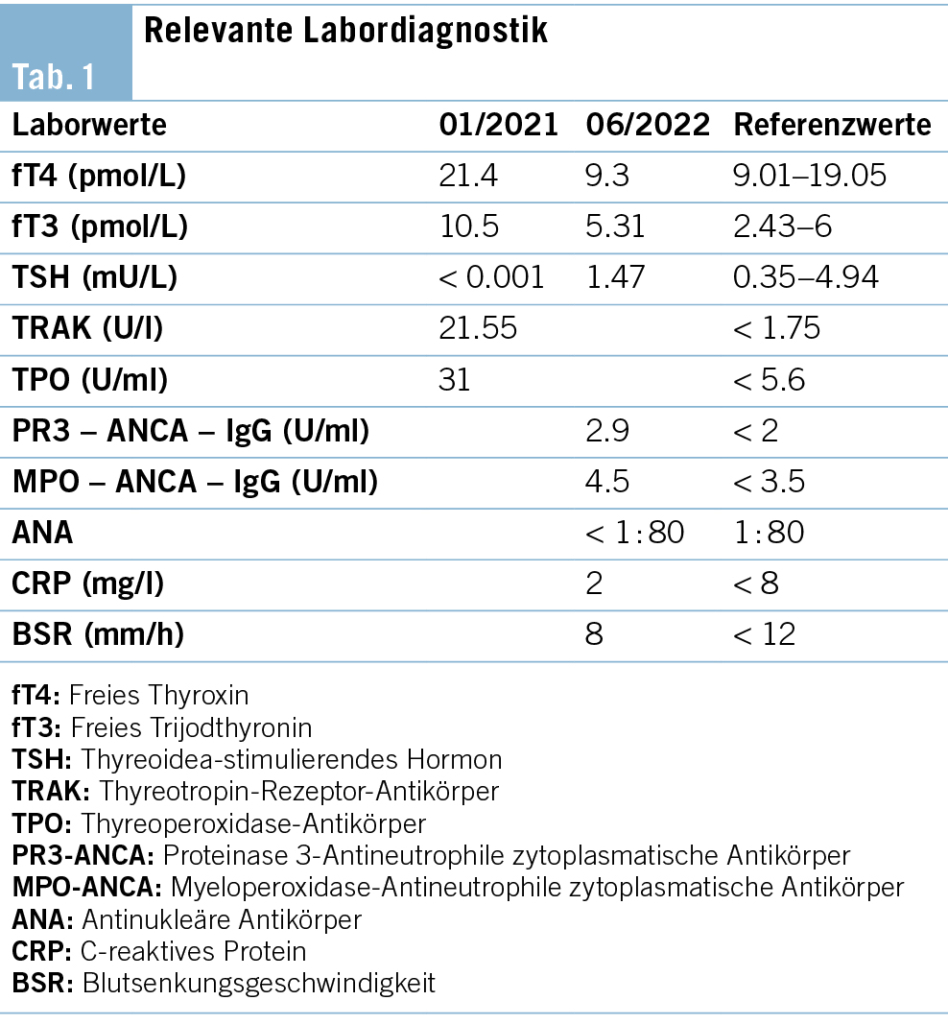
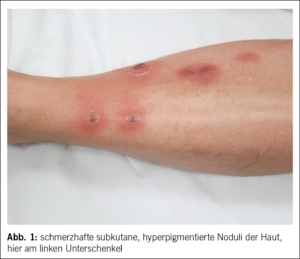
Unter der Medikation entwickelte die Patientin rasch unerwünschte Nebenwirkungen mit einer Stomatitis, Kopfschmerzen sowie Arthralgien, was zu einem Therapiewechsel auf Propylthiouracil (PTU, Propycil® 300 mg/Tag) führte. PTU wurde deutlich besser vertragen und anhand der regelmässigen Laborkontrollen (bei supprimiertem TSH initial anhand des fT4) gelang es, eine baldige Euthyreose und Dosisreduktion zu erreichen. 14 Monate später bemerkte die Patientin an der unteren Extremität neue schmerzhafte, subkutane, hyperpigmentierte Noduli, zunächst am linken Schienbein und später auch an der rechten Wade.
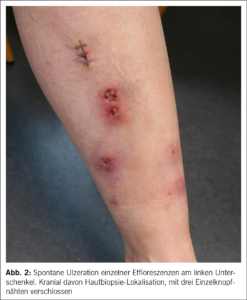
Im Verlauf entwickelten sich die Noduli zu seropurulent gefüllten Bullae, die schliesslich spontan ulzerierten und schmerzhafte Wunden hinterliessen (Abb. 1, 2). Es erfolgte eine dermatologische Zuweisung zur Mitbeurteilung. Aufgrund des klinischen Befundes wurde differenzialdiagnostisch primär an eine infektiöse Pannikulitis mit sporotrichoider Verteilung gedacht. Als Differenzialdiagnosen kamen eine tiefe Mykose, Leishmaniose, Hauttuberkulose oder auch ein Lymphom infrage. Die mikrobiologische Diagnostik einer frisch eröffneten, purulent gefüllten Bulla wies kein Bakterien- oder Pilzwachstum nach und sowohl die Kultur als auch die PCR für Mykobakterien blieb negativ. Histologisch liess sich in der Hautbiopsie eine granulomatöse Dermatitis mit septaler und lobulärer Pannikulitis objektivieren.
Aufgrund dessen und wegen der ausführlich erhobenen Medikamentenanamnese, welche nebst PTU lediglich ein NSAR beinhaltete, das die Patientin wegen den schmerzhaften Hautläsionen einnahm, wurde eine medikamentöse Nebenwirkung näher in Betracht gezogen und eine serologische Testung der Antineutrophilen zytoplasmatischen Antikörper (ANCA) angeordnet. Die Resultate ergaben sowohl einen erhöhten Titer für PR3-ANCA als auch für MPO-ANCA, was in der Zusammenschau der Befunde zur Verdachtsdiagnose einer PTU-induzierten, ANCA-assoziierten Vaskulitis führte. Entsprechend musste nebst einem umgehenden Sistieren der Therapie ein differenziertes Screening hinsichtlich systemischer Manifestationen der Vaskulitis gesucht werden: Untersuchung inkl. Neurostatus, erweiterte Labordiagnostik mit u.a. Blutbild, Entzündungs-, Nieren- und Leberparameter, Urinsediment sowie eine radiologische Diagnostik hinsichtlich einer Lungenbeteiligung. Bei fehlenden Hinweisen auf eine systemische Manifestation konnte schlussendlich von einer kutan limitierten Vaskulitis ausgegangen werden, sodass die Behandlung topisch und nicht systemisch eingeleitet wurde: Clobetasolpropionat (Dermovate®) wurde während zwei Wochen täglich auf die entzündlichen Läsionen aufgetragen, bei gutem Ansprechen dann schrittweise reduziert und auf ein topisches Tacrolimus (Protopic® 0.1 %) gewechselt. Zudem wurde zum Schutz vor einer bakteriellen Superinfektion antiseptische Externa angewendet (Triclosan Softcreme).
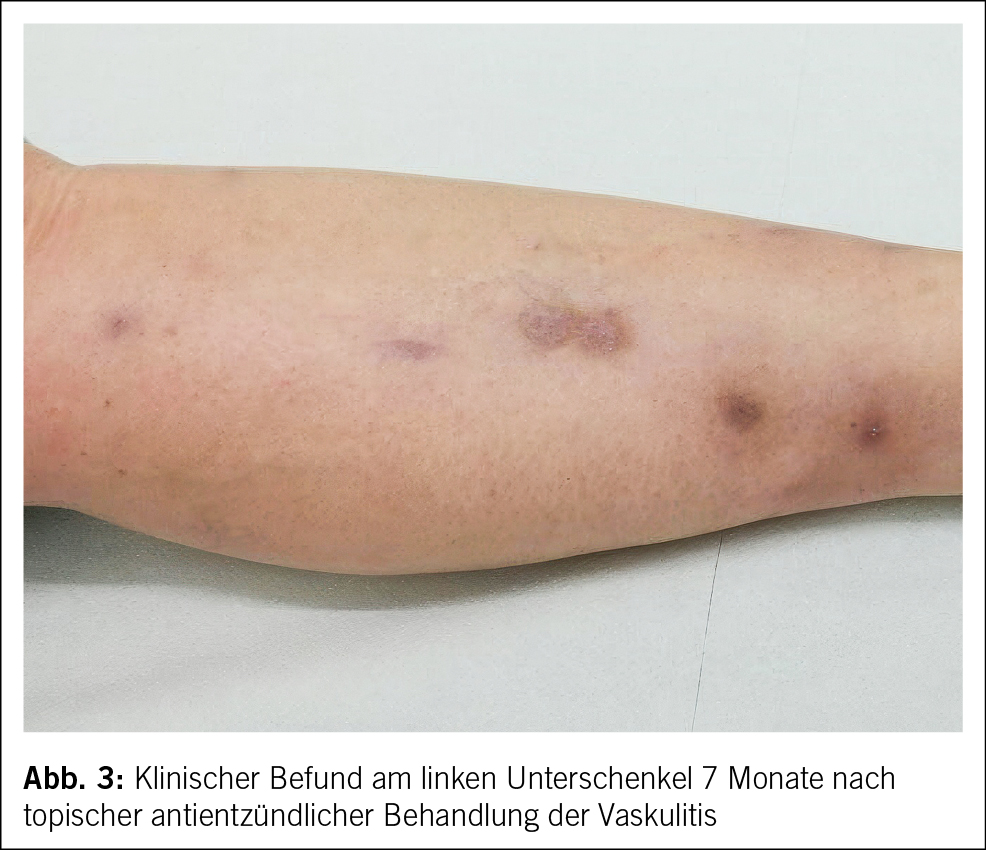
Nach einer Behandlungsdauer von 7 Monaten konnte eine deutliche Rückbildung der entzündlichen Hautläsionen, jedoch mit Narbenbildung, beobachtet werden (Abb. 3).
Hinsichtlich des Morbus Basedow wurde der Patientin wegen der Nebenwirkung auf beide gängigen thyreostatischen Medikamente zu einer definitiven Therapie (Radiojod-Behandlung oder Thyroidektomie) geraten, was sie jedoch ablehnte und sich für einen erneuten Versuch mit dem initialen verwendeten CMZ entschied. Dies wurde in der Folge problemlos vertragen. Nach weiteren 10 Monaten Therapie gelang es schlussendlich, die thyreostatische Behandlung nach insgesamt 14 Monaten dokumentierter Euthyreose unter Therapie erfolgreich abzusetzen, und die Patientin blieb euthyreot.
Diskussion
Carbimazol (CMZ, Neo-Mercazole®) und Propylthiouracil (PTU, Propycil®) sind die zwei in der Schweiz verfügbaren Thyreostatika und gehören beide chemisch zu der Gruppe der Thionamide. CMZ ist das Prodrug von Methimazol (MMZ), was beispielsweise in den USA anstatt CMZ verwendet wird. CMZ und MMZ haben im Vergleich zu PTU u.a. wichtige Vorteile hinsichtlich der Halbwertszeit, sodass es einmal täglich eingenommen werden kann, wohingegen PTU auf drei Einnahmen pro Tag verteilt werden muss. Zudem sind unter PTU schwerwiegendere Verläufe von Hepatotoxizität, in äusserst seltenen Fällen gar bis hin zum Leberversagen beschrieben.
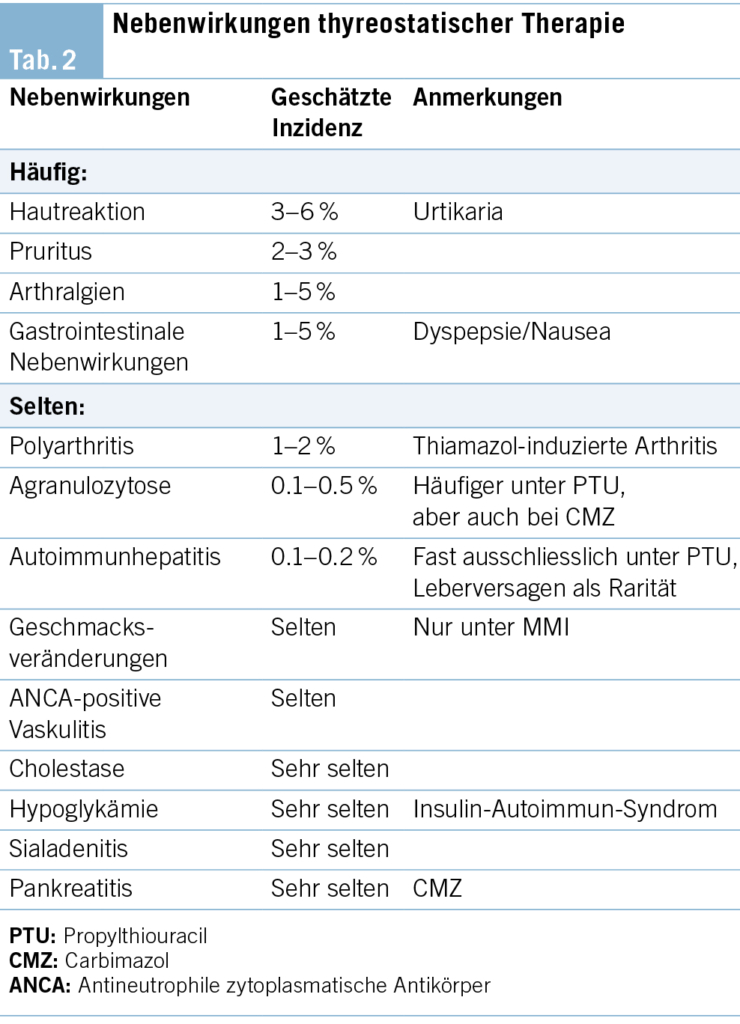
Infolgedessen wird es praktisch nur noch bei Unverträglichkeit gegenüber CMZ oder während einer Therapie im 1. Trimenon angewendet. Dort liegt der Vorteil gegenüber CMZ in den weniger schwerwiegenden, embryonalen Fehlbildungen, wobei beide Präparate potenziell teratogen sind. Zu den häufigeren und eher milden Nebenwirkungen beider Präparate zählen Hautreaktionen mit Urtikaria und makulöses Exanthem (4–6 %), Arthralgien (1–5 %), gastrointestinale Beschwerden mit Dyspepsie und Nausea (1–5 %) (1). Schwere Nebenwirkungen unter thyreostatischer Therapie sind zum Glück selten, beinhalten aber das Auftreten von Pankreatitiden (CMZ), Hepatotoxizität, eine ANCA-assoziierte Vaskulitis (PTU) oder die den meisten Klinikern bekannte Agranulozytose (CMZ oder PTU) (Tab. 2) (1). Die Prävalenz letzterer liegt gemäss Literatur bei rund 0.1–0.5 %, und es sind Kreuzreaktionen beschrieben. Thyreostatika-induzierte Agranulozytosen treten in den allermeisten Fällen innerhalb der ersten rund drei Monate der Therapie auf, sodass auch von einer Dosisabhängigkeit ausgegangen wird (zumindest für CMZ).
Interessanterweise konnten genetische Analysen das Risiko einer Agranulozytose mit gewissen HLA-Typen in Verbindung bringen, was aber aufgrund der Seltenheit der Nebenwirkung nicht im klinischen Alltag vor einem Therapiebeginn untersucht wird (3). Umso mehr müssen Betroffene vor Beginn der Therapie durch die Behandlungsperson eingehend über diese Nebenwirkung aufgeklärt werden und wissen, dass sie im Falle einer akuten febrilen Erkrankung, häufig mit Pharyngitis begleitet, das Präparat absetzen und sich zeitnah für eine Blutbild-kontrolle melden müssen.
Von einer generellen laborchemischen Überwachung der Patientinnen und Patienten unter Therapie raten wichtige internationale Guidelines ab (2, 4). Erhöhte Transaminasen und insbesondere eine erhöhte Gamma-GT ist ein relativ häufiger Befund einer Hyperthyreose bei Morbus Basedow und daher von einer medikamentösen Nebenwirkung durch Thyreostatika abzugrenzen. Sie normalisieren sich unter der Behandlung und dem Erreichen einer Euthyreose. In diesen Fällen sollten die Leberparameter zusammen mit der Schilddrüsenfunktion initial regelmässig kontrolliert werden, um eine Abgrenzung hinsichtlich einer Hepatotoxizität durch die Therapie zu ermöglichen (6).
Die in diesem Fall beschriebene ANCA-assoziierte Vaskulitis stellt eine überaus seltene Nebenwirkung einer thyreostatischen Therapie mit Thionamiden dar und ist fast ausschliesslich für PTU beschrieben. In der Regel kam es – wie in unserem Fall – deutlich verzögert (mehrere Monate bis sogar Jahre nach Behandlungsbeginn) zum Auftreten, sodass der Zusammenhang bei der initialen Beurteilung primär unterschätzt werden kann.
Die Diagnosestellung erfolgt bei passender Klinik und gegebenenfalls unterstützendem Befund in der Histologie einer biopsierten Läsion mittels Nachweis von erhöhten ANCA-Titern.
Anders als bei anderen ANCA-assoziierten Vaskulitiden scheint es durch PTU zu einer unspezifischen Aktivierung mehrerer ANCA zu kommen, sodass sowohl der Nachweis von Antikörpern gegen Myoloperoxidase und Proteinase-3 beschrieben ist. Ein generelles laborchemisches Screening während einer Therapie mit PTU wird nicht empfohlen, da erhöhte ANCA-Titer bei bis zu 60 % asymptomatischer Patienten im Verlauf gefunden wurden und damit der positive prädiktive Wert sehr limitiert ist (5). Entscheidend bei der Diagnosestellung ist die Diagnostik hinsichtlich systemischer Manifestationen der Vaskulitis. Bei Hinweisen auf beispielsweise einer pulmonalen oder renalen Beteiligung wurde in den in der Literatur beschriebenen Fällen nebst dem Absetzen des auslösenden Agens stets mit einer hoch dosierten, systemischen Glukokortikoidtherapie und im Verlauf allenfalls anderen Immunsuppressiva wie Cyclophosphamid, Azathioprin, Mycophenolat mofetil behandelt. Bei einer kutan limitierten Erkrankung kann wie im geschilderten Fall eine topische antientzündliche Behandlung ausreichen.
Hinsichtlich der thyreostatischen Therapie bestätigt dieser Fall die verfügbare Datenlage, dass ein Wechsel auf CMZ möglich ist und keine Kreuzreaktionen im Sinne eines persistierenden Triggers für die Vaskulitis resultiert.
Schlussfolgerung
Zusammenfassend illustriert dieser Fall eine schwerwiegende, wenngleich seltene Nebenwirkung von PTU in Form einer ANCA-assoziierten Vaskulitis der Haut. Im Vergleich zu primären ANCA-assoziierten Vaskulitiden tritt die PTU-induzierte Vaskulitis häufiger bei jungen Frauen auf und hat bei früher Diagnosestellung in der Regel eine bessere Prognose. Da das Auftreten meist mehrere Monate nach Beginn der Behandlung auftritt, muss das Auftreten kutaner Veränderungen jederzeit an diese Nebenwirkung denken lassen und bei Verdacht entsprechend zeitnahe Abklärungen in die Wege geleitet werden. Ein laborchemisches Screening ist einerseits wegen der Seltenheit der Nebenwirkung und andererseits wegen der geringen Sensitivität der ANCA-Antikörper für die Entwicklung einer klinischen Vaskulitis unangebracht. Bei Diagnosestellung bedarf es eines Screenings hinsichtlich anderer Organbeteiligungen, wobei insbesondere auf eine Affektion der Lunge, Niere und des Nervensystems geachtet werden muss. Je nach Resultaten kann die Initialbehandlung topisch antientzündlich erfolgen oder muss mit systemischen Immunsuppressiva angegangen werden. Das frühzeitige Sistieren der PTU-Behandlung ist in jedem Falle zentral. Hinsichtlich der Hyperthyreose kann ein Therapiewechsel auf CMZ ohne Gefahr von Kreuzreaktionen erfolgen, wobei aber auch über eine definitive Behandlung mittels Thyroidektomie oder Radiojod-Behandlung individuell beraten werden muss.
Abkürzungen
TSH Thyreoidea-stimulierendes Hormon
T4 Thyroxin
T3 Triiodthyronin
TRAK Thyreotropin-Rezeptor-Antikörper
MMZ Methimazol
CMZ Carbimazol
PTU Propylthiouracil
ANCA Antineutrophile zytoplasmatische Antikörper
PR3-ANCA Proteinase-3-Antineutrophile zytoplasmatische Antikörper
Assistenzärztin Allgemeine Innere Medizin
Kantonsspital Münsterlingen
Medizinische Klinik, Onkologie
Spitalcampus 1
8596 Münsterlingen
armgard.buechel@stgag.ch
Fachassistenzarzt
Klinik für Endokrinologie, Diabetologie,
Osteologie und Stoffwechselerkrankungen
Kantonsspital St. Gallen
markus.koster@kssg.ch
Klinik für Dermatologie, Venerologie und Allergologie,
Kantonsspital St. Gallen,
St. Gallen
Kantonsspital St. Gallen
Rorschacher Strasse 95
Haus 20
9007 St. Gallen
antonio.cozzio@kssg.ch
Klinik für Endokrinologie, Diabetologie,
Osteologie und Stoffwechselerkrankungen,
Kantonsspital St. Gallen,
St. Gallen
stefan.bilz@kssg.ch
Die Autorin und die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Cooper DS. Antithyroid drugs. N Engl J Med. 2005;352(9):905-17.
2. Kahaly GJ, Bartalena L, Hegedus L, Leenhardt L, Poppe K, Pearce SH. 2018 European Thyroid Association Guideline for the Management of Graves’ Hyperthyroidism. Eur Thyroid J. 2018;7(4):167-86.
3. Chen PL, Shih SR, Wang PW, Lin YC, Chu CC, Lin JH, et al. Genetic determinants of antithyroid drug-induced agranulocytosis by human leukocyte antigen genotyping and genome-wide association study. Nat Commun. 2015;6:7633.wwww
4. Ross DS, Burch HB, Cooper DS, Greenlee MC, Laurberg P, Maia AL, et al. 2016 American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. Thyroid. 2016;26(10):1343-421.
5. Balavoine AS, Glinoer D, Dubucquoi S, Wemeau JL. Antineutrophil Cytoplasmic Antibody-Positive Small-Vessel Vasculitis Associated with Antithyroid Drug Therapy: How Significant Is the Clinical Problem? Thyroid. 2015;25(12):1273-81.
6. Hsieh A, Adelstein S, McLennan SV, Williams PF, Chua EL, Twigg SM. Liver enzyme profile and rogression in association with thyroid autoimmunity in Graves’ disease. Endocrinol. Diab Metab 2019;2:e00086
PRAXIS
- Vol. 113
- Ausgabe 9
- Oktober 2024