- Symptomkontrolle in der nephrologischen Palliative Care
Die Nephrologie weist in vielen Aspekten Überschneidungen mit der Palliative Care auf. Beispiele hierfür sind die konservative Therapie einer terminalen Niereninsuffizienz oder die Durchführung eines Dialyseabbruchs. Eine palliative Mitbetreuung von chronisch nierenkranken Patientinnen und Patienten findet jedoch noch immer eher selten statt, einerseits aufgrund von Unsicherheiten hinsichtlich Nutzen und Chancen eines Einbezugs der Palliative Care in der Nephrologie, andererseits aufgrund einer Verwechslung der Palliative Care mit einer reinen «End-of-Life»-Betreuung. Durch das Aufzeigen des Spektrums der Palliative Care sollen die Zusammenarbeit dieser zwei Disziplinen gefördert und palliativmedizinische Angebote frühzeitig in das nephrologische Behandlungskonzept integriert werden können.
Einführung
Aufgrund der immer älter werdenden Schweizer Bevölkerung werden auch Krankheiten, welche die Niere betreffen (z.B. Diabetes mellitus, arterielle Hypertonie), immer häufiger. Die Prävalenz der chronischen Nierenerkrankung (Chronic Kidney Disease, CKD) liegt in der Schweiz bei ca. 10 % [1]. Definiert wird die chronische Nierenerkrankung als abnorme Nierenfunktion oder -struktur für mehr als drei Monate mit Einfluss auf die Gesundheit [2]. Eingeteilt wird die CKD dabei basierend auf der GFR und der Albuminausscheidung. Anhand dieser Faktoren kann eine Risikoabschätzung hinsichtlich Progression der CKD und der damit assoziierten Mortalität vorgenommen werden, denn mit zunehmender Einschränkung der Nierenfunktion steigt auch das kardiovaskuläre Risiko (Abb. 1). Insgesamt verläuft eine chronische Nierenerkrankung vor allem anfangs relativ asymptomatisch, sodass neun von zehn Personen mit CKD nicht wissen, dass sie erkrankt sind [3]. Mit fortschreitender Verschlechterung der Nierenfunktion entwickeln sich eine Reihe von Komplikationen wie eine arterielle Hypertonie, Anämie, metabolische Azidose oder ein sekundärer Hyperparathyreoidismus. Besonders in den späten Stadien, insbesondere dem der terminalen Niereninsuffizenz (GFR < 15 ml/min/1,73 m2, entsprechend einem CKD Stadium 5), kommt es zu einer merklichen Zunahme von Symptomen. Bei Patient_innen mit einer GFR < 15 ml/min/1,73 m2, welche konservativ – sprich ohne den Einsatz eines Nierenersatzverfahrens – behandelt werden, sind die häufigsten Symptome Fatigue/Energielosigkeit (75 %), Juckreiz (74 %), Benommenheit (65 %), Atemnot (61 %), Ödembildung (58 %), Schmerz (53 %), Muskelkrämpfe (50 %) und Inappetenz (47 %) [4]. Dabei wurden Fatigue, Juckreiz und Schmerzen als besonders belastend erlebt.
Was kann die Palliative Care in der Nephrologie leisten?
Unweigerlich stellt sich bei Voranschreiten der Nierenerkrankung die Frage nach dem «wie weiter»? Im Idealfall findet eine Auseinandersetzung mit diesem Thema zwischen Patient_in und der behandelnden Nephrologin/dem behandelnden Nephrologen bereits frühzeitig statt, um eine mögliche Notfallsituation (beispielswiese eine relevante Hyperkaliämie oder ein Lungenödem infolge Hypervolämie) zu verhindern. Als Alternativen stehen bei einem Nierenversagen die Heim- oder Zentrums-Hämodialyse, die Peritonealdialyse, die Nierentransplantation, aber auch ein konservativer Behandlungsansatz zur Auswahl.
Symptomkontrolle
Entscheidet sich ein_e Patient_in für einen konservativen Therapieweg, steht das möglichst lange Aufrechterhalten einer guten Lebensqualität im Vordergrund. Dies mittels adäquater Symptomkontrolle, das Leisten von medizinischer, pflegerischer und wo nötig psychosozialer Unterstützung sowie Hilfe bei der Zukunftsplanung. Hierin liegt eine der Kernkompetenzen der Palliative Care. Das Ziel ist es, eine Über- oder Unterbehandlung sowie unnötige Hospitalisationen zu verhindern. Das absolute Ziel einer Erhaltung der Nierenfunktion um jeden Preis verliert an Priorität. Der Fokus bei der Behandlung der kardiovaskulären Risikofaktoren beispielsweise liegt darauf, invalidisierende Sekundärschäden (wie einen zerebrovaskulären Insult, eine Hirnblutung oder eine Blutung des diabetischen Fundus) zu vermeiden. Im Zentrum steht die Frage: «Stört es die Patientin/den Patienten?». So können im Arzt-Patient- Gespräch individuelle Behandlungsziele definiert werden. Im Nachfolgenden soll auf Ursachen und Therapiemöglichkeiten einiger der häufigsten Symptome der terminalen Nierenerkrankung näher eingegangen werden.
Fatigue
Drei Viertel der Patient_innen mit einer terminalen Nierenerkrankung leiden an Fatigue, ein Drittel (36 %) davon gaben an, «sehr stark» davon betroffen zu sein [4]. Die Pathophysiologie der Fatigue im Fall der chronischen Nierenfunktionseinschränkung ist multifaktoriell bedingt. Infolge eines gesteigerten anaeroben Metabolismus kommt es zu einer reduzierten Bereitstellung von Sauerstoff. Durch den intensivierten anaeroben Metabolismus kommt es bei körperlicher Aktivität zu einer rascheren Entwicklung einer Laktatazidose, was zu Muskelbeschwerden führt [5]. Die chronisch metabolische Azidose und die renal bedingte Hyperphosphatämie beeinflussen ausserdem direkt die Funktion der Skelettmuskulatur, indem es wegen des erhöhten intrazellulären Phosphats zu einer Verringerung der zur Verfügung stehenden Calcium- Ionen für die elektromechanische Kopplung und so zur Leistungsintoleranz und Muskelermüdung kommt [6]. Längerfristig führt die metabolische Azidose ausserdem zu einem Protein-Energy-Wasting und durch den Verbrauch von Bicarbonat zur teilweisen Proteolyse und damit unter anderem zur Sarkopenie [7, 8]. Insgesamt führen diese Vorgänge zu einer Verschlechterung der physischen Funktion und des allgemeinen Funktionsniveaus, was wiederum mit einer schlechten Prognose einhergeht [9]. Das Vorliegen einer renalen Anämie begünstigt das Auftreten eines Müdigkeits- und Erschöpfungsgefühls. Nierenerkrankte Patient_innen weisen hierbei geringere Kompensationsmechanismen – wie z.B. eine Erhöhung des kardialen Outputs oder Erhöhung der Sauerstoffextraktion auf – als gesunde Proband_innen, um die tiefere arterielle Sauerstoffsättigung zu kompensieren [7]. Erschwerend hinzu kommt die zwei- bis dreimal höhere Prävalenz einer Depression bei CKD-Patient_innen im Vergleich zur Allgemeinbevölkerung [10]. Erklärbar ist dies einerseits durch verhaltensbezogene Ursachen (psychische Belastung der chronischen Erkrankung, häufige Arzt-und Spitalbesuche, Diät- und Trinkmengenrestriktionen, hohe Pillenlast etc.), andererseits konnte wiederholt ein bidirektionaler Zusammenhang zwischen dem Vorliegen eines erhöhten Inflammationszustands bei chronischen Erkrankungen und dem Auftreten von Depressionen nachgewiesen werden [11]. Ähnlich verhält es sich mit dem obstruktiven Schlaf-Apnoe-Syndrom (OSAS). Das Vorliegen eines OSAS beschleunigt den Verlust der Nierenfunktion durch wiederholtes Auftreten von Hypoxämien und Überaktivierung des sympathischen Nervensystems sowie des Renin-Angiotensin-Aldosteron-Systems (RAAS). Andererseits spielt das Vorliegen eines hypervolämen Zustands, bedingt durch eine abnehmende Diurese, eine wichtige Rolle in der Pathogenese des OSAS [12]. Die Behandlung der Fatigue bei der terminalen Nierenfunktionseinschränkung gestaltet sich schwierig und die evidenzbasierte Datenlage ist spärlich. Kleinere Studien konnten lediglich für die CKD-Stadien 3–4 zeigen, dass eine regelmässige körperliche Betätigung zu einer Verbesserung der Fatigue führte [13, 14]. Auch die Behandlung depressiver Symptome mittels Sertralin versus Placebo in einer randomisierten Doppelblindstudie bei Patient_innen mit CKD-Stadien 3–5 erbrachte keinen signifikanten Therapieerfolg [15]. Eine aktuell laufende Studie untersucht nun, ob bei Patient_innen mit fortgeschrittener bis terminaler Niereninsuffizenz die Behandlung mit verhaltensaktivierender Therapie oder der Einsatz von Bupropion, respektive die Kombination beider Methoden bei Nicht-Ansprechen, zu einer Verbesserung der Depression und/oder der Fatigue führt [16].
Pruritus
Ein häufig sehr störendes Symptom der fortgeschrittenen Niereninsuffizienz ist der Juckreiz, der wie das OSAS unter anderem einen Einfluss auf die Schlafqualität und somit auf die Lebensqualität haben kann. Der Juckreiz des urämisch bedingten Pruritus wird durch myelinierte A-delta und unmyelinierte C-Nervenfasern vermittelt, von denen nur eine Minderheit (10 %) histaminerg und eine Mehrheit (90 %) Histamin-unabhängig wirken. Wahrscheinlich wird die Neurotransmission des Juckreizes durch die urämisch bedingten Veränderungen des immunchemischen Milieus der epidermalen und dermalen Hautschichten vermittelt [8]. Die Hautbefunde des urämischen Pruritus sind eine Xerodermie sowie oftmals Kratzspuren. Bei Vorliegen eines Ausschlags muss an eine nicht-urämische Ursache des Juckreizes gedacht und gegebenenfalls eine dermatologische Beurteilung eingeholt werden. Therapeutisch soll auf ein regelmässiges Anwenden von Feuchtigkeitscremes geachtet und insbesondere im Winter eine zu trockene Raumluft vermieden werden. Warme Bäder sind besser als tägliches Duschen und Waschen, wenn möglich mit pH-neutralen Pflegeprodukten. Bei lokalisiertem Pruritus können topische Antihistaminika, Capsaicin- oder steroidhaltige Cremes versucht werden. Speziell beim nephrogenen Pruritus kann bei ausbleibender Besserung ein Therapieversuch mit Gabapentin oder Pregabalin versucht werden (Off-label-Gebrauch bei jedoch sehr guter Evidenz). Die Anwendung von Naltrexon (solange die Patient_innen keine Opiate einnehmen!) lieferte bisher unterschiedliche Resultate [17]. Eine proteinreiche Ernährung führt zu einer Akkumulation von urämischen Toxinen, weshalb auch eine proteinarme Diät versucht werden kann, um den Juckreiz zu lindern. Andererseits birgt eine proteinarme Ernährung die Gefahr einer Malnutrition, weshalb dies nur in der palliativen Situation versucht werden sollte. Möglicherweise kann auch die Umstellung auf eine vegetarische Diät ausprobiert werden, da bei Langzeitvegetarier_innen geringere systemische wie auch spezifische, mit dem urämischen Pruritus assoziierte, Entzündungsmarker nachgewiesen werden konnten [18, 19]. Als physikalische Therapie steht die Phototherapie mit ultravioletten Strahlen (UV)-A/-B zur Verfügung. Ebenfalls versucht werden können autogenes Training oder eine kognitive Verhaltenstherapie. Bei Schlafstörungen allenfalls der Einsatz von schlafanstossenden Medikamenten.
Schmerzen
Nozizeptiver Schmerz
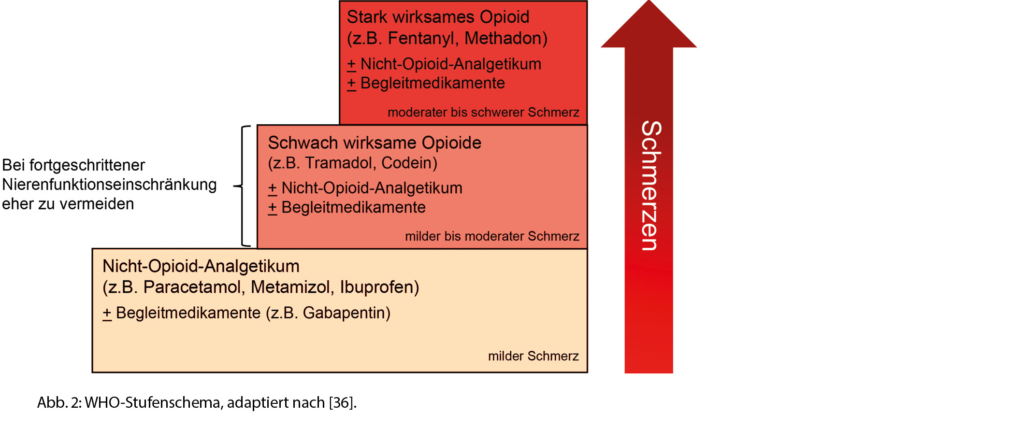
In der Behandlung nozizeptiver Schmerzen kommt auch bei Niereninsuffizenten das WHO-Stufenschema zum Zuge (Abb. 2). Beim Einsatz von Opiaten bei Vorliegen einer fortgeschrittenen Nierenfunktionseinschränkung treten bei Behandelnden häufig Unsicherheiten hinsichtlich der Wahl einer geeigneten Substanz auf. Dies aus Angst vor den potenziell schwerwiegenden Nebenwirkungen infolge einer erhöhten Plasmakonzentration und möglichen Akkumulation des Wirkstoffs durch die veränderte renale Pharmakokinetik. Werden Opioide zur Schmerzeinstellung benötigt, werden bei Personen mit chronischer Nierenfunktionseinschränkung auf Grund ihrer Pharmakodynamik Fentanyl, Buproenorphin, Hydromorphon und Methadon empfohlen. Andererseits wird aus denselben Überlegungen vom Einsatz schwacher Opioide (z.B. Tramadol, Codein) bei fortgeschrittener Niereninsuffizenz abgeraten (siehe unten).
Opiate
Buprenorphin ist ein partieller Agonist am Opioid-Rezeptor und liegt als sublinguale und transdermale Formulierung vor. Die Ausscheidung von Buprenorphin wird durch die Nierenfunktion nicht beeinträchtigt, weshalb es in Standarddosen verabreicht werden kann [20]. Fentanyl wird zu 90 % hepatisch metabolisiert und bildet keine aktiven Metaboliten, weshalb es bei Niereninsuffizenz ein geeignetes Opioid ist [21]. Der Hauptmetabolit von Hydromorphon ist Hydromorphon-3-Glucuronid, der bei fortgeschrittener Niereninsuffizienz akkumulieren und neurotoxisch wirken kann. In verschiedenen Studien konnte aber ein sicherer und vorteilhafter Einsatz im Vergleich zu Morphin gezeigt werden ohne Auftreten von relevanten Nebenwirkungen [22]. Ein Vorteil von Hydromorphon ist, dass es keinen Phase-I-Metabolismus durchläuft, weshalb es zu weniger Medikamenteninteraktionen kommt [23]. Methadon hat eine lange Halbwertszeit von ca. 30 Stunden und wird vor allem über die Faeces eliminiert. Es haben sich keine Hinweise für die Akkumulation von toxischen Metaboliten bei eingeschränkter Nierenfunktion gezeigt [24]. Die Anwendung bei Niereninsuffizienz scheint daher sicher zu sein. Beachtet werden sollte die Gefahr eine QT-Zeit-Verlängerung. Eine Parallelbehandlung mit anderen QT-Zeit verlängernden Medikamenten sollte deshalb vermieden werden. Morphin wird in der Leber glucuronidiert, wobei die aktiven Metaboliten Morphin-3-Glukuronid (M3G) und Morphin-6-Glukuronid (M6G) entstehen, welche bei einer Nierenfunktionseinschränkung akkumulieren. M6G kann neben der analgetischen Wirkung auch sedativ und atemdepressiv wirken. M3G seinerseits führt ab einem kritischen Schwellenwert zu Neuroexzitationen (Allodynie, Mycoloni, Epilepsie) [25]. Die Dosisfindung sollte deshalb bei eingeschränkter Nierenfunktion vorsichtig erfolgen oder eine andere Substanz verwendet werden. M6G ist ausserdem auch einer der aktiven Metaboliten von Codein, weshalb Letzteres ebenfalls nur mit Vorsicht eingesetzt werden sollte [26]. Tramadol besitzt einen dualen Wirkmechanismus und bindet einerseits schwach an Opioid-Rezeptoren, andererseits hemmt es die Wiederaufnahme der Neurotransmitter Serotonin und Noradrenalin. Daher kann es, unabhängig von der Nierenfunktion, sowohl zu Opioid-assoziierten wie auch Serotonin-typischen Nebenwirkungen kommen (z.B. dem serotoninergen Syndrom). Die Serumkonzentration ist in relevantem Masse abhängig von der Aktivität des CYP2D6-Gens und Beeinflussung der CYP3A4-Aktivität durch eine entsprechende Ko-Medikation. Auch auf Grund des hohen Interaktionspotenzials wird von Tramadol deshalb abgeraten [23]. Oxycodon wird hauptsächlich via CYP3A4 zu Noroxycodon metabolisiert, was den Metabolismus anfällig für eine Interaktion mit anderen Medikamenten macht. Bei schwerer Niereninsuffizienz wiesen die Behandelten deutlich mehr Nebenwirkungen auf als Nierengesunde [27]. Grundsätzlich gilt jedoch die Regel, dass dasjenige Opiat verwendet werden soll, mit dem die Behandelnden die meiste Erfahrung haben. Einen Überblick über die verschiedenen Opiate und deren Eigenschaften bei Vorliegen einer chronischen Nierenfunktion liefert Tabelle 1.
Neuropathische Schmerzen
Zur Behandlung von neuropathischen Schmerzen werden als First-line-Therapeutika Calciumkanal-Hemmer (Gabapentin oder Pregabalin), Serotonin-Noradrenalin-Wiederaufnahmehemmer (z.B. Duloxetin) sowie trizyklische Antidepressiva (z.B. Amitriptylin) empfohlen. Für unter anderem Carbamazepin oder Capsaicin-Pflaster liegen widersprüchliche Daten vor [28]. Aus der Gruppe der Opioide weist Methadon ein geeignetes Wirkprofil auf, da es antagonistisch am N-Methyl-D-Aspartat-Rezeptor (NMDA-Rezeptor) wirkt, der an der Vermittlung von spinalen Sensibilisierungsprozessen und dadurch an der Entstehung neuropathischer Schmerzzustände beteiligt ist [29].
Restless-Legs-Syndrom
Der genaue Mechanismus, der für das urämisch vermittelte Restless-Legs-Syndrom verantwortlich ist, ist weiterhin nicht eindeutig geklärt. Vermutet wird ein Zusammenspiel von der Dysfunktion des dopaminergen Systems, eines Eisendefizits und dem Vorliegen einer Anämie [30]. Davon abzuleiten sind die entsprechenden Therapieansätze mit Ausgleich des Eisenmangels und Behandlung mit Dopaminagonisten (Levodopa oder Pramipexol).
Entscheidungsfindung
Besonders kritisch ist der Moment, in dem sich ein_e Patient_in für oder gegen den Beginn eines Nierenersatzverfahrens entscheiden muss. Dieser Entscheidungsprozess ist vielschichtig und deshalb äusserst schwierig und sollte immer zusammen mit der betreuenden Nephrologin/dem betreuenden Nephrologen / Hausarzt/-ärztin und den Angehörigen nach sorgfältiger Aufklärung über die verschiedenen Therapieoptionen unter Berücksichtigung der aktuellen Lebenssituation getroffen werden. Bezüglich der Entscheidungsfindung hinsichtlich eventueller Dialysemodalitäten kommt dem Dialyse-Pflegepersonal eine wichtige Rolle zu. Zum einen erfolgt die Veranschaulichung von sowohl technischen wie auch praktischen Aspekten der unterschiedlichen Nierenersatzverfahren (zum Beispiel Zeigen der Dialysestation und -geräte oder Aufzeigen des Ablaufs eines Beutelwechsels der Peritonealdialyse) meist durch das Pflegepersonal, zum anderen ist das Pflegepersonal durch die intensive und regelmässige Betreuung den Alltagsproblemen und -herausforderungen der Dialysepatient_innen oftmals näher als die betreuen den Ärztinnen und Ärzte. Als weitere Therapieoption soll auch die Möglichkeit eines nephrologisch-palliativen Therapieansatzes ohne Nierenersatzverfahren angeboten werden. Denn für viele Patient_innen steht die Lebensqualität und nicht eine möglichst lange Lebensdauer im Vordergrund. Bezüglich Lebensdauer konnte beispielsweise gezeigt werden, dass ältere (> 80 Jahre) Patient_innen mit einer fortgeschrittenen Nierenerkrankung und konservativer Behandlung im Median 16 Monate überlebten, bei einem Zwölf-Monats-Überleben von 53 %. Ungefähr ein Drittel der Patient_innen, die formal bereits dialysepflichtig waren, überlebten länger als ein Jahr [31]. Durch eine palliativ-nephrologische Betreuung kann eine suffiziente Symptomkontrolle erzielt und die Lebensqualität auch bei Verzicht auf ein Nierenersatzverfahren aufrechterhalten oder sogar verbessert werden [31, 32]. Ob Patient_innen punkto Lebensdauer überhaupt von einer Dialysebehandlung profitieren, ist ausserdem sehr von deren Ko-Morbiditäten abhängig. Der Überlebensvorteil von > 75-jährigen CKD-5-Patient_innen, die sich für eine Dialyse entscheiden, reduziert sich drastisch bei Vorliegen relevanter Nebenerkrankungen. Liegt eine ischämische Herzerkrankung vor, scheint der Überlebensvorteil im Vergleich zur konservativen Therapie sogar ganz aufgehoben zu sein [33]. Auch die durch die Dialysebehandlung gewonnene Lebenszeit muss kritisch betrachtet werden. So verbringen Dialysepatient_innen im Schnitt ca. 50 % ihrer Zeit entweder an der Dialyse oder wegen Komplikationen im Krankenhaus (173 Tage/Patient_in/Jahr). Im Vergleich dazu sind es 16 Tage/Patient_in/Jahr bei Patient_innen mit konservativer Therapie [34]. Nierenerkrankte Personen, die sich für eine konservative Therapie entscheiden, überleben im Durchschnitt zwar kürzer, jedoch mit einer ähnlichen Anzahl an tatsächlich gewonnen freien Tagen wie Dialysepatient_innen. Es kann also festgehalten werden, dass der Beginn einer Dialysebehandlung nicht per se mit einer Verbesserung der Lebensqualität, respektive einer Lebensverlängerung einhergeht. Die Entscheidung für oder gegen ein Nierenersatzverfahren muss daher individuell abgewogen werden anhand von Erwartungen und Zielen der Patientin/des Patienten und der bisherigen Krankengeschichte. Unabhängig davon, wofür sich ein_e Patient_in entschieden hat, empfiehlt es sich, diesen Entscheid in regelmässigen Abständen zu re-evaluieren: «Decken sich die Erwartungen mit der Realität?»; «Sind die Ziele und Wünsche hinsichtlich Lebensende noch die gleichen?»; «Hat sich die Lebenssituation geändert?». Von knapp 400 Befragten in sieben Dialyseeinrichtungen in Cleveland (USA) und Umgebung gaben 82 (21 %) an, die Entscheidung für die Dialyse zu bereuen. Besonders häufig war dies dann der Fall, wenn die Dialysetherapie den Angehörigen oder der Ärztin/dem Arzt zuliebe begonnen worden war. Personen, die zuvor mit dem Behandlungsteam Prognosegespräche geführt oder eine Patientenverfügung verfasst hatten, bereuten die Entscheidung weniger häufig [35]. Natürlich besteht auch immer die Möglichkeit eines Dialyseabbruchs. Gründe, die die Patient_innen dennoch hindern, sich für einen geplanten Dialyseabbruch zu entscheiden, sind beispielsweise die Befürchtung, Mitmenschen damit zu enttäuschen oder im Stich zu lassen, Angst respektive Unkenntnis vor dem klinischen Verlauf und der Dauer bis zum Eintreten des Todes, das Empfinden, damit «aufzugeben» oder schlicht das Nichtwissen/eine fehlende Aufklärung seitens des betreuenden Ärzteteams bezüglich eines geplanten Dialyseabbruchs [36]. Die Überlebenszeit nach einem Dialyseabbruch ist stark von der Restnierenfunktion abhängig. Bei Kranken ohne jegliche Restfunktion beträgt die Überlebenszeit selten mehr als 5–7 Tage, kann aber je nach Ausmass der erhaltenen Restdiurese bis über drei Monate erstrecken [37]. Die Mehrheit der Personen (81 %), die einen Dialyseabbruch durchführte, musste während der letzten 24 Stunden nicht leiden, und der Tod wurde durch Angehörige und Pflegefachpersonen in 85 % als «guter Tod» bezeichnet [38].
Als Hürden der Etablierung der Palliative Care in der Nephrologie haben sich die ungeklärte Verantwortlichkeit zwischen den verschiedenen Behandelnden bezüglich Ansprechen von Prognosen, Definieren von Behandlungszielen und Thematisieren einer vorausschauenden Planung für den Fall einer Urteilsunfähigkeit gezeigt. Weitere Gründe waren eine subjektiv geäusserte ungenügende Ausbildung der Nephrolog_innen auf dem Gebiet der Palliative Care wie auch in der Sprechstunde/im Spital ungenügend zur Verfügung stehende zeitliche Ressourcen [39].
Das palliative Assessment, also das Erfassen der Probleme und Herausforderungen der Situation aus Sicht der Patientin/des Patienten und/oder ihrer/seiner Angehörigen, erfolgt mittels thematischer Strukturierung. Hierfür wird häufig die sogenannte SENS-Struktur verwendet [40]. Das SENS-Modell (Symptom-Management; Entscheidungsfindung und Erwartungen; Netzwerkorganisation; Support für das Umfeld, Tabelle 2) hat sich als umfassendes, multidimensionales Vorgehen bewährt. Das palliative Assessment wird immer im interprofessionellen Team durchgeführt. Bei der zugrundeliegenden Kernfrage «Woran leidet dieser Mensch?» steht im palliativen Assessment nicht nur die medizinische Diagnose im Mittelpunkt, sondern ebenfalls die Frage, welche konkreten Ängste, Sorgen und Probleme, aber auch welche Ressourcen und Vorlieben die befragte Person hat. Durch diesen partizipativ-strukturierten Ansatz wird die Selbstbestimmung der Patientinnen und Patienten gestärkt und die verschiedenen belastenden Themenbereiche werden erfasst.
Ein frühzeitiger Einbezug von Palliative-Care-erfahrenen Fachpersonen kann den Prozess der Entscheidungsfindung und der krankheitsspezifischen Vorausplanung (engl.: care planning) zwischen betroffenen Personen, ihren Angehörigen und behandelnden Nephrolog_innen begleiten und unterstützen, um individuelle Behandlungswünsche zu definieren und gegebenenfalls zu dokumentieren. Falls sich der/die Patient_in für einen konservativen Weg entschieden hat, bietet sich eine palliative Mitbetreuung zur Optimierung der Symptomkontrolle an. Ein weiterer Aspekt ist das Antizipieren möglicher krankheitsbedingter Komplikationen und das Festlegen von Behandlungswünschen für den Fall, dass die Urteilsfähigkeit nicht mehr gegeben ist (engl.: Advance Care Planning, ACP) durch das Anlegen einer ärztlichen Notfallanordnung, eines therapeutischen Notfallplans oder einer Patientenverfügung. Damit kann eine Stärkung der Selbstbestimmung und Klarheit der Verantwortlichkeit in Notfällen mit oder ohne erhaltene Urteilsfähigkeit erreicht werden. Im besten Fall können so zudem unnötige Hospitalisationen vermieden werden, was natürlich primär im Sinne der Patient_in ist, aber auch zu einer Kostenreduktion im Gesundheitssystem führen könnte.
Im Artikel verwendete Abkürzungen
ABS Abbreviated Burn Severity Index
CKD Chronic Kidney Disease
GFR Glomeruläre Filtrationsrate
M3G Morphin-3-Glukuronid
M6G Morphin-6-Glukuronid
NMDA N-Methyl-D-Aspartat
OSAS Obstruktives Schlaf-Apnoe-Syndrom
SENS Symptom-Management, Entscheidungsfindung und Erwartungen, Netzwerkorganisation, Support für das Umfeld UV Ultraviolette Strahlen
Oberarzt meV Kompetenzzentrum Palliative Care
UniversitätsSpital Zürich
Klinik für Radio-Onkologie
Rämistrasse 100
8091 Zürich
david.blum@usz.ch
Historie
Manuskript eingereicht: 07.12.2023
Nach Revision angenommen: 15.02.2023
Interessenskonflikte
Es bestehen keine Interessenskonflikte.
ORCID
Stefan Pelz
https://orcid.org/0000-0001-5553-7276
- Die Betreuung nephrologisch erkrankter Patient_innen weist zahlreiche Überschneidungen mit der Palliative Care auf.
- Die palliative Mitbetreuung kann helfen, die Symptomkontrolle zu optimieren.
- Ein frühzeitiger Einbezug von Palliative Care kann den Prozess der Entscheidungsfindung sowie der krankheitsspezifischen Vorausplanung auch für den Fall der Urteilsunfähigkeit (Advanced Care Planning) zwischen betroffenen Personen, ihren Angehörigen und dem Behandlungsteam begleiten und unterstützen.
Learning Questions
1. Welche Aussage zur Symptomlast bei fortgeschrittener Niereninsuffizienz ist falsch?
a) Zu den häufigsten Symptomen der terminalen
Niereninsuffizienz gehören Fatigue, Juckreiz und Ödembildung.
b) Die renale Hyperphosphatämie trägt via Beeinflussung der elektromechanischen Kupplung zur
Muskelermüdung bei.
c) Beim Vorliegen eines Restless-Legs-Syndroms sollte ein Eisenmangel gesucht und gegebenenfalls
substituiert werden.
d) Der urämische Pruritus wird hauptsächlich via
histaminerge Nervenfasern vermittelt.
2. Den grössten Einfluss auf die Überlebensdauer nach einem geplanten Dialyseabbruch hat:
a) Das Alter
b) Die Ko-Morbiditäten
c) Die Restnierenfunktion
d) Die Zeitspanne seit Initiierung der Dialysebehandlung
1. Niemann S, Achermann Stürmer Y, Derrer P, Ellenberger L. Status 2022: Statistik der Nichtberufsunfälle und des Sicherheitsniveaus in der Schweiz. 2022. https://www.bfu.ch/de/ die-bfu/doi-desk/10-13100-bfu-2-399-01-2021; last access: 10.09.2022.
2. Konferenz der kantonalen Gesundheitsdirektorinnen und ‑direktoren (GDK). Reevaluation der HSM-Leistungszuteilungen im Bereich der schweren Verbrennungen beim Erwachsenen. 2013. https://www.gdkcds.ch/fileadmin/docs/public/gdk/themen/ hsm/hsm_spitalliste/201311_01a_bb_dc_burns_20131127_ def_d.pdf; last access: 01.01.2023.
3. Jester I, Jester A, Demirakca S, Waag KL. Notfallmanagement bei der Primärversorgung kindlicher Verbrennungen. Intensivmed Notfallmed. 2005;42(1):60–65.
4. Dries DJ. Burn care: before the burn center. Scand J Trauma Resusc Emerg Med. 2020;28(1).
5. Deutschen Gesellschaft für Verbrennungsmedizin (DGV). Behandlung thermischer Verletzungen des Erwachsenen. 2021. https://www.awmf.org/uploads/tx_szleitlinien/044-001l_ S2k_Behandlung-thermischer-Verletzungen-des-Erwachse nen_2021-07.pdf; last access: 10.09.2022.
6. Park DH, Hwang JW, Jang KS, Han DG, Ahn KY, Baik BS. Use of laser Doppler flowmetry for estimation of the depth of burns. Plast Reconstr Surg. 1998;101(6):1516–1523.
7. Shepherd AP, Öberg PÅ. Laser-Doppler Blood Flowmetry. Kluwer Academic Publishers. Basic Theory and Operating Principles of Laser Doppler Blood Flow Monitoring and Imaging (LDF & LDI), Issue 1; 1990 (ISBN 0-7923-0508-6).
8. Hop MJ, Hiddingh J, Stekelenburg C, et al. Cost-effectiveness of laser Doppler imaging in burn care in the Netherlands. BMC Surg. 2013;13(1).
9. Zuo KJ, Medina A, Tredget EE. Important Developments in Burn Care. Plast Reconstr Surg. 2017;139(1):120e–138e.
10. Wallace AB. The exposure treatment of burns. Lancet. 1951;1 (6653):501–504.
11. Williams RY, Wohlgemuth SD. Does the “rule of nines” apply to morbidly obese burn victims? J Burn Care Res. 2013;34(4):447– 452.
12. Thom D. Appraising current methods for preclinical calculation of burn size – A pre-hospital perspective. Burns. 2017;43 (1):127–136.
13. Moore RA, Waheed A, Burns B. Rule of Nines. StatPearls. 2021. https://www.ncbi.nlm.nih.gov/books/NBK513287/; last access: 02.09.2022.
14. Livingston EH, Lee S. Percentage of burned body surface area determination in obese and nonobese patients. J Surg Res. 2000;91(2):106–110.
15. Nichter LS, Williams J, Bryant CA, Edlich RF. Improving the accuracy of burn-surface estimation. Plast Reconstr Surg. 1985;76 (3):428–433.
16. Parvizi D, Giretzlehner M, Dirnberger J, et al. The use of telemedicine in burn care: development of a mobile system for TBSA documentation and remote assessment. Ann Burns Fire Disasters. 2014;27(2):94.
17. Tobiasen J, Hiebert JM, Edlich RF. The abbreviated burn severity index. Ann Emerg Med. 1982;11(5):260–262.
18. Bartels P, Thamm OC, Elrod J, et al. The ABSI is dead, long live the ABSI – reliable prediction of survival in burns with a modified Abbreviated Burn Severity Index. Burns. 2020;46(6):1272– 1279.
19. Tsurumi A, Que YA, Yan S, Tompkins RG, Rahme LG, Ryan CM. Do standard burn mortality formulae work on a population of severely burned children and adults? Burns. 2015;41(5):935– 945.
20. Mehta M, Tudor GJ. Parkland Formula. StatPearls. 2022. https://www.ncbi.nlm.nih.gov/books/NBK537190/; last access: 12.09.2022.
21. Haberal M, Sakallioglu Abali AE, Karakayali H. Fluid management in major burn injuries. Indian J Plast Surg. 2010; 43 (Suppl):S29–S36.
22. Zodda D. Calculated decisions: Parkland formula for burns. Emerg Med Pract. 2018;20(Suppl 2):S1–S2.
23. Blumetti J, Hunt JL, Arnoldo BD, Parks JK, Purdue GF. The Parkland formula under fire: is the criticism justified? J Burn Care Res. 2008;29(1):180–186.
24. Daniels M, Fuchs PC, Lefering R, et al. Is the Parkland formula still the best method for determining the fluid resuscitation volume in adults for the first 24 hours after injury? – A retrospective analysis of burn patients in Germany. Burns. 2021;47 (4):914–921.
25. Saffle JL. The phenomenon of “fluid creep” in acute burn resuscitation. JBCR. 2007;28:382–385. 26. Utha department of health. Utha EMS Protocoll Guideliness. 2020. Available from: https://bemsp.utah.gov/wp-content/up loads/sites/34/2020/03/2020-Utah-EMS-Protocol-Guidelines- Final.pdf; last access: 05.02.2023.
27. Bittner EA, Shank E, Woodson L, Martyn JAJ. Acute and perioperative care of the burn-injured patient. Anesthesiology. 2015;122(2):448–464.
28. Oda J, Kasai K, Noborio M, Ueyama M, Yukioka T. Hypothermia during burn surgery and postoperative acute lung injury in extensively burned patients. J Trauma. 2009; 66(6):1525–9.
29. Ziegler B, Kenngott T, Fischer S, Hundeshagen G, Hartmann B, Horter J, et al. Early hypothermia as risk factor in severely burned patients: A retrospective outcome study. Burns. 2019; 45(8):1895–1900.
30. Weaver MD, Rittenberger JC, Patterson PD, et al. Risk factors for hypothermia in EMS-treated burn patients. Prehospl Emerg Care. 2014;18(3):335–341.
31. Sherren PB, Hussey J, Martin R, Kundishora T, Parker M, Emerson B. Lethal triad in severe burns. Burns. 2014;40(8):1492– 1496.
32. Furrer F, Wendel-Garcia PD, Pfister P, Hofmaenner DA, Franco C, Sachs A. Perioperative targeted temperature management of severely burned patients by means of an oesophageal temperature probe. Burns. 2022;S0305-4179(22)00066-3.
33. Lönnecker S, Schoder V. [Hypothermia in patients with burn injuries: influence of prehospital treatment]. Chirurg. 2001;72 (2):164–167.
34. Singer AJ, Taira BR, Thode HC, McCormack JE, Shapiro M, Aydin A, et al. The association between hypothermia, prehospital cooling, and mortality in burn victims. Acad Emerg Med. 2010; 17(4):456–459.
35. Morris C, Emsley P, Marland E, Meuleneire F, White R. Use of wound dressings with soft silicone adhesive technology. Paediatr Nurs. 2009;21(3):38–43
36. Waring M, Bielfeldt S, Mätzold K, Wilhelm KP, Butcher M. An evaluation of the skin stripping of wound dressing adhesives. J Wound Care. 2011;20(9):412–422.
37. Bugmann P, Taylor S, Gyger D, et al. A silicone-coated nylon dressing reduces healing time in burned paediatric patients in comparison with standard sulfadiazine treatment: A prospective randomized trial. Burns. 1998;24(7):609–612.
38. Gotschall CS, Morrison MIS, Eichelberger MR. Prospective, randomized study of the efficacy of Mepitel on children with partial-thickness scalds. J Burn Care Rehabil. 1998; 19(4): 279–283.
39. Schwarze H, Küntscher M, Uhlig C, et al. Suprathel, a new skin substitute, in the management of partial-thickness burn wounds: results of a clinical study. Ann Plast Surg. 2008;60 (2):181–185.
40. Uhlig C, Rapp M, Hartmann B, Hierlemann H, Planck H, Dittel KK. Suprathel-an innovative, resorbable skin substitute for the treatment of burn victims. Burns. 2007;33(2):221–229.
41. Uhlig C, Hierlemann H, Dittel K-K. Actual Strategies in the Treatment of Severe Burns – Considering Modern Skin Substitutes. Osteosynthesis Trauma Care. 2007;15(01):2–7.
42. Merz KM, Sievers R, Reichert B. Suprathel® bei zweitgradigoberflächlichen Verbrennungen im Gesicht. GMS Verbrennungsmed. 2011; 4:Doc01.
43. Nolte SV., Xu W, Rodemann H-P, Rennekampff H-O. Suitability of Biomaterials for Cell Delivery in Vitro. Osteosynthesis Trauma Care. 2007;15(01):42–47.
44. Uhlig C, Rapp M, Dittel KK. New strategies for the treatment of thermally injured hands with regard to the epithelial substitute Suprathel. Handchir Mikrochir Plast Chir. 2007;39(5):314– 319.
45. Koller J. Topical treatment of partial thickness burns by silver sulfadiazine plus hyaluronic acid compared to silver sulfadiazine alone: a double-blind, clinical study. Drugs Exp Clin Res. 2004;30(5–6):183–190.
46. Costagliola M, Agrosì M. Second-degree burns: A comparative, multicenter, randomized trial of hyaluronic acid plus silver sulfadiazine vs. silver sulfadiazine alone. Curr Med Res Opin. 2005;21(8):1235–1240.
47. Janzekovic Z. A new concept in the early excision and immediate grafting of burns. J Trauma. 1970;10(12):1103–1108
48. Singh M, Nuutila K, Kruse C, Robson MC, Caterson E, Eriksson E. Challenging the Conventional Therapy: Emerging Skin Graft Techniques for Wound Healing. Plast Reconstr Surg. 2015;136 (4):524e–530e.
49. Kadam D. Novel expansion techniques for skin grafts. Indian J Plast Surg. 2016;49(1):5–15.
50. Pallua N, Von Bülow S. Behandlungskonzepte bei Verbrennungen. Teil II: Technische Aspekte. Chirurg. 2006;77(2):179–188.
51. Paggiaro AO, Bastianelli R, Carvalho VF, Isaac C, Gemperli R. Is allograft skin the gold-standard for burn skin substitute? A systematic literature review and meta-analysis. J Plast Reconstr Aesthet Surg. 2019;72(8):1245–1253.
52. Rosenberg L, Shoham Y, Krieger Y, et al. Minimally invasive burn care: a review of seven clinical studies of rapid and selective debridement using a bromelain-based debriding enzyme (Nexobrid®). Ann Burns Fire Disasters. 2015;28(4):264.
53. Singer AJ, McClain SA, Taira BR, Rooney J, Steinhauff N, Rosenberg L. Rapid and selective enzymatic debridement of porcine comb burns with bromelain-derived Debrase: acute-phase preservation of noninjured tissue and zone of stasis. J Burn Care Res. 2010;31(2):304–309.
54. Waldner M, Ismail T, Lunger A, et al. Evolution of a concept with enzymatic debridement and autologous in situ cell and platelet-rich fibrin therapy (BroKerF). Scars Burn Heal. 2022;8:20595 131211052394. DOI: 10.1177/20595131211052394 [eCollection 2020 Jan–Dec.].
55. Grünherz L, Michienzi R, Schaller C, et al. Enzymatic debridement for circumferential deep burns: the role of surgical escharotomy. Burns. 2022;S0305–4179(22)00312–6.
56. Shakespeare P. Burn wound healing and skin substitutes. Burns. 2001;27(5):517–522.
57. Lohana P, Hassan S, Watson SB. IntegraTM in burns reconstruction: Our experience and report of an unusual immunological reaction. Ann Burns Fire Disasters. 2014;27(1):17.
58. Berger A, Tanzella U, Machens HG, Liebau J. Administration of Integra on primary burn wounds and unstable secondary scars. Chirurg. 2000;71(5):558–563.
59. Stern R, McPherson M, Longaker MT. Histologic study of artificial skin used in the treatment of full-thickness thermal injury. J Burn Care Rehabil. 1990;11(1):7–13.
60. Phillips GSA, Nizamoglu M, Wakure A, Barnes D, El-Muttardi N, Dziewulski P. The Use Of Dermal Regeneration Templates For Primary Burns Surgery In A UK Regional Burns Centre. Ann Burns Fire Disasters. 2020;33(3):245.
61. Heimbach D, Luterman A, Burke J, et al. Artificial dermis for major burns. A multi-center randomized clinical trial. Ann Surg. 1988;208(3):313–320.
62. Magnusson S, Baldursson BT, Kjartansson H, Rolfsson O, Sigurjonsson GF. Regenerative and Antibacterial Properties of Acellular Fish Skin Grafts and Human Amnion/Chorion Membrane: Implications for Tissue Preservation in Combat Casualty Care. Mil Med. 2017;182(S1):383–388.
63. Baldursson BT, Kjartansson H, Konrádsdóttir F, Gudnason P, Sigurjonsson GF, Lund SH. Healing rate and autoimmune safety of full-thickness wounds treated with fish skin acellular dermal matrix versus porcine small-intestine submucosa: a noninferiority study. Int J Low Extrem Wounds. 2015;14(1): 37–43.
64. Wallner C, Holtermann J, Drysch M, Schmidt S, Reinkemeier F, et al. The Use of Intact Fish Skin as a Novel Treatment Method for Deep Dermal Burns Following Enzymatic Debridement: A Retrospective Case-Control Study. Eur Burn J. 2022;3(1): 43–55.
65. ter Horst B, Chouhan G, Moiemen NS, Grover LM. Advances in keratinocyte delivery in burn wound care. Adv Drug Deliv Rev. 2018;123:18–32.
66. Mühlbauer W, Henckel von Donnersmarck G, Hoefter E, Hartinger A. [Keratinocyte culture and transplantation in burns]. Chirurg. 1995;66(4):271–276.
67. Biedermann T, Klar AS, Böttcher-Haberzeth S, Schiestl C, Reichmann E, Meuli M. Tissue-engineered dermo-epidermal skin analogs exhibit de novo formation of a near natural neurovascular link 10 weeks after transplantation. Pediatr Surg Int. 2014;30(2):165–172.
68. Platt AJ, McKiernan MV, McLean NR. Free tissue transfer in the management of burns. Burns. 1996;22(6):474–476.
PRAXIS
- Vol. 112
- Ausgabe 10
- August 2023