- Update valvuläre Herzkrankheiten: Entscheidungen im interdisziplinären Herzteam anhand von Beispielen
Die Mitralinsuffizienz (MI) und die Aortenstenose (AS) sind in Europa die häufigsten Klappenvitien, die Interventionen bedürfen. In fortgeschrittenem Stadium beeinträchtigen diese Klappenpathologien die Lebensqualität und Prognose der Betroffenen. Die Prävalenz der schweren MI und AS nimmt im Alter zu. Angesichts der steigenden Lebenserwartung in der Bevölkerung und den mit dem Alter verbundenen Ko-Morbiditäten stellen diese Klappenvitien eine wachsende Herausforderung dar. Heutzutage stehen sowohl chirurgische als auch kathetertechnische Behandlungsverfahren zur Verfügung. In interdisziplinären Herzteams sollen die bestmöglichen Therapieoptionen gefunden werden. Ziel dieses Artikels ist es, anhand von Patient_innenbeispielen eine Übersicht über mögliche individualisierte Therapieentscheide zu geben, die im Herzteam in Anlehnung an die aktuellen Europäischen Richtlinien der Gesellschaften für Kardiologie und Herz- und Thoraxchirurgie getroffen werden können.
Schlüsselwörter: Mitralinsuffizienz, Aortenstenose, Operation, kathetertechnische Behandlung, Herzteam
Update Valvular Heart Disease: Heart Team Decision-Making Based on Patient Examples
In Europe, mitral regurgitation and aortic stenosis are the most common valve lesions requiring interventions. In advanced stages, these valve pathologies affect patients‘ quality of life and prognosis. The prevalence of mitral regurgitation and aortic stenosis is increasing with age. In view of an aging population and the comorbidities associated with age, these valve defects represent an increasing challenge to health care providers. Nowadays, surgical as well as catheter-based treatment options are available to treat affected patients. Therapeutic strategies suitable to the individual patient should be discussed in interdisciplinary heart teams. The aim of the present article is to give an overview of possible guideline-conform heart team decisions based on patient examples.
Keywords: Mitral regurgitation, aortic stenosis, operation, catheter-based therapy, heart team
Mise à jour cardiopathie valvulaire: décisions de l‘équipe interdisciplinaire basées sur des exemples de patients
En Europe, l‘insuffisance mitrale et la sténose aortique sont les valvulopathies les plus courantes nécessitant une intervention. Aux stades avancés, elles affectent la qualité de vie et le pronostic des patients. La prévalence des insuffisances mitrale et sténoses aortique sévères augmente avec l‘âge. Compte tenu de la population vieillissante et des comorbidités associées, ces-dernières représentent un défi croissant. Aujourd‘hui, des options thérapeutiques chirurgicales ou percutanées sont disponibles. Les stratégies thérapeutiques adaptées doivent être discutées au sein d‘équipes interdisciplinaires. L‘objectif de cet article est de donner, à l‘aide d‘exemples, un aperçu des décisions possibles prises au sein de ces équipes interdisciplinaires, en se basant sur les directives européennes actuelles des sociétés de cardiologie et de chirurgie cardiothoracique.
Mots-clés: insuffisance mitrale, sténose aortique, opération, traitement percutané, équipe interdisciplinaire
Einleitung
Die Mitralinsuffizienz (MI) und die Aortenstenose (AS) sind in Europa die häufigsten Klappenvitien, die Interventionen bedürfen [1]. In fortgeschrittenem Stadium beeinträchtigen diese Klappenpathologien die Lebensqualität und Prognose der Betroffenen. Die Prävalenz der schweren MI und AS nimmt im Alter zu [2, 3]. Angesichts der steigenden Lebenserwartung in der Bevölkerung [4] und den mit dem Alter verbundenen Ko-Morbiditäten stellen diese Klappenvitien eine wachsende Herausforderung dar.
Mitralinsuffizienz
Einteilung nach Pathomechanismus
Basierend auf dem zugrundeliegenden Mechanismus wird bei der MI zwischen der primären und der sekundären Form unterschieden. Nach dieser Einteilung richten sich auch die möglichen therapeutischen Massnahmen [1]. Bei der primären MI besteht die Pathologie im Bereich der Mitralklappe und/oder dem Klappenapparat. Die degenerative Form ist in westlichen Ländern am häufigsten [5]. Dazu gehören der Mitralklappenprolaps und das sogenannte «Flail Leaflet», das durch eine Sehnenfadenruptur entsteht und mit oder ohne Prolaps auftreten kann. Weit seltenere Ursachen sind Endokarditiden oder eine rheumatische Herzerkrankung, wobei Letztere in einkommensschwachen Ländern die häufigste Ätiologie der MI darstellt [6]. Bei der sekundären MI sind Mitralklappe und Halteapparat grundsätzlich strukturell intakt. Hier entsteht die MI durch eine Geometriestörung des linken Ventrikels (LV) beziehungsweise des linken Vorhofs [7]. Häufigste Ursachen sind eine dilatative oder eine ischämische (zugrundeliegende koronare Herzkrankheit) Kardiomyopathie [1].
Primäre Mitralinsuffizienz: Indikationen zur Intervention
Die klarste Indikation zur Sanierung einer primären MI ist das Auftreten von Symptomen. Die Art des Verfahrens richtet sich dabei nach der Operabilität der Patientin/des Patienten (Tab. 1) [1]. Bei beschwerdefreien operablen Patient_innen können folgende Befunde mit einer Verschlechterung der Prognose einhergehen und sind daher ebenfalls Indikationen für eine operative Sanierung: LV-Ejektionsfraktion (LVEF) <60 %, LV endsystolischer Diameter >40 mm, indexiertes linksatriales Volumen >60 ml/m2, systolischer pulmonalarterieller Druck >50 mmHg und MI-assoziiertes Vorhofflimmern [1].
Beispiel operative Mitralklappenrekonstruktion bei schwerer primärer MI
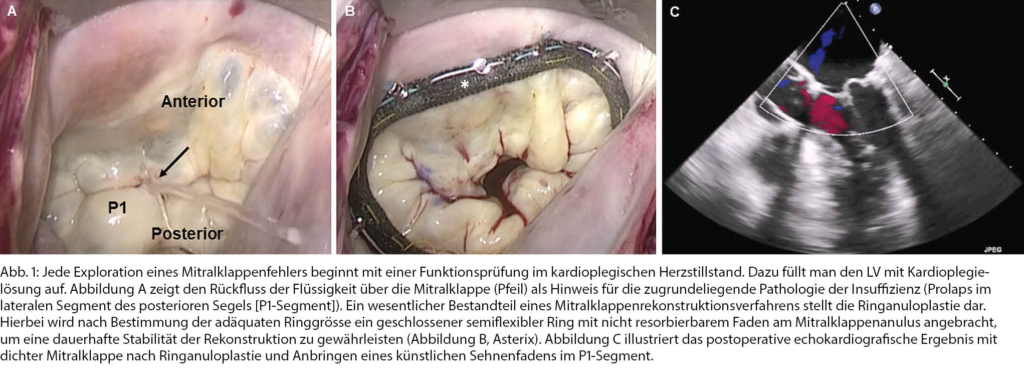
Die operativen Mitralklappenrekonstruktionsverfahren basieren auf dem zunehmenden Verständnis der zugrundeliegenden Pathologie des Mitralklappenapparates, die bereits in den 1970er-Jahren von Alain Carpantier analysiert und klassifiziert wurde [8]. Ein Beispiel hierfür bietet ein 47-jähriger Architekt, der sich aufgrund von wiederholten Palpitationen und wegen eines durch den Hausarzt auskultierten bandförmigen Systolikums einer kardiologischen Abklärung unterzog. In der transthorakalen Echokardiografie (TTE) imponierte eine schwere Mitralklappeninsuffizienz bei Prolaps des posterioren Mitralsegels mit exzessiver Segelbeweglichkeit aufgrund einer Sehnenfadenruptur («Flail Leaflet»). Darüber hinaus zeigte sich eine signifikante Dilatation des LV (LV endsystolischer Diameter >40 mm) und im Langzeit-Elektrokardiogramm liess sich ein paroxysmales Vorhofflimmern dokumentieren. Die Befunde wurden ausführlich im Herzteam besprochen. In Übereinstimmung mit den Europäischen Richtlinien wurde die Indikation zur kardiochirurgischen Sanierung des Mitralklappenvitiums gestellt (Tab. 1) [1]. Alle chirurgischen Eingriffe an der Mitralklappe erfolgen wenn möglich videoassistiert und minimalinvasiv via eine rechtsseitige laterale Minithorakotomie. Jede Exploration eines Mitralklappenfehlers beginnt mit einer Funktionsprüfung im kardioplegischen Herzstillstand. Dazu füllt man den linken Ventrikel mit Kardioplegielösung auf. Der Rückfluss über die Mitralklappe zeigt die zugrundeliegende Pathologie der Insuffizienz auf (Abb. 1A). Ein wesentlicher Bestandteil der Mitralklappenrekonstruktionsverfahren stellt die Ringanuloplastie dar. Hierbei wird nach Bestimmung der adäquaten Ringgrösse ein geschlossener semiflexibler Ring mit nicht resorbierbarem Faden an den Mitralklappenanulus angebracht, um eine dauerhafte Stabilität der Rekonstruktion zu gewährleisten (Abb. 1B). Anschliessend erfolgt eine Sehnenfadenplastik mit dem Ziel, den rupturierten Sehnenfaden zu ersetzen. Hierfür wird ein künstlicher Sehnenfaden zum einen durch den fibrösen Teil des involvierten Papillarmuskels und zum anderen durch das prolabierende Segel gestochen. Ein verlässliches, gutes Ergebnis nach einer Mitralklappenrekonstruktion ist daran gebunden, dass die Funktionsfähigkeit der Klappe schon intraoperativ mittels einer transösophagealen Echokardiografie (TEE) am schlagenden Herzen dokumentiert wird (Abb. 1C). Durch die in den vergangenen Jahrzenten stattgehabte technische Entwicklung im operativen Bereich respektive die gezielte Anwendung von chirurgischen Korrekturmassnahmen an der Mitralklappe werden heutzutage – je nach zugrundeliegender Klappenpathologie – Rekonstruktionsraten von bis zu 98 % erreicht [9, 10, 11].
Beispiel TEER (Transkatheter «Edge-to- Edge Repair») bei schwerer primärer MI und hohem Operations(OP)-Risiko
Obwohl Patient_innen mit einer symptomatischen schweren MI grundsätzlich eine unbestrittene OP-Indikation haben, wurden in der Studie «Euro Heart Survey on Valvular Heart Disease» nahezu 50 % der Betroffenen nicht operiert, wobei die überwiegende Mehrzahl unter ihnen an einer primären MI litt. Ursachen für ein konservatives Vorgehen waren das Alter, Komorbiditäten oder eine schlechte LVEF [12].
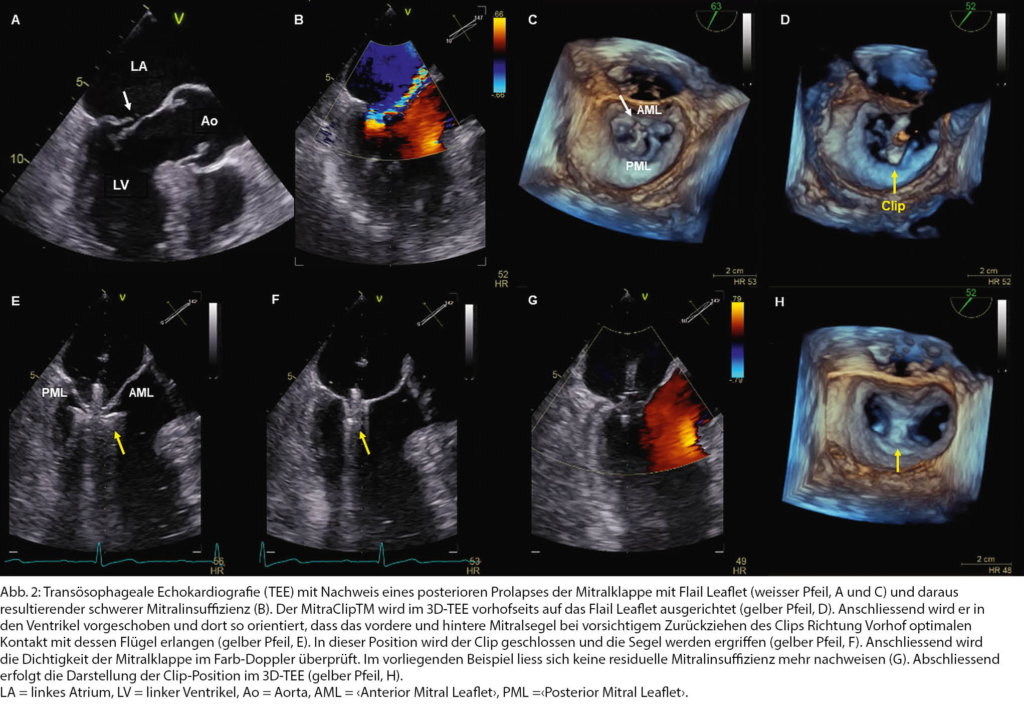
Ein Beispiel hierfür ist ein 81-jähriger Patient, bei dem seit längerem eine mittelschwere Aorteninsuffizienz bekannt war, die ihn im Alltag jedoch nicht beeinträchtigte. In letzter Zeit klagte er allerdings über zunehmende Anstrengungsdyspnoe. Seine Kardiologin fand neben der bekannten Aorteninsuffizienz neu eine schwere MI infolge eines «Flail Leaflets» bei vorbestehendem Mitralklappenprolaps (Abb. 2 A-C). Der Patient litt daneben an einer chronischen Bronchitis und einem obstruktiven Schlafapnoe-Syndrom. Die Befunde wurden im Herzteam besprochen. Ein operatives Vorgehen hätte nach Einschätzung der Kolleg_innen der Herzchirurgie einen Doppelklappen-Eingriff bedeutet, damit eine Entwöhnung von der Herzlungenmaschine hätte sicher gewährleistet werden können. Aufgrund des Alters und der Ko- Morbiditäten wurde das Risiko des Patienten für eine solch komplexe OP als zu hoch eingestuft. Da die MI als führendes Vitium und die echokardiografischen Befunde für eine TEER (z.B. mittel MitraClipTM, Abbott Laboratories, Abbott Park, IL) als günstig eingeschätzt wurden, konnte dem Patienten diese kathetertechnische Intervention angeboten werden (Tab. 1). Der MitraClipTM wird mit einem Katheter via Zugang in der Vena femoralis zum Herzen vorgebracht und über eine transseptale Punktion in den linken Vorhof geführt, von wo aus der Clip in den Bereich der undichten Stelle an der Mitralklappe positioniert und diese anschliessend mit dem Clip Vollnarkose und unter Ultraschallkontrolle mittels transösophagealer 3D-Echokardiografie (Abb. 2 D–H). Wenngleich diese Behandlungsmethode im Vergleich mit der operativen Sanierung in bisherigen Studien eine geringere Effektivität zeigte, kann die TEER bei Inoperabilität oder bei hohem OP-Risiko als sichere und sinnvolle Alternative angeboten werden [13, 14, 15].
Beispiel schwere sekundäre MI bei dilatativer Kardiomyopathie
Eine schwere sekundäre (oder funktionelle) MI ist mit einer ungünstigen Prognose assoziiert [16]. Sie ist typischerweise Folge einer LV-Geometriestörung bei herzinsuffizienten Patient_innen. In erster Linie sollte in dieser Situation versucht werden, die Herzinsuffizienz-Therapie zu optimieren [1, 17]. Persistiert trotz optimaler medikamentöser Therapie eine symptomatische schwere MI, ist eine Intervention an der Mitralklappe zu evaluieren [1].
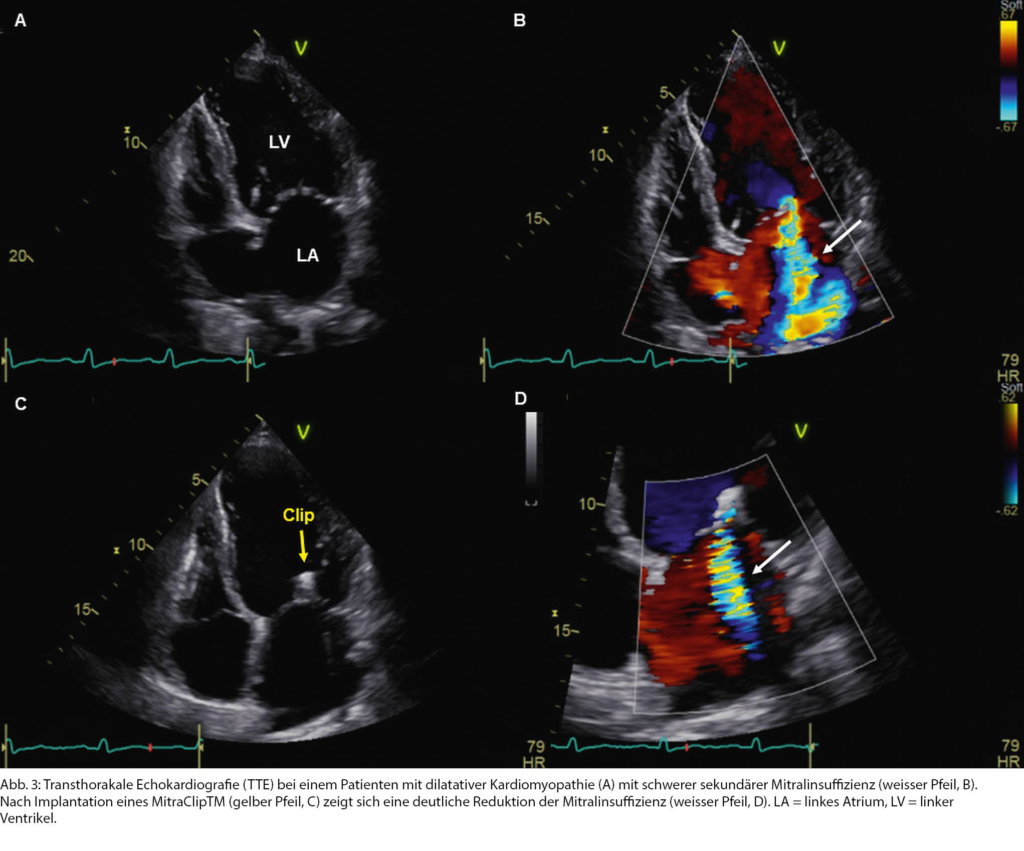
Dies traf auf einen 66-jährigen Patienten zu, bei dem eine dilatative Kardiomyopathie bekannt war. In letzter Zeit beklagte er eine zunehmende Leistungsintoleranz. Bei dilatiertem LV mit schwer eingeschränkter LVEF fand sich neu eine schwere sekundäre MI (Abb. 3 A, B). Bei hypotonen Blutdruckwerten mit Schwindelsymptomatik liess sich die medikamentöse Herzinsuffizienztherapie nicht weiter ausbauen. Da angiografisch keine behandlungsbedürftige koronare Herzkrankheit vorlag, wurde der Patient in Hinblick auf eine TEER abgeklärt (Tab. 1). In der TEE waren die anatomischen Verhältnisse hierfür geeignet. Die TEER mittels eines MitraClipTM konnte in der Folge erfolgreich durchgeführt werden, was zu einer deutlichen Reduktion der Mitralinsuffizienz führte (Abb. 3 C, D).
Zwei randomisierte Studien, COAPT- und Mitra-FR, haben die Sicherheit und Effektivität der TEER bei Patient_innen untersucht, bei denen Herzinsuffizienz-Symptome und eine schwere sekundäre MI trotz optimaler medikamentöser Therapie persistierten [18, 19]. Die beiden Studien zeigten unterschiedliche Resultate. Während bei der COAPT-Studie in der TEER-Gruppe eine signifikant niedrigere Mortalität und Herzinsuffizienz-Hospitalisationsrate im Vergleich zur ausschliesslich medikamentös behandelten Gruppe gefunden wurde, konnte die Mitra- FR-Studie keinen vergleichbaren Effekt aufzeigen [18, 19]. Als mögliche Erklärungen für diese Unterschiede wurden Differenzen in den Patientenzahlen, dem Studiendesign, technische Faktoren und nicht zuletzt auch Unterschiede in der Patientenselektion diskutiert. So war in der COAPT-Studie unter anderem das Ausmass der sekundären MI im Durchschnitt grösser und das LV enddiastolische Volumen dagegen kleiner als in der Mitra-FR-Studie [1]. Die Europäischen Richtlinien sehen vor, dass die Durchführung einer TEER bei Patient_innen mit schwerer sekundärer MI erwogen werden sollte, sofern bei ihnen die COAPT-Kriterien erfüllt sind [1, 20].
Aortenstenose
Indikationen zum Aortenklappenersatz
Das Auftreten von pektanginösen Beschwerden, Dyspnoe oder synkopalen Ereignissen stellt bei Patient_innen mit einer schweren AS eine klare Indikation zur Behandlung des Aortenklappenvitiums dar. Eine frühzeitige Intervention wird bei im Alltag beschwerdefreien Patient_innen mit schwerer AS empfohlen, wenn eine systolische LV-Dysfunktion (LVEF <50 %) vorliegt oder beim Belastungstest Symptome oder ein Blutdruckabfall auftreten. In Betracht gezogen werden sollte eine Intervention ferner bei asymptomatischen Patient_innen mit normaler LVEF und normalem Belastungstest, wenn das prozedurale Risiko niedrig ist und prognostisch ungünstige Parameter wie eine sehr schwere AS, schwere Klappenverkalkungen oder deutlich erhöhte BNP-Werte vorliegen [1].
Beispiel transfemorale TAVI («Transcatheter Aortic Valve Implantation»)
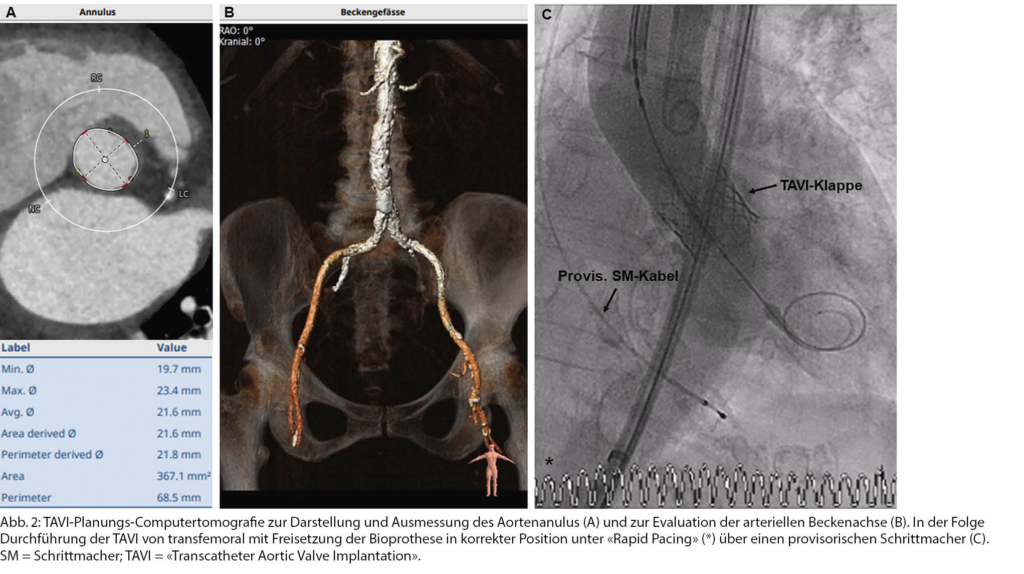
Der kathetergestützte Aortenklappenersatz (TAVI) hat als komplementäre Behandlungsoption zum chirurgischen Aortenklappenersatz (SAVR = «Surgical Aortic Valve Replacement») bewirkt, dass in den letzten Jahren deutlich mehr Patient_innen als früher wegen einer schweren Aortenstenose behandelt werden konnten [21]. Ein exemplarisches Beispiel hierfür ist eine 92-jährige Dame, die uns zur Evaluation eines Aortenklappenersatzes zugewiesen wurde. Bei progredienter Anstrengungsdyspnoe fand sich bei ihr bei konzentrisch hypertrophem LV mit normaler LVEF ein mittlerer Druckgradient von 49 mmHg über der Aortenklappe, was für eine fortgeschrittene Aortenstenose sprach. In der invasiven Abklärung fand sich zusätzlich eine koronare Zweigefässerkrankung. Aufgrund des Alters, ihrer Gebrechlichkeit und den Ko-Morbiditäten wurde im Herzteam besprochen, dass eine TAVI die beste therapeutische Option für die Patientin darstellen würde (Tab. 2). Die computertomografisch erfassten anatomischen Verhältnisse und Messparameter, insbesondere im Bereich des Aortenklappenanulus und der arteriellen Beckenachse, wurden bei ihr als geeignet zur Durchführung einer transfemoralen TAVI eingestuft (Abb. 4 A, B). Bei diesem Eingriff wird von der Leiste her kathetergestützt eine zusammengefaltete Aortenbioprothese eingeführt und unter Röntgenkontrolle im Bereich der nativen Aortenklappe in Position gebracht. Die Bioprothese wird anschliessend in korrekter Position unter «Rapid Pacing», das über einen provisorischen Schrittmacher erfolgt und einen passageren kardialen Stillstand bewirkt, freigesetzt (Abb. 4 C). Der Eingriff konnte bei der Patientin erfolgreich in Lokalanästhesie durchgeführt werden.
Mehrere randomisierte Studien, in die v.a. ältere Patient_innen eingeschlossen wurden, haben den prognostischen Nutzen der TAVI untersucht. Die Patient_innen wurden dabei aufgrund chirurgischer Risiko-Scores stratifiziert. Es zeigte sich eine Überlegenheit der TAVI gegenüber der medikamentösen Behandlung bei inoperablen Patient_innen [22] und eine Nichtunterlegenheit der TAVI verglichen zum SAVR bei hohem [23, 24] und bei intermediärem OP-Risiko, wobei die Beobachtungsperiode der Studien bis zu fünf Jahren dauerte [25, 26, 27].
Beispiel chirurgischer Aortenklappenersatz
Eine rüstige 70-jährige Patientin stellte sich aufgrund von progredienter belastungsabhängiger Dyspnoe bei ihrer Hausärztin vor. Synkopen oder pektanginöse Beschwerden wurden verneint. Vorbekannt waren lediglich ein allergisches Asthma bronchiale und eine arterielle Hypertonie. Nach Auskultation eines spindelförmigen Holosystolikums erfolgte die Überweisung der Patientin zur kardiologischen Abklärung mittels TTE. Hierbei zeigte sich eine schwere Aortenklappenstenose (mittlerer transvalvulärer Druckgradient 45 mmHg, maximale Flussgeschwindigkeit >4 m/s, errechnete Klappenöffnungsfläche 0,8 cm2). Im Rahmen einer abklärenden Herzkatheterunersuchung konnte eine koronare Herzerkrankung ausgeschlossen und die schwere Aortenklappenstenose bestätigt werden. Nach ausführlicher Besprechung sämtlicher Befunde wurde durch das Herzteam bei niedrigem Operationsrisiko («European System for Cardiac Operative Risk Evaluation» [EuroSCORE] II <4 %) leitlinienkonform ein chirurgischer biologischer Aortenklappenersatz empfohlen (Tab. 2) [1]. Der Wunsch der Patientin nach einer minimalinvasiven Therapie wurde berücksichtigt und der biologische Aortenklappenersatz durch eine fünf Zentimeter messende anterolaterale Thorakotomie durchgeführt. Über diese kleine Hautinzision lässt sich im Rahmen eines kardioplegen Herzstillstandes die degenerativ veränderte Aortenklappe exzidieren und eine biologische Aortenklappenprothese implantieren. Nach komplikationslosem postoperativem Verlauf konnte die Patientin nach einem fünftägigen Klinikaufenthalt in die ambulante Rehabilitation entlassen werden.
TAVI versus SAVR: anatomische, prozedurale und anamnestische Faktoren
Beim Entscheid, ob bei einer Patientin/einem Patienten ein chirurgischer oder ein transkathetertechnischer Aortenklappenersatz durchgeführt werden soll, werden in erster Linie das Alter und das individuelle OP-Risiko berücksichtigt (Tab. 2) [1].
Daneben müssen weitere anatomische, prozedurale und anamnestische Faktoren beachtet werden. Klinische und anatomische Merkmale, die eine kathetergestützte Therapie favorisieren, sind beispielsweise Gebrechlichkeit, vorausgegangene kardiochirurgische Eingriffe via mediane Sternotomie oder das Vorliegen einer Porzellanaorta. Eine bikuspide Aortenklappe oder eine ausgeprägte Verkalkung im Bereich des aortomitralen Übergangs sprechen wiederum für die Durchführung einer SAVR. Bei einer Aortenklappenendokarditis stellt die TAVI keine sinnvolle Option dar. Hier ist bei Indikation für einen Aortenklappenersatz die chirurgische Sanierung unabdingbar [1].
Die Wahl des optimalen therapeutischen Verfahrens lässt sich also nicht allein durch Eckdaten der Patient_innen und Errechnung von Risiko-Scores festlegen. Die Patient_innen müssen präoperativ möglichst ganzheitlich abgeklärt und erfasst werden. Die anschliessende Besprechung im interdisziplinären Herzteam erfordert erfahrene Diskussionspartner_innen, die sich auf Augenhöhe begegnen und die Expertise des Gegenübers wertschätzen. Nur so können Entscheide zum Wohle der Patient_innen getroffen werden.
Antworten zu den Lernfragen
1. Antwort d) ist richtig.
2. Antwort b) ist richtig.
Stadtspital Triemli
Klinik für Kardiologie
Birmensdorferstrasse 497
8063 Zürich
Alain.Bernheim@triemli.stzh.ch
Wir bedanken uns bei Dr. Olivier Roux für die Übersetzung
der Zusammenfassung ins Französische.
Historie
Manuskript akzeptiert: 13.02.2023
ORCID
Alain M. Bernheim
https://orcid.org/0000-0001-5513-3503
Raban V. Jeger
https://orcid.org/0000-0003-1290-5491
Die Prävalenz der schweren Mitralinsuffizienz und Aortenstenose nimmt im Alter zu, was angesichts der steigenden Lebenserwartung und den mit dem Alter verbundenen Komorbiditäten eine wachsende Herausforderung für die betreuenden Ärzt_innen darstellt.
Für beide Klappenvitien stehen heutzutage sowohl chirurgische als auch kathetertechnische Behandlungsmöglichkeiten zur Verfügung.
Ziel der Fallbesprechung im interdisziplinären Herzteam ist es, unter Berücksichtigung von Alter, anamnestischen und anatomischen Gegebenheiten eine optimale Therapieoption für jede/n Patientin/Patienten zu finden.
Als Leitlinie für die zu wählenden Behandlungsstrategien dienen die Empfehlungen der Europäischen Gesellschaften für Kardiologie und Herz- Thoraxchirurgie.
1. Vahanian A, Bayersdorf F, Praz F, et. al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43:561–632.
2. Nkomo VT, Gardin JM, Skelton TN, et al. Burden of valvular heart diseases: a population-based study. Lancet. 2006;368: 1005–1011.
3. Eveborn GW, Schirmer H, Heggelund G, et al. The evolving epidemiology of valvular aortic stenosis. the Tromsø study. Heart. 2013;99:396–400.
4. Bundesamt für Statistik. Statistiken der natürlichen Bevölkerungsbewegung BEVNAT. www.bfs.admin.ch/bfs/de/home/ statistiken/bevoelkerung/erhebungen/bevnat.html
5. Iung B, Delgado V, Rosenhek R, et al. Contemporary presentation and management of valvular heart disease: The EURObservational Research Programme Valvular Heart Disease II Survey. Circulation. 2019;140:1156–1169.
6. Kingue S, Ba SA, Balde D, et al. The VALVAFRIC study: a registry of rheumatic heart disease in Western and Central Africa. Arch Cardiovasc Dis. 2016;109:321–329.
7. Asgar AW, Mack MJ, Stone GW. Secondary mitral regurgitation in heart failure: pathophysiology, prognosis, and therapeutic considerations. J Am Coll Cardiol. 2015;65:1231–1248.
8. Carpentier A. Mitral valve reconstructive surgery. In: Jamieson SW, Shumway NE (eds) Operative surgery. Butterworth; London: 1977.
9. Holzhey DM, Seeburger J, Misfeld M, Borger MA, Mohr FW. Learning minimally invasive mitral valve surgery: a cumulative sum sequential probability analysisof 3895 operations from a single high-volume center. Circulation. 2013;128:483–491.
10. Seeburger J, Borger MA, Falk V, et al. Minimal invasive mitral valve repair for mitral regurgitation: results of 1339 consecutive patients. Eur J Cardiothorac Surg. 2008;34:760–765.
11. McClure RS, Cohn LH, Wiegerinck E, Couper GS, et al. Early and late outcomes in minimally invasive mitral valve repair: an eleven-year experience in 707 patients. J Thorac Cardiovasc Surg 2009;137:70–75.
12. Mirabel M, Iung B, Baron G, et al. What are the characteristics of patients with severe, symptomatic, mitral regurgitation who are denied surgery? Eur Heart J. 2007;28:1358–1365.
13. Feldman T, Foster E, Glower DD, et al. Percutaneous repair or surgery for mitral regurgitation. N Engl J Med. 2011;364:1395– 1406.
14. Buzzatti N, Van Hemelrijck M, Denti P, et al. Transcatheter or surgical repair for degenerative mitral regurgitation in elderly patients: a propensity-weighted analysis. J Thorac Cardiovasc Surg. 2019;158:86–94e81.
15. Lim DS, Reynolds MR, Feldman T, et al. Improved functional status and quality of life in prohibitive surgical risk patients with degenerative mitral regurgitation after transcatheter mitral valve repair. J Am Coll Cardiol. 2014;64:182–192.
16. Rossi A, Dini FL, Faggiano P, et al. Independent prognostic value of functional mitral regurgitation in patients with heart failure. A quantitative analysis of 1256 patients with ischaemic and non-ischaemic dilated cardiomyopathy. Heart. 2011;97: 1675–1680.
17. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42:3599–3726.
18. Obadia JF, Messika-Zeitoun D, Leurent G, et al. Percutaneous repair or medical treatment for secondary mitral regurgitation. N Engl J Med. 2018;379:2297–2306.
19. Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med. 2018;379:2307–2318.
20. Coats AJS, Anker SD, Baumbach A, et al. The management of secondary mitral regurgitation in patients with heart failure: a joint position statement from the Heart Failure Association (HFA), European Association of Cardiovascular Imaging (EACVI), European Heart Rhythm Association (EHRA), and European Association of Percutaneous Cardiovascular Interventions (EAPCI) of the ESC. Eur Heart J. 2021;42:1254–1269.
21. Carroll JD, Mack MJ, Vemulapalli S, et al. STS-ACC TVT Registry of transcatheter aortic valve replacement. J Am Coll Cardiol. 2020;76:2492–2516.
22. Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597–1607.
23. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187–2198.
24. Mack MJ, Leon MB, Smith CR, et al. 5-year outcomes of transcatheter aortic valve replacement or surgical aortic valve replacement for high surgical risk patients with aortic stenosis (PARTNER 1): a randomised controlled trial. Lancet. 2015; 385:2477–2484.
25. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2016;374:1609–1620.
26. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or transcatheter aortic valve replacement in intermediate-risk patients. N Engl J Med. 2017;376:1321–1331.
27. Makkar RR, Thourani VH, Mack MJ, et al. Five-year outcomes of transcatheter or surgical aortic-valve replacement. N Engl J Med. 2020;382:799–809.
PRAXIS
- Vol. 112
- Ausgabe 9
- Juli 2023