- Update zum Delir: Risikofaktoren, Management und Biomarker
Das Delir ist in nahezu allen Fachbereichen im Krankenhaus anzutreffen. Die Prävalenz variiert zwischen 20 und 40 % auf internistischen und chirurgischen Bettenstationen und über 50–60 % in der Palliativmedizin und auf Intensivstationen. Das Delir ist charakterisiert durch eine Aufmerksamkeits- und Bewusstseinsstörung sowie kognitive Störung mit akutem Auftreten und fluktuierendem Verlauf. Menschen mit Delir haben schlechtere klinische Ergebnisse, unter anderem eine höhere Mortalität und Pflegebedürftigkeit nach Entlassung. In dieser Übersicht werden zunächst die klinischen und pathophysiologischen Grundlagen des Delirs aufgearbeitet. Im Anschluss erfolgt eine ausführliche Darstellung individueller Risikoprofile anhand einer prospektiven spitalweiten Kohortenstudie (Delir-Path), die am Universitätsspital Zürich durchgeführt wurde. Danach erfolgen ein kurzes Update zu Diagnose und Management des Delirs und abschliessend ein Ausblick, wie Neurophysiologie und Blut-Biomarker künftig die Delirversorgung ergänzen können.
Einführung
Das Delir ist das häufigste neuropsychiatrische Syndrom bei hospitalisierten Personen [1]. Die Häufigkeit hängt von der untersuchten Spitalpopulation ab. Sie liegt auf internistischen und chirurgischen Bettenstationen bei 20–40 % [2, 3] und bei über 50–60 % in der Palliativmedizin [4] und auf Intensivstationen [5]. Klinisch zeigen sich akut und im Verlauf fluktuierende Störungen kognitiver Funktionen und neuropsychologische Defizite (Kasten 1) [6, 7]. Zum Delir führen ein oder meistens mehrere medizinische Auslöser, auch Präzipitationsfaktoren genannt. Systemische Trigger-Faktoren, zum Beispiel eine Sepsis oder Leberfunktionsstörung, oder eine primär hirnorganische Ursache, zum Beispiel ein Schlaganfall oder Schädel-Hirn-Trauma, führen zu einer Kaskade an pathophysiologischen Prozessen im Gehirn. Ein Delir kann auch post-operativ auftreten und muss gegenüber anderen post-operativen neurokognitiven Störungen abgegrenzt werden (hierzu zählen z.B. die verzögerte neurokognitive Erholung und die postoperative kognitive Dysfunktion) [8, 9]. Der Begriff Delir ist zunächst eine Sammelbezeichnung für ein neuropsychiatrisches Syndrom. Zur Vereinheitlichung der Begriffe wird von der Nutzung anderer, früher geläufiger Bezeichnungen, wie z.B. akute organische Psychose oder Durchgangssyndrom, abgeraten [10]. Die Manifestation bei unterschiedlichsten Ursachen und in verschiedenen Fachdisziplinen hat zur Herausbildung einiger krankheitsspezifischer Bezeichnungen für das Delir geführt, z.B. hepatische und metabolische [11], oder septische Enzephalopathie [12]. Diese Herangehensweise unterstreicht die naheliegende Annahme, dass unterschiedliche pathophysiologische Prozesse zum Delir führen und unterschiedliche Behandlungsmöglichkeiten existieren, führt aber auch dazu, dass Personen mit ähnlicher neuropsychiatrischer Symptomatik in den inzwischen verfügbaren grossen Delirstudien bislang keine Berücksichtigung fanden. Wichtig ist die Beachtung der Delirkriterien nach DSM-5, da es akute kognitive Störungen gibt, die die Kriterien nicht erfüllen [13]. Eine Übersicht über die pathophysiologischen Prozesse, auch Endotypen genannt, wird in Kasten 2 gegeben [14]. All diese Mechanismen führen zu einer Systemintegrationsstörung und einer Desorganisation neuronaler Netzwerke [3]. Menschen mit Delir haben unabhängig von der Grunderkrankung und demografischen Faktoren eine erhöhte kurz- und mittelfristige Mortalität und Pflegebedürftigkeit nach Spitalaustritt [15, 16, 17]. Viele Patientinnen und Patienten, aber auch ihre Angehörigen und Pflegepersonen, erinnern das Delir als traumatische Erfahrung [18]. Ausserdem ist das Delir unter anderem aufgrund des hohen Pflegeaufwandes, verlängerter Aufenthaltsdauer, medizinischer Komplikationen und hoher post-stationärer Pflegebedürftigkeit mit hohen Kosten verbunden [19, 20]. Im Rahmen dieser Übersicht kann nicht näher auf die Besonderheiten des Delirs in der Pädiatrie eingegangen werden, hierzu sei auf entsprechende Übersichten verwiesen [21, 22].
Risikofaktoren des Delirs
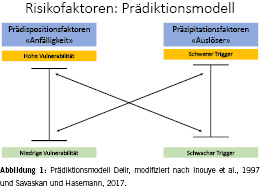
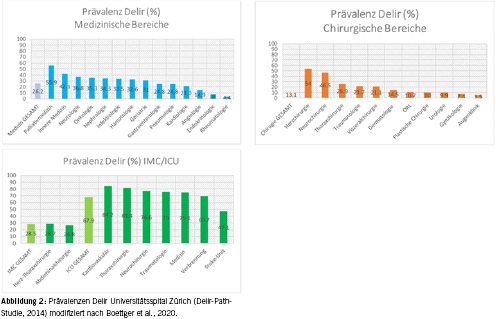
Es gibt mehrere Möglichkeiten, die Risikofaktoren für das Delir einzuteilen. Eine Möglichkeit ist die Einteilung nach modifizierbaren und nicht modifizierbaren Faktoren, eine andere nach pharmakologischen und nicht pharmakologischen Faktoren. Im Folgenden soll jedoch näher auf die Unterteilung nach prädisponierenden (Anfälligkeit) und präzipitierenden (Auslöser) Faktoren eingegangen werden. Ein lange etabliertes Delir-Prädiktionsmodell beschreibt das Verhältnis dieser Faktoren [23]: Bei hoher Prädisposition reicht ein relativ schwacher Auslöser aus, wohingegen bei niedriger Prädisposition ein schwerwiegender vorhanden sein muss (Abb. 1). Das am weitesten verbreitete Risikoprofil allgemein hospitalisierter Personen umfasst fortgeschrittenes Lebensalter, vorbestehende Demenz, reduzierter funktioneller Status (z.B. Seh-/Hörstörung und Immobilität) bei multiplen Komorbiditäten und Polypharmazie [24]. Zwischen der Demenz und dem Delir besteht eine bidirektionale Beziehung: Menschen mit Demenz haben ein erhöhtes Risiko für ein Delir und Menschen mit Delir haben ein erhöhtes Risiko, eine Demenz zu entwickeln [25, 26]. Es ist hervorzuheben, dass die pathologischen Begleiterscheinungen im Rahmen geriatrischer Syndrome ausschlaggebend sind und nicht das Alter allein [27, 28]. In einer prospektiven Kohortenstudie am Universitätsspital Zürich wurden Risikoprofile von Patientinnen und Patienten mit Delir in über 30 Fachabteilungen untersucht (Delir-Path) [29]. Die Prävalenz variierte zwischen den betreuenden chirurgischen und medizinischen Fachabteilungen und erreichte die höchsten Zahlen auf den Intensivstationen (Abb. 2) [30]. Je nach Fachabteilung konnten individuelle Risikoprofile herausgearbeitet werden. Bei Schlaganfallpatientinnen und -patienten konnte dabei ein Krankheits-spezifisches Profil gefunden werden, bei dem vor allem die Schlaganfallschwere, die Art des Schlaganfalls und das Auftreten epileptischer Anfälle die Wahrscheinlichkeit für ein Delir erhöht ist [19]. Auf der neurologischen Bettenstation waren hingegen ein höheres Lebensalter (≥ 65 Jahre), epileptische Anfälle und ein reduzierter funktioneller Status entscheidend für das Risiko, ein Delir zu entwickeln [31]. In der Neurochirurgie waren eine reduzierte kognitive Reserve durch Schlaganfallvorgeschichte und Herzinsuffizienz bei gleichzeitigem Vorhandensein von Schädel-Hirn-Trauma und intrakranieller Blutung unter den relevantesten Risikofaktoren [32]. In der Neurochirurgie zeigten sich auch spezifisch chirurgische Faktoren, die zu einer Erhöhung des Delirrisikos führen, wie mehrere Eingriffe, künstliche Beatmung und Bedarf einer intensivmedizinischen Behandlung als Risikofaktoren. Im Kontrast hierzu ergab sich auf der kardiologischen Bettenstation ein typisch geriatrisches Risikoprofil mit Demenz, funktioneller Behinderung und höherem Lebensalter, bei geringerer Relevanz der kardiologischen Grunderkrankung [33]. Zuletzt ist von den Bettenstationen auch die Kohorte der Hepatologie und Gastroenterologie zu erwähnen, bei der sich besonders deutlich zeigte, dass auch junge Patientinnen und Patienten bei einem entsprechend starken auslösenden Faktoren ein Delir entwickeln können, etwa bei akutem Nierenversagen oder eine Leberfunktionsstörung [34]. Eine grosse und wichtige Untergruppe von Patientinnen und Patienten entwickelt bei der Behandlung auf der Intensivstation ein Delir [35]. Zusätzlich zu den bereits genannten allgemeinen Risikofaktoren sind bei Intensivpatientinnen und -patienten besonders sedierende Medikation, maschinelle Beatmung und akute metabolische Störungen hervorzuheben. Im Delir-Path konnte gezeigt werden, dass der Anteil von Patientinnen und Patienten unter 65 Jahren mit Delir auf den Intensivstationen besonders hoch ist (70 bis über 80 %) [36].
Diagnose und Verlaufsbeurteilung des Delirs
Der Goldstandard zur Diagnose ist die ärztliche Untersuchung mit Prüfung der Diagnosekriterien nach DSM-5 [7]. Es existieren über 50 verschiedene Assessment-Instrumente zur Erkennung des Delirs mit jeweils individuellen methodischen Stärken und Schwächen [10]. Es gibt keine Allround-Skala, die für alle Patientenpopulationen und Einrichtungen gleichermassen geeignet ist. Eine systematische Übersicht hat sechs Instrumente als besonders hochwertig beurteilt (Kasten 3a): Confusion Assessment Method-Severity Score (CAM), Confusional State Examination (CSE), Delirium-O-Meter (D-O-Meter), Delirium Observation Scale (DOS), Delirium Rating Scale (DRS), and Memorial Delirium Assessment Scale (MDAS) [37]. Auch der 4-«A»-Test (4AT), eine relativ neue Skala, ist aufgrund der schnellen Durchführbarkeit und einfachen Anwendung besonders vielversprechend (Kasten 3b) [38]. Es werden zunehmend Skalen entwickelt, die auch die Perspektive der Angehörigen einbeziehen, z.B. der Family CAM (FAM-CAM) [39]. Es ist zu beachten, dass die Skalen sich auf unterschiedliche Versionen des DSM beziehen, der DOS z.B. auf DSM-IV, der CAM hingegen auf DSM-III-Kriterien und die Detektionsraten daher variieren können [40]. Die Nützlichkeit einer Skala hängt dabei vom Setting (z.B. Besonderheiten in der Intensivmedizin, bei Menschen mit Demenz und bei Alkohol-Entzug) und von spezifischen Anforderungen ab (z.B. Einschätzung motorischer Subtyp und Schweregrad). Für die Intensivstation wird zur Erhöhung der richtig-positiv erkannten Fälle ein kombiniertes Assessment des Bewusstseins, z.B. mit Richmond Agitation-Sedation Scale (RASS) und CAM-ICU und Intensive Care Delirium Screening Checklist (ICDSC) empfohlen [5, 41]. Bei Personen mit Demenz ist die Differenzialdiagnose eines zusätzlich bestehenden Delirs besonders herausfordernd. Von den verfügbaren Beurteilungsinstrumenten zeigte der CAM eine hohe Spezifität (96–100 %) und moderate Sensitivität (77 %) [42]. Die klinische Präsentation des Delirs lässt sich in verschiedene motorische Subtypen einteilen. Beschrieben werden der hyperaktive, hypoaktive, gemischt hyperaktiv-hypoaktive Subtyp und das Delir ohne spezifischen motorischen Subtyp [43]. Zudem werden Extremformen der motorischen Subtypen als «kataton gehemmt» oder «kataton übererregt» bezeichnet [3]. Einige Skalen, z.B. die Delirium Motor Subtype Scale (DMSS)-4 [44], erlauben die Zuordnung zu einem motorischen Subtyp.
Delir-Management
Das erste Ziel ist die Prävention des Delirs. Hierzu müssen Risikopatientinnen und -patienten identifiziert werden, wozu die individuellen Risikoprofile dienen. Praktisch helfen dabei routinemässige Screenings bei Spitaleintritt, frühzeitige Versorgung mit Hilfsmitteln, adäquate Schmerztherapie und die Vermeidung delirauslösender Substanzen [45, 46]. Derzeit gibt es keine Evidenz für eine routinemässige pharmakologische Delirprävention mit Haloperidol oder atypischen Neuroleptika [46, 47]. Wenn das Delir eingetreten ist, steht an erster Stelle die Suche nach einer oder mehreren behandelbaren Ursachen mittels klinischer Untersuchung und Zusatzdiagnostik (Kasten 4). Parallel ist frühzeitig ein nicht-pharmakologisches Delirmanagement mit Multi-Komponenten-Programm indiziert [48]. Hierzu gehören Reorientierung, das Einsetzen fester Bezugspflege, Einbinden der Angehörigen, falls möglich Ausschleichen/Absetzen delirbegünstigender Medikamente (z.B. Anticholinergika) und adäquate Schmerzkontrolle [49, 50]. Auf der Intensivstation hat sich das ABCDEF-Schema bewährt [51]: «Assessment» für die Behandlung von Schmerz, «Breathing» steht für Aufwach- und Spontanatmungsversuche, «Choice» steht für die gezielte delirreduzierende Analgosedation, «Delirium»-Management wie bereits ausgeführt, «Early» steht für Frühmobilisation und «Family» für das Einbeziehen und Stärken von Familie und anderen Bezugspersonen. Hinsichtlich sedierender Medikation gibt es Evidenz für einen Vorteil durch Einsatz von Dexmedetomidin in spezifischen Situationen, z.B. bei Personen mit erschwerter Extubation [52]. Auch nach Eintreten eines Delirs gibt es keine Belege für den routinemässigen Einsatz von sedierender oder antipsychotischer Medikation zur Verkürzung der Delirdauer oder Verringerung des Delir-Schweregrades [52, 53]. Je nach Auslöser des Delirs sollte eine spezifische Therapie eingeleitet werden. So unterscheidet sich das Management des Alkohol- und Opiat-Entzugsdelirs deutlich vom Management anderer Delirunterformen [54]. Insbesondere der Einsatz von Benzodiazepinen beim Alkoholentzugsdelir sollte hervorgehoben werden, weil dieser bei anderen Delirursachen aufgrund seiner potenziell delirverstärkenden Wirkung nicht allgemein empfohlen wird [55, 56, 57]. Der Einsatz von Antipsychotika beim Delir sollte unter anderem bei starker Agitation, Angst, Eigen- und Fremdgefährdung erwogen werden [58].
Ausblick: Neurophysiologie und Biomarker
In diesem Abschnitt soll eine Auswahl an neuen Studien zur Neurophysiologie und Blut-Biomarkern des Delirs vorgestellt werden. Die neurophysiologischen Erkenntnisse können helfen, die Pathophysiologie des Delirs besser zu verstehen [59]. Das EEG hilft routinemässig in der Differenzialdiagnostik bei der Frage nach epileptischer Aktivität. Darüber hinaus ist das EEG, auch kombiniert mit anderen neurophysiologischen Techniken, z.B. der transkraniellen Magnetstimulation (TMS), eine vielversprechende Option zur Delirerkennung, Risikoeinschätzung und Verlaufsbeurteilung. In einer kardiochirurgischen Kohorte konnte gezeigt werden, dass die relative frontoparietale Delta-Aktivität bei Personen mit Delir höher ist als bei Personen ohne Delir [60]. Bei intubiert-beatmeten
Patientinnen und Patienten, bei denen die Delir-Erkennung besonderes herausfordernd ist, kann die Kombination verschiedener EEG-Parameter (u.a. Delta- und hochfrequente Beta-Variabilität) zur Unterscheidung zwischen Koma und (hypoaktivem) Delir helfen [61]. Auch zur Unterscheidung zwischen Patienten mit Demenz und Patienten mit Demenz und Delir gibt es Anhaltspunkte für einen Zusatznutzen des EEGs [62, 63]. Mittels kombinierter Anwendung von TMS und EEG wurden Eigenschaften kortikaler Netzwerke gefunden, die bei Schlaganfallpatientinnen und -patienten mit einer höheren Wahrscheinlichkeit eines Delirs im Verlauf assoziiert sind [64]. Ein weiteres Forschungsfeld ist die EEG-gesteuerte Narkosetiefe zur Reduktion des postoperativen Delirs. Auch wenn hierzu inzwischen grosse randomisiert-kontrollierte Studien durchgeführt wurden [65, 66], wird der Zusatznutzen für die Delir-Prävention noch kontrovers diskutiert [67].
Zuletzt seien noch die aktuellen Entwicklungen auf dem Gebiet der Blut-Biomarker vorgestellt. Diese Biomarker haben den Zweck, bei der Diagnose, der Prognose und Verlaufsbeurteilung des Delirs zu unterstützen und sind dank der einfachen wiederholten Materialgewinnung von grossem Interesse. Die meiste Evidenz findet sich zu Interleukin-6 (IL-6), C-reaktivem Protein (CRP) und Kortisol, wobei die meisten Studien diese Marker bei Personen ohne Demenz oder andere neuropsychiatrische Komorbiditäten untersuchten [68]. Die meisten Studien zu IL-6 wurden in chirurgischen Kohorten durchgeführt und zeigten zum Teil eine positive Assoziation zwischen dem Vorhandensein eines Delirs und der Höhe von IL-6. Auch ein Zusammenhang zwischen der Höhe des CRP und dem Auftreten eines Delirs wurde in manchen Studien festgestellt. Bislang zeigten sich für die genannten und auch die übrigen untersuchten Marker inkonsistente Befunde und somit keine überzeugende Evidenz für eine Anwendung in der klinischen Routine. Eine Herausforderung dieser Studien sind die häufig zum Delir parallel anzutreffenden Störvariablen wie systemische Inflammation, kognitive Dysfunktion und Trauma. Ein vielversprechender neuerer Biomarker ist das Leichtketten-Neurofilament (Neurofilament light chain, NfL). Bei NfL handelt es sich um ein neuronales zytoplasmatisches Protein, das vor allem in grossen myelinisierten Axonen exprimiert wird und bei neurologischen Erkrankungen im Serum erhöht sein kann als Ausdruck von Neurotoxizität [69]. In einer chirurgischen Kohorte zeigte sich, dass erhöhtes NfL mit dem Delir-Schweregrad assoziiert war, auch nach Adjustierung der Höhe inflammatorischer Marker [70]. In einer weiteren chirurgischen Kohorte wurde eine Assoziation zwischen präoperativ erhöhtem NfL und einer höheren Wahrscheinlichkeit für ein postoperatives Delir gezeigt [71]. In zwei Studien mit Intensivpatientinnen und -patienten (eine davon bei an COVID-19-Erkrankten) konnte gezeigt werden, dass eine Assoziation zwischen NfL-Spiegel und Delir-Dauer besteht [72, 73]. Die Beziehung zu anderen Risikofaktoren des Delirs und der klinische Nutzen werden derzeit in weiteren Studien untersucht.
Im Artikel verwendete Abkürzungen
CAM Confusion Assessment Method
CRP C-reaktives Proteon
EEG Elektroenzephalografie
NfL Leichtketten-Neurofilament
TMS Transkranielle Magnetstimulation
Oberarzt
Universitätsklinik Balgrist
Neurologie und Paraplegie
Forchstrasse 340
8008 Zürich
carlmoritz.zipser@balgrist.ch
Historie
Manuskript akzeptiert: 01.02.2023
Interessenskonflikte
Es bestehen keine Interessenskonflikte
- Das Delir ist ein sehr häufiges neuropsychiatrisches Syndrom bei hospitalisierten Patienten.
- Die Kenntnis individueller Risikoprofile erleichtert die Früherkennung des Delirs.
- Blut- Biomarker und Neurophysiologie können in Zukunft die Delirversorgung ergänzen.
1. Inouye SK, Westendorp RG, Saczynski JS. Delirium in elderly people. Lancet. 2014;383(9920):911–922.
2. Vasilevskis EE, Han JH, Hughes CG, Ely EW. Epidemiology and risk factors for delirium across hospital settings. Best Pract Res Clin Anaesthesiol. 2012;26(3):277–287.
3. Maldonado JR. Delirium pathophysiology: An updated hypothesis of the etiology of acute brain failure. Int J Geriatr Psychiatry. 2018;33(11):1428–1457.
4. Watt CL, Momoli F, Ansari MT, et al. The incidence and prevalence of delirium across palliative care settings: A systematic review. Palliat Med. 2019;33(8):865–877.
5. Stollings JL, Kotfis K, Chanques G, Pun BT, Pandharipande PP, Ely EW. Delirium in critical illness: clinical manifestations, outcomes, and management. Intensive Care Med. 2021;47(10):1089–1103.
6. Wilson JE, Mart MF, Cunningham C, et al. Delirium. Nat Rev Dis Primers. 2020;6(1):90.
7. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 5th Ed. 2013.
8. Migirov A, Chahar P, Maheshwari K. Postoperative delirium and neurocognitive disorders. Curr Opin Crit Care. 2021;27(6).
9. Schenning KJ, Deiner SG. Postoperative Delirium in the Geriatric Patient. Anesthesiol Clin. 2015;33(3):505–516.
10. Savaskan E, Baumgartner M, Georgescu D, et al. [Recommendations for the Prevention, Diagnostic and Therapy of Delirium in the Elderly]. Praxis (Bern 1994). 2016;105(16):941–952.
11. Wijdicks EFM. Metabolic Encephalopathy: Behind the Name. Neurocrit Care. 2018;29(3):385–387.
12. Gofton TE, Young GB. Sepsis-associated encephalopathy. Nat Rev Neurol. 2012. 8(10):557–566.
13. Slooter AJC. Delirium, what’s in a name? Br J Anaesth. 2017;
119(2):283–285.
14. Oldham MA, Slooter AJC, Ely EW, Crone C, Maldonado JR, Rosenthal LJ. An Interdisciplinary Reappraisal of Delirium and Proposed Subtypes. J Acad Consult Liaison Psychiatry. 2022.
15. Zipser CM, Spiller TR, Hildenbrand FF, et al. Discharge Destinations of Delirious Patients: Findings From a Prospective Cohort Study of 27,026 Patients From a Large Health Care System. J Am Med Dir Assoc. 2022;23(8):1322–1327.e2.
16. Witlox J, Eurelings LS, de Jonghe JF, Kalisvaart KJ, Eikelenboom P, van Gool WA. Delirium in elderly patients and the risk of postdischarge mortality, institutionalization, and dementia: a meta-analysis. JAMA. 2010;304(4):443–451.
17. Eeles EM, Hubbard RE, White SV, O’Mahony MS, Savva GM, Bayer AJ. Hospital use, institutionalisation and mortality associated with delirium. Age Ageing. 2010;39(4):470–475.
18. Breitbart W, Gibson C, Tremblay A. The delirium experience: delirium recall and delirium-related distress in hospitalized patients with cancer, their spouses/caregivers, and their nurses. Psychosomatics. 2002;43(3):183–194.
19. Zipser CM, Deuel JW, Held JPO, et al. Economic Impact of Poststroke Delirium and Associated Risk Factors: Findings From a Prospective Cohort Study. Stroke. 2021;52(10):3325–3334.
20. Leslie DL, Inouye SK. The importance of delirium: economic and societal costs. J Am Geriatr Soc. 2011;59 Suppl 2:S241–S243.
21. Traube C, Silver G, Gerber LM, et al. Delirium and Mortality in Critically Ill Children: Epidemiology and Outcomes of Pediatric Delirium. Crit Care Med. 2017;45(5):891–898.
22. Hatherill S, Flisher AJ. Delirium in children and adolescents: A systematic review of the literature. J Psychosom Res. 2010; 68(4):337–344.
23. Inouye SK, Charpentier PA. Precipitating factors for delirium in hospitalized elderly persons. Predictive model and interrelationship with baseline vulnerability. JAMA. 1996;275(11):852–857.
24. Fong TG, Inouye SK, Jones RN. Delirium in older persons. N Engl J Med;2006;354(11):1157–1165.
25. Fong TG, Inouye SK, Jones RN. Jones, Delirium, Dementia, and Decline. JAMA Psychiatry. 2017;74(3):212–213.
26. Fong TG, Davis D, Growdon ME, Albuquerque A, Inouye SK, et al. The interface between delirium and dementia in elderly adults. Lancet Neurol. 2015;14(8):823–832.
27. Inouye SK, Studenski S, Tinetti ME, Kuchel GA, et al. Geriatric syndromes: clinical, research, and policy implications of a core geriatric concept. J Am Geriatr Soc. 2007;55(5):780–791.
28. von Renteln-Kruse W. Geriatrische Syndrome – eine diagnostische und therapeutische Herausforderung, in Medizin des Alterns und des alten Menschen. W. von Renteln-Kruse (Hrsg.). Steinkopff; Heidelberg: 2004; 61–66.
29. Schubert M, Schürch R, Boettger S, et al. A hospital-wide evaluation of delirium prevalence and outcomes in acute care patients – a cohort study. BMC Health Serv Res. 2018;18(1):550.
30. Boettger S, Zipser CM, Bode L, et al. The prevalence rates and adversities of delirium: Too common and disadvantageous. Palliat Support Care. 2021;19(2):161–169.
31. Zipser CM, Deuel J, Ernst J, et al. Predisposing and precipitating factors for delirium in neurology: a prospective cohort study of 1487 patients. J Neurol, 2019. 266(12):3065–3075.
32. Zipser CM, Deuel J, Ernst J, et al. The predisposing and precipitating risk factors for delirium in neurosurgery: a prospective cohort study of 949 patients. Acta Neurochir (Wien). 2019;161(7):1307–1315.
33. Zipser CM, Hildenbrand FF, Haubner B, et al. Predisposing and Precipitating Risk Factors for Delirium in Elderly Patients Admitted to a Cardiology Ward: An Observational Cohort Study in 1,042 Patients. Front Cardiovasc Med. 2021;8:686665.
34. Hildenbrand FF, Murray FR, von Känel R, et al. Predisposing and precipitating risk factors for delirium in gastroenterology and hepatology: Subgroup analysis of 718 patients from a hospital-wide prospective cohort study. Front Med. 2022;9.
35. Girard TD, Pandharipande PP, Ely EW. Delirium in the intensive care unit. Crit Care. 2008;12 Suppl 3(Suppl 3):S3.
36. Zipser CM, Seiler A, Deuel J, et al. Hospital-wide evaluation of delirium incidence in adults under 65 years of age. Psychiatry Clin Neurosci. 2020;74(12):669–670.
37. Jones RN, Cizginer S, Pavlech L, et al. Assessment of Instruments for Measurement of Delirium Severity: A Systematic Review. JAMA Intern Med. 2019;179(2):231–239.
38. Bellelli G, Morandi A, Davis DH, et al. Validation of the 4AT, a new instrument for rapid delirium screening: a study in 234 hospitalised older people. Age Ageing. 2014;43(4):496–502.
39. Mailhot T, Darling C, Ela J, Malyuta Y, Inouye SK, Saczynski J. Family Identification of Delirium in the Emergency Department in Patients With and Without Dementia: Validity of the Family Confusion Assessment Method (FAM-CAM). J Am Geriatr Soc. 2020;68(5):983–990.
40. Adamis D, Rooney S, Meagher D, Mulligan O, McCarthy G. A comparison of delirium diagnosis in elderly medical inpatients using the CAM, DRS-R98, DSM-IV and DSM-5 criteria. Int Psychogeriatr. 2015;27(6):883–889.
41. Kotfis K, Marra A, Ely EW. ICU delirium – a diagnostic and therapeutic challenge in the intensive care unit. Anaesthesiol Intensive Ther. 2018;50(2):160–167.
42. Morandi A, McCurley J, Vasilevskis EE, et al. Tools to detect delirium superimposed on dementia: a systematic review. J Am Geriatr Soc. 2012;60(11):2005–2013.
43. Meagher D. Motor subtypes of delirium: past, present and future. Int Rev Psychiatry. 2009;21(1):59–73.
44. Meagher D, Moran M, Raju B, et al. A new data-based motor subtype schema for delirium. J Neuropsychiatry Clin Neurosci. 2008;20(2):185–193.
45. Hshieh TT, Yang T, Gartaganis SL, Yue J, Inouye SK. Hospital Elder Life Program: Systematic Review and Meta-analysis of Effectiveness. Am J Geriatr Psychiatry. 2018;26(10):1015–1033.
46. Siddiqi N, Harrison JK, Clegg A, Teale EA, Young J, Taylor J, Simpkins SA, et al. Interventions for preventing delirium in hospitalised non-ICU patients. Cochrane Database Syst Rev. 2016;3:Cd005563.
47. Oh ES, Needham DM, Nikooie R, et al. Antipsychotics for Preventing Delirium in Hospitalized Adults: A Systematic Review. Ann Intern Med. 2019;171(7):474–484.
48. Taulbee LR, Folsom JC. Reality orientation for geriatric patients. Hosp Community Psychiatry. 1966;17(5):133–135.
49. By the American Geriatrics Society 2015 Beers Criteria Update Expert Panel. American Geriatrics Society 2015 Updated Beers Criteria for Potentially Inappropriate Medication Use in Older Adults. J Am Geriatr Soc. 2015;63(11):2227–2246.
50. Barr J, Fraser GL, Puntillo K, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med. 2013;41(1):263–306.
51. Hipp DM, Ely EW. Pharmacological and nonpharmacological management of delirium in critically ill patients. Neurotherapeutics. 2012;9(1):158–175.
52. Devlin JW, Skrobik Y, Gélinas C, et al. Clinical Practice Guidelines for the Prevention and Management of Pain, Agitation/Sedation, Delirium, Immobility, and Sleep Disruption in Adult Patients in the ICU. Crit Care Med. 2018;46(9).
53. Nikooie R, Neufeld KJ, Oh ES, et al. Antipsychotics for Treating Delirium in Hospitalized Adults: A Systematic Review. Ann Intern Med. 2019;171(7):485–495.
54. Kosten TR, O’Connor PG. Management of drug and alcohol withdrawal. N Engl J Med. 2003;348(18):1786–1795.
55. Zaal IJ, Devlin JW, Hazelbag M, et al. Benzodiazepine-associated delirium in critically ill adults. Intensive Care Med. 2015;41(12): 2130–2137.
56. Lonergan E, Luxenberg J, Areosa Sastre A. Benzodiazepines for delirium. Cochrane Database Syst Rev. 2009(4):Cd006379.
57. Rothberg MB, Herzig SJ, Pekow PS, Avrunin J, Lagu T, Lindenauer PK, et al. Association between sedating medications and delirium in older inpatients. J Am Geriatr Soc. 2013;61(6):923–930.
58. National Institute for Health and Care Excellence: Guidelines, in Delirium: prevention, diagnosis and management. National Institute for Health and Care Excellence (NICE); London: 2019.
59. Shafi MM, Santarnecchi E, Fong TG, et al. Advancing the Neurophysiological Understanding of Delirium. J Am Geriatr Soc. 2017;65(6):1114–1118.
60. van der Kooi AW, Zaal IJ, Klijn FA, et al. Delirium detection using EEG: what and how to measure. Chest. 2015;147(1):94–101.
61. Williams Roberson S, Azeez NA, Taneja R, et al. Quantitative EEG signatures of delirium and coma in mechanically ventilated ICU patients. Clin Neurophysiol. 2022;146:40–48.
62. Wijnen VJM, Oudewortel L, van Luijtelaar G, Witlox J, Slooter AJC, van Gool WA. Feasibility and potential of a bedside mini-EEG for diagnosing delirium superimposed on dementia. Clin Neurophysiol. 2022;142:181–189.
63. Thomas C, Hestermann U, Walther S, et al. Prolonged activation EEG differentiates dementia with and without delirium in frail elderly patients. J Neurol Neurosurg Psychiatry. 2008;79(2):119–125.
64. Bai Y, Belardinelli P, Thoennes C, et al. Cortical reactivity to transcranial magnetic stimulation predicts risk of post-stroke delirium. Clin Neurophysiol. 2022;S1388–S12457.
65. Wildes TS, Mickle AM, Ben Abdallah A, et al. Effect of Electroencephalography-Guided Anesthetic Administration on Postoperative Delirium Among Older Adults Undergoing Major Surgery: The ENGAGES Randomized Clinical Trial. JAMA. 2019;321(5):473–483.
66. Radtke FM, Franck M, Lendner J, Krüger S, Wernecke KD, Spies CD. Monitoring depth of anaesthesia in a randomized trial decreases the rate of postoperative delirium but not postoperative cognitive dysfunction. Br J Anaesth. 2013;110:Suppl 1:i98–105.
67. Wildes TS, Avidan MS. Critical appraisal of ENGAGES: cognitive dissonance and anesthesia research. Ann Transl Med. 2019; 7(20):599.
68. Dunne SS, Coffey JC, Konje S, et al. Biomarkers in delirium: A systematic review. J Psychosom Res. 2021;147:110530.
69. Gaetani L, Blennow K, Calabresi P, et al. Neurofilament light chain as a biomarker in neurological disorders. J Neurol Neurosurg Psychiatry. 2019;90(8):870–881.
70. Casey CP, Lindroth H, Mohanty R, et al. Postoperative delirium is associated with increased plasma neurofilament light. Brain. 2020;143(1):47–54.
71. Fong TG, Vasunilashorn SM, Ngo L, et al. Association of Plasma Neurofilament Light with Postoperative Delirium. Ann Neurol. 2020;88(5):984–994.
72. Smeele PJ, Vermunt L, Blok S, et al. Neurofilament light increases over time in severe COVID-19 and is associated with delirium. Brain Commun. 2022;4(4):fcac195.
73. Page VJ, Watne LO, Heslegrave A, et al. Plasma neurofilament light chain protein as a predictor of days in delirium and deep sedation, mortality and length of stay in critically ill patients. EBioMedicine. 2022;80:104043.
PRAXIS
- Vol. 112
- Ausgabe 12
- Oktober 2023