- Verdächtige Veränderungen an der Zunge: Abgrenzung zwischen Normvarianten und Pathologie
Die Zunge ist mit ihrer Sensibilität, den Geschmacksknospen und dem komplexen anatomischen Aufbau aus verschiedenen Muskeln ein zentrales Organ beim Sprechen, Schmecken und der Nahrungsaufnahme, insbesondere auch beim oralen Nahrungstransport, dem Kauen und Schlucken. Veränderungen der Zunge sind häufig und führen nicht selten zu Verunsicherung der Patientinnen und Patienten und in einem zweiten Schritt zum Besuch einer Hausärztin/eines Hausarztes, einer Hals-, Nasen-, Ohrenarztpraxis, einer zahnärztlichen oder kieferchirurgischen Praxis. Oft stellt die Entscheidung, ob es sich um eine behandlungsbedürftige Läsion oder eine Normvariante handelt, eine grosse Herausforderung dar. Die Differenzialdiagnosen sind breit, die Palette von möglichen Erkrankungen reicht von harmlosen Veränderungen bis zu bedrohlichen Krankheiten. Bei der Anamnese sind Zeitpunkt und Dauer des Auftretens, Begleitsymptome wie Zungenbrennen oder Geschmacksstörungen und Risikofaktoren wie Nikotin- und Alkoholkonsum wichtig. Mögliche Ursachen können Mangelernährung, systemische Erkrankungen, entzündliche Prozesse oder Tumorerkrankungen sein. Entsprechend kann als erste diagnostische Massnahme eine Blutuntersuchung, ein Abstrich oder eine Biopsie nötig werden. Ziel dieser Übersichtsarbeit ist es, die verschiedenen Arten und Ursachen von Zungenveränderungen darzulegen und zu erklären, in welchen Fällen weiterführende Abklärungen notwendig sind.
Anatomie
Die Zunge, bestehend aus Zungenspitze, Zungenrücken, Zungenrand und Zungengrund, weist ein dichtes muskuläres Faserwerk auf, das von Mundschleimhaut bedeckt ist. Die Zungenschleimhaut enthält die Papillae linguales, von spezieller Mukosa überzogene Bindegewebszapfen, sowie die Glandulae linguales. Während die Zungenbinnenmuskulatur, bestehend aus den Mm. transversus, verticalis, longitudinales superioris/inferioris linguae, der Formveränderung dienen (Streckung, Verkürzung, Verschmälerung, Verbreiterung), führen die äusseren Zungenmuskeln, bestehend aus den Mm. genioglossus, hyoglossus, chondroglossus und styloglossus, zur Lageveränderung, dies durch ihren Ursprung entweder an der Schädelbasis oder dem Os hyoideum. Die motorische Innervation der Zunge erfolgt über den N. hypoglossus. Ausfälle des N. hypoglossus führen zu einer ipsilateralen Deviation der Zunge bei Protrusion derselben. Neben ihrer mechanischen Funktion dient die Zunge der Nahrungslubrifikation, der Geschmacks- sowie der sensiblen Empfindung. Die neurale Versorgung für die Geschmacksempfindung läuft über die Chorda tympani aus dem N. facialis sowie den Nn. glossopharyngeus und vagus. Während die vorderen zwei Drittel durch die Chorda tympani versorgt werden, zieht der N. glossopharyngeus in das hintere Drittel. Posterior des Sulcus terminalis übernimmt der N. vagus diese Funktion. Die sensible Versorgung der vorderen zwei Drittel der Zunge erfolgt über den N. lingualis, der aus dem N. mandibularis entspringt, das hintere Drittel über den N. glossopharyngeus und posterior des Sulcus terminalis über den N. vagus. Sowohl die gustatorische als auch die sensible Innervation sind strikt seitengetrennt. So führt ein jeweiliger Ausfall zum ipsilateralen Ausfall.
Harmlose Veränderungen der Zunge
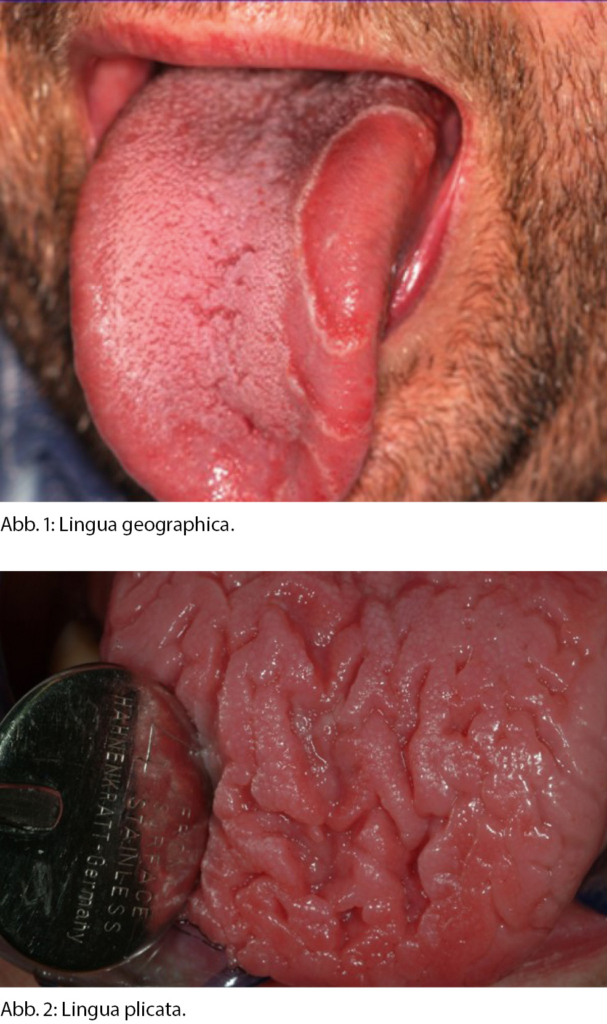
Normvarianten treten häufig auf und können in ausgeprägten Fällen zu Verunsicherung und Symptomen wie Zungenbrennen und Zungenstechen führen. Gemäss einer US-amerikanischen Untersuchung leiden bis zu 15 % der Erwachsenen unter Auffälligkeiten der Zunge [1]. Eine gezielte Untersuchung durch eine Fachspezialistin oder einen Fachspezialisten führt in den meisten Fällen rasch und sicher zur Entwarnung. Eine der häufigsten Veränderungen stellt die Lingua geographica (Syn. Exfoliatio areata linguae, benign migratory glossitis) (Abb. 1) dar. Dabei handelt es sich um landkartenförmig angeordnete Areale mit Desquamation der Papillae filiformes. Diese zentral vertieften roten oder rosafarbenen Areale können jegliche Begrenzung aufweisen, treten jedoch meist girlandenförmig auf und sind von einem graugelblichen Saum umzogen. Die Prävalenz in der Literatur variiert und liegt bei ca. 2–4 %, Frauen sind etwas häufiger betroffen als Männer. Phasen mit plötzlicher Remission treten auf. Eine Therapie ist nicht indiziert, auch wenn sich histologisch ein entzündliches Infiltrat bestehend aus Lymphozyten, Plasmazellen, Mastzellen und neutrophilen Granulozyten zeigt. Einige Betroffene berichten über brennende oder stechende Sensationen, in den meisten Fällen führt die Veränderung jedoch nicht zu Symptomen.
Bei der Lingua plicata (Syn. Lingua fissurata, Faltenzunge) (Abb. 2) handelt es sich um eine kongenitale Variante der lingualen Mukosa, wobei die Zunge unterschiedlich tiefe Falten aufweist. Die Prävalenz liegt bei 10–15 %. Zungenbrennen kann ein seltenes Symptom der Lingua plicata sein, üblicherweise sind die gesunden Personen asymptomatisch. Bis auf eine Assoziation mit dem Melkersson- Rosenthal-, dem Cowden- und dem Sjögren-Syndrom hat diese angeborene Variante keinen Krankheitswert. Die Therapie richtet sich gegen die Grunderkrankungen, ansonsten gilt es, eine gute Mundhygiene inklusive Zungenreinigung zu praktizieren. Die Lingua plicata und geographica können auch simultan auftreten [2].
Die Lingua villosa nigra wird durch eine Verlängerung mit konsekutiver Hyperkeratose der Papillae filiformes verursacht und ist durch einen dunklen Zungenbelag charakterisiert, welcher einen pelzigen Aspekt aufweist. Die Verfärbung entsteht durch Nahrungsbestandteile und/ oder Reizstoffe. Dazu gehören auch chlorhexidinhaltige Mundspüllösungen. Die Therapie besteht in der Meidung von Noxen und in einer Umstellung der Ernährung [3].
Zungenbelag
Der Zungenbelag setzt sich aus abgeschilfertem Epithel der oralen Mukosa, Bakterien und ihren Abbauprodukten, Blutbestandteilen, Nährstoffen sowie Speichel zusammen [4]. Ältere Menschen – vor allem zahnlose – tendieren zu einem dickeren Zungenbelag. Dies ist am ehesten durch die Nahrungsaufnahme von weicher Kost und somit weniger Abrasion während der Nahrungszerkleinerung zu erklären. Hierdurch kann eine grosse, mikrobiell besiedelte Fläche entstehen, welche eine der Ursachen für Halitosis sein kann. Verfärbungen im Zungenbelag sind – neben den beschriebenen Erkrankungen – oftmals auf Ernährungsgewohnheiten (Rotwein, Kaffee), Nikotinkonsum oder auch auf eine regelmässige Chlorhexidin-haltige Mundspülung zurück zu führen.
Zungenbrennen
Zungenbrennen (Syn. burning-mouth syndrome, Glossodynie) hat eine Prävalenz von 0,7–2,6 Prozent [5], wobei überproportional viele postmenopausale Patientinnen hierunter leiden [6]. Das beschriebene Brennen muss sich nicht auf die Zunge beschränken, es kann die gesamte Mundhöhle und die Lippen betreffen. Die Pathophysiologie ist bis heute nicht vollständig geklärt und man geht von einer Kombination aus psychosozialen Belastungsfaktoren und neuropathischen Veränderungen im Versorgungsgebiet des N. trigeminus aus. Studien zeigten eine verringerte Anzahl an Nervenfasern in entnommenen Zungenbiopsien. Dies würde die These einer sensorischen Neuropathie stützen [7]. Ebenfalls wird eine Häufung bei Personen mit Depressionen oder Angststörungen beobachtet [8]. Eine ausführliche Anamnese mit besonderem Augenmerk auf Medikamente, Noxen, neue dentale Restaurationen und Allergien sollte routinemässig erfolgen. Zum Ausschluss einer somatischen Ursache ist neben einem Abstrich zur Testung auf eine Candida-albicans-Infektion ein ergänzendes Blutbild anzufertigen (TSH, HbA1C, Eisenstatus, Vitamin-B-Komplex, Harnsäure, antinukleäre Antikörper) zum Ausschluss einer atrophen Glossitis oder einer zugrundeliegenden Autoimmunerkrankung. Neben Lokalanästhetika, Capsaicin, Gabapentin ebenso wie SSRI oder trizyklischen Antidepressiva sollte zur Therapie immer auch eine psychosomatische Mitbehandlung erwogen werden.
Infektionen
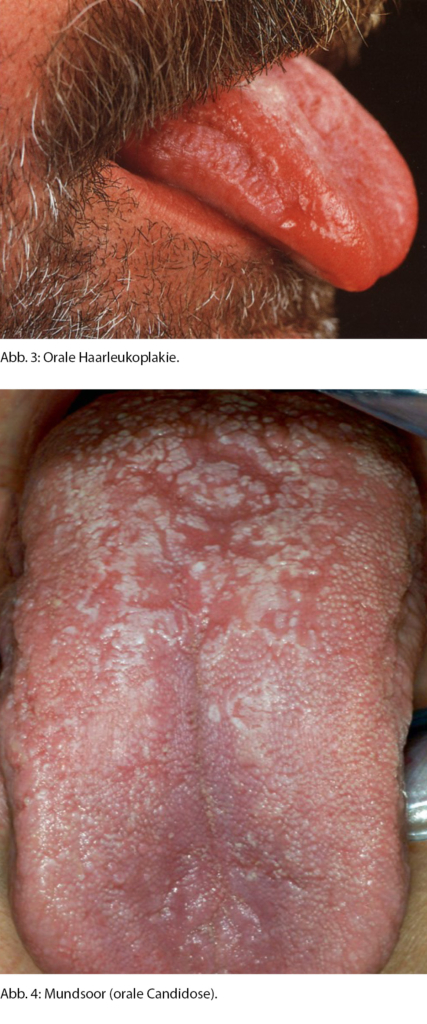
Die orale Haarleukoplakie ist charakterisiert durch hyperkeratotische, weisse Beläge meist am lateralen Zungenrand (Abb. 3). Diese Beläge sind asymptomatisch und lassen sich mit einem Tupfer nicht abstreifen. Erstbeschreibung war während der HIV-Epidemie 1984 [9]. Es ist eines der spezifischsten Symptome für eine HIV-Infektion und oft Zeichen einer Krankheitsprogression [10]. Bedingt ist diese Veränderung durch eine EBV-Infektion im Rahmen der Immunsuppression. Die Behandlung ist die antivirale Therapie in Kombination mit der Therapie der HIV-Infektion.
Die orale Candidose (Mundsoor) (Abb. 4) ist meist bedingt durch eine Infektion mit Candida albicans [11]. Candida albicans gehört zur normalen Mundflora und ist bei 30–50 % aller Menschen insbesondere auch im Alter nachweisbar. Durch eine antibiotische oder topische Steroidbehandlung, Immunsuppression, Diabetes mellitus oder reduzierten Speichelfluss beispielsweise nach Strahlentherapie im Kopf-Hals-Bereich kann es zu einer gestörten Balance der Mundflora mit Überhandnehmen der Pilzorganismen kommen [11]. Klinisch zeigt sich eine gerötete, schmerzhafte Zunge mit dickem, weissen Belag, der nach dem Abstreifen blutet. Behandelt wird es durch topische oder in schweren Fällen systemische Antimykotika und eine Verbesserung der Mundhygiene [12].
Systemische Erkrankungen
Systemische Autoimmunerkrankungen sind häufig und betreffen gemäss einer Studie bis zu 8 % der erwachsenen US-Amerikaner [13]. Oft kommt es bei Autoimmunerkrankungen zu Veränderungen der Mundschleimhaut, nicht selten auch als Erstsymptom. Entsprechend wichtig ist es, typische Befunde zu erkennen und die Abklärungen in die richtige Richtung zu lenken. Morbus Behcet ist eine chronische, inflammatorische Multisystemerkrankung, die oft mit Ulzerationen der Mundschleimhaut beginnt und im weiteren Verlauf die Haut, das Genitale, die Augen, den Darm und das Nervensystem befallen kann. Diese Ulzerationen im Sinne von weisslich-gelbem Fleck mit rötlichem Randsaum können als scharf begrenzte, einzelne Läsionen oder als Cluster in der bukkalen Schleimhaut, am Gaumen, den Lippen oder dem Zungenrücken und dem lateralen Zungenrand auftreten. Als Differenzialdiagnosen sind neben infektiösen Ulcera wie beispielsweise bei der Syphilis die habituellen Aphthen, Pemphigus vulgaris und oraler Lichen planus zu berücksichtigen [13]. Die Diagnose kann gestellt werden, wenn neben der oralen Ulzeration mindestens zwei Begleitsymptome (rezidivierende genitale Ulcera, Augenläsionen, Hautläsionen) oder ein positiver Pathergy-Test vorliegen [14].
Zu den chronisch entzündlichen Darmerkrankungen gehören der Morbus Crohn und die Colitis ulcerosa. Gemäss einer Studie von Jose et al.[15] sind aphtöse Ulzerationen in der Mundschleimhaut die häufigste extraintestinale Manifestation von chronisch entzündlichen Darmerkrankungen. Nicht selten treten diese vor der eigentlichen Diagnose auf. Gemäss einer Untersuchung sind orale Läsionen vor allem bei Kindern mit Morbus Crohn mit 40–48 % sehr häufig [16]. Als spezifische Veränderung gilt die sogenannten «Pyostomatitis vegetans» mit miliaren Abszessen und pustulösen Läsionen [17]. Neben rezidivierenden Ulzerationen kann es durch den mit der Darmerkrankung assoziierten Vitaminmangel auch zu einer atrophen Glossitis und Zungenbrennen kommen [17].
Beim systemischen Lupus erythematodes (SLE) können ebenfalls orale Ulzerationen auftreten. Meist handelt es sich dabei um mehr als eine Läsion, die aber häufiger am Gaumen oder in der bukkalen Schleimhaut vorkommen als auf der Zunge [18].
Bei der Amyloidose ist der Kopf-Hals-Bereich je nach Literatur in 12–90 % involviert [19]. Dabei handelt es sich typischerweise um Veränderungen an Zunge und Larynx. Die Zunge ist in aller Regel bei der systemischen Amyloidose in Form einer Makroglossie mit Artikulationsstörungen und Dysphagie involviert [19, 20]. In ganz seltenen Fällen handelt es sich um eine lokalisierte Form der Amyloidose mit gut umschriebenen, nodulären Veränderungen der Zunge [19]. Diese Form wird nicht zu einer Systemerkrankung gezählt und kann mittels chirurgischer Exzision gut behandelt werden [20].
Präkanzerosen der Zunge
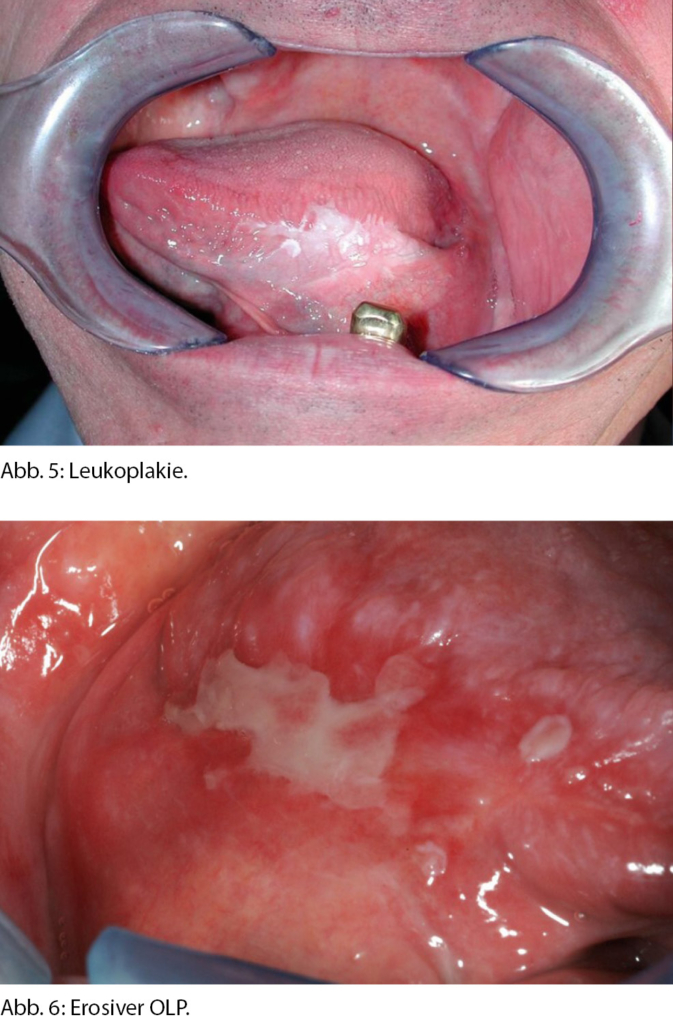
Bei den Präkanzerosen handelt es sich um Veränderungen, die ein Risiko haben, zu entarten oder schrittweise in ein invasives Plattenepithelkarzinom überzugehen. Dazu gehören die Leukoplakie, die Erythroplakie und die Erythroleukoplakie, die als potenziell maligne Veränderungen der Mundhöhle (OPMD) zusammengefasst werden [21]. Sie treten oft am lateralen Zungenrand oder am Mundboden auf. Die häufigste Veränderung ist die Leukoplakie, ein deskriptiver Begriff, welcher das Erscheinungsbild als weissen Fleck beschreibt und erstmalig 1877 in der Literatur erwähnt wurde [22]. Diese Veränderungen sind nicht abstreifbar und kommen insbesondere in der männlichen Bevölkerung der 6. Dekade mit einer Prävalenz von 2 % vor [23] (Abb. 5). Leukoplakien können homogen, flach, aber auch nodulär, exophytisch und erosiv erscheinen. Je inhomogener sich eine Veränderung präsentiert und je grösser sie ist (> 200 mm2), desto höher ist das Transformationsrisiko [24, 25]. Die Erythroleukoplakie oder Erythroplakie präsentiert sich als rot-weisser oder primär roter Fleck. Beide kommen seltener vor (Prävalenz 0,1 %), weisen aber ein höheres Transformationsrisiko von bis zu 50 % auf [26]. Risikofaktoren für die Entstehung sind Nikotin- und Alkoholkonsum. Interessanterweise ist das Risiko für Malignität bei OPMDs von weiblichen Nichtrauchern am höchsten [25]. Das Management von OPMDs hängt von der Art und Grösse sowie der Lokalisation ab. Bei Persistenz oder Progredienz ist eine vollständige Exzision im Sinne einer oberflächlichen Abtragung (Mukosektomie) mit histologischer Aufarbeitung einer Biopsie vorzuziehen, da bei der Biopsie das Risiko eines «sampling errors» besteht. Die Exzision sollte mit einem Sicherheitsabstand von 1–2 mm erfolgen. Je nach Histologie und Risikoprofil der Patientin/des Patienten sind Nachkontrollen im Intervall von 3–6 Monaten zu empfehlen [27].
Die deskriptive Bezeichnung Lichen planus leitet sich aus dem griechischen Wort «leichen» für Flechten und dem lateinischen Wort «planus» für flach ab und beschreibt eine meist selbstlimitierende Hauterkrankung. Die orale Form, der orale Lichen planus (OLP) ist eine chronisch entzündliche Erkrankung der Mundschleimhaut, die sich durch häufige Rezidive und das Risiko der malignen Transformation auszeichnet. Sie kommt mit einer Prävalenz von 2 % häufiger bei Frauen als bei Männern (2:1) vor. Unterschieden wird zwischen dem retikulären, flächigen, atrophen, erosiv-ulcerativen, papulären und bullösen OLP, der auch in Mischformen auftreten kann [28]. Die häufigste und klassische Form ist der retikuläre OLP, der sich mit einem Netz aus streifigen, weiss-grauen Veränderungen primär in der bukkalen Schleimhaut präsentiert, auch bekannt als die pathognomonischen «Wickham-Streifen»[29]. Die anderen Formen sind kaum von Leukoplakien, entzündlichen Veränderungen, blasenbildenden Erkrankungen oder einer atrophen Glossitis zu unterscheiden. Oft leiden die Betroffenen unter empfindlicher Schleimhaut mit Brennen und Verschlechterung der Symptomatik durch scharfe oder saure Speisen. Zur Diagnose wird eine Biopsie – auch zum Ausschluss einer Dysplasie – empfohlen. Bei symptomatischen Personen ist die Behandlung mit topischen oder bei fehlendem Ansprechen systemischen Steroiden am zielführendsten. Zum Risiko der malignen Transformation gibt es in der Literatur widersprüchliche Aussagen [28, 30]. Die WHO hat die Begriffe OLP und OLL (orale lichenoide Läsion) unterschieden, die explizit dysplastische Veränderungen als Ausschlusskriterien definiert. Gemäss einer systematischen Übersichtsarbeit ergab sich ein Transformationsrisiko von 1,09 % bei OLP und 3,2 % bei OLL [31]. Eine Transformation war bei erosiv-ulcerativen Formen (Abb. 6), Veränderungen auf der Zunge, weiblichem Geschlecht und Alter > 60 Jahre häufiger [28]. Gemäss Literatur wurden bei 29 % der Personen mit Mundhöhlenkarzinom auf dem Boden einer OLP bei der Diagnose zwei oder mehr unabhängige Tumoren nachgewiesen (19 % ein Zweittumor, 10 % multiple Tumoren) [32]. Obwohl das Transformationsrisiko in der Literatur sehr unterschiedlich gewertet wird, ist es empfehlenswert, die Betroffenen regelmässig, mindestens einmal im Jahr, nachzukontrollieren und bei Veränderungen der Läsionen Biopsien zu wiederholen.
Maligne Zungenveränderungen
Der häufigste maligne Tumor der Zunge ist das Plattenepithelkarzinom. Hauptrisikofaktor sind Rauchen und übermässiger Alkoholkonsum, insbesondere auch in der Kombination. Es manifestiert sich meist als nicht abheilende, grössenprodiente, mit der Zeit schmerzhafte, leicht blutende exulzerierte oder exophytische Wunde am lateralen Zungenrand. Die Metastasierung ist primär lymphogen mit
einem Risiko für okkulte Metastasen auch bei Tumorfrühstadien von 30 % [33]. Das Management der Tumoren erfolgt primär chirurgisch mit transoraler Tumorresektion und Sentinellymphknotenbiopsie bei frühen Stadien (cT1/ cT2, cN0) und Tumorresektion, Rekonstruktion des Defektes und Neck Dissection sowie adjuvanter Radio(chemo) therapie bei fortgeschrittenen Tumoren [34]. Zu berücksichtigen ist bei der Abklärung das Risiko für Zweittumoren im oberen Aerodigestivtrakt und der Lunge [34]. Trotz Fortschritten in der Krebsbehandlung liegt die 10-Jahres-Überlebensrate bei Mundhöhlen- und Rachenkrebs in der Schweiz noch immer bei lediglich 44 % [35]. Seltenere Malignome sind Tumoren der kleinen Speicheldrüsen, das
Kaposi-Sarkom als häufigste HIV-assoziierte Neoplasie [36] und das Lymphom, das hauptsächlich im lymphatischen Gewebe des Zungengrundes entsteht.
Im Artikel verwendete Abkürzungen
CRP C-reaktives Protein
EBV Epstein-Barr-Virus
HIV Humanes Immundefizienz-Virus
OLL Orale lichenoide Läsion
OLP Oraler Lichen planus
SLE Systemischer Lupus erythematodes
WHO Welt-Gesundheits-Organisation (World Health Organisation)
Leitung Kopf-Hals-Tumorzentrum CCCZ
Leitende Ärztin Klinik für Ohren-, Nasen-, Hals-und Gesichtschirurgie
Universitätsspital Zürich, Frauenklinikstrasse 24, 8091 Zürich
Historie
Manuskript eingereicht: 30.10.2022
Manuskript akzeptiert: 30.01.2023
Interessenskonflikte
Es bestehen keine Interessenskonflikte.
ORCID
Martina Broglie Däppen
https://orcid.org/0000-0002-5012-8294
- Normvarianten der Zunge wie die Lingua geographica, die Lingua plicata und die Lingua villosa nigra treten häufig auf und können in ausgeprägten Fällen zu Verunsicherung der Patientin/des Patienten führen.
- Die Pathophysiologie des Zungenbrennens ist nicht vollständig geklärt. Am ehesten handelt es sich um eine Kombination aus psychosozialen Belastungsfaktoren und neuropathischen Veränderungen des N. V. trigeminus? Wichtig ist eine Abgrenzung zur atrophen Glossitis bei Vitaminmangel.
- Oft kommt es bei systemischen Erkrankungen wie M. Bechet, M. Crohn, Colitis ucerosa und SLE zu ulzerierenden Veränderungen der Mundschleimhaut, nicht selten auch als Erstsymptom. Entsprechend wichtig ist es, typische Befunde zu erkennen und die Abklärungen in die richtige Richtung zu lenken.
- Die Leukoplakie, die Erythroplakie und die Erythroleukoplakie haben ein Risiko, zu entarten und schrittweise in ein invasives Plattenepithelkarzinom überzugehen. Therapie der Wahl ist wenn möglich die vollständige Exzision (Mukosektomie). Der orale Lichen planus gehört ebenfalls zu den Präkanzerosen, wobei eine Transformation bei erosiv-ulcerativen Formen, Veränderungen auf der Zunge, weiblichem Geschlecht und Alter > 60 Jahre häufiger ist.
- Der häufigste maligne Tumor der Zunge ist das Plattenepithelkarzinom mit den Hauptrisikofaktoren Rauchen und übermässiger Alkoholkonsum. Die Therapie ist in aller Regel die Chirurgie mit adjuvanter Radio(chemo)therapie bei fortgeschrittenen Stadien.
Lernfragen
1. Welche Veränderung zeigt sich bei einer HIV-Infektionhäufig an der Zunge?
a) Leukoplakie
b) Oraler Lichen planus
c) Orale Haarleukoplakie
d) Ulzeriende Entzündung
e) Erythroplakie
2. Welche Faktoren beeinflussen das Risiko einer malignen Entartung bei oralem Lichen planus, ausser:
a) Weiblichem Geschlecht
b) Alter unter 50 Jahren
c) Erosiver Form
d) Läsionen an der Zunge
e) Alter über 60 Jahre
3. Welche Veränderung der Zunge gehört zu den
Normvarianten und kommt nicht als Symptom eines Syndroms vor?
a) Lingua geographica
b) Lingua plicata
c) Leukoplakie
d) Orale Haarleukoplakie
e) Atrophe Glossitis
1. Reamy BV, Derby R, Bunt CW. Common tongue conditions in primary care. Am Fam Physician. 2010;81(5):627–634.
2. Zhang C, Pan D, Li Y, Hu Y, Li T, Zhou Y. The risk factors associated with geographic tongue in a southwestern Chinese population. Oral Surg Oral Med Oral Pathol Oral Radiol. 2022;134(3): 342–346.
3. Yuca K, Calka O, Kiroglu AF, Akdeniz N, Cankaya H. Hairy tongue: a case report. Acta Otorhinolaryngol Belg. 2004;58(4): 161–163.
4. Yaegaki K, Sanada K. Biochemical and clinical factors influencing oral malodor in periodontal patients. J Periodontol. 1992;63(9):783–789.
5. Klausner JJ. Epidemiology of chronic facial pain: diagnostic usefulness in patient care. J Am Dent Assoc. 1994;125(12): 1604–1611.
6. Ben Aryeh, H., et al., Oral complaints related to menopause. Maturitas, 1996. 24(3):185–9.
7. Lauria G, Majorana A, Borgna M, et al. Trigeminal small-fiber sensory neuropathy causes burning mouth syndrome. Pain. 2005;115(3):332–337.
8. Galli F, Lodi G, Sardella A, Vegni E. Role of psychological factors in burning mouth syndrome: A systematic review and meta-analysis. Cephalalgia. 2017;37(3):265–277.
9. Greenspan D, Greenspan JS, Conant M, Petersen V, Silverman S Jr, de Souza Y. Oral “hairy” leucoplakia in male homosexuals: evidence of association with both papillomavirus and a herpes-group virus. Lancet. 1984;2(8407):831–834.
10. Mangold AR, Torgerson RR, Rogers RS, 3rd. Diseases of the tongue. Clin Dermatol. 2016;34(4):458–469.
11. Singh A, Verma R, Murari A, Agrawal A. Oral candidiasis: An overview. J Oral Maxillofac Pathol. 2014;18(Suppl 1):S81–S85.
12. Akpan A, Morgan R. Oral candidiasis. Postgrad Med J. 2002; 78(922):455–459.
13. Mays JW, Sarmadi M, Moutsopoulos NM. Oral manifestations of systemic autoimmune and inflammatory diseases: diagnosis and clinical management. J Evid Based Dent Pract. 2012; 12(3 Suppl):265–282.
14. Criteria for diagnosis of Behcet’s disease. International Study Group for Behcet’s Disease. Lancet. 1990;335(8697):1078–1080.
15. Jose FA, et al. Development of extraintestinal manifestations in pediatric patients with inflammatory bowel disease. Inflamm Bowel Dis. 2009;15(1):63–68.
16. Pittock S, Drumm B, Fleming P, McDermott M, Imrie C, Flint S, Bourke B. The oral cavity in Crohn’s disease. J Pediatr. 2001; 138(5):767–771.
17. Li C, Wu Y, Xie Y, et al. Oral manifestations serve as potential signs of ulcerative colitis: A review. Front Immunol. 2022;13: 1013900.
18. Lourenço SV, de Carvalho FR, Boggio P, et al. Lupus erythematosus: clinical and histopathological study of oral manifestations and immunohistochemical profile of the inflammatory infiltrate. J Cutan Pathol. 2007;34(7):558–564.
19. Fahrner KS, Black CC, Gosselin BJ. Localized amyloidosis of the tongue: a review. Am J Otolaryngol. 2004;25(3):186–189.
20. Kerner MM, Wang MB, Angier G, Calcaterra TC, Ward PH. Amyloidosis of the head and neck. A clinicopathologic study of the UCLA experience, 1955–1991. Arch Otolaryngol Head Neck Surg. 1995;121(7):778–782.
21. Wetzel SL, Wollenberg J. Oral Potentially Malignant Disorders. Dent Clin North Am. 2020;64(1):25–37.
22. Bewley AF, Farwell DG. Oral leukoplakia and oral cavity squamous cell carcinoma. Clin Dermatol. 2017;35(5):461–467.
23. Maymone MBC, Greer RO, Kesecker J, et al. Premalignant and malignant oral mucosal lesions: Clinical and pathological findings. J Am Acad Dermatol. 2019;81(1):59–71.
24. Warnakulasuriya S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125(6):582–590.
25. Paglioni MP, Khurram SA, Ruiz BII, Lauby-Secretan B, Normando AG, Ribeiro ACP, et al. Clinical predictors of malignant transformation and recurrence in oral potentially malignant disorders: A systematic review and meta-analysis. Oral Surg Oral Med Oral Pathol Oral Radiol. 2022.
26. Villa A, Villa C, Abati S. Oral cancer and oral erythroplakia: an update and implication for clinicians. Aust Dent J. 2011;56(3): 253–256.
27. Amagasa T, Yamashiro M, Uzawa N. Oral premalignant lesions: from a clinical perspective. Int J Clin Oncol. 2011;16(1):5–14.
28. Alrashdan MS, Cirillo N, McCullough M. Oral lichen planus: a literature review and update. Arch Dermatol Res. 2016;308(8): 539–551.
29. Eisen D, Carrozzo M, Bagan Sebastian JV, Thongprasom K. Number V Oral lichen planus: clinical features and management. Oral Dis, 2005;11(6):338–349.
30. Krutchkoff DJ, Eisenberg E. Lichenoid dysplasia: a distinct histopathologic entity. Oral Surg Oral Med Oral Pathol. 1985; 60(3):308–315.
31. Fitzpatrick SG, Hirsch SA, Gordon SC. The malignant transformation of oral lichen planus and oral lichenoid lesions: a systematic review. J Am Dent Assoc. 2014;145(1):45–56.
32. Mignogna MD, Lo Russo L, Fedele S, Ruoppo E, Califano L, Lo Muzio L. Clinical behaviour of malignant transforming oral lichen planus. Eur J Surg Oncol. 2002. 28(8):838–843.
33. Hanai N, Asakage T, Kiyota N, Homma A, Hayashi R. Controversies in relation to neck management in N0 early oral tongue cancer. Jpn J Clin Oncol, 2019. 49(4):297–305.
34. NCCN Clinical Practice Guidelines In Oncology Head and Neck Cancers. URL: http://www.nccn.org/professionals/physician_ gls/pdf/head-and-neck.pdf; letzter Zugriff: 30.01.2023.
35. NICER – Nationales Institut für Krebsepidemiologie und -registrierung. www.nicer.org. Die Statistiken zur nationalen Krebsmortalität 1989–2019, aktualisiert am 14.12.2022.
36. Narani N, Epstein JB. Classifications of oral lesions in HIV infection. J Clin Periodontol, 2001. 28(2):137–145.
PRAXIS
- Vol. 112
- Ausgabe 10
- August 2023