- Wenn das Hirn den Takt angibt
In seltenen Fällen kann eine HSV-Enzephalitis zu einer Sinusknotendysfunktion führen. So auch im vorliegenden Fall einer 70-jährigen Patientin, die rezidivierende Synkopen erlitt. Bei beobachteten Sinusbradykardien und kurzzeitigen Sinusarrests wurden die Synkopen initial einer kardialen Ursache zugeschrieben. Als im Verlauf Fieber und neurologische Beschwerden hinzukamen, konnte eine HSV-1-Enzephalitis nachgewiesen werden. Der Zusammenhang hierfür, so zeigt die Literatur-Recherche, ist nicht abschliessend geklärt. In Versuchen konnte gezeigt werden, dass der Befall des Inselkortex, der Prädilektionsstelle einer zerebralen HSV-Infektion, Einfluss auf das autonome Nervensystem hat. Im vorliegenden Fall vermuten wir jedoch eine iktale Genese, unter anderem, weil die Arrhythmien nach Einleitung einer antiepileptischen Therapie sistierten. Der vorliegende Fall betont die Bedeutung differenzialdiagnostischer Überlegungen bei Synkopen.
Fallbericht
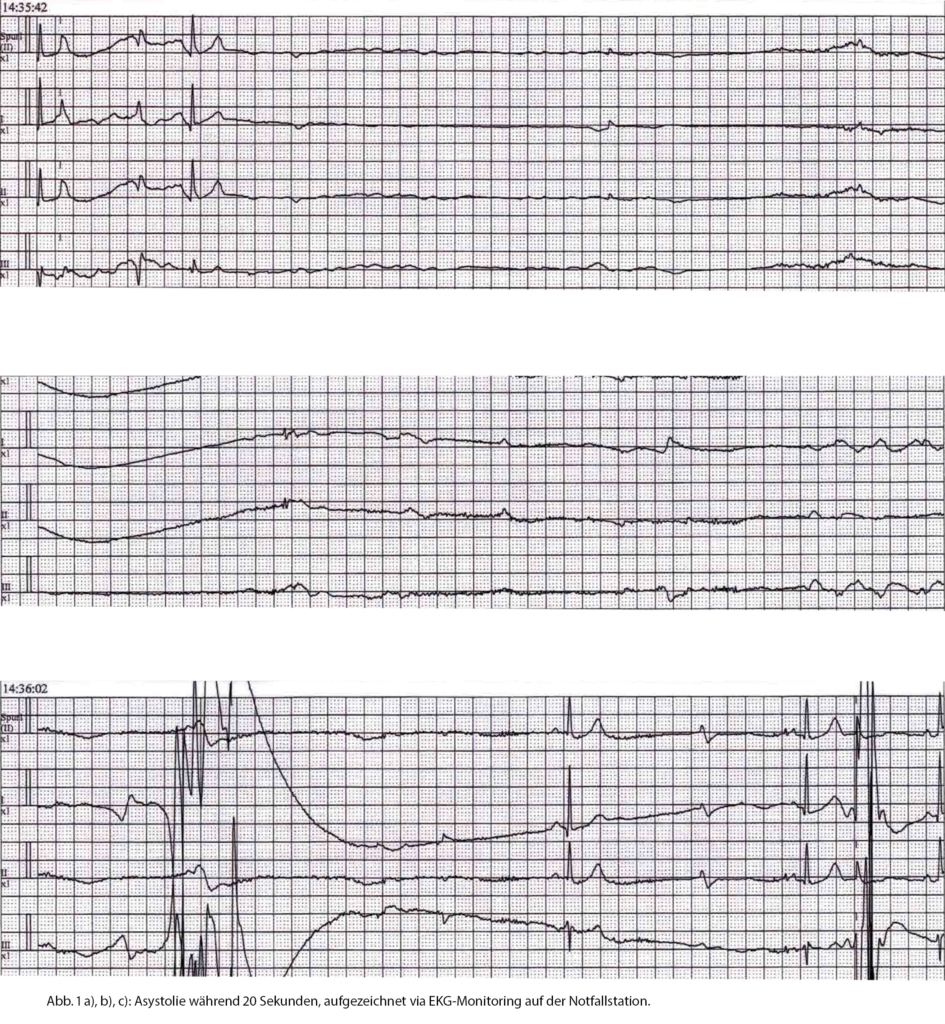
Die 70-jährige, bis auf eine bekannte arterielle Hypertonie gesunde und selbständig lebende Patientin wurde nach einer Synkope auf die Notfallstation zugewiesen. Beim Spielen mit den Enkelkindern hatte sie Nausea verspürt und war plötzlich bewusstlos geworden. Bis auf passagere, ungewöhnlich starke Kopfschmerzen am Vorabend wurden keine weiteren Beschwerden registriert. Die Patientin präsentierte sich wach, orientiert und ohne neurologische Ausfälle. Auf der Notfallstation kam es erneut zu einer Synkope, wobei eine ca. 20-sekündige Asystolie aufgezeichnet werden konnte (Abb. 1a, b, c). Im Intervall liess sich ein normales EKG ableiten. Laboranalytisch zeigte sich einzig eine leichte Leukozytose. CT-grafisch erfolgte eine Thorax- sowie eine Schädelaufnahme zum Ausschluss einer Lungenarterienembolie oder einer intrazerebralen Blutung. Die Patientin wurde zur Rhythmusüberwachung auf die Überwachungsstation aufgenommen. Bei Verdacht auf kardiale Synkope bei dokumentierter Asystolie wurde eine Schrittmacher-Implantation geplant. Auf der Überwachungsstation kam es rezidivierend zu kurzanhaltenden Sinusbradykardien und insgesamt zu fünf weiteren Episoden eines Sinusarrests mit begleitenden Synkopen. Zweimalig musste Atropin verabreicht und aufgrund der Bradykardien mit konsekutiver Hypotonie und Verschlechterung des neurologischen Zustandsbildes ein Isoprenalin-Perfusor eingesetzt werden.
Bereits am ersten Tag der Hospitalisation fieberte die Patientin bis 38,2 °C auf ohne klinischen Fokus (insbesondere kein Meningismus). Der SARS-CoV2-Abstrich sowie die Blutkulturen waren unauffällig. Bei Klebsiellen im Urin starteten wir, bei Verdacht auf einen febrilen Harnwegsinfekt und vor geplanter Schrittmacher-Implantation, eine Antibiotikatherapie mit Ceftriaxon. Das Fieber war zwischenzeitlich regredient, die Entzündungsparameter im Blut stiegen jedoch leicht an (CRP max. 26 mg/l (Normwert < 5 mg/l)).
Bei vermuteter kardialer Ursache der Synkopen erfolgte eine Echokardiografie, welche eine normale links- und rechtsventrikuläre Funktion ohne regionale Wandbewegungsstörungen und mit unauffälligen Klappen zeigte.
Im weiteren Verlauf präsentierte sich die Patientin fluktuierend desorientiert und teilweise unruhig. Aufgrund der wechselhaften Symptomatik interpretierten wir dies initial im Rahmen eines Delirs und starteten eine Therapie mit Quetiapin.
Am fünften Hospitalisationstag fieberte die Patientin wieder auf, es kam zu neuen intermittierenden linksseitigen fazialen Myoklonien und es konnte ein Meningismus festgestellt werden. Zudem wurde eine spastisch-dystone Hemisymptomatik der linken Körperseite beobachtet. Aufgrund der intermittierenden fazialen Myoklonien erfolgte bei Verdacht auf einen Status epilepticus die intravenöse Gabe von Lorazepam und Levetiracetam. Im Schädel-CT zeigte sich eine diskrete Anschwellung des Hippocampus, respektive des rechten temporalen Hirnbereichs. Wir starteten bei Verdacht auf eine virale Enzephalitis/Meningitis empirisch eine Therapie mit Aciclovir und führten eine Lumbalpunktion durch, welche einen erhöhten Eröffnungsdruck (32 cmH2O [Normwert 6–25 cmH2O]), eine erhöhte Zellzahl (188 G/l [Normwert < 0,004 G/l], 100 % mononukleäre Leukozyten) und einen erhöhten Proteinspiegel (0,89 g/l [Normwert 0,15–0,45 g/l]) ergab. Die PCR wies schliesslich HSV-1 nach, womit sich eine Herpes-Enzephalitis bestätigte.
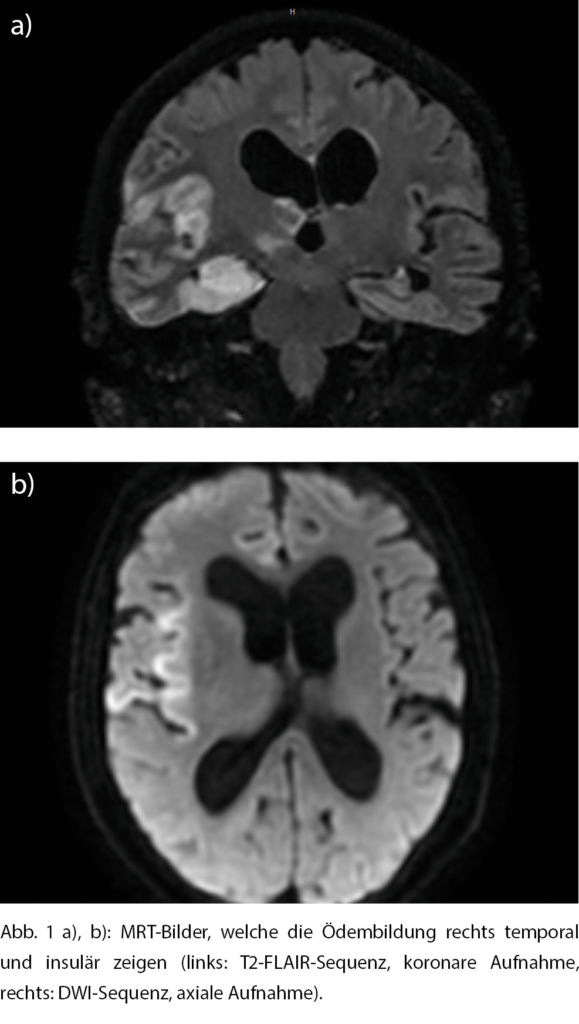
Im Verlauf kam es klinisch zu einem intermittierenden GCS-Abfall auf 11 bei persistierender Schwäche der linksseitigen Extremitäten mit Persistenz der Desorientierung. Unter der anfallsunterdrückenden Therapie mit Levetiracetam kam es vorerst nicht mehr zu einem epileptischen Anfall. Das im Verlauf durchgeführte MRT des Schädels bestätigte den obigen Befund bei radiologischen Zeichen einer Enzephalitis temporal und insulär rechts (Abb. 2).
Unter der Therapie mit Aciclovir in der Dosierung von 10 mg/kg Körpergewicht achtstündlich kam es zu einer Verschlechterung der Nierenfunktion auf eGFR 19 ml/ min/1,73 im Sinne einer interstitiellen (allergischen) Nephritis. Die Aciclovir-Gaben wurden nierenfunktionsadaptiert reduziert und zudem Methylprednisolon 40 mg i.v. einmal pro Tag verabreicht. Hierunter normalisierte sich die Nierenfunktion im Verlauf.
Die Patientin konnte daraufhin – nach elf Tagen auf der Überwachungsstation – auf die Normalstation verlegt werden. Die Therapie mit Aciclovir wurde für insgesamt
14 Tage fortgeführt.
Auf der Bettenstation erfolgte ein weiterer fokaler, nicht bewusst erlebter Anfall, im EEG zeigte sich eine leichte Allgemeinveränderung mit Zeichen eines frontotemporalen Herdbefunds beidseits rechtsbetont. Zudem erfolgte nun auch die Einlage eines Zweikammer-Schrittmachers. Die Patientin trat nach drei Wochen Hospitalisation in wachem, allerdings persistierend desorientiertem und psychomotorisch verlangsamten Zustand in die neurologische Rehabilitation aus.
Hintergrund
Die Herpes-simplex-Virus-Enzephalitis ist mit schätzungsweise fünf Fällen/Million die häufigste sporadische Enzephalitis in Westeuropa. Hierbei können alle Altersgruppen betroffen sein; ⅓ der Fälle tritt bei unter 20-Jährigen auf, 50 % der Fälle bei über 50-Jährigen [1]. Die Letalität beträgt unbehandelt 70 %, unter virostatischer Therapie immer noch 20–30 % [1, 2].
Klinisch lassen sich nebst Fieber auch neurologische Symptome wie Kopfschmerzen, Hemiparesen, Dysarthrien oder Aphasien, Ataxien, psychotische Symptome, epileptische Anfälle oder Vigilanzstörungen bis hin zum Koma beobachten [1, 2].
Neuropathologisch konnte gezeigt werden, dass die akute nekrotisierende Enzephalitis, zu welcher es bei einer akuten HSV-Erkrankung kommen kann, oft asymmetrisch ist und vor allem den orbitofrontalen und temporalen Kortex betrifft [3]. Vermutungen, welche diese Prädilektionsstelle begründen könnten, sind einerseits der mögliche Viruseintritt bei einer De-novo-Infektion über den N. olfactorius entlang der Hirnbasis zu den Temporallappen oder im Fall einer Virusreaktivierung und Ausbreitung vom Ganglion trigeminale aus zum temporalen und frontalen Kortex [4].
Klinik, Blutuntersuchung, Liquordiagnostik inklusive PCR-Virusnachweis sowie Bildgebung werden zur Diagnosestellung herangezogen. Das MRT ist dem CT vorzuziehen, typischerweise zeigen sich bereits früh im Krankheitsverlauf in der Diffusions- und FLAIR-Wichtung ein Enhancement temporobasal und periinsulär oder einzelne kortikale Herde. Ebenfalls kann das EEG früh im Krankheitsverlauf pathologisch verändert sein mit fokaler oder generalisierter Verlangsamung und lateralisierten periodischen Entladungen (LPDs) [1]. Die Bildgebung kann aber in seltenen Fällen auch ohne Befund ausfallen – insbesondere die CT-Aufnahme kann in den ersten Tagen einer akuten Infektion unauffällig sein [1, 4].
Eine Aciclovir-Therapie (10 mg/kg/8 h) über 14 Tage bei Immunkompetenten und über 21 Tage bei Immunkompromittierten gilt als Therapiestandard [5].
HSV-1-Enzephalitis und Sinusknotendysfunktion: die Hirn-Herz-Achse
Verschiedene Regionen des Gehirns sind für die Kontrolle der Herzfrequenz und der Kontraktilität der Herzmuskelzellen verantwortlich: darunter fallen der vordere Inselkortex, der Gyrus cinguli, die Amygdala, der Hypothalamus, das periaquäduktale Grau, die parabrachialen Kerne sowie Teile der Medulla. Die Steuerung erfolgt über das parasympathische und sympathische Nervensystem [6]. So erstaunt es nicht, dass zerebrale Pathologien zu kardialen Dysfunktionen und Arrhythmien führen können.
Dr. Harvey Cushing beschrieb bereits 1901 den Zusammenhang eines erhöhten intrakraniellen Drucks mit einer Blutdrucksteigerung und konsekutiver Bradykardie (Cushing-Reflex) [7]. Weiter ist bekannt, dass es im Rahmen von Hirnschlägen (ischämisch wie auch hämorrhagisch) zu systolischen und diastolischen Dysfunktionen, erhöhten Herzenzymwerten wie auch zu EKG-Veränderungen bis hin zu potenziell letalen Arrhythmien kommen kann [8]. Auch im Rahmen von Epilepsien kann es zu Herzrhythmusstörungen kommen (sowohl iktale Bradykardien als auch Asystolien bei einer Überstimulation des parasympathischen Nervensystems). Des Weiteren sind im Zusammenhang mit Epilepsien plötzliche Todesfälle (‹sudden unexpected death in epilepsy [SUDEP]›) beschrieben [9]. Deren Ursache ist zwar nicht abschliessend geklärt, es wird jedoch nebst einer zerebralen Suppression und einer respiratorischen Genese auch eine kardiologische Ursache
diskutiert [10].
In der Literatur wurde das Auftreten von Sinusarrhythmien im Rahmen von bestätigten HSV-1-Enzephalitiden – wie im vorliegenden Fall – in sechs Fallberichten beschrieben [11, 12, 13, 14, 15, 16]. In vier dieser Fallberichte wurde zudem ein auffälliges EEG abgeleitet [11, 12, 15, 16], wobei es in zwei dieser Fälle auch klinisch zu epileptischen Anfällen kam [11, 12]. Aus den Fallberichten kann jedoch nicht sicher eruiert werden, ob beim Auftreten der Sinusarrhythmien jeweils auch gleichzeitig eine EEG-Ableitung erfolgte.
In weiteren drei Fallberichten traten Asystolien bei vermuteten HSV-Enzephalitiden auf (ohne Bestätigung mittels HSV-PCR im Liquor) [17, 18, 19]. Davon kam es in einem Fallbericht zu mehrmaligen epileptischen Anfällen mit gleichzeitiger Asystolie, weshalb eine iktale Ursache der Asystolie vermutet wurde [17]. Die Anfälle wie auch die Asystolien
waren in diesem Fall unter antiviraler Therapie rückläufig. Ebenfalls traten HSV-Enzephalitis-Fälle mit autonomer Instabilität und QT-Verlängerung respektive ventrikulärer Tachykardie auf [20, 21].
Der zugrundeliegende pathophysiologische Zusammenhang einer Sinusknotendysfunktion und HSV-Enzephalitis konnte bisher nicht abschliessend geklärt werden, bekannt ist jedoch, dass Pathologien im Bereich des Inselkortex zu kardialen Dysfunktionen führen können [22]. Oppenheimer zeigte 1990 in einem Tierversuch, dass durch eine Mikrostimulation des posterioren Inselkortex Arrhythmien und EKG-Veränderungen bis hin zur Asystolie ausgelöst werden konnten [23]. In einem weiteren Tierversuch beobachtete er, dass eine elektrische Stimulation des caudalen posterioren Inselkortex zu Bradykardien führte, eine Stimulation des rostralen posterioren Inselkortex löste aber Tachykardien aus, wobei beide Effekte mit Atenolol, aber nicht mit Atropin aufgehoben werden konnten, was für eine Aktivität des sympathischen Nervensystems spricht [24]. In einem weiteren Versuch an Patienten, bei denen aufgrund einer Epilepsie eine Temporallappenlobektomie geplant war, zeigte Oppenheimer, dass eine Stimulation des linken Inselkortex häufiger zu Bradykardien führte, während eine Stimulation des rechten Inselkortex häufiger eine Tachykardie auslöste [25]. Diese vermutete Lateralisierung (links parasympathisches Nervensystem versus rechts sympathisches Nervensystem) konnte allerdings bisher nicht ausreichend belegt werden [6].
Zusammenfassend lässt sich sagen, dass Läsionen unterschiedlicher Ursachen im Bereich des Inselcortex – der Prädilektionsstelle der HSV-Enzephalitis – zu EKG-Veränderungen und Arrhythmien führen können. Ob es im vorliegenden Fall aufgrund des Ödems im Bereich des rechten Inselkortex zu einer Unterfunktion des sympathischen Nervensystems gekommen ist oder ob die Läsionen zu fokalen insulären Epilepsien geführt haben und daher die rezidivierenden Bradykardien und Asystolien aufgetreten sind, bleibt unklar. Für Letzteres sprächen die wiederholten und jeweils nur kurz andauernden kardialen Episoden, wohingegen im ersteren Fall eher eine länger andauernde Sinusbradykardie zu erwarten wäre.
Die unauffälligen kardialen Untersuchungen (Echokardiografie, EKG im Intervall) lassen jedenfalls vermuten, dass die Ursache der Sinusknotendysfunktion im beschriebenen Fall eher nicht kardiogener Genese, sondern im Bereich der neuralen Steuerung zu suchen ist.
Diskussion
Die HSV1-Enzephalitis ist eine seltene Ursache einer Sinusknotendysfunktion. Im vorliegenden Fall ist eine epileptische Genese der meist selbstlimitierenden Asystolien im Rahmen der nachgewiesenen HSV-Enzephalitis anzunehmen. Leider konnte eine hierfür beweisende zeitgleiche EEG-Aufzeichnung nicht durchgeführt werden. Gestützt wird diese These dadurch, dass nach Start der antiepileptischen Therapie keine Arrhythmien mehr auftraten, obschon die strukturelle Schädigung und das Begleitödem persistierten. Dass solche strukturellen zerebralen Alterationen zu einem epileptischen Geschehen und im Rahmen dessen zu Arrhythmien führen, ist sehr selten, jedoch bei frontalen, temporalen und auch insulären fokalen epileptischen Anfällen durchaus bekannt.
Hinsichtlich der kardialen Dysfunktion weisen die in der Literatur beschriebenen Fälle darauf hin, dass diese mit dem Abheilen der Enzephalitis regredient sind und somit auch das Risiko einer erneuten Arrhythmie oder Asystolie als passager anzunehmen ist. Die Indikation der im vorliegenden Fall durchgeführten Herzschrittmacher-Implantation ist somit, nach Start der anfallsunterdrückenden
Therapie, kontrovers zu diskutieren.
Eine grosse Bedeutung hat in jedem Fall die unmittelbare Therapieeinleitung mit Virostatika und anfallsunterdrückender Therapie.
Mit der Aufarbeitung des Falls möchten wir zum breiten differenzialdiagnostischen Denken bei unklaren Synkopen anregen, um die Ursache nicht einzig und allein im Formenkreis der kardiovaskulären oder kardioregulatorischen Krankheiten zu suchen.
Im Artikel verwendete Abkürzungen
CRP C-reaktives Protein
CT Computertomogramm
EEG Elektroenzephalogramm
eGFR Estimated Glomerular Filtration Rate
EKG Elektrokardiogramm
GCS Glasgow Coma Scale
HSV-1 Herpes-Simplex-Virus Typ 1
MRT Magnetresonanztomogramm
PCR Polymerase Chain Reaction
Kantonsspital Olten
Baslerstrasse 150
4600 Olten
michael.studhalter@spital.so.ch
Historie
Manuskript eingereicht: 03.07.2022
Nach Revision angenommen: 09.01.2023
Interessenskonflikte
Es bestehen keine Interessenskonflikte.
ORCID
Nina Graf
https://orcid.org/0000-0002-7067-9536
Michael Studhalter
https://orcid.org/0000-0002-5467-2879
- Die HSV1-Enzephalitis ist mit 5 Fällen/Mio. die häufigste sporadische Enzephalitis in Westeuropa.
- In seltenen Fällen kann eine HSV1-Enzephalitis die Ursache für eine Sinusknotendysfunktion sein.
- Die Ursache ist nicht vollständig geklärt, vermuten lässt sich eine Störung der Hirn-Herz-Achse. Einerseits führt der Befall des Inselkortex zu einer autonomen Dysregulation des Herzens, andererseits ist eine iktale Genese zu evaluieren.
1. Meyding-Lamadé U, et al., Virale Meningoenzephalitis, S1- Leitlinie, 2018; in: Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie. www.dgn.org/leitlinien; letzter Zugriff: 11.01.2023.
2. Levitz RE. Herpes simplex encephalitis: a review. Heart Lung J Crit Care. 1998;27:209–12.
3. Davis LE, Johnson RT. An explanation for the localization of herpes simplex encephalitis? Ann Neurol. 1979;5:2–5
4. Kennedy PGE, Chaudhuri A. Herpes simplex encephalitis. J Neurol Neurosurg Psychiatry. 2002;73:237–8.
5. Stahl JP, Mailles A. Herpes simplex virus encephalitis update. Curr Opin Infect Dis. 2019;32:239–43.
6. Palma J-A, Benarroch EE. Neural control of the heart: Recent concepts and clinical correlations. Neurology. 2014;83:261–71.
7. Dinallo S, Waseem M. Cushing Reflex. StatPearls Publishing; 2022.
8. Manea M, Comsa M, Minca A, Dragos D, Popa C. Brain-heart axis – Review Article. J Med Life. 2015;8:266–71.
9. Cole AJ, Eskandar E, Mela T, Noebels JL, Gonzalez RG, McGuone D. Case records of the Massachusetts General Hospital. Case 18-2013: a 32-year-old woman with recurrent episodes of altered consciousness. N Engl J Med. 2013;368:2304–12.
10. Pathak SJ, Yousaf MIK, Shah VB. Sudden Unexpected Death in Epilepsy. Treasure Island (FL): StatPearls; 2022.
11. Pollock S, Reid H, Klapper P, Metcalfe RA, Ahmed N. Herpes simplex encephalitis presenting as the sick sinus syndrome. J Neurol Neurosurg Psychiatry. 1986;49:331–2.
12. Nicol PP. Herpes Simplex Encephalitis, an Unusual Cause of Sinus Node Dysfunction: Case Report and Literature Review. Int J Clin Cardiol. 2015;2:042.
13. Braiman D, Konstantino Y, Westreich R. When the brain slows the heart – herpes encephalitis and sinus arrest: a case report. Eur Heart J Case Rep. 2021;5:ytab254.
14. Wendl E, Telles-Garcia N. Herpes simplex virus encephalitis with a cause for pause: A case report. Int J Heart Rhythm. 2020:5:14–7.
15. Sabri WMNWM, Yahaya NA, Alias A, Anuar MA. A Case of Severe Transient Sinus Bradycardia in Herpes Simplex Infection. Mal J Med Health Sc. 2021;17(4):428–30.
16. Smith BK, Cook MJ, Prior DL. Sinus node arrest secondary to HSV encephalitis. J Clin Neurosci. 2008;15:1053–6.
17. Gooch R. Ictal asystole secondary to suspected herpes simplex encephalitis: a case report. Cases J. 2009;2:9378.
18. Saffran L, Goldner BG, Adler H, Feingold BD, Feingold RM, Latcha S, et al. Asystole associated with herpes simplex encephalitis. J Invasive Cardiol. 1995;7:152–5.
19. Alsolaiman MM, Alsolaiman F, Bassas S, Amin DK. Viral encephalitis associated with reversible asystole due to sinoatrial arrest. South Med J. 2001;94:540–1.
20. Huemer M, Boldt L-H, Wutzler A, Parwani A, Rolf S, Blaschke D, et al. Polymorphic ventricular tachycardia in a patient with herpes encephalitis. J Clin Neurosci Off J Neurosurg Soc Australas. 2012;19:483–4.
21. Kikumoto M, Nagai M, Ohshita T, Toko M, Kato M, Dote K, et al. Insular cortex lesion and autonomic instability in a herpes simplex virus encephalitis patient. J Neurovirol. 2018;24:649– 51.
22. Nagai M, Hoshide S, Kario K. The insular cortex and cardiovascular system: a new insight into the brain-heart axis. J Am Soc Hypertens JASH. 2010;4:174–82.
23. Oppenheimer SM, Wilson JX, Guiraudon C, Cechetto DF. Insular cortex stimulation produces lethal cardiac arrhythmias: a mechanism of sudden death? Brain Res. 1991;550:115–21.
24. Oppenheimer SM, Cechetto DF. Cardiac chronotropic organization of the rat insular cortex. Brain Res. 1990;533:66–72.
25. Oppenheimer SM, Gelb A, Girvin JP, Hachinski VC. Cardiovascular effects of human insular cortex stimulation. Neurology. 1992;42:1727–32.
PRAXIS
- Vol. 112
- Ausgabe 10
- August 2023