- XDR-Tuberkulose: Nicht nur medizinisch eine Herausforderung
Ein junger Patient aus Georgien präsentiert sich mit einer pulmonalen XDR-Tuberkulose, nachdem er in seinem Heimatland bereits über Monate erfolglos mit diversen Reservetherapeutika behandelt worden ist. Nach Bestätigung der Diagnose auf Basis von genotypischen Untersuchungen der Sputumproben sowie eines georgischen Resistenzogramms wurde eine empirische Therapie gestartet. Trotz vieler Unsicherheiten und im Verlauf schweren Therapienebenwirkungen, die Therapieanpassungen nötig machten, verlief die Behandlung erfolgreich mit klarem klinischen und radiologischen Ansprechen, und der Patient konnte nach knapp einem Jahr nach Georgien zurückkehren.
Schlüsselwort: XDR-Tuberkulose
Fallbericht
Anamnese und Befunde
Im Folgenden berichten wir von einem Fall von extensively drug-resistant Tuberkulose (XDR-Tb) bei einem Patienten aus Georgien, der nach frustraner Therapie in seinem Heimatland in der Schweiz Asyl beantragt hat, um sich hier behandeln zu lassen. Der 32-jährige Patient wurde vom Bundesasylzentrum auf unsere Notfallstation zugewiesen, nachdem er einen Tag zuvor mit seiner Familie in die Schweiz eingereist ist. Er berichtet, in Georgien über fast ein halbes Jahr erfolglos gegen eine resistente Form von pulmonaler Tuberkulose behandelt worden zu sein, wobei sich sein Zustand immer weiter verschlechtert habe. Er leide unter Husten, progredienter Schwäche und Gewichtsverlust. Auch sein sechsjähriger Sohn sei erkrankt und von schweren Therapienebenwirkungen betroffen.
Fünf Monate zuvor sei eine Therapie mit den Medikamenten Bedaquilin, Linezolid und Pretomanid begonnen und nach zwei Monaten auf eine Kombination aus Levofloxacin, Linezolid, Delamanid, Paraaminosalicylsäure und Cycloserin umgestellt worden. Bei fehlendem Ansprechen habe man ihm schliesslich als letzte therapeutische Option eine Operation nahegelegt, was, neben dem schwierigen Verlauf beim Sohn, zum Entscheid geführt habe, sich in der Schweiz behandeln zu lassen.
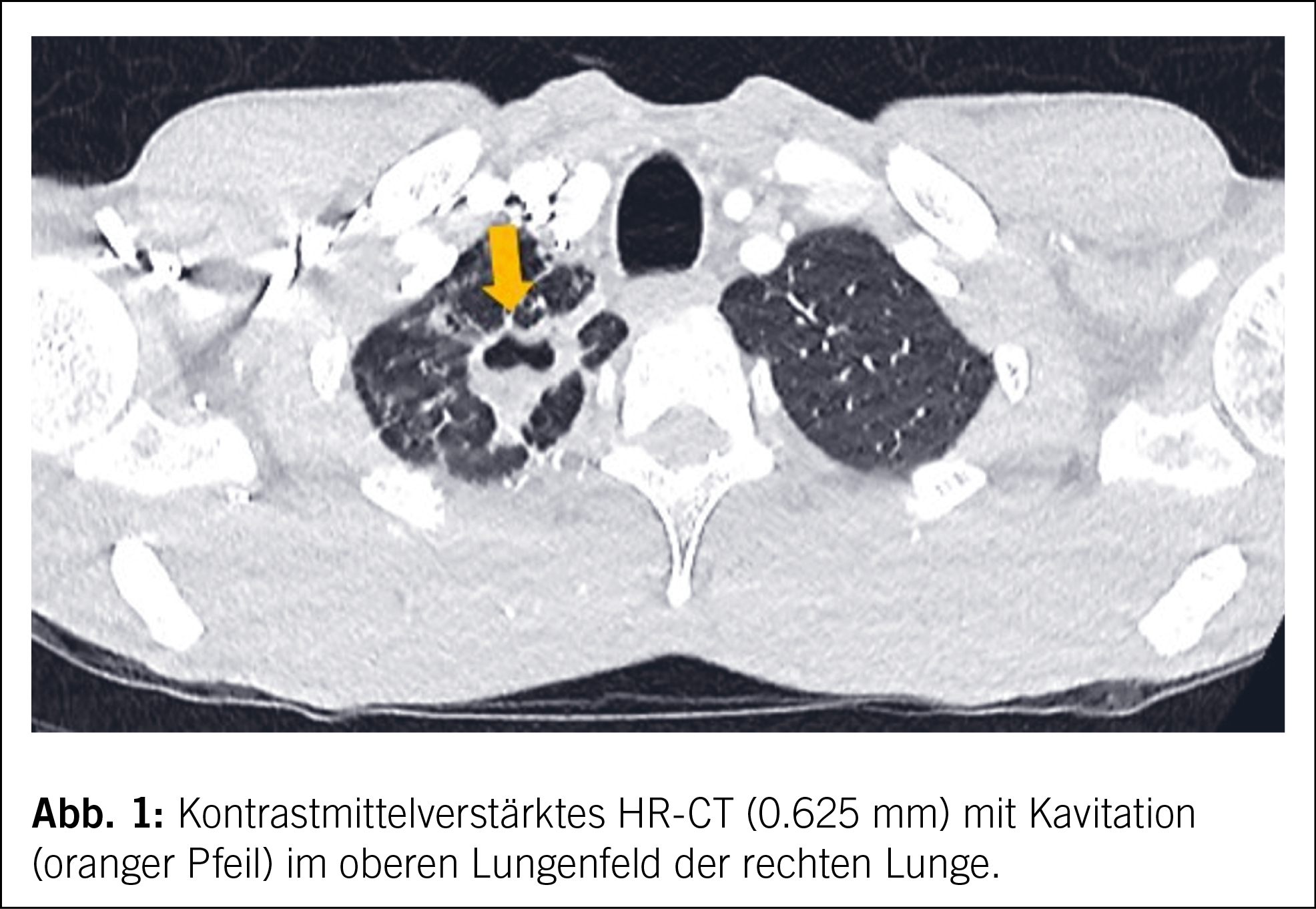
Der Patient präsentierte sich bei Eintritt kachektisch mit einem BMI von 17,8 kg/m2, die pulmonale Auskultation ergab abgeschwächte Atemgeräusche über dem rechten Mittelfeld. Computertomographisch kamen postspezifische Veränderungen im rechten Ober- und Unterlappen mit ausgedehnten Konsolidierungen und mehreren Kavernen mit Anschluss an das Bronchialsystem zur Darstellung (Abb. 1).
Differenzialdiagnostische Überlegungen
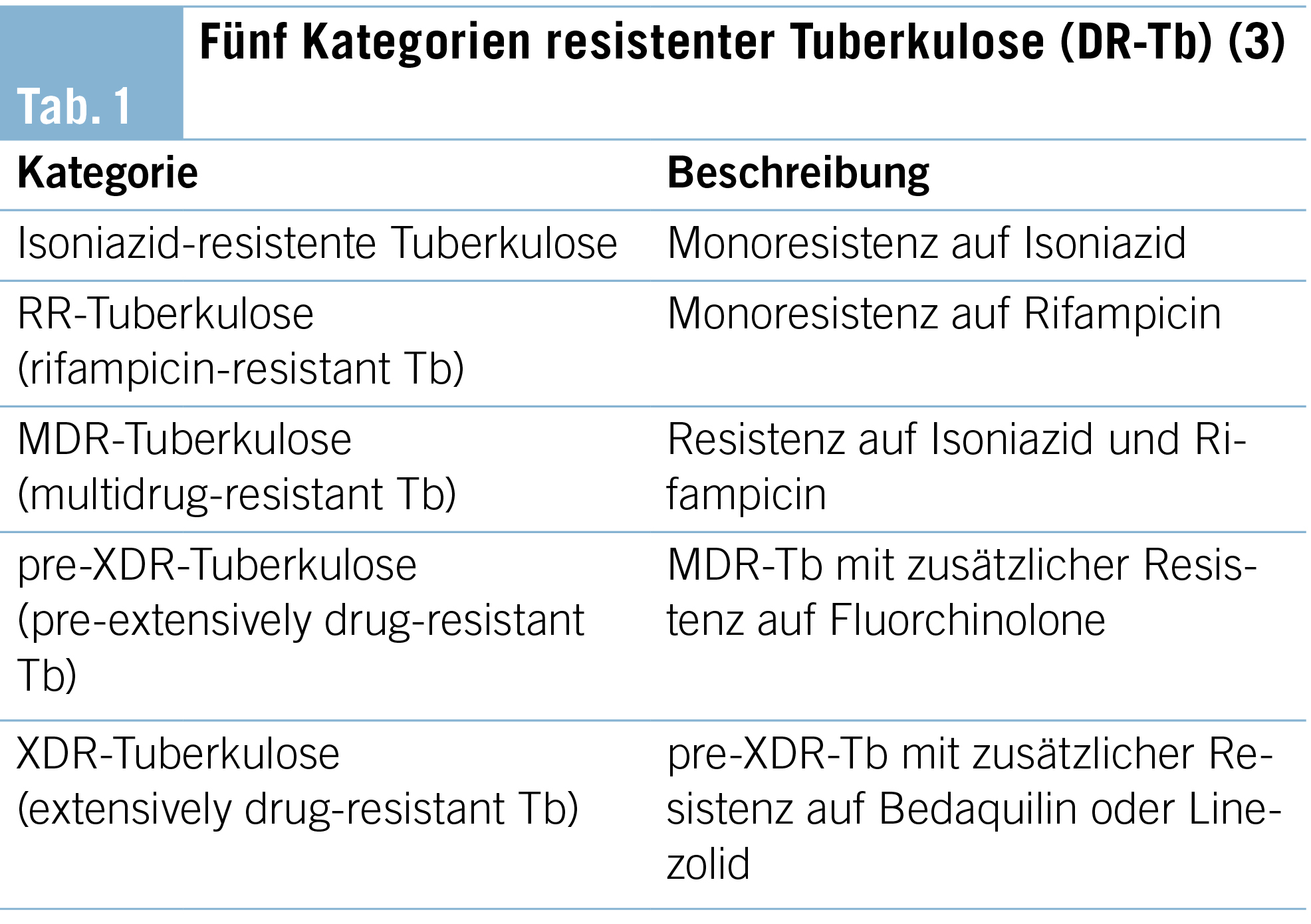
Die resistente Tuberkulose wird von der WHO je nach Grad der Resistenz in fünf Kategorien unterteilt (Tab. 1).
Je mehr Medikamente der Standardtherapie und der Reservewirkstoffe unwirksam sind, desto höhergradig ist die Resistenz. Die Unterscheidung ist aufgrund unterschiedlicher Therapieregime von Bedeutung. Zur Differenzierung stehen geno- sowie phänotypische Untersuchungsmethoden zur Verfügung. Eine kulturelle Anzucht der Mykobakterien zur direkten Austestung der Medikamentenwirksamkeit (phänotypische Resistenzprüfung) ist der Goldstandard, jedoch aufgrund der langen Generationszeit der Mykobakterien häufig erst nach langer Bebrütungszeit (bis zu mehreren Wochen) verfügbar. Wesentlich schneller sind die genotypischen Testungen, bei denen beispielsweise mittels PCR nach konkreten Resistenzmutationen gesucht wird. Nicht für jedes Tuberkulosemedikament ist jedoch eine entsprechende Resistenzmutation bekannt, sodass sich nicht alle Medikamente mittels genotypischer Methode austesten lassen. Unter einer ungeeigneten Therapie können sich schnell neue Resistenzen bilden und Medikamente ihre Wirksamkeit verlieren, sodass eine präzise Diagnose für den Therapieerfolg zentral ist.
Weitere Abklärungsschritte
Säurefeste Stäbchen konnten mikroskopisch in zwei von sechs Sputumproben detektiert werden, der Direktnachweis des Mycobacterium tuberculosis-Komplex mittels PCR (GeneXpert) gelang aus drei von sechs Proben. Diese initiale PCR bestätigte auch das Vorliegen einer Rifampicin-Resistenz durch Nachweis der Resistenzmutation S450L/W im rpoB-Gen. Weiter konnten molekular mittels Line Probe Assay und Sequenzanalyse folgende Resistenzen nachgewiesen werden: Isoniazid high-level-Resistenz (katG-Gen, S315T Mutation), Pyrazinamid-Resistenz (pncA-Gen, H71R Mutation), Fluorchinolon-Resistenz (gyrA-Gen, D94N Mutation) sowie eine Streptomycin-Resistenz (rpsL-Gen, K88R Mutation). Eine kulturelle Anzucht aus kumulativ neun Proben mit Inkubation über zwölf Wochen gelang nicht, sodass keine phänotypische Resistenzprüfung durchgeführt werden konnte.
Mit einigem Aufwand liessen sich im Verlauf die georgischen Vorbefunde auftreiben. Es fand sich dabei ein Resistogramm aus der ersten kulturell positiven Sputumprobe, in dem zusätzlich Resistenzen auf die neueren Medikamente Bedaquilin und Delamanid beschrieben war. Mit dieser zusätzlichen Information war die Diagnose einer XDR-Tuberkulose gestellt.
Kommentar
Die extensively drug-resistant Tuberkulose (XDR-Tb) ist mit null bis drei Fällen pro Jahr in der Schweiz eine Seltenheit (E. Altpeter, Bundesamt für Gesundheit). In anderen Regionen der Welt, vor allem in Zentralasien und Osteuropa, sind resistente Formen der Tuberkulose verbreiteter. Bezogen auf die Ansteckungsrate unterscheiden sie sich nicht von der sensiblen Form, sind jedoch schwieriger zu behandeln und weisen eine deutlich höhere Morbidität und Mortalität auf (1). Die Therapieerfolgsrate ist mit 31 % sehr tief (2).
Präzise Zahlen zur Prävalenz weltweit sind nicht verfügbar, da in vielen Ländern Resistenztestungen aus Ressourcengründen nur sehr begrenzt durchgeführt werden. Im Jahr 2022 wurden weltweit nur ca. 70 % aller mikrobiologisch bestätigten Fälle von pulmonaler Tuberkulose auf das Vorliegen einer Rifampicin-Resistenz getestet (absolut 2.9 von 4 Millionen Fällen). Von den getesteten waren
4.4 % Rifampicin-resistent (RR), und bei wiederum ca. 15 % davon lag eine pre-XDR- oder XDR-Tb vor. Global werden jährlich nur ca. 43 % aller Patienten, die eine MDR/RR-Tb entwickeln, einer adäquaten Therapie zugeführt (3). Demgegenüber werden in der Schweiz alle diagnostizierten RR-, MDR-, preXDR- oder XDR-Tb-Fälle vom Nationalen Referenzzentrum für Mykobakterien (NZM, Institut für Med. Mikrobiologie, Universität Zürich) tiefergehend analysiert. Es wird eine umfassende phänotypische und genetische Resistenztestung für Erst- und Zweitlinien-Antituberkulotika sowie eine Typisierung mittels Next Generation Sequencing (NGS) durchgeführt.
Die Viererkombination aus Rifampicin, Isoniazid, Ethambutol und Pyrazinamid, die sich zur Therapie der sensiblen Tuberkulose etabliert hat, ist bei den resistenten Formen nicht wirksam (4).
Nachdem 1968 Rifampicin auf den Markt gekommen ist, dauerte es über 40 Jahre, bis 2012 mit Bedaquilin ein neuer Wirkstoff für die Behandlung der Tuberkulose von der FDA zugelassen wurde (5–7). Es folgten 2014 Delamanid (8) und 2019 Pretomanid (9). Diese neuen Wirkstoffe gelten als Reservemedikamente für die Therapie einer resistenten Tuberkulose.
In den 2022 veröffentlichten neuesten WHO-Guidelines zur Therapie der resistenten Tuberkulose wird zur Behandlung der MDR-Tb prioritär die Viererkombination der Medikamente Bedaquilin, Pretomanid, Linezolid und Moxifloxacin («BPaLM-Regimen») über sechs Monate empfohlen. Im Fall einer pre-XDR-Tb (zusätzliche Fluorchinolon-Resistenz) soll Moxifloxacin weggelassen werden. Bei Vorliegen einer XDR-Tb wird empfohlen, eine ‘individualisierte Therapie’ aus Zweitlinienmedikamenten zusammenzustellen auf Basis der Empfindlichkeitsprüfung und der Krankengeschichte.
Diese Zweitlinienmedikamente wurden von der WHO in die drei Gruppen A, B und C in absteigender Hierarchie nach Wirksamkeit, Sicherheit und Einfachheit in der Anwendung eingeteilt (Tab. 2). Die Therapie soll zusammengesetzt werden aus mindestens vier ‘wahrscheinlich wirksamen’ Medikamenten, nach Möglichkeit soll eine Kombination von drei Substanzen der Gruppe A und mindestens einer Substanz der Gruppe B gewählt werden. Wenn keine vier ‘wahrscheinlich wirksamen’ Medikamente in den Gruppen A und B vorhanden sind (bei Vorliegen von Resistenzen oder Intoleranzen), sollen welche der Gruppe C eingeschlossen werden. Die Therapiedauer beträgt 18–20 Monate (10).
Diese – vornehmlich sehr alten – Zweitlinienmedikamente sind mit einer Bandbreite an teils schwerwiegenden Nebenwirkungen assoziiert, die die Therapieerfolgsrate entscheidend negativ beeinflussen. Die Anwendung von Linezolid kann dosisabhängig zu therapielimitierender Knochenmarksdepression, Polyneuropathie, Laktatazidose und Optikusneuritis führen, während Amikazin aufgrund von irreversibler Innenohrschädigung mit Hörverlust gefürchtet ist (11–14). Unter Therapie mit Cycloserin sind vor allem neuropsychiatrische Nebenwirkungen beschrieben, die von Kopfschmerzen (meist nicht therapielimitierend) über Depression bis hin zu schweren Psychosen und Suizidalität reichen und die folglich nicht nur im Zusammenhang mit der Compliance von Bedeutung sind (15, 16).
Auch chirurgische Optionen zur Behandlung von Fällen mit ausgedehnter Medikamentenresistenz werden in den WHO-Guidelines von 2022 erwähnt. Eine pulmonale Wedge-Resektion oder Lobektomie kann unter bestimmten Umständen und zusätzlich zur bestmöglichen medikamentösen Therapie helfen, den Bakterienload zu verringern und die Prognose zu verbessern (10).
Therapie und Verlauf
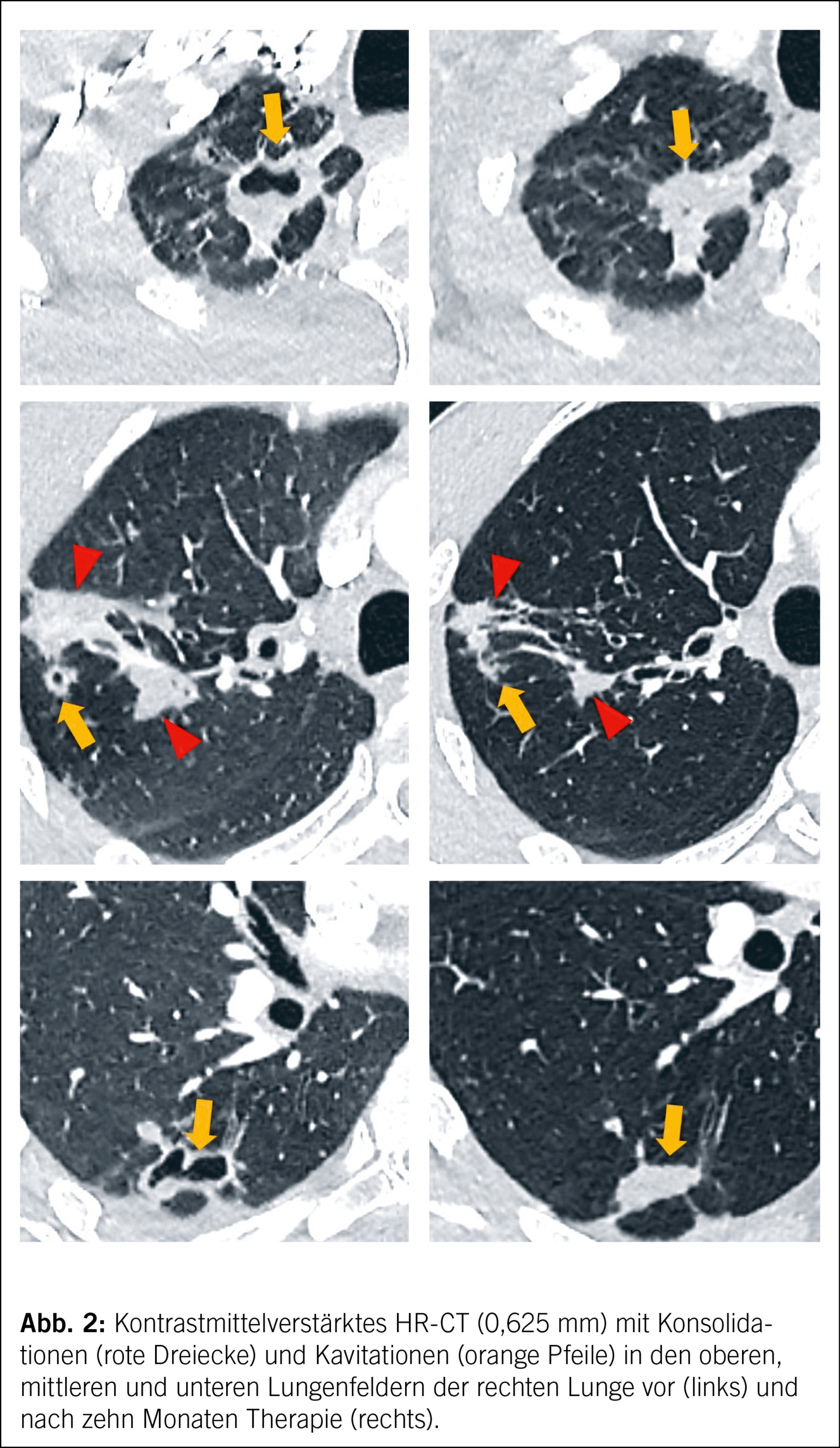
Der Patient war über fünf Wochen unter aerogener Isolation hospitalisiert, bis die geeignete Therapie gestartet werden konnte. Nach interdisziplinärer Besprechung am Mykobakterien-Board, unter Beizug von Experten des deutschen Referenzzentrums für Mykobakterien sowie konsiliarisch der Thoraxchirurgie, fiel die Entscheidung auf eine empirische Therapie mit Linezolid p.o., Cycloserin p.o., Amikacin i.v. und Meropenem plus Clavulansäure i.v. (mangels Verfügbarkeit eines Clavulansäure-Monopräparats verabreichten wir Co-Amoxicillin plus Meronem). Cycloserin musste aus Japan bzw. den USA bestellt werden, was den Therapiestart um zwei Wochen verzögerte. Drei Wochen nach Beginn der Behandlung zeigte sich ein erfreuliches Ansprechen mit komplett sistiertem Husten, Afebrilität und einer Gewichtszunahme von 5 kg. Der Patient wurde zur Fortsetzung der Therapie unter weiterhin strenger Isolationsmassnahme in eine andere Klinik verlegt. Unter Therapie erfolgten zum Zeitpunkt sechs, sieben und acht Wochen erneute Sputumkontrollen, die mikroskopisch und kulturell negativ blieben. Nach zweimonatiger Behandlung wurde eine Verlaufs-Computertomographie durchgeführt, die eine Resolution der pulmonalen Kavernen zeigte und das klinische Therapieansprechen radiologisch bestätigte (Abb. 2).
Die Isolation wurde aufgehoben, Meropenem/Clavulansäure i.v. durch Levofloxacin p.o. ersetzt, der Patient aus der Klinik entlassen und die Vierfachtherapie mit Linezolid, Levofloxacin, Cycloserin und Amikacin mithilfe der Spitex ambulant fortgesetzt.
Zur Monitorisierung erfolgte wöchentlich ein Polyneuropathie-Screening mittels Stimmgabeltest, eine initial wöchentliche Kontrolle von Blutbild, Kreatinin, Transaminasen und Laktat und regelmässige Audiometriekontrollen sowie Amikacin-Spiegel zur Früherkennung einer Innenohrschädigung. Nach knapp viermonatiger Therapie kam es zu ausgeprägter psychiatrischer Symptomatik mit selbst- und fremdaggressivem Verhalten, das eine notfallmässige Versorgung von Schnittwunden und eine Kurzhospitalisation in einer psychiatrischen Klinik nach sich zog. Nach Stoppen von Cycloserin sistierte die neuropsychiatrische Symptomatik, eine klassische Nebenwirkung dieser Substanz, komplett. Weitere drei Monate später entwickelte der Patient eine schwergradige Hochtonschwerhörigkeit beidseits, sodass wir auch Amikacin absetzen mussten. Stattdessen sollte Paraaminosalicylsäure (PAS) eingesetzt werden, was jedoch weder in der Schweiz noch aus dem Ausland lieferbar war. Es wurde also eine Zweifach-Therapie mit Linezolid und Levofloxacin weitergeführt für eine kumulative Therapiedauer von zwölf Monaten. Solange hat der Patient (trotz negativem Asylentscheid) in der Schweiz bleiben können. Sein Sohn wurde unterdessen erfolgreich an einer Kinderklinik behandelt und konnte ebenfalls genesen nach Georgien zurückkehren.
Danksagung
Die Publikation wurde mit finanzieller Unterstützung durch die wissenschaftlichen Stiftung Stadtspital Zürich (Fonds Medizin) ermöglicht. Wir bedanken uns ausserdem herzlich bei Dr. sc. nat. Bettina Schulthess, Ko-Leiterin Nationales Zentrum für Mykobakterien, für die kritische Durchsicht dieses Beitrags.
Klinik für Innere Medizin
Stadtspital Zürich Trieml
Klinik für Infektiologie
Universitätsspital Zürich
Institut für Radiologie und Nuklearmedizin
Stadtspital Zürich
Leitender Arzt Infektiologie
Leitung Med. Mikrobiologie
Stadtspital Zürich Triemli
Birmensdorferstrasse 497
8063 Zürich
Die Autorin und Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
• Bei Vorgeschichte einer Tuberkulosetherapie oder Herkunft aus einem Hochprävalenzland (z.B. Länder der ehemaligen Sowjetunion, Zentralasien) muss an die Möglichkeit einer DR-Tb gedacht und eine entsprechende Untersuchung durchgeführt werden.
• Bei Nachweis einer MDR-, pre-XDR- oder XDR-Tb sollte die Therapie in Zusammenarbeit mit einem spezialisierten Zentrum besprochen werden.
• Unerwünschte Wirkungen der Therapie sind häufig, bisweilen schwer, und können therapielimitierend sein. Sie müssen streng monitorisiert werden.
• 2023 wurde in Zürich das interdisziplinäre Mykobakterien-Board ins Leben gerufen, an welchem alle vier Wochen bzw. bei Bedarf häufiger komplexe Fälle vorgestellt und interdisziplinär zwischen Infektiologen, Pneumologen und Mikrobiologen des NZM besprochen werden. Das Board findet online via Zoom statt, zu diskutierende Fälle sind vorgängig zu melden an Johannes.Nemeth@usz.ch oder Marisa.Kälin@usz.ch.
1. Dheda K, Mirzayev F, Cirillo DM, et al. Multidrug-resistant tuberculosis. Nat Rev Dis Primers. 2024;10:1.
2. Dahl VN, Butova T, Rosenthal A, et al. Drug-Resistant Tuberculosis, Georgia, Kazakhstan, Kyrgyzstan, Moldova, and Ukraine, 2017–2022. Emerg Infect Dis. 2024;30:831–3.
3. World Health Organisation. Global Tuberculosis Report 2023. 2023.
4. World Health Organisation. WHO consolidated guidelines on tuberculosis. Module 4, Treatment: drug-resistant tuberculosis treatment. Geneva: World Health Organization; 2020.
5. Brändli O. Tuberkuloseforschung ist wichtig und nötig. Swiss Medical Forum. 2020;20:767–8.
6. Approval Dates for Existing and Prospects for Development of New Antituberculosis Drugs and Vaccines – Ending Neglect – NCBI Bookshelf (nih.gov). https://www.ncbi.nlm.nih.gov/books/NBK225602/; letzter Zugriff: 11. April 2024.
7. Dooley KE, Nuermberger EL, Diacon AH. Pipeline of drugs for related diseases: tuberculosis. Current Opinion in HIV and AIDS. 2013;8:579–85.
8. Auflistung zugelassener Orphan Drugs einsehen | vfa. https://www.vfa.de/de/arzneimittel-forschung/datenbanken-zu-arzneimitteln/orphan-drugs-list?filterWirkstoff=delamanid&filterIndikation=&sprungmarke=listmedikamenteorphan-90654#listmedikamenteorphan-90654; letzter Zugriff: 10. April 2024.
9. DailyMed – PRETOMANID tablet (nih.gov). https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=f1906fc9-cb3c-4e13-8a4a-da76100c1bf3; letzter Zugriff: 10. April 2024.
10. WHO operational handbook on tuberculosis. Module 4: treatment – drug-resistant tuberculosis treatment, 2022 update. 2022.
11. Wasserman S, Brust JCM, Abdelwahab MT, et al. Linezolid toxicity in patients with drug-resistant tuberculosis: a prospective cohort study. Journal of Antimicrobial Chemotherapy. 2022;77:1146–54.
12. Wangchuk P, Ram Adhikari T, Nima G, Dendup P. Audiological monitoring of patients undergoing multidrug resistant tuberculosis treatment at Jigme Dorji Wangchuk National Referral Hospital and Gidakom Hospital, Bhutan. Journal of Clinical Tuberculosis and Other Mycobacterial Diseases. 2021;23:1–4.
13. Wang S, Forsman LD, Xu C, Zhang H, Zhu Y, Shao G, u. a. Second-line antituberculosis drug exposure thresholds predictive of adverse events in multidrug-resistant tuberculosis treatment. International Journal of Infectious Diseases. 2024;140:62–9.
14. Borisov S, Danila E, Maryandyshev A, et al. Surveillance of adverse events in the treatment of drug-resistant tuberculosis: first global report. Eur Respir J. 2019;54:1–14.
15. Yadav S. Cycloserine-Induced Insomnia and Psychosis in Multidrug-Resistant Pulmonary Tuberculosis – A Case Report. Cureus. 2022;14:1–5.
16. Yadav S, Rawal G. Adverse drug reactions due to cycloserine on the central nervous system in the multidrug-resistant tuberculosis cases: a case series. PAMJ Clinical Medicine. 2019;1.
PRAXIS
- Vol. 113
- Ausgabe 11-12
- Dezember 2024