- You only ECHO Twice – man “ECHO”ed nur zweimal
Der ischämische Schlaganfall resultiert aus einer plötzlichen Unterbrechung des zerebralen Blutflusses, oft verursacht durch Thrombosen, Embolien oder Hypoperfusion. Selten sind Herztumoren die Ursachen eines embolischen Ereignisses. Wir berichten über eine 80-jährige Frau mit einem Hirnschlag. Die erfolgreiche Thrombektomie enthüllte ein histopathologisch bestätigtes papilläres Fibroelastom als die Emboliequelle. Obwohl es bei der ersten Echokardiographie nicht nachweisbar war, wurde der Tumor durch transösophageale Echokardiographie entdeckt. Dieser Fall betont die Bedeutung, primäre Herztumoren als potenzielle Emboliequellen bei ischämischen Schlaganfallfällen in Betracht zu ziehen.
Einführung
Wir berichten über eine 80-jährige Patientin, die sich mit einem armbetonten faciobrachiocruralen sensomotorischen Hemisyndrom links und Dysarthrie auf unserer Notfallstation präsentierte. Fremdanamnestisch konnte indirekt eruiert werden, dass sich die Symptomatik bereits in den letzten 12-24 Stunden entwickelte.
Bis auf eine leichtgradige Adipositas, waren keine weiteren kardiovaskulären Risikofaktoren bei der Patientin bekannt. Es lag keine relevante Dauermedikation vor, die Familienanamnese war unauffällig. Die Patientin war Rechtshänderin.
Im späteren Verlauf erwähnte die Patientin lediglich, dass sie in den letzten Wochen immer wieder febril gewesen sei. Andere Symptome wurden verneint. Etwaige kardiopulmonale Beschwerden waren nicht erinnerlich.
Die Patientin zeigte sich initial hypertensiv mit einem Blutdruck von 150/80 mmHg bei einer Sauerstoffsättigung von 98 % unter Raumluft. In der klinischen Untersuchung standen die neurologischen Defizite im Vordergrund, nämlich die deutliche Facialisparese links, Armplegie links, Beinparese links, Zungendeviation nach links und ein Neglect links bei zudem Dysarthrie. Die NIHSS bei Eintritt lag bei 10 Punkten; die mRS bei 5 Punkten. Der GCS lag bei 15. Die Lungen waren auskultatorisch unauffällig, das Herz rhythmisch und ohne pathologische Nebengeräusche. Das Abdomen war palpatorisch weich und druckindolent mit regelrechten Darmgeräuschen.
Als Ursache der neurologischen Manifestation boten sich differentialdiagnostisch eine Epilepsie, Synkope, Migräne, Hypo-/Hyperglykämie, Medikamentenintoxikation oder ein Hirntumor.
Im Primary Survey durch die Rettungssanitäter, wurde unter anderem eine Hypoglykämie ausgeschlossen, sodass wir den Stroke als häufigste und naheliegendste Ursache, abklärten.
In der Bildgebung mittels Schädel CT-Angiografie, bestätigte sich eine akute Ischämie rechtshemisphärisch im Mediastromgebiet bei M1-Verschluss der MCA rechts mit relativ grosser Penumbra und bereits Infarktdemarkierung in der Insula, Capsula externa, Putamen, periventrikulärem Marklager bis hin zur Cauda nuclei caudati, reichend (Bild 1).
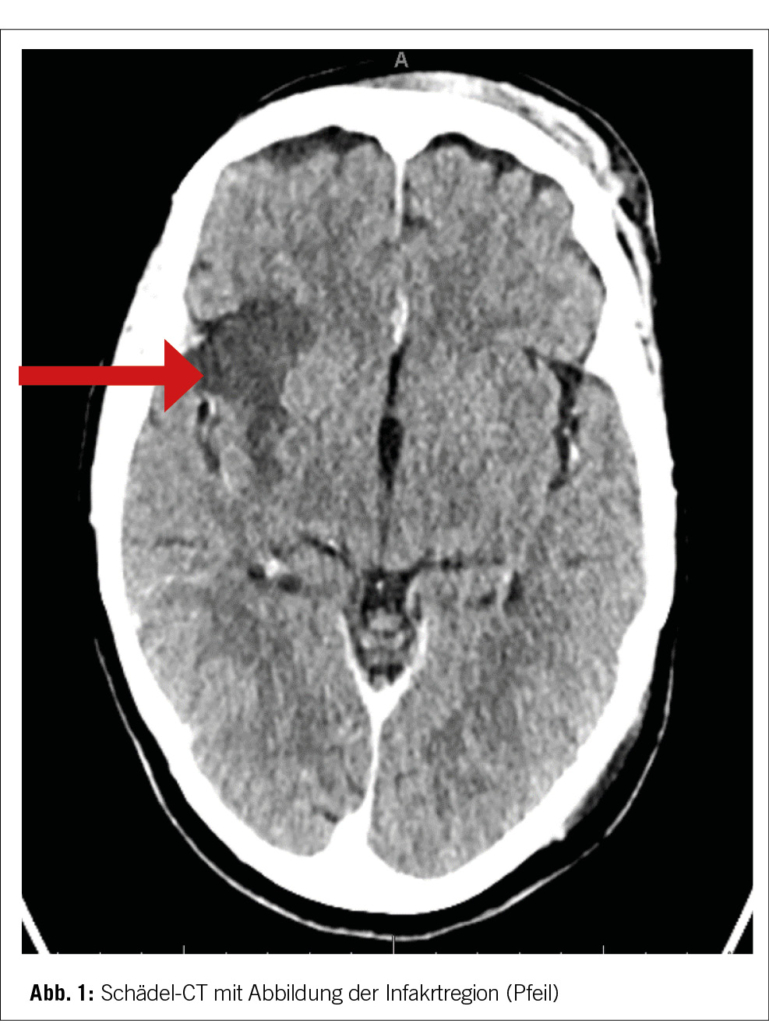
Aufgrund des zeitlich unklaren Symptombeginns und der computertomografisch beginnenden Demarkation mit jedoch vorhandenem MTT/CBV-Mismatch, wurde auf eine intravenöse Lyse verzichtet und die Patientin direkt zur mechanischen Thrombektomie in ein Strokezentrum verlegt.
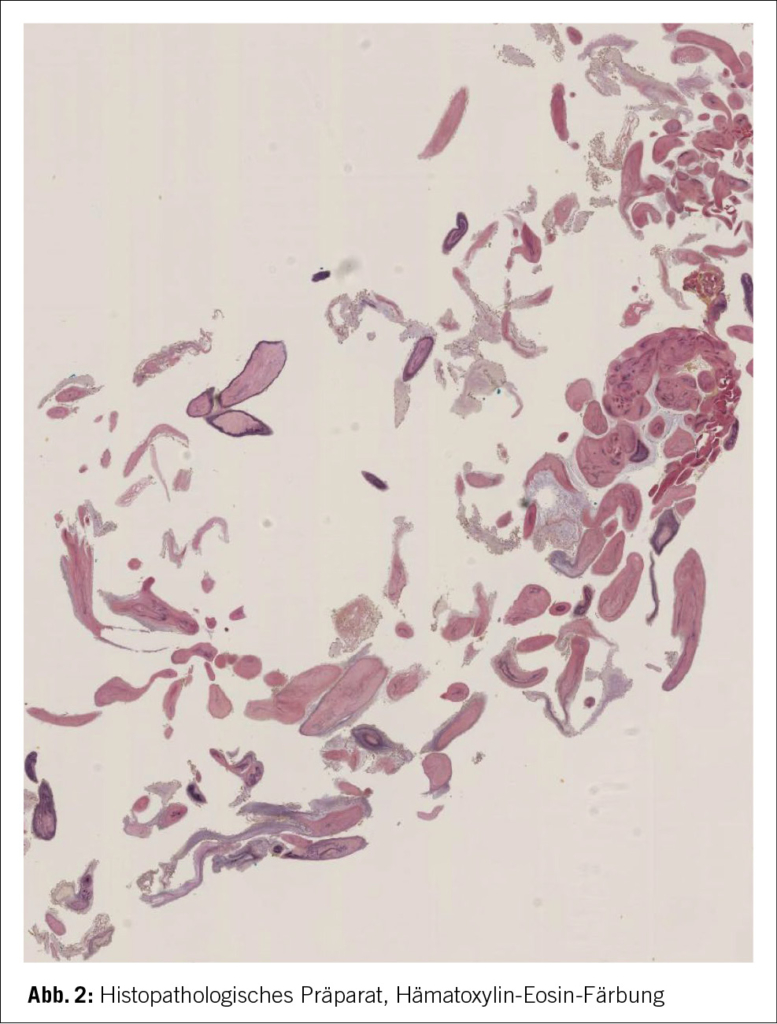
Dort erfolgte eine komplikationslose mechanische Thrombendarteriektomie und das Gefäss konnte mittels Stentretriever und Thrombo-Aspiration wiedereröffnet werden. Das Aspirat wurde anschliessend zur histopathologischen Untersuchung abgeschickt. Postinterventionell erfolgte das Standard-Post-Stroke Work-Up mittels Langzeit-EKG, Duplexsonographie der Halsgefässe und TTE. In den durchgeführten Untersuchungen liess sich initial keine Strokeursache eruieren. Im Verlauf kam das Ergebnis der Histopathologie des aspirierten Thrombus, an. Es konnten dabei im Thrombus papillär ausgebaute Gewebsfragmente mit fibroelastischen Kernstücken und wenig myxoiden Anteilen, welche an eine Embolie eines papillären Fibroelastoms denken liessen, nachgewiesen werden (Bild 2).
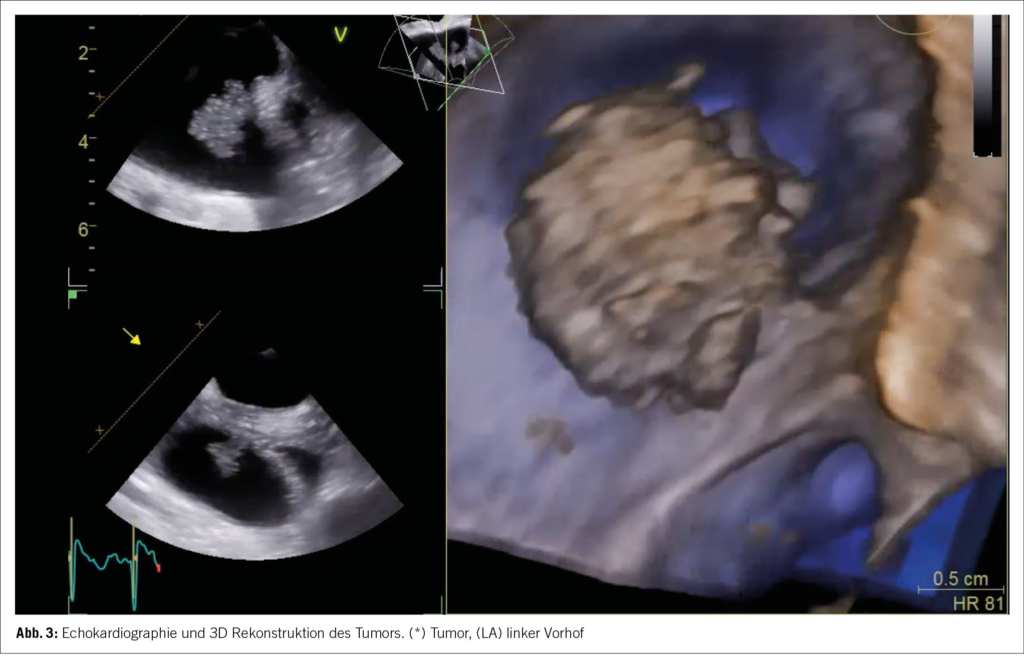
Das Stroke-Work-Up wurde um ein zusätzliches TEE ergänzt. Dieses bestätigte schliesslich den histologischen Befund, mit Darstellung einer 15×18 mm messenden kugeligen flottierenden Struktur zwischen dem linken Vorhof und der linken oberen Lungenvene (im Bereich der Warfarin Ridge, Bild 3). Durch das TEE wurde somit das Herz als primäre Emboliequelle des Hirninfarktes, bestätigt.
Herztumoren, obwohl im Vergleich zu anderen Herzerkrankungen selten, stellen aufgrund ihrer vielfältigen Ursprünge, variablen klinischen Manifestationen, Komplikationen und komplexen Behandlungsansätzen, einzigartige Herausforderungen dar. Sie können entweder als primäre Tumoren entstehen, die im Herzen selbst ihren Ursprung haben, oder als sekundäre Tumoren, die an anderer Stelle im Körper entstehen und zum Herzen metastasieren (1). Diese Tumoren umfassen eine breite Palette histologischer Typen, einschliesslich gutartiger und bösartiger Neoplasien, von denen jeder seine eigene biologische Verhaltensweise mit entsprechenden klinischen Auswirkungen hat (siehe Tabelle 1) (1).

Von allen primären Herztumoren sind mehr als 75% benigne. Myxome respektive Papilläre Fibroelastome sind zwar die zwei häufigsten primären Herztumore, jedoch beträgt die Häufigkeit der Tumoren nur 0.021%–0.019% (2, 3.)
Im klinischen Alltag gehören die Herztumoren zu einer Rarität. Primäre Herztumore haben eine Prävalenz von weniger als 0.1% (4, 5). Dagegen sind Herzmetastasen deutlich häufiger. Bei mehr als 9.1% der Patienten, die mit einer malignen Krebserkankung sterben, können Herzmetastasen post mortem nachgewiesen werden (5).
Die Symptome eines Herztumors können durch nachfolgende Prozesse erklärt werden (6).
Embolisation – Es kann sich um einen abgebrochenen Teil des Tumors handeln, oder um einen Thrombus, der sich auf der Tumorwand gebildet hat und mit dem Blutstrom in den Kreislauf gelangt. Wächst der Tumor im rechten Vorhof respektive in den rechten Ventrikel, kann es dabei zu Symptomen, vereinbar mit einer Lungenembolie (Rechtsherzbelastung, gestaute Halsvenen, periphere Ödeme, Aszites, Tachykardie, Hypotonie), kommen. Bei Linksherztumoren mit Ursprung im linken Vorhof oder im linken Ventrikel, sind die Symptome weniger systemisch und eher lokal betont. Bei einer Embolisation ins Gehirn, tritt ein Strokeartiges neurologisches Muster, auf. Andererseits kann der Embolus auch ein peripheres Gefäss obstruieren und dadurch eine akute Extremitätenischämie verursachen.
Obstruktion – Je nach Grösse und Lokalisation, können die Herztumoren rechtsseitige oder linksseitige Herzkompartimente obstruieren und dadurch entsprechende Herzinsuffizienzmuster imitieren.
Imitation von Herzklappenfehlern – Ähnlich zum Obstruktionsmechanismus, können die Tumoren je nach Intensität der Interferenz mit den Herzklappen, verschiedene Klappenvitien imitieren und dadurch zur Links- respektive Rechtsherzinsuffizienz führen.
Invasivität – Bei signifikanter Infiltration des Myokards, ist nicht nur dessen mechanische Fähigkeit beeinträchtigt, sondern auch die Elektrophysiologie, was sich als Blockbildung oder Arrhythmie manifestieren kann. Bei noch tieferem Wachstum kann der Tumor bis ins Perikard hineinwachsen. Dadurch kommt es zur Ergussbildung mit oder ohne Symptome einer Perikardtamponade. Falls der Tumor sehr invasiv wächst und die Lunge infiltriert, können Symptome eines Bronchialcarcinoms imitiert werden.
Systemische Symptome – Unspezifische Beschwerden wie Schwäche, (sub-)febrile Temperaturen, Müdigkeit, Appetitlosigkeit, Gewichtsverlust sowie laborchemische Veränderungen (CRP, Blutbild) können auftreten.
In der letzten Dekade steigen die Zahlen der per Zufall diagnostizierten Herztumoren durch Ausbreitung von bildgebenden Methoden wie PET-/CT/MRI/TTE/TEE, etc. (7)
Bei Verdacht auf einen Herztumor der ursächlich für den Schlaganfall sein kann, ist eine transthorakale Echokardiographie, die Bildgebung der Wahl. Diese Untersuchung, zusammen mit dem CT und MRI, kann Myxome, papilläre Fibroelastome, Fibrome und Lipome, differenzieren (7). Eine transösophageale Echokardiographie hat indessen, im Vergleich zur TTE, durch fehlende Knochen- und Lungenartefakte sowie minimale Entfernung des Ösophagus zum Herzen, eine bessere Qualität (8). Das TEE wird als ergänzende Diagnostik, bei schlechter Echoqualität des TTEs respektive bei Kryptogenem Stroke, zur weiteren Abklärung verwendet, falls die primären Untersuchungen keine Ursache der Embolie, zeigen konnten.
Das Herz-MRI ist die beste non-invasive bildgebende Methode, um die topographischen und morphologischen Fähigkeiten des Tumors darzustellen (9).
Ein PET-Scan wird vor allem bei Patienten mit metastasierten Tumoren durchgeführt, wobei dabei eine Herzmetastase bestätigt wird.
Eine Koronarangiographie wird zur Darstellung der genauen Blutversorgung sowie zur Planung einer Resektion des Herztumors, durchgeführt. Falls eine Resektion nicht möglich/erwünscht ist, kann eine perkutane Tumorbiopsie durchgeführt werden, um die weitere non-invasive Therapie planen zu können (6). Die Biopsien tragen jedoch ein hohes Risiko für Komplikationen mit sich, wie zum Beispiel eine Herzwand- oder Septumperforation, Tamponade, Pneumothorax oder Infektion.
Es gibt keine umfangreichen Studien zur optimalen Therapie von Herztumoren, insbesondere bei malignen Formen; es liegen oftmals nur Einzelfallberichte vor. Die vollständige Resektion in Kombination mit einer Chemo-/Radiotherapie ist in den meisten Fällen die bevorzugte Behandlung von malignen Tumoren. Benigne Neubildungen tendieren zur Embolisation. Die chirurgische Entfernung eines Myxoms/papillären Fibroelastoms, ist somit die einzige kurative Möglichkeit, das thromboembolische Risiko des Tumors, zu eliminieren (10-12).
In Konsens mit den aktuellen Richtlinien, wurde auch der Patientin unseres Fallbeispiels, aufgrund des bestehenden, erhöhten Embolisationsrisikos, eine kardiochirurgische minimalinvasive Tumorexzision empfohlen.
Jedoch entschied sich die Patientin gegen eine solche Operation, sodass mit einer medikamentösen Sekundärprophylaxe mittels Antiaggregationshemmer (Aspirin cardio) lebenslang, Antikoagulation (Apixaban) lebenslang sowie einer begleitenden Statintherapie begonnen wurde.
Im Anschluss absolvierte die Patientin eine intensive 3-Monate lange Neurorehabilitation. In einem interdisziplinären, multimodalen Behandlungskonzept erhielt die Patientin Physio-, Ergo-, Logopädie mit Dysphagietherapie, manuelle Aktivierungstherapie, Ernährungsberatung sowie neuropsychologische Diagnostik und Therapie. Sie konnte die Rehabilitation schliesslich in deutlich gebessertem Zustand verlassen. Der NIHSS lag bei 3 Punkten; der mRS bei 2 Punkten.
Ein Jahr nach dem Hirninfarkt, ging es der Patientin weiterhin gut, sie war selbstständig, konnte ohne Hilfsmittel laufen und hatte keine Beschwerden mit dem Sprechen. Der Neglect war komplett regredient. Das einzige bestehende Defizit zeigte sich in Form einer fehlenden Feinmotorik im Bereich der linken Hand.
Die Sekundärprophylaxe mit Apixaban, Aspirin cardio und dem Statin, wird weiterhin vollständig eingenommen.
Dieser klinische Fall hebt die Stärken, Vorteile und Limitationen von moderner Evidence-based Medizin, hervor.
Mithilfe der standardisierten und raschen Behandlung der Stroke-Patientin, konnte eine gezielte Diagnostik und rasche Therapieentscheidung, erfolgen.
Die typischen neurologischen Ausfälle, mit welchen sich die Patientin initial auf dem Notfall vorstellte, führten zu einer gezielten Bildgebung mittels Schädel CT-Angiographie, wo der Hirninfarkt im rechten Mediastromgebiet, dargestellt werden konnte. Die initialen Abklärungen mittels TTE, Carotis-Sonographie und Herzrhythmusüberwachung, lieferten zunächst keine Ätiologie. Es wurde der Entscheid zur mechanischen Thrombendarteriektomie getroffen, wobei sich letztendlich erst im Thrombusaspirat histopathologisch ein papilläres Fibroelastom, als primäre kardiale Emboliequelle des Schlaganfalls, darstellen liess und die Stroke-Ursache somit geklärt werden konnte.
Wie bereits in der Fallbeschreibung erwähnt, fiel die erste transthorakale Echokardiographie nach dem Hirninfarkt, unauffällig aus. Nachdem im Thrombusaspirat ein papilläres Fibroelastom gezeigt wurde, erfolgte eine Re-Echokardiographie mittels TEE, wo der Befund bestätigt wurde. Diese Erfahrung steht im Einklang mit Daten der Mayo-Clinic Studie, wo ein zugrundeliegender Herztumor in 70% der transthorakalen Echokardiographien, initial verpasst wurde (13). Deshalb ist es wichtig, insbesondere bei Kryptogenen Strokes, in zweitrangigen diagnostischen Abklärungen, die Bedeutung der transösophagealen Echokardiographie, nicht zu unterschätzen.
Obwohl die Anwesenheit einer Herzneoplasie in der TEE nicht überraschend war, konnte der differentialdiagnostische Verdacht eines Myxoms, aufgrund der Grösse, Lage und Morphologie der Neoplasie im TEE, widerlegt werden. Die unspezifischen klinischen Symptome, wie rezidivierende subfebrile Temperaturen und ein laborchemisch erhöhtes CRP sowie IL-6, unterstützten den echokardiographischen Verdacht der Kardiologen zusätzlich (6).
Zudem lag der histopathologische Befund des Thrombusaspirates vor, welcher ein papilläres Fibroelastom, bestätigte. Eine definitive Sicherheit in der Diagnosestellung, erlangt man letztendlich jedoch nur mittels einer kardiochirurgischen Exzision.
Da die chirurgische Entfernung eines Myxoms/papillären Fibroelastoms, das thrombembolische Risiko des Tumors praktisch eliminiert, wurde auch unserer Patientin, eine Operation empfohlen. Trotz des relativ tiefen Mortalitätsrisikos der minimalinvasiven Resektion (ca. 5%;10-12), entschied sich die Patientin für eine konservative Behandlung. Somit wurde eine kombinierte medikamentöse Sekundärprophylaxe mit Apixaban, Aspirin cardio und einem Statin, begonnen.
Damit soll insbesondere das erhöhte Risiko einer Thrombusbildung auf der Oberfläche des Tumors, kontrolliert, und eine erneute Thromboembolisation vermieden werden (14, 15). Eine Embolisation des Tumorfragmentes kann jedoch per se durch die medikamentöse Behandlung nicht beeinflusst werden.
Aufgrund der Seltenheit von Herztumoren, ist die Möglichkeit einer prospektiven randomisierten Studie im Bereich des Managements des Tumors, Risiken und der geeigneten Thromboembolieprophylaxe, unrealistisch. Weitere Fallbeispiele und retrospektive Studien sind notwendig, um die umstrittenen Punkte einer optimalen Versorgung genauer abzuklären.
Die selteneren Ursachen einer Hirnischämie dürfen nicht vergessen werden. Es gilt insbesondere initial auf der Not-fallstation, einen weitläufigen differentialdiagnostischen Blick zu behalten, um auch eine Epilepsie, einen Hirntumor, eine Medikamentenintoxikation oder Hypo-/Hyperglykämien, nicht zu verpassen. Eine unauffällige transthorakale Echokardiographie schliesst zudem einen Herztumor, Thrombus oder eine Klappenvegetation, nicht vollständig aus, sodass hier sicherlich eine transösophageale Echokardiographie als nächste Option, zu überlegen ist. Die einzige kurative Option zur Behandlung des Herztumors, ist eine Resektion. Die Pros Und Contras einer solchen Operation, sind individuell zu betrachten und mit der/dem Patientin/en sorgfältig abzuwägen; eine systematische Studie hinsichtlich der konservativen Behandlung ist erforderlich.
Im Artikel verwendete Abkürzungen
NIHSS National Institutes of Health Stroke Scale
ABCD2-Score Prognostisches Scoring System zur Abschätzung des Schlaganfallrisikos nach TIA (Alter, Blutdruck, Clinical features bei Erstuntersuchung, Dauer der Symptome, Diabetes mellitus)
mRS Modifizierte Rankin-Skala
GCS Glasgow Coma Scale
MCA Middel cerebral artery (Arteria cerebri media)
MTT Mean transit time
CBV Cerebral blood volume
TTE Transthorakale Echokardiographie
TEE Transoesophageale Echokardiographie
ESUS Embolischer Schlaganfall unklaren Ursprungs
PCT Primary Cardiac Tumors
PFE Papillary FIbroelastom
MX Myxom
DAPT Duale Antiplättchentherapie
Luzerner Kantonsspital
Herzzentrum
Spitalstrasse
6004 Luzern
Es bestehen keine Interessenkonflikte.
Historie:
Manuskript eingereicht: 15.11.2023
Nach Revision angenommen: 20.02.2024
- Mithilfe der standardisierten und raschen Behandlung der Stroke-Patientin, konnte eine gezielte Diagnostik und rasche Therapieentscheidung, erfolgen.
- Es ist wichtig, insbesondere bei Kryptogenen Strokes, in zweitrangigen diagnostischen Abklärungen, die Bedeutung der transösophagealen Echokardiographie, nicht zu unterschätzen.
- Eine definitive Sicherheit in der Diagnosestellung eines Herztumors, erlangt man letztendlich nur mittels einer kardiochirurgischen Exzision.
- Nur die chirurgische Entfernung eines Myxoms/papillären Fibroelastoms, eliminiert praktisch das thrombembolische Risiko eines Herztumors. Alternative ist eine medikamentöse Therapie, bestehend aus einer oralen Antikoagulation, einem Thrombozytenaggregationshemmer sowie einem Statin.
- Eine Embolisation des Tumorfragmentes kann per se durch die medikamentöse Behandlung jedoch nicht beeinflusst werden.
- Die optimale Versorgung von Herztumoren bleibt umstritten. Weitere Fallbeispiele sowie retrospektive Studien werden benötigt.
1. International Agency for Research on Cancer. WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart 4th edn (World Health Organization, 2015).
2. Lak HM, Kerndt CC, Unai S, Maroo A. Cardiac papillary fibroelastoma originating from the coumadin ridge and review of literature. BMJ Case Rep. 2020 Aug 26;13(8):e235361.
3. Cresti A, Chiavarelli M, Glauber M, Tanganelli P, Scalese M, Cesareo F, et al. Incidence rate of primary cardiac tumors: a 14-year population study. J Cardiovasc Med (Hagerstown). 2016;17(1):37–43.
4. Wang Z, Chen S, Zhu M, Zhang W, Zhang H, Li H, et al. Risk prediction for emboli and recurrence of primary cardiac myxomas after resection. J Cardiothorac Surg. (2016) 11:22.
5. Bussani R, De-Giorgio F, Abbate A, Silvestri F. Cardiac metastases. J Clin Pathol. 2007;60:27–34.
6. Bussani R, Castrichini M, Restivo L, Fabris E, Porcari A, Sinagra G., et al. Cardiac Tumors: Diagnosis, Prognosis, and Treatment. Curr Cardiol Rep. 2020 Oct 10;22(12):169.
7. Lee PT, Hong R, Pang PY, Chua YL, Ding ZP. Clinical presentation of cardiac myxoma in a Singapore national cardiac centre. Singapore Med J. 2021 Apr;62(4):195-198. doi: 10.11622/smedj.2020041. Epub 2020 Mar 31.
8. Jain S, Maleszewski JJ, Stephenson CR, Klarich KW. Current diagnosis and management of cardiac myxomas. Expert Rev Cardiovasc Ther. 2015;13:369–375.
9. Maleszewski JJ, Anavekar NS, Moynihan TJ, Klarich KW. Pathology, imaging, and treatment of cardiac tumours. Nat Rev Cardiol. 2017;14(9):536–549.
10. Yusuf SW, Bathina JD, Qureshi S, et al. Cardiac tumors in a tertiary care cancer hospital: clinical features, echocar- diographic findings, treatment and outcomes. Heart Int 2012;7:e4.
11. Mkalaluh S, Szczechowicz M, Torabi S, et al. Surgical treat- ment of cardiac tumors: insights from an 18-year single- center analysis. Med Sci Monit 2017;23:6201–9.
12. El Bardissi AW, Dearani JA, Daly RC, et al. Survival after resection of primary cardiac tumors: a 48-year experience. Circulation 2008;118(14 Suppl):S7–15.
13. Tamin SS, Maleszewski JJ, Scott CG, Khan SK, Pellikka PA, Klarich KW, et al. Prognostic and Bioepidemiologic Implications of Papillary Fibroelastomas. J Am Coll Cardiol. 2015 Jun 9;65(22):2420-9..
14. Ekinci EI, Donnan GA. Neurological manifestations of cardiac myxoma: a review of the literature and report of cases. Intern Med J. (2004) 34:243–9.
15. Gee GT, Bazan C 3rd, Jinkins JR. Imaging of cerebral infarction caused by atrial myxoma. Neuroradiology 1994; 36: 271–2.
PRAXIS
- Vol. 113
- Ausgabe 3
- März 2024