- Zystische Pankreasläsionen – wie abklären und überwachen?
Während Pankreasraumforderungen sonographisch schwierig zu detektieren sind, hilft die Schichtbildgebung enorm, fördert aber mit zunehmender Verfügbarkeit der Magnetresonanztomographie (MRI) zunehmend Inzidentalome zutage. Die Anamnese und Krankengeschichte ist nur bei zwei Entitäten charakteristisch. Eine bekannte akute/chronische Pankreatitis spricht für eine benigne Pseudozyste, eine vorhandene B-Symptomatik für einen malignen Tumor. Herausfordernder ist die Zuordnung asymptomatischer Zysten, welche ausgiebige Diagnostik und in fortgeschrittenen Stadien auch Pankreasresektionen nach sich ziehen können. Kommt es zur Überdiagnostik und – therapie, spricht man auch von VOMIT: victims of modern imaging technology (1). Auf der anderen Seite gilt es, diejenigen Präkanzerosen ohne Symptome zu identifizieren, welche einer Überwachung zugeführt werden sollen, mit dem Ziel, die Progression in Richtung eines invasiven Karzinoms rechtzeitig zu erkennen.www
Ziel dieser Übersicht ist, auf inzidentell nachgewiesene Pankreaszysten zu fokussieren mit Darstellung der Abklärungen sowie der weiteren Überwachung; nicht im Vordergrund stehen Pankreaskarzinom und Pseudozysten. Letztere werden im Sinne der Differenzialdiagnosen mit besprochen, da Pseudozysten im klinischen Alltag gelegentlich ebenfalls zufällig nachgewiesen werden, jedoch nicht überwacht werden sollten.
Schlüsselwörter: Pankreaszyste, IPMN, seröses Zystadenom, muzinöses Zystadenom
Einführung
Bei einer 70-jährigen, bis auf eine arterielle Hypertonie sowie Übergewicht (BMI 27 kg/m2), gesunden Patientin wird aufgrund eines Fahrradunfalls eine Computertomographie (CT) durchgeführt, wo sich als Zufallsbefund eine 28 mm grosse zystische Pankreasläsion bei ansonsten normalem Pankreasparenchym nachweisen lässt. Die Patientin stellt sich in der Folge zur Besprechung des weiteren Vorgehens in der Sprechstunde vor.
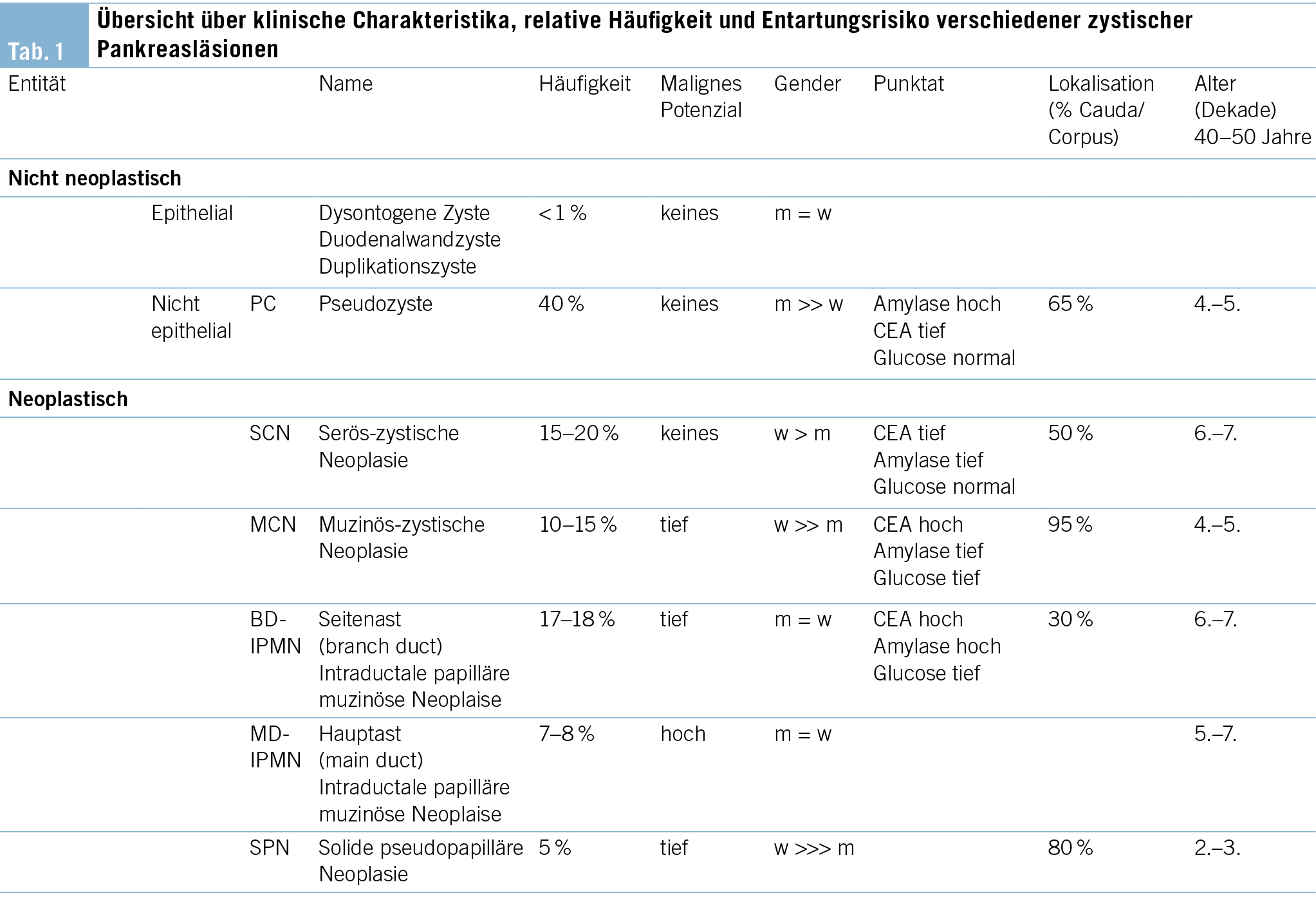
Aus klinischer Sicht stellt sich zunächst die Frage, wie hoch das maligne Potenzial der inzidentell nachgewiesenen zystischen Pankreasläsion zu beziffern ist. Während nicht neoplastische Entitäten wie Pseudozysten oder dysontogene Zysten keinerlei malignes Potenzial aufweisen, handelt es sich bei der Mehrheit der zufällig nachgewiesenen zystischen Pankreasläsionen um neoplastische Zysten respektive Präkanzerosen (Tab. 1). Dementsprechend steht in unserem Beispiel differenzialdiagnostisch eine neoplastische Zyste im Vordergrund, weshalb als nächster Schritt ein MRI durchgeführt wird (Abb. 1a/b), welches eine Verbindung der Läsion zum Gangsystem nachweist. Infolgedessen besteht der dringende Verdacht auf eine Seitenast-IPMN. Aufgrund der Grösse des Befundes entscheidet man sich ferner zur Durchführung einer oberen Endosonographie inkl. Kontrastmittelgabe, wo Noduli definitiv ausgeschlossen werden können (Abb. 1b). Die Analyse der endosonographisch gesteuerten punktierten Zystenflüssigkeit (hohes CEA, hohe Amylase, tiefe Glucose) lässt die Diagnose einer Seitenast-IPMN definitiv stellen. Aufgrund des erhöhten Risikos für die Entwicklung eines Pankreaskarzinoms wird die Aufnahme in ein Surveillance-Programm empfohlen.
Bei der Seitenast-IPMN handelt es sich mit ca. 80 % aller zufällig nachgewiesener zystischer Pankreasneoplasien um die häufigste Entität (2). Das maligne Potenzial hängt von verschiedenen Parametern ab. Wichtigste Kriterien diesbezüglich stellen die Grösse der Läsion, Dilatation des Hauptganges sowie Noduli dar. Hierauf basierend erfolgt eine Risikostratifikation, welche für die weitere Beratung der Patientinnen und Patienten essenziell ist. Diesbezüglich stellt die Arbeit von Mukewar et al. (3) die Verhältnisse sehr anschaulich dar. Während das Risiko eines Pankreaskarzinoms bei einer IPMN mit Hauptgangbeteiligung oder Nodulus als hoch zu bezeichnen ist (ca. 25 %/10 Jahre), ist das Risiko für Patienten mit Seitenast-IPMNs ohne weiterer radiologischer oder klinischer Risikofaktoren deutlich kleiner, relativ zur Normalbevölkerung jedoch immer noch deutlich erhöht (ca. 8 %/ 10 Jahre) (4), wobei das Risiko über die Jahre kontinuierlich ansteigt. Aufgrund der daraus abzuleitenden Indikation zur langfristigen Überwachung ist eine zweifelsfreie Diagnose essenziell. Insbesondere gutartige seröse Zystadenome (Abb. 1c/d) oder inzidentell nachgewiesene Pseudozysten müssen bildgeberisch oder ggf. auch mithilfe einer endosonographisch gesteuerten Punktion ausgeschlossen werden, damit unnötige, repetitive Verlaufskontrollen verhindert werden.
Diagnostik zystischer Pankreasläsionen: Stellenwert der Radiologie
Die primäre Aufgabe der Radiologie ist es, zystische Pankreasläsionen einerseits zu detektieren und andererseits wenn möglich zu charakterisieren. Wie oben erwähnt, werden zystische Pankreasläsionen häufig zufällig entdeckt. Der Nachweis von zystischen Pankreasläsionen in populations-basierten Studien hängt von der Art der Bildgebung ab und liegt bei der Kernspintomographie (MRI) bei bis zu 49 % der untersuchten Personen (5). Die Prävalenz der zystischen Läsionen und somit die Detektionsrate steigt mit dem Alter und liegt bei 61 % bei > 70 Jahren (6).
Wichtigste bildgebende Modalität zur Abklärung von zystischen Pankreasläsionen ist das MRI mittels umfassendem multiparametrischem Pankreasprotokoll. In diesem Zusammenhang hat sich die Magnetresonanz-Cholangiopankreatikographie (MRCP) als Standard etabliert, welche eine stark T2-gewichtete Sequenz verwendet. Strukturen mit hohem Wassergehalt stellen sich im Gegensatz zu den umgebenden Weichteilstrukturen hyperintens, d. h. hell, dar, während die umgebenden Weichteilstrukturen dunkel bleiben. Dies führt zum gewollten Aspekt der hellen Darstellung des Pankreasganges, der Gallengänge und auch der zystischen Pankreasläsionen auf dunklem Hintergrund (Abb. 1a).
Das MRI mit MRCP ist sowohl bei der Detektion als auch bei der Charakterisierung von zystischen Pankreasläsionen sowohl der Computertomographie (CT) als auch der transabdominalen Sonographie überlegen (7, 8). Auch die fehlende Applikation ionisierender Strahlung ist bei der Notwendigkeit von teilweise langjährigen Verlaufskontrollen ein wichtiger Faktor.
Radiologische Differenzialdiagnose
Im Folgenden sollen die typischen bildgebenden Eigenschaften der häufigsten zystischen Pankreasneoplasien (Tab. 1) beschrieben werden. Die bereits oben erwähnte intraduktale papilläre muzinöse Neoplasie (IPMN) kann sich in drei verschiedenen Formen manifestieren, als Seitengang-, als Hauptgang-IPMN oder als gemischte Form. Sie stellt sich als zystische (T2-hyperintense) Dilatation der besagten Gänge dar, d. h. bei Befall der Seitengänge als uni- oder mulitlokuläre, lobulierte, traubenartige Läsion, bei Befall des Hauptgangs in Form als segmentale oder diffuse Dilatation des Pankreashauptganges ≥ 5mm. Ein spezifisches bildgebendes Kriterium, das die IPMN von den anderen zystischen Neoplasien unterscheidet, ist die nachweisliche Verbindung zum Gangsystem (Abb. 1a). Eine typische Eigenschaft der Seitengang-IPMN ist ausserdem die Multiplizität.
Die muzinös-zystische Neoplasie (MCN) tritt fast ausschliesslich bei Frauen auf, mit höchster Inzidenz in der 5. Dekade. Klinisch ist das Erkennen dieser Entität wichtig, da diese Läsionen ein mit der Hauptast-IPMN vergleichbares Malignitätsrisiko aufweisen (9, 10). Die Lokalisation ist häufig im Pankreascorpus oder -cauda. Eine Kommunikation zum Ductus pancreaticus besteht, im Gegensatz zu den IPMN, nicht. Bildmorphologisch besteht meistens eine uni- oder multilokuläre Makrozyste (> 2cm) mit oder ohne Septierungen, teils mit «Zyste-in-Zyste»-Aspekt. Die äussere Begrenzung ist meistens rund, im Gegensatz zur eher lobulierten Seitengang-IPMN. In 25 % finden sich murale Verkalkungen.
Die serös-zystische Neoplasie (SCN) (Abb. 1c/d) kann sich in Form verschiedener Phänotypen manifestieren. Der typische Aspekt ist allerdings der mikrozystische (Zysten < 2 cm) oder Honigwaben-Aspekt. Die Zysten sind oft so klein, dass in der CT der Eindruck einer soliden Läsion entsteht. Ausserdem typisch ist eine zentrale, manchmal verkalkte Narbe, welche sich computertomographisch bestätigen lässt. Erschwerend kommen in ca. 10 % auch atypische, rein makrozystische Formen der SCN vor, welche bildgebend nicht von einer muzinösen Läsion mit Malignitätspotenzial unterschieden werden können.
Die solid-pseudopapilläre Neoplasie (SPN) ist eine seltene Läsion und kommt fast nur bei jungen Frauen in der 2.–3. Dekade vor. Es handelt sich hier um eine gemischt solid-zystische Neoplasie mit Nekrosen und hämorrhagischen Anteilen, typischerweise in der Cauda lokalisiert. Sie sind meist asymptomatisch und werden als Zufallsbefund in der Schnittbildgebung entdeckt.
Bei Pseudozysten handelt es sich typischerweise um hypodense zystische Läsionen mit flächigem Kontakt zum Pankreas. Die Wand der Pseudozyste ist in der Regel zart. Im MRI lässt sich im Gegensatz zur Seitengang-IPMN keine Verbindung zum Gangsystem nachweisen. Nebst der Anamnese mit St. n. Pankreatitis ist das Aspirat des Zysteninhalts charakteristisch, in dem die Amylase bei gleichzeitig tiefem CEA stark erhöht ist (Tab. 1).
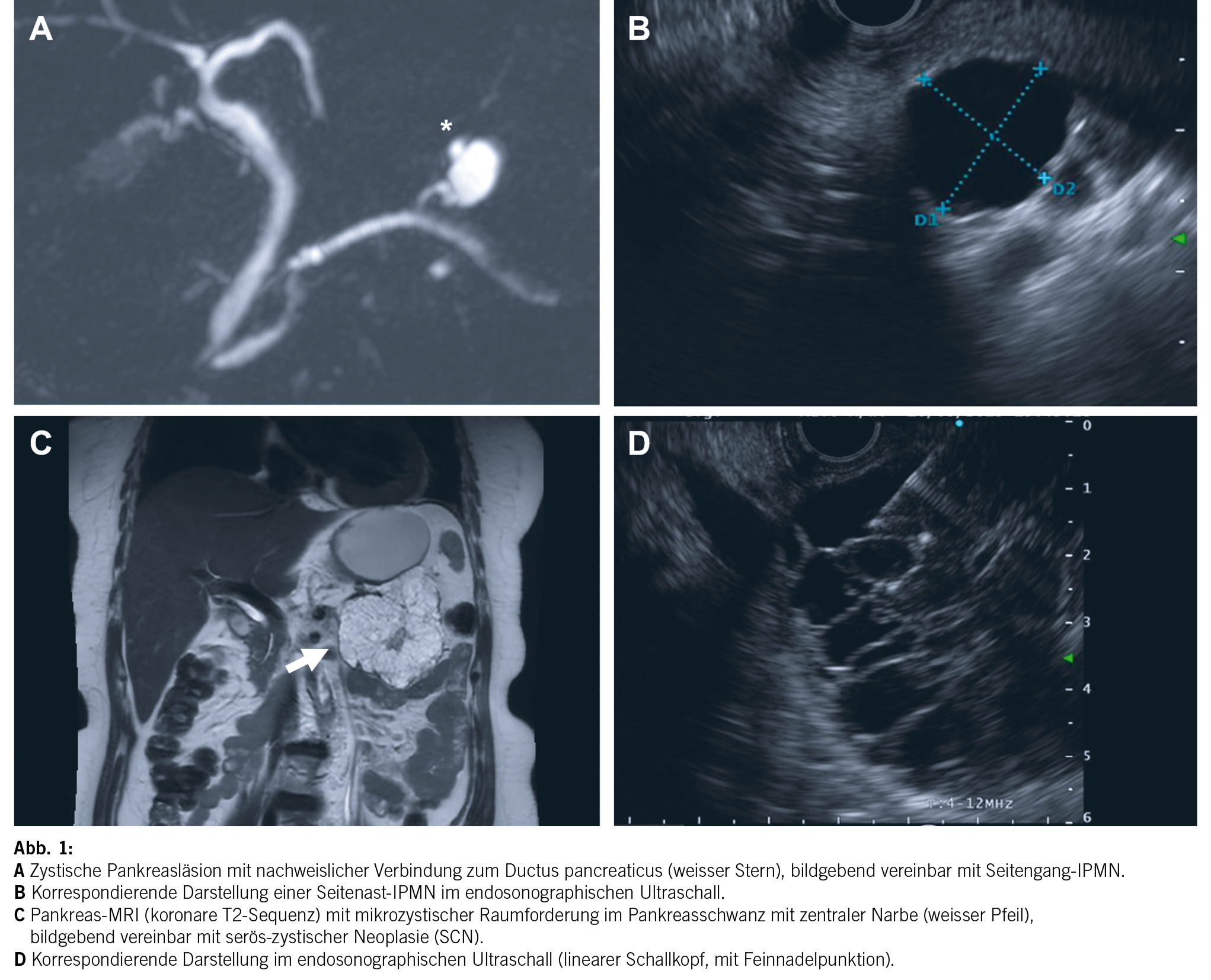
Nebst der Charakterisierung einer zystischen Pankreasläsion ist es auch Aufgabe der Radiologie, nach bildgebenden Zeichen zu suchen, welche auf ein erhöhtes Malignitätsrisiko weisen. Diese bildgebenden Zeichen werden in verschiedenen Leitlinien meist in einem zwei- oder mehrstufigen System abgebildet. In den European evidence-based guidelines on pancreatic cystic neoplasms (11) werden bei radiologisch vermuteter IPMN folgende bildgebende Zeichen als «relative Indikation für Chirurgie» bezeichnet (Abb. 2): Wachstumsrate der zystischen Läsion von ≥ 5 mm/Jahr, eine Dilatation des Pankreashauptganges von 5–9.9 mm, Zystendurchmesser von ≥ 4 cm und kontrastmittelaufnehmende murale Knoten von < 5 mm.
Rolle der gastroenterologischen Abklärungen mit Endoskopie/Endosonographie
Der Stellenwert der Endosonographie (EUS) besteht ergänzend zur MRI-Untersuchung und beantwortet bei Unklarheiten bezüglich Entität diese mithilfe mitunter einer Feinnadelpunktion.
Fokussiert zur Differenzierung der benignen Zysten SCA, MCA und IPMN kann die Punktion mit Bestimmung CEA, Amylase und Glucose nebst der Zytologie relevant sein. Hohe Amylasewerte im Punktat beweisen den Anschluss an den Pankreasgang bei der IPMN oder sprechen bei gleichzeitig normalen CEA-Werten für eine Pseudozyste. Hohe CEA-Werte bei normwertiger Amylase hingegen deuten auf ein MCA. In den letzten Jahren konnte gezeigt werden, dass eine tiefe Glucose (< 2.8 mmol/l) prädiktiv für das Vorliegen einer muzinösen Neoplasie ist (12). In naher Zukunft dürfte sich ferner die «Next Generation Sequencing» aus dem Aspirat als Standardmethode etablieren, mit welcher molekulargenetisch die Läsion zweifelsfrei charakterisiert werden kann.
Bei Knoten in Zysten können diese im Gegensatz zum MRI mit Kontrast-EUS von verklumptem Mukus unterschieden werden. Die EUS-gesteuerte Punktion erlaubt zudem gelegentlich den Nachweis dysplastischer oder malignen Zellen.
Die Indikation für eine EUS besteht somit bei Unklarheit betreffend Dignität, Entität oder aber bei Grössenwachstum und im Zusammenhang mit den oben beschriebenen Zeichen mit erhöhtem Malignitätsirisiko.
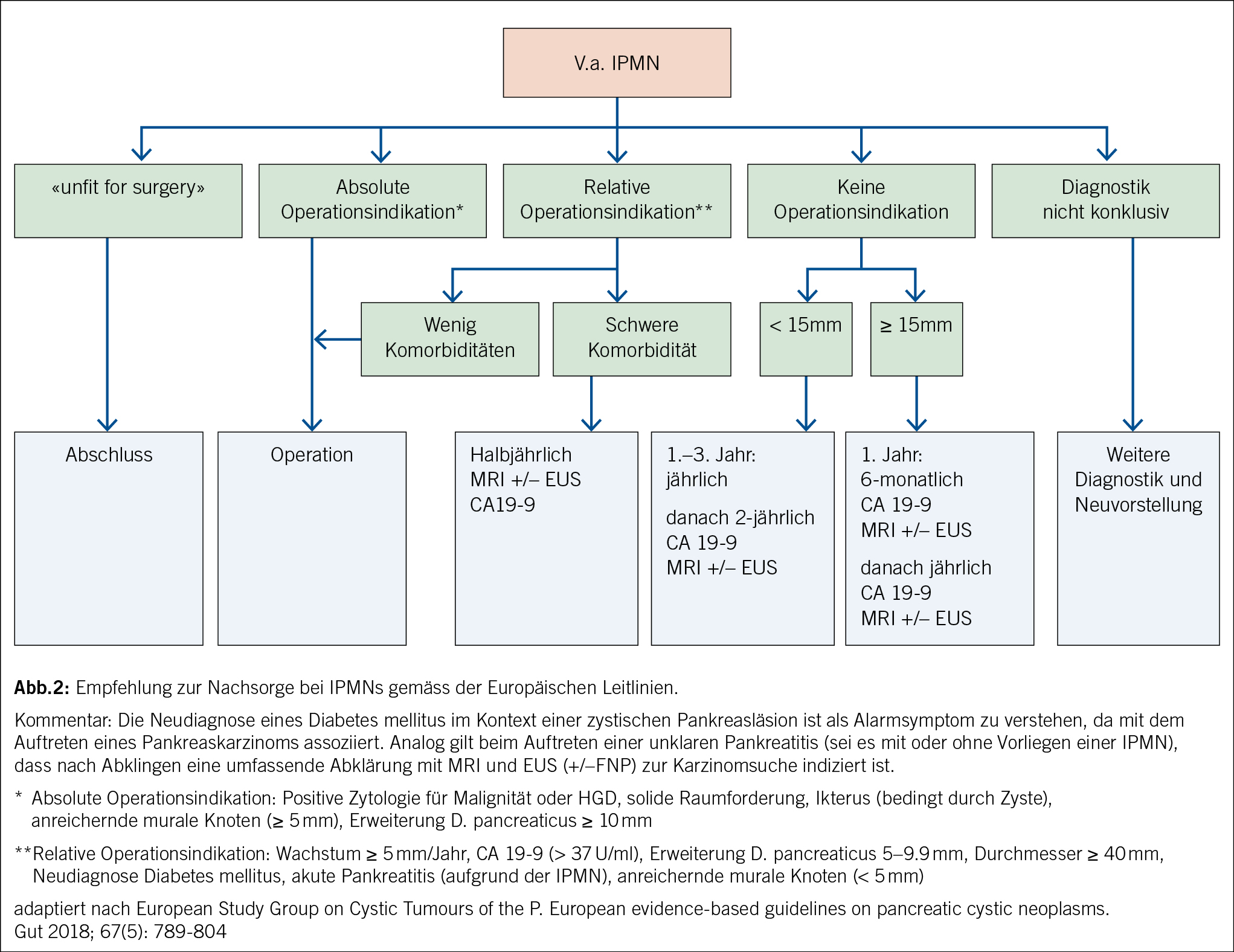
Die Duodenoskopie mit echter Seitblickoptik beurteilt die Papille. Eine sogenannte Fischmaulpapille (Abb. 3) ist pathognomonisch für eine Hauptast-IPMN und führt direkt zur Diskussion der chirurgischen Resektion.
Leitlinien und Überwachung
In den letzten Jahren wurden verschiedene Leitlinien zur Surveillance von Pankreaszysten, im speziellen IPMN, publiziert. Zuletzt wurde im Dezember 2023 eine weitere revidierte Version der «Fukuoka»-Leitlinien veröffentlicht (13), in welcher die Rolle der EUS noch etwas stärker gewichtet und ein adaptierter Abklärungsalgorithmus vorgeschlagen wird. Im Zentrum dieser Publikationen stehen radiologische Merkmale, welche auf ein klinisch signifikantes Malignitätsrisiko weisen. Da Pankreasresektionen im Allgemeinen mit einer verhältnismässig hohen Morbidität vergesellschaftet sind, sollten die Leitlinien gleichzeitig unnötige Resektionen verhindern. Anhand von klinischen Zeichen (u. a. Ikterus, Pankreatitis), radiologischen Befunden (z. B. Zystengrösse, Weite D. pancreaticus, Noduli), Tumormarker (CA19-9) und in selektiven Fällen zytologischen oder histologischen Untersuchungen wird versucht, eine Risikostratifikation vorzunehmen.
Dabei bestehen insbesondere bezüglich der Indikationsstellung zur Resektion resp. Durchführung der Surveillance bezüglich Modalität, dem Intervall und der absoluten Dauer der Nachsorge deutliche Unterschiede.
Die meistverwendeten Guidelines sind die
- Revised International Consensus Guidelines (Fukuoka/Kyoto-Guidelines) (13, 14)
- European evidence-based guidelines on pancreatic cystic neoplasms (11)
- American Gastroenterology Association Guidelines (15)
Die Guidelines haben gemeinsam, dass sie zur Entdeckung High-grade-Dysplasien oder invasiver Karzinome eine relativ hohe Sensitivität besitzen, leider aber eine geringe Spezifität aufweisen. Dies führt tendenziell zu einer Überbehandlung der Patienten (17). Ein weiteres Problem in der Behandlung der Pankreaszysten ist die ungenügende Adhärenz zu den Guidelines. Daten aus der Literatur zeigen, dass nur ca. 2/3 aller der Patienten mit bekannten Pankreaszysten einen adäquaten Follow-up erhalten (18). Einen sehr lesenswerten Überblick über die verschiedenen Leitlinien resp. deren Unterschiede bietet die Arbeit von Aziz et al. (19).
Um ein strukturiertes Follow-up zu gewährleisten, aber auch da es sich um potenzielle Krebserkrankungen handelt, sehen wir eine interdisziplinäre Diskussion im Rahmen eines «Pankreaszystenboard» als empfehlenswert. Diese Diskussion soll einerseits unnötige Resektionen verhindern und andererseits eine adäquate und verhältnismässige Surveillance sicherstellen.
Ausblick
Die Häufigkeit zystischer Pankreasläsionen gerade bei älteren Patienten stellt eine klinische Herausforderung dar. Dem Risiko einer meist tödlich verlaufenden Karzinomerkrankung steht die Gefahr der «Überdiagnostik» mit damit assoziierter psychischer Belastung Betroffener und unnötigen Pankreasresektionen gegenüber. Dazuzurechnen sind Belastungen für das Gesundheitswesen finanzieller und logistischer Art in einem Gesamtsystem, in welchem in Zukunft die Ressourcen knapp werden dürften.
Die interdisziplinäre Diskussion der radiologischen resp. endosonographischen Befunde unter Berücksichtigung der Europäischen Leitlinien bietet Rahmenbedingungen, welche eine angemessene Überwachung oder chirurgische Therapie ermöglichen.
Unter welchen Umständen diese Überwachung bei einem gesunden Patienten beendet werden darf, ist ebenfalls noch umstritten. Erste Studien empfehlen jedoch, bei einem stabilen Verlauf über 5 Jahre und einer maximalen Zystengrösse von 30 mm bei über 75-Jährigen bzw. 15 mm bei über 65-Jährigen die Überwachung einzustellen (20).
Key Messages
• Symptomatische Pankreaszysten sind oft Pseudozysten.
• Asymptomatische Zysten sind in der Regel echte Neoplasien, am häufigsten IPMN vom Seitenast-Typ (BD-IPMN), welche zumeist ein niedriges Entartungsrisiko aufweisen.
• Eine Hauptast-IPMN (MD-IPMN) > 10 mm, anreichernde murale Knoten (≥ 5 mm) oder eine positive Zytologie stellen eine Indikation zur chirurgischen Resektion dar.
• Vor Abklärung oder Surveillance muss geklärt sein, ob eine chirurgische Therapie infrage käme. Im negativen Fall soll der Fall abgeschlossen werden.
• Die Nachsorge wird mittels MRCP seriell über Jahre vollzogen, wobei sich die Intervalle anhand der Risikostratifikation bemessen.
• Die obere Endosonographie hilft beim Nachweis von Zystencharakteristika, welche für eine Operation sprechen.
• Bei absoluter und insbesondere auch bei relativer Operationsindikation sollte der Patient an ein HSM-Zentrum zur weiteren Evaluation zugewiesen werden.
Abteilung für Gastroenterologie und Hepatologie
Stadtspital Zürich
Birmensdorferstrasse 497
8063 Zürich
bernhardkaspar.morell@stadtspital.ch
Leitender Arzt
Institut für Radiologie und Nuklearmedizin
Birmensdorferstrasse 497
8063 Zürich
Leitender Arzt
Klinik für Viszeral-, Thorax- und Gefässchirurgie
Stadtspital Zürich Triemli
Birmensdorferstrasse 497
8063 Zürich
Facharzt für Chirurgie
Klinik für Viszeral- Thorax- und Gefässchirurgie
Stadtspital Zürich
Leitender Arzt, Klinik Viszeral-, Thorax- und Gefässchirurgie
Chefarzt Klinik für Belegärzte
Stadtspital Zürich Triemli
Birmensdorferstrasse 497
8063 Zürich
Gastroenterologie & Hepatologie
Stadtspital Zürich
Birmensdorferstrasse 497
8063 Zürich
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
• Symptomatische Pankreaszysten sind oft Pseudozysten.
• Asymptomatische Zysten sind in der Regel echte Neoplasien, am häufigsten IPMN vom Seitenast-Typ (BD-IPMN), welche zumeist ein niedriges Entartungsrisiko aufweisen.
• Eine Hauptast-IPMN (MD-IPMN) > 10 mm, anreichernde murale Knoten (≥ 5 mm) oder eine positive Zytologie stellen eine Indikation zur chirurgischen Resektion dar.
• Vor Abklärung oder Surveillance muss geklärt sein, ob eine chirurgische Therapie infrage käme. Im negativen Fall soll der Fall abgeschlossen werden.
• Die Nachsorge wird mittels MRCP seriell über Jahre vollzogen, wobei sich die Intervalle anhand der Risikostratifikation bemessen.
• Die obere Endosonographie hilft beim Nachweis von Zystencharakteristika, welche für eine Operation sprechen.
• Bei absoluter und insbesondere auch bei relativer Operationsindikation sollte der Patient an ein HSM-Zentrum zur weiteren Evaluation zugewiesen werden.
1. Shaikh U, Lewis-Jones H: Commercial CT scans: VOMIT victim of medical investigative technology. BMJ 2008, 336(7634):8.
2. Chang YR, Park JK, Jang JY, Kwon W, Yoon JH, Kim SW: Incidental pancreatic cystic neoplasms in an asymptomatic healthy population of 21,745 individuals: Large-scale, single-center cohort study. Medicine (Baltimore) 2016, 95(51):e5535.
3. Mukewar S, de Pretis N, Aryal-Khanal A, Ahmed N, Sah R, Enders F, Larson JJ, Levy MJ, Takahashi N, Topazian M et al: Fukuoka criteria accurately predict risk for adverse outcomes during follow-up of pancreatic cysts presumed to be intraductal papillary mucinous neoplasms. Gut 2017, 66(10):1811-1817.
4. Choi SH, Park SH, Kim KW, Lee JY, Lee SS: Progression of Unresected Intraductal Papillary Mucinous Neoplasms of the Pancreas to Cancer: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol 2017, 15(10):1509-1520 e1504.
5. Kromrey ML, Bulow R, Hubner J, Paperlein C, Lerch MM, Ittermann T, Volzke H, Mayerle J, Kuhn JP: Prospective study on the incidence, prevalence and 5-year pancreatic-related mortality of pancreatic cysts in a population-based study. Gut 2018, 67(1):138-145.
6. Moris M, Bridges MD, Pooley RA, Raimondo M, Woodward TA, Stauffer JA, Asbun HJ, Wallace MB: Association Between Advances in High-Resolution Cross-Section Imaging Technologies and Increase in Prevalence of Pancreatic Cysts From 2005 to 2014. Clin Gastroenterol Hepatol 2016, 14(4):585-593 e583.
7. Waters JA, Schmidt CM, Pinchot JW, White PB, Cummings OW, Pitt HA, Sandrasegaran K, Akisik F, Howard TJ, Nakeeb A et al: CT vs MRCP: optimal classification of IPMN type and extent. J Gastrointest Surg 2008, 12(1):101-109.
8. Sainani NI, Saokar A, Deshpande V, Fernandez-del Castillo C, Hahn P, Sahani DV: Comparative performance of MDCT and MRI with MR cholangiopancreatography in characterizing small pancreatic cysts. AJR Am J Roentgenol 2009, 193(3):722-731.
9. Zamboni G, Scarpa A, Bogina G, Iacono C, Bassi C, Talamini G, Sessa F, Capella C, Solcia E, Rickaert F et al: Mucinous cystic tumors of the pancreas: clinicopathological features, prognosis, and relationship to other mucinous cystic tumors. Am J Surg Pathol 1999, 23(4):410-422.
10. Reddy RP, Smyrk TC, Zapiach M, Levy MJ, Pearson RK, Clain JE, Farnell MB, Sarr MG, Chari ST: Pancreatic mucinous cystic neoplasm defined by ovarian stroma: demographics, clinical features, and prevalence of cancer. Clin Gastroenterol Hepatol 2004, 2(11):1026-1031.
11. European Study Group on Cystic Tumours of the P: European evidence-based guidelines on pancreatic cystic neoplasms. Gut 2018, 67(5):789-804.
12. McCarty TR, Garg R, Rustagi T: Pancreatic cyst fluid glucose in differentiating mucinous from nonmucinous pancreatic cysts: a systematic review and meta-analysis. Gastrointest Endosc 2021, 94(4):698-712 e696.
13. Tanaka M, Fernandez-Del Castillo C, Kamisawa T, Jang JY, Levy P, Ohtsuka T, Salvia R, Shimizu Y, Tada M, Wolfgang CL: Revisions of international consensus Fukuoka guidelines for the management of IPMN of the pancreas. Pancreatology 2017, 17(5):738-753.
14. Ohtsuka T, Fernandez-Del Castillo C, Furukawa T, Hijioka S, Jang JY, Lennon AM, Miyasaka Y, Ohno E, Salvia R, Wolfgang CL, Wood LD: International evidence-based Kyoto guidelines for the management of intraductal papillary mucinous neoplasm of the pancreas. Pancreatology 2024, 24(2):255-270.
15. Scheiman JM, Hwang JH, Moayyedi P: American gastroenterological association technical review on the diagnosis and management of asymptomatic neoplastic pancreatic cysts. Gastroenterology 2015, 148(4):824-848 e822.
16. Hasan A, Visrodia K, Farrell JJ, Gonda TA: Overview and comparison of guidelines for management of pancreatic cystic neoplasms. World J Gastroenterol 2019, 25(31):4405-4413.
17. Canakis A, Maoz A, Tkacz JN, Huang C: Factors affecting the rates of adherence to surveillance recommendations for incidental pancreatic cystic lesions in a large urban safety net hospital. BMJ Open Gastroenterol 2020, 7(1).
18. Aziz H, Acher AW, Krishna SG, Cloyd JM, Pawlik TM: Comparison of Society Guidelines for the Management and Surveillance of Pancreatic Cysts: A Review. JAMA Surg 2022, 157(8):723-730.
19. Marchegiani G, Pollini T, Burelli A, Han Y, Jung HS, Kwon W, Rocha Castellanos DM, Crippa S, Belfiori G, Arcidiacono PG et al: Surveillance for Presumed BD-IPMN of the Pancreas: Stability, Size, and Age Identify Targets for Discontinuation. Gastroenterology 2023, 165(4):1016-1024 e1015.
PRAXIS
- Vol. 113
- Ausgabe 10
- November 2024