- Akute Herzinsuffizienz
Zusammenfassung: Die akute Herzinsuffizienz (AHF) ist ein häufiger Grund für Notfallkonsultationen, führt zu langen Hospitalisationen und ist durch hohe Mortalität und Rehospitalisationsrate charakterisiert, wobei die ersten Monate nach dem Spitalaufenthalt das höchste Risiko aufweisen («vulnerable Phase»). Die klinische Präsentation wird meistens durch eine Flüssigkeitsakkumulation geprägt. Während den letzten drei Dekaden konnten wenige Fortschritte in der Behandlung erreicht werden, da die meisten Studien mit Diuretika oder Vasodilatatoren zwar eine Verbesserung der Symptome und der Hämodynamik zeigen konnten, jedoch keine positive prognostische Wirkung hinsichtlich Mortalität und Rehospitalisationen. In diesem Kontext muss die Behandlung der AHF einen integrativen Ansatz haben, bestehend einerseits aus einer raschen Korrektur der systemischen Stauung, anderseits mit spezifischen Therapien für die Auslösefaktoren, die zugrunde liegende Herzpathologie und die Komorbiditäten. Erst kürzlich konnte gezeigt werden, dass eine rasche und intensive Etablierung der oralen Herzinsuffizienzmedikamente während und unmittelbar nach einem stationären Aufenthalt die Prognose bereits während der vulnerablen Phase verbessern kann. In diesem Artikel werden die Prinzipien der Optimierung und Personalisierung der diuretischen Therapie und der oralen Herzinsuffizienzmedikamente während des Spitalaufenthaltes und der frühen ambulanten Phase diskutiert.
Acute heart failure (AHF)
Abstract: Acute heart failure (AHF) is a frequent cause for emergency consultations, leads to long hospital stays and is characterized by high mortality and rehospitalization rates, with the first months after hospitalization having the highest risk («vulnerable phase»). The clinical presentation is usually characterized by fluid accumulation. Over the last three decades, few advances have been achieved in the treatment of AHF, as most studies with diuretics or vasodilators failed to show positive effects in terms of mortality and rehospitalization rates. In this context, the treatment of AHF must have an integrative approach, consisting of rapid correction of systemic congestion on the one hand, and specific therapies for the precipitating factors, the underlying cardiac pathology, and non-cardiac comorbidities on the other. Recently, it has been shown that a rapid and intensive up-titration of oral heart failure medical therapy during and immediately after hospitalization can improve the prognosis during the vulnerable phase after AHF. In this article, the principles of optimization and personalization of diuretic therapy and oral heart failure medication during hospitalization and the early outpatient phase after AHF are discussed.
Einleitung
Die Herzinsuffizienz wird als akut bezeichnet (AHF), wenn Symptome oder klinische Zeichen entweder neu oder verstärkt auftreten (1). Die klinische Präsentation wird meistens durch Flüssigkeitsakkumulation und/oder -umverteilung (systemische Stauung, «congestion») geprägt. Eine periphere Minderperfusion («hypoperfusion») wird nur in wenigen Fällen (kardiogener Shock) beobachtet (2, 3). Die AHF ist ein häufiger Grund für Notfallkonsultationen, führt häufig zu überdurchschnittlich langen Hospitalisationen und ist durch eine hohe Mortalität und Rehospitalisationsrate charakterisiert, wobei die ersten Monate nach dem Spitalaufenthalt das höchste Risiko aufweisen («vulnerable Phase»).
Während den letzten drei Dekaden wurden mehrere Medikamente, Interventionen und Devices in die Behandlung der chronischen Herzinsuffizienz eingeführt, die die langfristige Prognose verbessern konnten. Im Gegensatz dazu konnten nur wenige Fortschritte in der Behandlung der AHF erreicht werden, da die meisten Studien mit Inotropika, Vasodilatatoren und Diuretika zwar eine Verbesserung der Symptome und/oder der Hämodynamik zeigen konnten, jedoch keine positive prognostische Wirkung hinsichtlich Mortalität und Herzinsuffizienz-Hospitalisationen (HFH).
In diesem Kontext muss die Behandlung der AHF einen integrativen Ansatz haben, bestehend einerseits aus einer raschen Korrektur der systemischen Stauung, anderseits mit spezifischen Therapien für die Auslösefaktoren, die zugrunde liegende Herzpathologie und die Komorbiditäten («7-P-Abklärung», siehe (4)).
Erst kürzlich konnte gezeigt werden, dass eine rasche und intensive Etablierung der oralen Herzinsuffizienzmedikamente («guideline-directed medical therapy», GDMT) während und unmittelbar nach einem stationären Aufenthalt die Prognose während der vulnerablen Phase nach AHF verbessern kann. Dies wurde in den Guidelines entsprechend hervorgehoben (5, 6). In diesem Artikel werden die Prinzipien der Optimierung und Personalisierung der diuretischen Therapie und der GDMT während des Spitalaufenthaltes und der frühen ambulanten Phase nach AHF diskutiert.
Fallvignette
Ein 78-jähriger Patient mit chronischer Herzinsuffizienz mit reduzierter Auswurffraktion (HFrEF) wird notfallmässig mit zunehmender Belastungsdyspnoe und Orthopnoe hospitalisiert. Im Alltag war er bis vor einer Woche nur leicht eingeschränkt (NYHA II), seit einem subakuten ST-Hebungsinfarkt 4 Jahre zuvor ist die linksventrikuläre Auswurffraktion jedoch reduziert (LVEF 35-40%). Seine Medikation besteht aus Aspirin, Bisoprolol 2.5 mg, Ramipril 2.5 mg, Torasemid 10 mg und Rosuvastatin 10 mg. Der Blutdruck bei Eintritt ist 105/55 mmHg, der Puls 88/min. und die SpO2 89% nativ (94% mit 3l/min. Sauerstoff). Die körperliche Untersuchung ist bis auf pulmonale Rasselgeräusche und gestaute Halsvenen unauffällig. Wie würden Sie den Patienten initial behandeln? Passen Sie die medikamentöse Therapie an, und wenn ja, wie?
Initiale Behandlung und diuretische Therapie
Das Management von Patienten mit klinisch vermuteter AHF beinhaltet – nach der Triage von Patienten mit hämodynamischer oder respiratorischer Instabilität, welche eine intensivmedizinische Behandlung erfordern – ein diagnostisches Work-up und eine rasche Verabreichung der initialen medikamentösen Therapie, idealerweise innerhalb von 60 Minuten nach erstem Patientenkontakt (7). Die initiale Therapie besteht – je nach hämodynamischer Präsentation (Phänotyp) – meistens aus Schleifendiuretika (bei systemischer Stauung), ggf. ergänzt durch Vasodilatatoren (bei hypertensiver Entgleisung) oder Inotropika (nur bei peripherer Minderperfusion!) (5).
Schleifendiuretika werden meistens intravenös verabreicht, um eine allfällig reduzierte enterale Aufnahme bei gastrointestinaler Stauung zu umgehen. Die initiale Dosis hängt von der Erhaltungsdosis ab. Im Stadtspital Zürich Triemli haben wir dazu erfolgreich ein standardisiertes Management eingeführt (Abbildung 1): Diuretika-naive Patienten (oder Patienten, die mit einer oralen Torasemid-Erhaltungsdosis < 40 mg täglich eingestellt sind) erhalten einen intravenösen Furosemid-Bolus von 40 mg, bei einer Torasemid-Erhaltungsdosis von 40 mg täglich und mehr wird ein Furosemid-Bolus von 80 mg verabreicht.
Das weitere Vorgehen hängt von der Antwort auf die initiale Diuretikagabe ab. Die Wichtigkeit einer frühen Beurteilung der diuretischen Wirksamkeit wurde in den letzten Jahren zunehmend propagiert, um eine frühzeitige Therapieanpassung vornehmen zu können (8). Eine routinemässige Beurteilung der diuretischen Antwort wurde ebenfalls als Teil des standardisierten Managements am Stadtspital Zürich Triemli eingeführt. Diese quantitative Beurteilung findet 2 Stunden nach der initialen Diuretikagabe statt und basiert einerseits auf dem Urinvolumen und anderseits auf der natriuretischen Antwort gemessen als Natriumkonzentration im Spoturin. Ein Urinvolumen > 300 ml oder – bei geringerer Ausscheidung – ein Urinnatrium > 70 mmol/L nach 2 Stunden definieren eine gute diuretische Antwort und suggerieren die Fortsetzung der diuretischen Therapie in gleicher Dosierung, wiederholt zwei- bis dreimal täglich (9). Der Nachweis von kleineren Urinvolumina und tieferen Urinnatriumkonzentrationen weisen auf eine diuretische Resistenz hin, die eine Eskalationsstrategie erfordert (9). Andere Ursachen einer insuffizienten diuretischen Antwort sollen ebenfalls gesucht und ausgeschlossen werden (z. B. Hypoperfusion, renale oder postrenale Ursache).
Verschiedene Eskalationsstrategien können angewendet werden, um die diuretische Antwort zu steigern. Diese beinhalten eine Verdoppelung der Schleifendiuretikadosis sowie die Kombination von Schleifendiuretika mit einer anderen Diuretikaklasse (sog. sequenzielle Nephronblockade) wie Thiazide oder Acetazolamid.
Die randomisierte DOSE-Studie zeigte, dass eine 2.5-fache Furosemid-Dosis eine grössere Negativbilanz und eine markantere Gewichtsabnahme erreichte, war jedoch punkto klinischer Wirksamkeit der Standarddosis nicht überlegen (10). Der Verabreichungsmodus (Bolus vs. Perfusor) zeigte bezüglich Wirksamkeit keinen Unterschied (10); die kontinuierliche Furosemid-Gabe wird trotzdem weiterhin angewendet, um toxische Nebenwirkungen zu vermeiden, wenn hohe Tagesdosen notwendig sind.
Die Placebo-kontrollierte randomisierte CLOROTIC-Studie zeigte, dass die Kombinationstherapie von Furosemid mit Hydrochlorothiazid in Vergleich zu Furosemid allein eine höhere Wirksamkeit zur Gewichtsabnahme aufweist. Sie ist jedoch mit einer höheren Prävalenz von Kreatininanstieg und Hypokaliämie verbunden und bezüglich klinischer Endpunkte nicht überlegen (11). Ähnliche Daten existieren aus kleineren Studien zu anderen Thiaziden oder Metolazon.
Der additive Effekt von Acetazolamid zum Schleifendiuretikum wurde in der randomisierten Placebo-kontrollierten ADVOR-Studie untersucht. Mehr Patienten in der Kombinationstherapie von Schleifendiuretikum plus Acetazolamid konnten erfolgreich rekompensiert werden als in der Gruppe Schleifendiuretikum allein. Die Therapie wurde gut vertragen, und es traten kaum Nebenwirkungen auf, es zeigte sich jedoch kein Unterschied in den klinischen Endpunkten (12).
All diese Eskalationsstrategien sind wirksam, weisen aber unterschiedliche Nebenwirkungsprofile auf. Es ist aktuell unbekannt, ob eine Strategie gegenüber den anderen überlegen ist. Die randomisierte Studie P-Value-AHF (NCT 36423214), welche aktuell an den Zentren in Zürich und Lugano durchgeführt wird, vergleicht diese Strategien hinsichtlich Diurese und Natriurese.
Nach erreichter Rekompensation wird die intravenöse Furosemid-Therapie durch orale Diuretika, meistens Torasemid, ersetzt. Eine kürzlich publizierte Studie hat die Praxis untersucht, die Spitalentlassung hinauszuzögern, um die diuretische Antwort und den Gewichtsverlauf unter oraler Therapie im stationären Setting zu beobachten. Eine Verzögerung der Spitalentlassung lieferte keine verwertbaren Informationen über das Ansprechen auf orale Diuretika oder die optimale Dosis im ambulanten Setting und war nicht mit einer niedrigeren Rehospitalisationsrate assoziiert (13).
Optimierung der oralen Herzinsuffizienztherapie (guideline-directed medical therapy», GDMT)
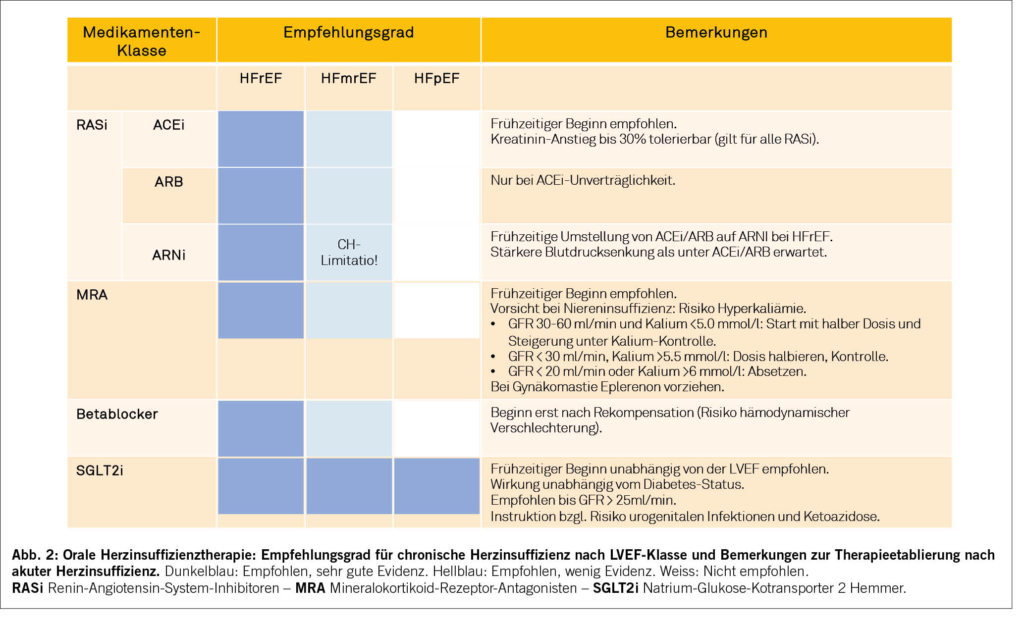
Die Wichtigkeit der oralen Herzinsuffizienztherapie zur Risikoreduktion während der vulnerablen Phasen nach AHF ist zunehmend deutlich geworden (14). Eine grosse Kohortenstudie zeigte eine Assoziation zwischen einer bei der Spitalentlassung verordneten Betablocker- oder Renin-Angiotensin-Inhibitionstherapie und einer 40-50%igen relativen Risikoreduktion bei der 90-Tage-Mortalität (15). Eine kombinierte Therapie war mit einer zusätzlichen 25-50%igen relativen Risikoreduktion im Vergleich zur alleinigen Therapie assoziiert (15). Die prospektive randomisierte STRONG-HF-Studie zeigte, dass eine intensivere Implementierung der oralen GDMT während und unmittelbar nach einem stationären Aufenthalt aufgrund AHF – kombiniert mit einem engmaschigem Follow-up – eine deutliche Reduktion des kombinierten Endpunktes Gesamtmortalität und HFH nach 180 Tagen bewirkte (16). Interessanterweise war der Benefit der GDMT sowohl bei reduzierter (HFrEF) als auch bei erhaltener Auswurffraktion (HFpEF) anzutreffen (17) und war unabhängig vom Alter, Geschlecht und nicht kardialen Komorbiditäten (18-20). Bei Patienten mit HFpEF bleibt jedoch unklar, ob eine Fortsetzung der GDMT jenseits der initialen 3-6 Monate nach AHF weiterhin vorteilhaft ist. Die meisten klinischen Studien bei stabiler HFpEF konnten bisher keine relevanten langfristigen Benefits der GDMT zeigen, mit Ausnahme der Sodium-Glucose-Kotransporter-Inhibitoren (SGLT2i). Die Fortsetzung der GDMT in HFpEF-Patienten muss somit individuell bestimmt werden. In den folgenden Abschnitten werden die wichtigsten Medikamentenklassen im Detail einzeln besprochen.
21_27_TU_02_24_Arrigo_Akute Herzinsuffizienz 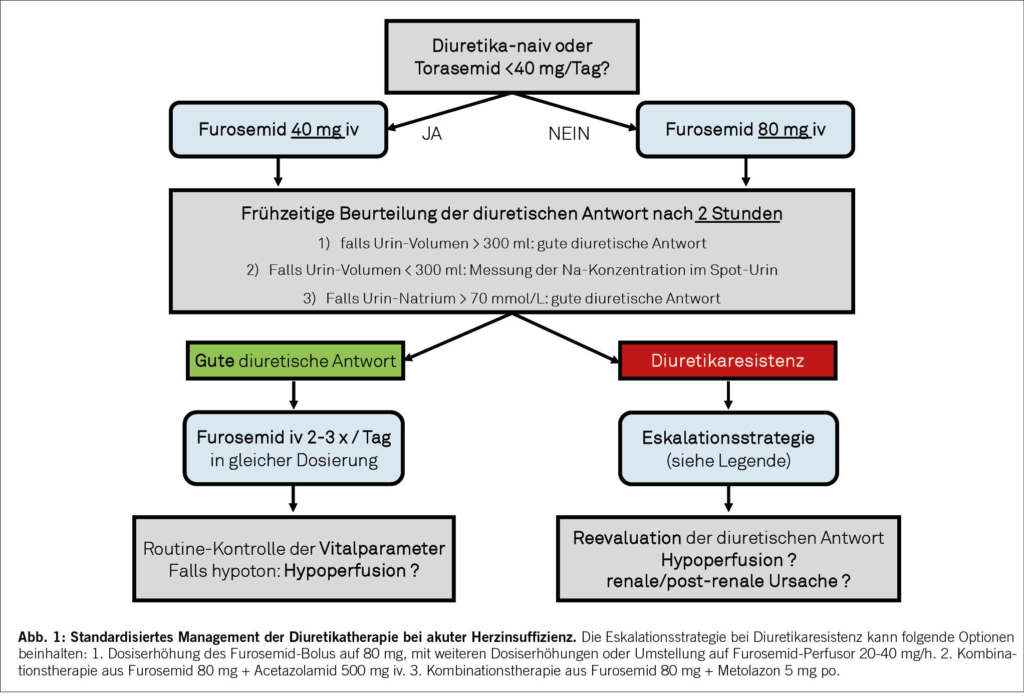
ACE-Hemmer und Angiotensin-Rezeptorantagonisten (Sartane)
Klinische Evidenz
Der Einsatz von ACE-Hemmern gehört bereits seit vielen Jahren zur Basistherapie der chronischen HFrEF, nachdem in den ersten Studien vor über 30 Jahren eine Reduktion der Mortalität und der HFH bei symptomatischen Patienten mit reduzierter Auswurffraktion gezeigt werden konnte (CONSENSUS- und SOLVD-Studien). Ebenfalls konnte bereits damals bei diesen Patienten eine Symptomverbesserung unter Einnahme eines ACE-Hemmers im Vergleich zur damals üblichen Herzinsuffizienztherapie (Digoxin, Diuretika und Vasodilatatoren) gezeigt werden (21, 22). So wird eine Therapie mit ACE-Hemmer bei HFrEF-Patienten in den europäischen Guidelines klar empfohlen und sollte bei Erstdiagnose zeitnah etabliert werden. Essenziell ist die sukzessive Dosissteigerung bis zur maximal verträglichen Dosis, da dies ebenfalls mit einer Reduktion von Mortalität und HFH im Vergleich zu tiefen Dosen einhergeht (23). Lediglich bei Intoleranz unter ACE-Hemmern ist eine Umstellung auf ein Sartan sinnvoll, da bei Patienten mit HFrEF die Datenlage in früheren Studien bezüglich Mortalität teils widersprüchlich war.
Betrachtet man die Studienlage bei Patienten mit HFpEF muss erwähnt werden, dass leider bisher keine Mortalitätsreduktion unter Therapie mit einem ACE-Hemmer oder einem Sartan gezeigt werden konnte. Bei diesen Patienten wird eine Behandlung der kardiovaskulären Komorbiditäten empfohlen, und im Falle einer arteriellen Hypertonie ist der Einsatz eines ACE-Hemmers oder eines Sartans sowieso sinnvoll.
Praktische Aspekte
Der frühe Beginn mit einem ACE-Hemmer ist wichtig und sollte auch bei kardial dekompensierten Patienten gemäss hämodynamischer Verträglichkeit mit sukzessiver Steigerung baldmöglichst angestrebt werden. Bei Neubeginn mit einem ACE-Hemmer sollten Kalium und Kreatinin regelmässig kontrolliert werden. Ein leichter Kreatininanstieg nach Therapiebeginn kann toleriert werden (Richtwerte: Anstieg des Kreatinins bis 50 µmol/l, max. 30% der Baseline, bis zu einem Wert von max. 250 µmol/l). Bei Patienten mit AHF kommt es ebenfalls im Rahmen dessen oft zu einem Anstieg des Kreatinins, was sich unter rekompensierenden Massnahmen jedoch innert weniger Tage wieder stabilisieren sollte.
Bei chronisch progressiver fortgeschrittener Niereninsuffizienz stellt sich oft die Frage, ob die Therapie mit ACE-Hemmern weitergeführt werden kann. Die STOP-ACEi-Studie zeigte hier über einen Zeitraum von 3 Jahren keinen signifikanten Unterschied der eGFR-Abnahme bei Patienten mit einer eGFR < 30ml/min./m2, wenn ein ACE-Hemmer pausiert wurde, im Vergleich zur weitergeführten Therapie (24). In dieser Patientengruppe sollte die Entscheidung interdisziplinär getroffen werden. Absolut kontraindiziert sind ACE-Hemmer bei Patienten mit bekanntem hereditären Angioödem und in der Schwangerschaft/Stillzeit (teratogene Wirkung).
Sacubitril/Valsartan
Klinische Evidenz
Vor knapp 10 Jahren wurde die randomisierte PARADIGM-Studie veröffentlicht, die eine signifikante Reduktion der Mortalität und der HFH bei chronischen HFrEF-Patienten zeigten, die Sacubitril/Valsartan statt Enalapril erhielten (25). Die darauffolgende PIONEER-HF-Studie, welche die Anwendung von Sacubitril/Valsartan bei Patienten bei HFrEF und akuter kardialer Dekompensation untersuchte, konnte zeigen, dass ein frühzeitiger Beginn nach klinischer Rekompensation sicher ist (Voraussetzungen: systolischer Blutdruck > 100 mmHg seit mindestens 6 Stunden, keine Orthostase, keine Vasoaktiva, keine hoch dosierten intravenösen Diuretika) und mit einem Trend zu weniger HFH im Vergleich zu Enalapril assoziiert war (26). Sacubitril/Valsartan wird in den aktuellen Leitlinien der Europäischen Gesellschaft für Kardiologie zur Behandlung der chronischen HFrEF (LVEF ≤40%) klar empfohlen (Empfehlungsgrad I) (5).
In der randomisierten PARAGON-HF-Studie wurden HFpEF-Patienten untersucht, welche Sacubitril/Valsartan oder Valsartan erhielten. Leider konnte unter Sacubitril/Valsartan keine signifikante Reduktion von Mortalität und HFH gezeigt werden (27). Entsprechend wird diese Therapie bei Patienten mit chronischer HFpEF nicht empfohlen (5, 6)
Praktische Aspekte
Im Alltag stellt sich häufig die Frage, welcher Patient von einem ACE-Hemmer auf Sacubitril/Valsartan umgestellt werden sollte. Die Guidelines empfehlen eine Umstellung bei Patienten mit HFrEF. Gemäss Spezialitätenliste ist Sacubitril/Valsartan in der Schweiz zugelassen bei symptomatischen HFrEF-Patienten (LVEF ≥40%), welche mit einem ACE-Hemmer respektive Sartan sowie einer anderweitigen Herzinsuffizienztherapie vorbehandelt sind. Bei einer Umstellung von einem ACE-Hemmer auf Sacubitril/Valsartan muss der ACE-Hemmer zwingend 36 Stunden vor Beginn mit Sacubitril/Valsartan pausiert werden. Diese Pause ist unter etablierter Sartantherapie nicht nötig. Die initial empfohlene Dosis nach Umstellung beträgt 50-100 mg zweimal täglich. Die wichtigsten potenziellen Nebenwirkungen entsprechen in etwa denjenigen des ACE-Hemmers mit symptomatischer Hypotonie, Hyperkaliämie, Niereninsuffizienz oder Angioödem, wobei v. a. die symptomatische Hypotonie unter Sacubitril/Valsartan etwas häufiger als bei ACE-Hemmern zu erwarten ist.
Betablocker
Klinische Evidenz
Betablocker werden bereits seit vielen Jahren zur medikamentösen Therapie bei symptomatischen Patienten mit chronischer HFrEF eingesetzt, nachdem sie in mehreren Studien eine Senkung der Mortalität und Morbidität gezeigt haben (COPERNICUS-, CIBIS-II-, MERIT-HF- und andere Studien) (28-31). Diese haben in Kombination mit den anderen oralen Herzinsuffizienztherapien einen additiven Effekt (32).
Wenige Studien haben untersucht, ob Betablocker im Falle einer AHF pausiert werden müssen. Die Daten zeigen eine tiefere Mortalität während oder kurz nach der Hospitalisation sowie eine tiefere HFH-Rate, wenn man die Betablockertherapie fortsetzt. Ein Teil der Langzeitergebnisse ist allerdings möglicherweise durch die langfristig bestehende Betablockertherapie bei Patienten erklärt, bei denen die Medikamente nicht pausiert wurden (33). Eine Reduktion der Betablockerdosierung bei AHF führt auch, ähnlich wie ein Absetzen, zu einer Verschlechterung der Prognose und wird deshalb nicht empfohlen (34).
Bei AHF-Patienten ohne Betablockertherapie sollte die neurohumorale Blockade frühzeitig begonnen werden und rasch aufdosiert werden. Die STRONG-HF-Studie hat klar gezeigt, dass eine intensive Implementierung der oralen Herzinsuffizienztherapie (inkl. Betablocker) während und unmittelbar nach einer Hospitalisation aufgrund AHF sicher ist, die Mortalität und HFH reduziert und zu einer Verbesserung der Lebensqualität führt (16). Der Effekt war unabhängig von der linksventrikulären Auswurffraktion und zeigt somit, dass auch bei diesen Patienten eine neurohumorale Aktivierung besteht und dass deren Blockade nach einer akuten Dekompensation vorteilhaft sein kann (17). Im Gegensatz dazu besteht bei chronischer Herzinsuffizienz keine klare Evidenz zugunsten einer Betablockertherapie, wenn die linksventrikuläre Auswurffraktion >40% ist; diese kann bei Patienten mit leicht reduzierter Pumpfunktion (HFmrEF, LVEF 41-49%) in Betracht gezogen werden (5). Patienten mit erhaltener Auswurffraktion haben allerdings häufig Komorbiditäten, weshalb sie diese Medikamente aufgrund einer anderen Indikation erhalten ( Tachyarrhythmien, myokardiale Ischämie). Umgekehrt haben Patienten mit erhaltener Pumpfunktion (HFpEF, LVEF ≥50%) häufig eine reduzierte Leistungsfähigkeit aufgrund einer chronotropen Inkompetenz, die allenfalls unter Betablocker verschlechtert wird (35). Somit sollten bei Patienten mit chronischer HFpEF ohne eine zusätzliche Indikation keine Betablocker neu angefangen bzw. diese bei fehlender Indikation sistiert werden (36). Zur Behandlung der arteriellen Hypertonie bei HFpEF sollen ACE-Hemmer oder Aldosteron-Antagonisten bevorzugt werden.
Praktische Aspekte
Eine chronische, gut vertragene Betablockertherapie kann auch bei einer AHF unverändert fortgeführt werden, ohne dadurch die Rekompensation zu verzögern. Eine Ausnahme bilden Patienten im kardiogenen Shock, welche eine positiv inotrope Therapie benötigen. Bei akut dekompensierten Patienten, welche keine Betablockertherapie bereits haben, sollte der Beginn frühzeitig erfolgen, d. h., sobald die Patienten klinisch stabil und euvoläm sind, idealerweise noch vor Spitalaustritt. Der Beginn einer Betablockertherapie muss bei Patienten mit schwer eingeschränkter/unbekannter Auswurffraktion und relevanter kardialer Dekompensation aufgrund des negativ inotropen Effektes besonders vorsichtig erfolgen (5). Durch engmaschige Kontrollen in den ersten Wochen nach der Hospitalisation sollte die maximal verträgliche Dosis erreicht werden (Ziel-Herzfrequenz 55-60/min.) (6). Hohes Alter und erhaltene Auswurffraktion sind häufig mit geringerer Verträglichkeit assoziiert.
Aldosteron-Antagonisten
Klinische Evidenz
Aldosteron-Antagonisten (auch als Mineralokortikoid-Rezeptor-Antagonisten, MRA, bekannt) werden in den aktuellen Leitlinien der Europäischen Gesellschaft für Kardiologie zur Behandlung der chronischen HFrEF (LVEF ≤40%) klar empfohlen (Empfehlungsgrad I) (5). Diese Empfehlung basiert auf mehreren klinischen Studien für Patienten mit chronischer HFrEF (RALES, EPHESUS, EMPHASIS-HF), die eine Reduktion bedeutender Endpunkte wie Gesamtmortalität, kardiovaskulärem Tod sowie Herzinsuffizienz- und Gesamthospitalisationen zeigten (37-39). Weniger eindeutig sind die Empfehlungen für Patienten mit chronischer HFmrEF (LVEF 41-49%) und mit HFpEF (LVEF ≥50%). Für den Einsatz von MRA bei HFmrEF wird ein Empfehlungsgrad IIb ausgesprochen, d. h., MRA können erwogen werden, um Todesfälle und Hospitalisationen aufgrund von Herzinsuffizienz zu vermeiden. Die schwache Empfehlung basiert auf der TOPCAT-Studie, welche MRA bei Patienten mit einer LVEF ≥45% untersuchte (40). Die Studie untersuchte den Nutzen von Spironolacton versus Placebo hinsichtlich des Auftretens eines kombinierten Endpunkts (kardiovaskulärer Tod, Herzinsuffizienz-Hospitalisationen, überlebter Herz-Kreislauf-Stillstand) und fiel neutral aus: Ein signifikanter Unterschied zwischen den Gruppen bezüglich des Auftretens des kombinierten primären Endpunkts konnte nicht gefunden werden, nur der Endpunkt HFH erreichte eine statistische Signifikanz. Post-hoc-Analysen kamen jedoch zu dem Ergebnis, dass der Nutzen von Spironolacton hinsichtlich Reduktion des kombinierten primären Endpunktes und Herzinsuffizienz-Hospitalisationen umso grösser ausfiel, je tiefer die LVEF war (41). Zudem wies die TOPCAT-Studie methodologische Mängel auf (42, 43). Für Patienten mit chronischer HFpEF gibt es in den Europäischen Guidelines folgerichtig keine Empfehlung zum Einsatz von MRA.
Die Patientenpopulation, bei der aufgrund einer chronischen Herzinsuffizienz ein MRA zum Einsatz kommen soll, ist also ziemlich klar definiert. Weniger Klarheit besteht hingegen im Fall einer AHF, insbesondere zum Zeitpunkt, ab welchem ein MRA begonnen oder hochtitriert werden sollte. Üblich ist ein Beginn bzw. eine Dosissteigerung erst nach Erreichen der klinischen Rekompensation. Die ATHENA-HF-Studie zeigte, dass auch ein früherer Beginn, also noch vor Erreichen einer Euvolämie, hinsichtlich Auftretens von Nierenfunktionsverschlechterung, Hyperkaliämie oder Hypotonie sicher ist (44). Zudem zeigte die STRONG-HF-Studie, dass eine intensivere Implementierung der oralen GDMT eine Reduktion der kardiovaskulären Ereignisse in den ersten 6 Monaten nach AHF unabhängig von der LVEF bewirkt (16, 17). Es kann also frühzeitig ein MRA in das Behandlungsregime von Patienten mit AHF integriert werden, unabhängig von der LVEF. Eine langfristige Fortsetzung nach der vulnerablen Phase muss für Patienten mit HFmrEF und HFpEF individuell festgelegt werden.
Praktische Aspekte
MRA sollen bei allen Patienten mit AHF so früh wie möglich zum Einsatz kommen. In der Regel wird zunächst das kostengünstigere Spironolacton angewendet, das aber zu Gynäkomastie und Mastodynie führen kann. Beim Auftreten dieser Nebenwirkung ist ein Wechsel auf Eplerenon sinnvoll, welches eine spezifischere mineralokortikoide Blockade bewirkt (39). Die initiale Dosierung beträgt
25 mg täglich. Bei guter Verträglichkeit kann die Dosis auf 50 mg hochtitriert werden, nur in Ausnahmefällen ist eine reduzierte initiale Dosis von 12.5 mg täglich (mit Hochtitration im Verlauf) nötig. Da Spironolacton in einer Dosis von 25 mg nur leicht hypotonisierend wirkt, kann es auch bei Patienten, die eher niedrige Blutdruckwerte aufweisen, eingesetzt werden. Vorsichtig mit dem Einsatz von MRA ist man bei Patienten mit Nierenfunktionseinschränkung und Neigung zu Hyperkaliämie (45). Ab einer glomerulären Filtrationsrate (GFR) von <30ml/min./1.73m2 oder K >5.5mmol/l sollte die MRA-Dosis halbiert und Kreatinin und Kalium engmaschig kontrolliert werden, bei einer GFR <20ml/min./1.73m2 oder K >6mmol/l sollen MRA abgesetzt werden (5). Andere kaliumsparende Diuretika und nephrotoxische Medikamente (wie z. B. NSAR) sollten vermieden werden. Bei chronischer HFrEF ist die Indikation zur langfristigen Therapie klar gegeben, bei chronischer HFmrEF und HFpEF werden MRA nicht routinemässig fortgesetzt.
Natrium-Glukose-Kotransporter 2 Hemmer (SGLT2-Hemmer)
Klinische Evidenz
Im letzten Jahrzehnt – seit der Veröffentlichung der positiven Resultate der EMPA-REG-Outcome-Studie, welche Empagliflozin bei Hochrisiko-Diabetikern untersucht hat – wurde zunehmend klar, dass diese neue Medikamentenklasse die kardiovaskuläre Prognose verbessern kann, insbesondere durch Senkung der Herzinsuffizienzereignisse, und zwar sowohl bei Diabetikern wie auch bei Nichtdiabetikern (46, 47). Die Mechanismen, welche für die günstige Wirkung auf die Herzinsuffizienz verantwortlich sind, sind noch nicht abschliessend geklärt. SGLT2-Hemmer fördern die Glukose- und Natriumausscheidung über die Niere und haben dadurch eine blutzuckersenkende und diuretische Wirkung. Es gibt Hinweise auf eine Reduktion der Inflammation, Verbesserung des kardialen Energiemetabolismus und verschiedene Effekte in anderen Organsystemen (48, 49). Mittlerweile werden die SGLT2-Hemmer Dapagliflozin und Empagliflozin von den aktuellen Leitlinien der Europäischen Gesellschaft für Kardiologie zur Behandlung der chronischen Herzinsuffizienz empfohlen, unabhängig vom diabetischen Status und von der linksventrikulären Auswurffraktion (Empfehlungsgrad I) (5, 6).
Zwei grosse klinische Studien konnten die Wirksamkeit bei Patienten mit chronischer HFrEF zeigen: Dapagliflozin konnte in der DAPA-HF-Studie eine beträchtliche Reduktion der kardiovaskulären Mortalität und der HFH zeigen (50); Empagliflozin konnte in der EMPEROR-Reduced-Studie eine vergleichbare Reduktion der Mortalitäts- und Hospitalisationsrate zeigen (51). Bei Patienten mit chronischer erhaltener (HFpEF) oder leicht reduzierter (HFmrEF) Auswurffraktion konnte ebenfalls ein Nutzen durch SGLT2-Hemmer gezeigt werden. Empagliflozin und Dapagliflozin konnten in der EMPEROR-Preserved- resp. DELIVER-Studie den primären Endpunkt aus kardiovaskulärer Mortalität und Herzinsuffizienzereignisse senken, primär durch eine markante Reduktion der HFH (52, 53) . Eine grosse Metaanalyse zeigte – unabhängig vom diabetischen Status und der Auswurffraktion – , dass eine Therapie mit SGLT2-Hemmern bei chronischer Herzinsuffizienz zu einer 13%igen Reduktion der kardiovaskulären Mortalität und einer 28%igen Reduktion der HFH führt (54).
Neuere Studien haben die Wirksamkeit von SGLT2-Hemmern in akut dekompensierten Patienten untersucht. In der EMPULSE-Studie wurden stationäre Patienten mit AHF nach klinischer Stabilisierung innerhalb von 3 Tagen zu Empagliflozin oder Placebo randomisiert (55). Der primäre Endpunkt – definiert als «win ratio» der hierarchischen Analyse von Tod, Herzinsuffizienzereignissen und Verbesserung der Lebensqualität nach 3 Monaten – war zugunsten der Empagliflozin-Gruppe. Ein klinischer Benefit fand sich sowohl für eine neu aufgetretene Herzinsuffizienz als auch bei akut dekompensierter chronischer Herzinsuffizienz.
In der EMPAG-HF- und DIURETIC-HF-Studie wurde der additive Effekt eines SGLT2-Hemmers zu einer Standarddiuretikatherapie untersucht (56). In der ersten Studie wurden AHF-Patienten innerhalb von 12 Stunden zu einer höheren Empagliflozin-Dosis (25mg/Tag) oder Placebo randomisiert. Empagliflozin führte zu einer 25%igen Zunahme der Urinmenge über 5 Tage (absolute Differenz: 2.2 l), einer höheren Diuretikaeffizienz, ohne negative Effekte auf die Nierenfunktion. In der zweiten Studie wurde eine höhere Natriurese, eine frühere Umstellung auf eine orale Diuretikatherapie und eine frühere Spitalentlassung in der AHF-Gruppe, die innerhalb von 24 Stunden Dapagliflozin in Kombination mit der Standarddiuretikatherapie erhielt, beobachtet. Bezüglich Diuretikaeffizienz (als primären Endpunkt), Gewichtsabnahme oder Nebenwirkungen bestanden keine Unterschiede. Hier bleibt die Publikation abzuwarten (57).
Praktische Aspekte
Anhand der aktuellen Studienlage sollte man bei allen AHF-Patienten so früh wie möglich eine Therapie mit einem SGLT2-Hemmer beginnen, da diese Therapie zu einer schnelleren Rekompensation beitragen und die Prognose bereits in der vulnerablen Phase verbessern kann. SGLT2-Hemmer sind in der Anwendung sicher und allgemein gut verträglich mit einem meistens vernachlässigbaren Effekt auf den Blutdruck. Nach Therapiebeginn ist mit einer kleinen funktionellen Abnahme der GFR zu rechnen, die aber langfristig im Vergleich zu Placebo deutlich geringer ausfällt und damit einen nephroprotektiven Effekt anzeigt (51). Durch den zusätzlichen diuretischen Effekt muss ggf. die Diuretikatherapie reduziert werden. Ohne begleitende
andere Diabetestherapie ist das Risiko für eine Hypoglykämie sehr gering. Durch die Glukosurie ist das Risiko für einen urogenitalen Infekt erhöht, sodass auf eine gute Intimhygiene geachtet werden muss. Bei einem nicht substituierten Insulinmangel und bei fehlender Nahrungsaufnahme steigt das Risiko für eine euglykäme diabetische Ketoazidose mit potenziell fatalem Ausgang. Bei ungenügender Flüssigkeitsaufnahme und/oder einem Flüssigkeitsverlust (z. B. bei Fieber, Diarrhoe, grosser Hitze) sollten SGLT2-Hemmer deshalb temporär pausiert werden.
Andere Substanzen
Ivabradin wirkt über den If-Kanal im Sinusknoten und führt so zu einer Reduktion der Herzfrequenz im Sinusrhythmus. In der SHIFT-Studie konnte bei HFrEF-Patienten gezeigt werden, dass eine tiefere Herzfrequenz unter Ivabradin mit einer signifikanten Reduktion des primären Endpunktes (Mortalität und HFH) einhergeht, wobei Patienten mit einer Herzfrequenz von > 75/min. am meisten davon profitiert haben. Patienten in der Ivabradin-Gruppe wiesen ein niedriges Risiko für HFH während der vulnerablen Phase auf (58). Deshalb kann Ivabradin als ergänzende Therapieoption bei HFrEF-Patienten nach kürzlicher kardialer Dekompensation und einer HF im Sinusrhythmus > 70/min. trotz Betablocker oder bei Betablockerunverträglichkeit erwogen werden, um das HFH-Risiko günstig zu beeinflussen.
Vericiguat, ein oraler Stimulator der löslichen Guanylatcyclase, wurde im VICTORIA-Trial bei HFrEF-Patienten untersucht, die in den vergangenen 6 Monaten eine kardiale Dekompensation erlitten haben, die entweder zu einer Hospitalisation oder der Notwendigkeit einer intravenösen Diuretikatherapie geführt hat. Bei diesen Patienten konnte eine signifikante Reduktion des kombinierten Endpunktes (Mortalität und HFH) gezeigt werden, wobei dieser v. a. durch eine Reduktion der HFH getriggert war. Somit stellt auch Vericiguat eine medikamentöse Therapieoption bei HFrEF-Patienten und bereits ausgebauter Herzinsuffizienztherapie in der Frühphase nach stabilisierter Akutsituation dar, insbesondere um das Risiko einer erneuten HFH zu reduzieren (59, 60). Hier ist ebenfalls die bestehende Limitatio des BAG in der Schweiz zu beachten.
Schlussfolgerung
Die moderne Behandlung der AHF besteht aus einer Vielzahl an Therapieoptionen, die – optimal genutzt und der klinischen Situation entsprechend angepasst – eine Senkung der Mortalität und der Rehospitalisationen erreichen können.
Wenn wir zurück auf die Fallvignette zurückblicken, ergeben sich folgende Überlegungen:
1. Die akute Verschlechterung der vorbestehenden Herzinsuffizienz erfolgte aus unklarem Grund. Hier sollten typische Auslösefaktoren gesucht und entsprechend behandelt werden. Ebenfalls müssen Medikamentenadhärenz und Lebensstil überprüft werden.
2. Neben der Erstbeurteilung muss parallel bereits eine Akuttherapie verabreicht werden. Der Patient sollte eine initiale intravenöse Furosemid-Dosis von 40 mg erhalten, welche im weiteren Verlauf anhand der diuretischen Antwort angepasst wird.
3. Bei fehlenden Zeichen für einen kardiogenen Schock – wie in der Fallvignette – kann die orale Herzinsuffizienz-therapie unverändert weitergegeben werden.
4. Nach hämodynamischer Stabilisierung sollte die Herzinsuffizienztherapie noch weiter optimiert werden: Frühzeitig kann ein SGLT-2-Hemmer eingesetzt werden, da hiermit ein additiver diuretischer und natriuretischer Effekt besteht; ein MRA sollte etabliert, der ACE-Hemmer vorsichtig aufdosiert (und ggf. im Verlauf auf Sacubitril/Valsartan gewechselt) und nach Erreichen der Euvolämie der Betablocker erhöht werden.
5. Der Patient sollte in ein ambulantes Herzinsuffizienzprogramm eingeschlossen werden, damit in engmaschigen Kontrollen die Medikamente auftitriert und weitere Therapieoptionen evaluiert werden können.
Klinik Innere Medizin
Stadtspital Zürich Triemli
Birmensdorferstrasse 497
8063 Zürich, Schweiz
mattia.arrigo@uzh.ch
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
Literatur:
1. Arrigo M, Jessup M, Mullens W, Reza N, Shah AM, Sliwa K, Mebazaa A. Acute heart failure. Nat Rev Dis Primers. 2020;6(1):16.
2. Arrigo M, Parissis JT, Akiyama E, Mebazaa A. Understanding acute heart failure: pathophysiology and diagnosis. Eur Heart J Suppl. 2016;18(suppl G):G11-G8.
3. Arrigo M, Blet A, Morley-Smith A, Aissaoui N, Baran DA, Bayes-Genis A, et al. Current and future trial design in refractory cardiogenic shock. Eur J Heart Fail. 2023;25(5):609-15.
4. Arrigo M, Ruschitzka F, Flammer AJ. [Acute heart failure]. Ther Umsch. 2018;75(3):155-60.
5. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Bohm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726.
6. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Bohm M, et al. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2023;44(37):3627-39.
7. Mebazaa A, Tolppanen H, Mueller C, Lassus J, DiSomma S, Baksyte G, et al. Acute heart failure and cardiogenic shock: a multidisciplinary practical guidance. Intensive Care Med. 2016;42(2):147-63.
8. Ter Maaten JM, Beldhuis IE, van der Meer P, Krikken JA, Postmus D, Coster JE, et al. Natriuresis-guided diuretic therapy in acute heart failure: a pragmatic randomized trial. Nat Med. 2023;29(10):2625-32.
9. Mullens W, Damman K, Harjola VP, Mebazaa A, Brunner-La Rocca HP, Martens P, et al. The use of diuretics in heart failure with congestion – a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2019;21(2):137-55.
10. Felker GM, Lee KL, Bull DA, Redfield MM, Stevenson LW, Goldsmith SR, et al. Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med. 2011;364(9):797-805.
11. Trulls JC, Morales-Rull JL, Casado J, Carrera-Izquierdo M, Snchez-Marteles M, Conde-Martel A, et al. Combining loop with thiazide diuretics for decompensated heart failure: the CLOROTIC trial. Eur Heart J. 2023;44(5):411-21.
12. Mullens W, Dauw J, Martens P, Verbrugge FH, Nijst P, Meekers E, et al. Acetazolamide in Acute Decompensated Heart Failure with Volume Overload. N Engl J Med. 2022;387(13):1185-95.
13. Ivey-Miranda JB, Rao VS, Cox ZL, Moreno-Villagomez J, Mahoney D, Maulion C, et al. In-Hospital Observation on Oral Diuretics After Treatment for Acute Decompensated Heart Failure: Evaluating the Utility. Circ Heart Fail. 2023;16(4):e010206.
14. Arrigo M, Mebazaa A. Addressing vulnerability: opening a new door to improved outcomes in acute heart failure. Eur J Heart Fail. 2018;20(2):292-4.
15. Gayat E, Arrigo M, Littnerova S, Sato N, Parenica J, Ishihara S, et al. Heart failure oral therapies at discharge are associated with better outcome in acute heart failure: a propensity-score matched study. Eur J Heart Fail. 2017;20(2):345-54.
16. Mebazaa A, Davison B, Chioncel O, Cohen-Solal A, Diaz R, Filippatos G, et al. Safety, tolerability and efficacy of up-titration of guideline-directed medical therapies for acute heart failure (STRONG-HF): a multinational, open-label, randomised, trial. Lancet. 2022;400(10367):1938-52.
17. Pagnesi M, Metra M, Cohen-Solal A, Edwards C, Adamo M, Tomasoni D, et al. Uptitrating Treatment After Heart Failure Hospitalization Across the Spectrum of Left Ventricular Ejection Fraction. J Am Coll Cardiol. 2023;81(22):2131-44.
18. Arrigo M, Biegus J, Asakage A, Mebazaa A, Davison B, Edwards C, et al. Safety, tolerability and efficacy of up-titration of guideline-directed medical therapies for acute heart failure in elderly patients: A sub-analysis of the STRONG-HF randomized clinical trial. Eur J Heart Fail. 2023;25(7):1145-55.
19. Cerlinskaite-Bajore K, Lam CSP, Sliwa K, Adamo M, Ter Maaten JM, Leopold V, et al. Sex-specific analysis of the rapid up-titration of guideline-directed medical therapies after a hospitalization for acute heart failure: Insights from the STRONG-HF trial. Eur J Heart Fail. 2023;25(7):1156-65.
20. Chioncel O, Davison B, Adamo M, Antohi LE, Arrigo M, Barros M, et al. Non-cardiac comorbidities and intensive up-titration of oral treatment in patients recently hospitalized for heart failure: Insights from the STRONG-HF trial. Eur J Heart Fail. 2023.
21. The Consensus Trial Study Group. Effects of Enalapril on Mortality in Severe Congestive Heart Failure. N Engl J Med. 1987;316(23):1429-35.
22. The Solvd Investigators. Effect of Enalapril on Survival in Patients with Reduced Left Ventricular Ejection Fractions and Congestive Heart Failure. N Engl J Med. 1991;325(5):293-302.
23. Packer M, Poole-Wilson PA, Armstrong PW, Cleland JG, Horowitz JD, Massie BM, et al. Comparative effects of low and high doses of the angiotensin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. ATLAS Study Group. Circulation. 1999;100(23):2312-8.
24. Bhandari S, Mehta S, Khwaja A, Cleland JGF, Ives N, Brettell E, et al. Renin-Angiotensin System Inhibition in Advanced Chronic Kidney Disease. N Engl J Med. 2022;387(22):2021-32.
25. McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014;371(11):993-1004.
26. Velazquez EJ, Morrow DA, DeVore AD, Duffy CI, Ambrosy AP, McCague K, et al. Angiotensin-Neprilysin Inhibition in Acute Decompensated Heart Failure. N Engl J Med. 2019;380(6):539-48.
27. Solomon SD, McMurray JJV, Anand IS, Ge J, Lam CSP, Maggioni AP, et al. Angiotensin-Neprilysin Inhibition in Heart Failure with Preserved Ejection Fraction. N Engl J Med. 2019;381(17):1609-20.
28. Packer M, Coats AJ, Fowler MB, Katus HA, Krum H, Mohacsi P, et al. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med. 2001;344(22):1651-8.
29. Packer M, Fowler MB, Roecker EB, Coats AJ, Katus HA, Krum H, et al. Effect of carvedilol on the morbidity of patients with severe chronic heart failure: results of the carvedilol prospective randomized cumulative survival (COPERNICUS) study. Circulation. 2002;106(17):2194-9.
30. Committees C-IIIa. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet. 1999;353(9146):9-13.
31. MERIT-HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in-Congestive Heart Failure (MERIT-HF). Lancet. 1999;353(9169):2001-7.
32. McMurray JJ. CONSENSUS to EMPHASIS: the overwhelming evidence which makes blockade of the renin-angiotensin-aldosterone system the cornerstone of therapy for systolic heart failure. Eur J Heart Fail. 2011;13(9):929-36.
33. Prins KW, Neill JM, Tyler JO, Eckman PM, Duval S. Effects of Beta-Blocker Withdrawal in Acute Decompensated Heart Failure: A Systematic Review and Meta-Analysis. JACC Heart Fail. 2015;3(8):647-53.
34. Metra M, Torp-Pedersen C, Cleland JG, Di Lenarda A, Komajda M, Remme WJ, et al. Should beta-blocker therapy be reduced or withdrawn after an episode of decompensated heart failure? Results from COMET. Eur J Heart Fail. 2007;9(9):901-9.
35. Shah AM, Pfeffer MA. The many faces of heart failure with preserved ejection fraction. Nat Rev Cardiol. 2012;9(10):555-6.
36. Desai AS, Lam CSP, McMurray JJV, Redfield MM. How to Manage Heart Failure With Preserved Ejection Fraction: Practical Guidance for Clinicians. JACC Heart Fail. 2023;11(6):619-36.
37. Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med. 1999;341(10):709-17.
38. Pitt B, Remme W, Zannad F, Neaton J, Martinez F, Roniker B, et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med. 2003;348(14):1309-21.
39. Zannad F, McMurray JJ, Krum H, van Veldhuisen DJ, Swedberg K, Shi H, et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med. 2011;364(1):11-21.
40. Pitt B, Pfeffer MA, Assmann SF, Boineau R, Anand IS, Claggett B, et al. Spironolactone for heart failure with preserved ejection fraction. N Engl J Med. 2014;370(15):1383-92.
41. Solomon SD, Claggett B, Lewis EF, Desai A, Anand I, Sweitzer NK, et al. Influence of ejection fraction on outcomes and efficacy of spironolactone in patients with heart failure with preserved ejection fraction. Eur Heart J. 2016;37(5):455-62.
42. de Denus S, O‘Meara E, Desai AS, Claggett B, Lewis EF, Leclair G, et al. Spironolactone Metabolites in TOPCAT – New Insights into Regional Variation. N Engl J Med. 2017;376(17):1690-2.
43. Pfeffer MA, Claggett B, Assmann SF, Boineau R, Anand IS, Clausell N, et al. Regional variation in patients and outcomes in the Treatment of Preserved Cardiac Function Heart Failure With an Aldosterone Antagonist (TOPCAT) trial. Circulation. 2015;131(1):34-42.
44. Butler J, Anstrom KJ, Felker GM, Givertz MM, Kalogeropoulos AP, Konstam MA, et al. Efficacy and Safety of Spironolactone in Acute Heart Failure: The ATHENA-HF Randomized Clinical Trial. JAMA Cardiol. 2017;2(9):950-8.
45. Guidetti F, Lund LH, Benson L, Hage C, Musella F, Stolfo D, et al. Safety of continuing mineralocorticoid receptor antagonist treatment in patients with heart failure with reduced ejection fraction and severe kidney disease: data from Swedish Heart Failure Registry. Eur J Heart Fail. 2023.
46. Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015;373(22):2117-28.
47. Arrigo M, Huber LC. Cardiovascular trials with SGLT2 inhibitors – a primer to survive in the jungle. Cardiovascular Medicine. 2023;26(1):6–8.
48. Lopaschuk GD, Verma S. Mechanisms of Cardiovascular Benefits of Sodium Glucose Co-Transporter 2 (SGLT2) Inhibitors: A State-of-the-Art Review. JACC Basic Transl Sci. 2020;5(6):632-44.
49. Packer M. SGLT2 inhibitors: role in protective reprogramming of cardiac nutrient transport and metabolism. Nat Rev Cardiol. 2023.
50. McMurray JJV, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019.
51. Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020;383(15):1413-24.
52. Solomon SD, McMurray JJV, Claggett B, de Boer RA, DeMets D, Hernandez AF, et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med. 2022;387(12):1089-98.
53. Anker SD, Butler J, Filippatos G, Ferreira JP, Bocchi E, Bohm M, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021;385(16):1451-61.
54. Vaduganathan M, Docherty KF, Claggett BL, Jhund PS, de Boer RA, Hernandez AF, et al. SGLT-2 inhibitors in patients with heart failure: a comprehensive meta-analysis of five randomised controlled trials. Lancet. 2022;400(10354):757-67.
55. Voors AA, Angermann CE, Teerlink JR, Collins SP, Kosiborod M, Biegus J, et al. The SGLT2 inhibitor empagliflozin in patients hospitalized for acute heart failure: a multinational randomized trial. Nat Med. 2022;28(3):568-74.
56. Schulze PC, Bogoviku J, Westphal J, Aftanski P, Haertel F, Grund S, et al. Effects of Early Empagliflozin Initiation on Diuresis and Kidney Function in Patients With Acute Decompensated Heart Failure (EMPAG-HF). Circulation. 2022;146(4):289-98.
57. Cox ZL, Collins SP, Aaron M, Hernandez GA, Iii ATM, Davidson BT, et al. Efficacy and safety of dapagliflozin in acute heart failure: Rationale and design of the DICTATE-AHF trial. Am Heart J. 2021;232:116-24.
58. Komajda M, Tavazzi L, Swedberg K, Bohm M, Borer JS, Moyne A, et al. Chronic exposure to ivabradine reduces readmissions in the vulnerable phase after hospitalization for worsening systolic heart failure: a post-hoc analysis of SHIFT. Eur J Heart Fail. 2016;18(9):1182-9.
59. Arrigo M. Vericiguat in heart failure – who benefits the most? Cardiovascular Medicine. 2021;24:w10049.
60. Armstrong PW, Pieske B, Anstrom KJ, Ezekowitz J, Hernandez AF, Butler J, et al. Vericiguat in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2020;382(20):1883-93.
Therapeutische Umschau
- Vol. 81
- Ausgabe 2
- April 2024