- Bildgebung bei Kristallarthropathien
Einleitung
Die Verwendung radiologischer Methoden zur Diagnose von Kristallarthropathien reicht zurück in die erste Hälfte des 20. Jahrhunderts und ist seither laufend im Wandel. Waren es zu Beginn nahezu ausschliesslich Verkalkungen, welche als direkte Auswirkung von Kristalldeposition in Gelenken beschrieben wurde, beschränkte sich die Diagnostik zu Anfangszeiten daher auch auf die Detektion solcher Verkalkungen mittels konventioneller Radiographie. Beispielsweise beschrieb Calthrop bereits 1946 die Diagnose von Gicht mittels Röntgenbildgebung (1).
Die zunehmende Komplexität der bildgebenden sowie mikroskopischen Methoden führte insbesondere in den vergangenen zwei Jahrzehnten zunehmend dazu, dass sowohl verschiedene Arten von Kristalldepositionen in ein und demselben Gelenk nachweislich koexistent sein können als auch sehr subtile Weichteilveränderungen bereits lange vor bildgebender manifester Deposition makroskopischer Verkalkungen mittels moderner Radiodiagnostik detektiert werden. In Kombination mit rasenden Entwicklungen auf dem Gebiet der Therapie von Kristallarthropathien und ihren zugrunde liegenden Systemerkrankungen resultierte daher eine zunehmend differenzierte Ansicht und Interpretation an Bildbefunden, verglichen zum «State of the Art» noch vor wenigen Jahren. Erkenntnisse um verschiedene Gruppen führten dazu, dass reine Bildbefunde zunehmend im gesamten Kontext der Systemerkrankung gesetzt und so radiologisch interpretiert werden sollten. Eine Abhilfe zum besseren Verständnis von Kristallarthropathien und ihren radiologischen Befunden liefern die unregelmässig erscheinenden Guidelines und Empfehlungen hinsichtlich Bildgebung bei Gicht und anderen Kristallarthropathien der European League Against Rheumatism (EULAR), an welchen jeweils ein breites Konsortium an rheumatologischen, radiologischen und anderen Autorinnen mitwirken. Die neuesten Empfehlungen aus dem Jahr 2023 beleuchten zunehmend auch die Relevanz neuartiger Modalitäten und unterstützender Mechanismen, beispielsweise auf multispektraler Schnittbildgebung (2).
In den nachfolgenden Kapiteln werden einerseits grundlegende technische Aspekte der verschiedenen radiologischen Modalitäten beleuchtet sowie andererseits Vorteile und Limitationen diskutiert. Abschliessend werden alle relevanten Subtypen von Kristallarthropathien gesondert diskutiert und diagnostische Möglichkeiten und typische Zeichen für die jeweilige Erkrankung erörtert. Abschliessend widmet sich dieser Artikel den neuesten Empfehlungen der European League Against Rheumatism (EULAR) und fasst diese einfach und mit Fokus auf praxisrelevante Informationen zusammen.
Radiologische Modalitäten bei Kristallarthropathien
Konventionelle Radiographie
Das konventionelle Röntgen bleibt die am weitesten verbreitete Bildgebungstechnik bei der Erstbeurteilung von Gelenkerkrankungen. Aufgrund der breiten Verfügbarkeit und guten Kosteneffizienz werden Röntgenbilder weiterhin in der Abklärung von Arthropathien üblicherweise frühzeitig und niederschwellig als erste bildgebende Methode eingesetzt. Die Röntgenbildgebung nutzt ionisierende Strahlung, um Bilder der inneren Strukturen des Körpers zu erstellen. Wenn Röntgenstrahlen den Körper durchdringen, werden sie je nach Dichte in unterschiedlichen Mengen von verschiedenen Geweben absorbiert. Knochen, die Kalzium enthalten, absorbieren mitunter den grössten Anteil der Strahlung und erscheinen auf Röntgenfilmen daher besonders deutlich, während Weichteile weniger absorbieren und in verhältnismässig ähnlichen Grautönen erscheinen. Dieser Kontrast ermöglicht die Visualisierung insbesondere von Skelettstrukturen und anderen kalziumbasierten Strukturen bzw. Gewebetypen mit hoher Ordnungszahl. Röntgenaufnahmen eignen sich besonders gut zur Aufdeckung fortgeschrittener, chronischer Gelenkveränderungen, die von Kristallarthropathien betroffen sind (3). Typische Befunde chronischer Gelenkdegeneration sind u.a. eine Verengung des Gelenkraums und subchondrale Sklerose (erhöhte Knochendichte unter dem Knorpel). Bei Kristallarthropathien kann insbesondere die Deposition von röntgendichten Kristallen in Projektion auf den Gelenkspalt diagnostisch wegweisend sein. Hinzu kommen z. B. bei fortgeschrittenen Fällen der Gicht Weichteilmassen, welche mit unterschiedlichem Verkalkungsgrad um Gelenke als sogenannte Tophi detektierbar sind.
Bei diagnostizierten Kristallarthropathien ist die langfristige Überwachung des Krankheitsverlaufs von entscheidender Bedeutung. Röntgenaufnahmen werden häufig verwendet, um das Fortschreiten von Gelenkschäden im Laufe der Zeit zu verfolgen. Regelmässige Bildgebung kann helfen, die Wirksamkeit von Behandlungen zu beurteilen, indem sie das Ausmass von Gelenkschäden und anderen strukturellen Veränderungen über Zeiträume hinweg vergleicht. Die strukturellen Erkenntnisse der Röntgenbildgebung helfen bei der Planung medizinischer oder chirurgischer Behandlungen. Beispielsweise kann eine erhebliche Gelenkschädigung Anlass zu Überlegungen zu einem chirurgischen Eingriff geben. Ebenso können Anzeichen einer akuten Verschlechterung zu Anpassungen der pharmakologischen Behandlung führen, um die Krankheit besser zu bewältigen. Die Röntgenbildgebung bietet insgesamt mehrere Vorteile, die sie zu einem wertvollen Instrument bei der Behandlung von Kristallarthropathien macht. Röntgengeräte sind in medizinischen Einrichtungen allgegenwärtig und machen diese Form der Bildgebung für die meisten Patienten zugänglich. Die Auswertung und Interpretation sind quasi in Echtzeit möglich. Diese Modalität ist meist kostengünstiger als andere bildgebende Verfahren, was sie zu einer effizienten Option sowohl für Erstdiagnose als auch für Monitoring bzw. Nachsorge macht.
Diesen Vorteilen steht insbesondere die reduzierte Darstellungsmöglichkeit von Weichteilstrukturen entgegen. Röntgenstrahlen sind oft nicht in der Lage, frühe Stadien von Kristallablagerungen und Entzündungen zu erkennen, welche strukturellen Schäden vorausgehen. Hinzu ist formal in der wiederholten Exposition gegenüber Röntgenstrahlen mit ionisierender Strahlung Sparsamkeit geboten, da diese möglicherweise schädliche Wirkungen birgt und somit eine sorgfältige Abwägung der Häufigkeit der Applikation indiziert ist («As Low As Reasonably Achievable») (4). Insgesamt ist jedoch die angewandte Dosis im Rahmen von Röntgenuntersuchungen des Extremitätenskeletts verhältnismässig gering.
Ultraschall
Medizinischer Ultraschall oder Sonographie nutzt hochfrequente Schallwellen, in der muskuloskelettalen Bildgebung üblicherweise zwischen 12 und 24 MHz, um Bilder oberflächlicher Weichteilstrukturen zu erstellen. Die Schallwellen werden von einer Sonde ausgesendet und beim Auftreffen auf verschiedene Gewebe reflektiert. Dadurch können Organe, Muskeln und Gelenke sichtbar gemacht werden. Im Bereich der Rheumatologie ist Ultraschall aufgrund seiner Fähigkeit, Echtzeitbilder von Weichgewebe zu liefern, zu einem Werkzeug von immensem Wert geworden.
Kristallarthropathien sind durch die Ablagerung von Kristallen in und um die Gelenke gekennzeichnet. Diese Ablagerungen führen zu Entzündungen und degenerativen Veränderungen, die sich im Ultraschall hervorragend darstellen lassen. Seine hohe Auflösung ermöglicht die Visualisierung von diagnostischen Zeichen von Depositionen in und um Gelenke. Diese Merkmale werden typischerweise als echoreiche (helle) Verstärkungen auf Ultraschallbildern dargestellt. Über die Kristallerkennung hinaus hilft Ultraschall dabei, den Entzündungsgrad im Weichteilgewebe zu beurteilen. Eine Synovialhypertrophie, ein erhöhter Blutfluss durch das Dopplersignal und Gelenkergüsse können als Hinweise auf eine aktive Entzündung sichtbar gemacht werden (5). Im Laufe der Zeit führen wiederholte Entzündungen zu Gelenk- und Weichteilschäden, die auch mittels Ultraschallbildgebung überwacht werden können. Der Einsatz von Ultraschall bei Kristallarthropathien geht allerdings über die Diagnostik hinaus. Er ist hilfreich bei gezielten Interventionen, z. B. Gelenkaspirationen und Injektionen. Die Echtzeitbildgebung ermöglicht eine präzise Platzierung der Nadeln, was die Wirksamkeit und Sicherheit dieser Verfahren erhöht.
Während Röntgenstrahlen und MRT auch bei der Diagnose und Überwachung von Kristallarthropathien eingesetzt werden, bietet Ultraschall mehrere entscheidende Vorteile. Ultraschall liefert sofortiges visuelles Feedback, welches für die Beurteilung der dynamischen Gelenkfunktion und die Wahl der Behandlung von entscheidender Bedeutung ist. Im Gegensatz zu Röntgenstrahlen kommt beim Ultraschall keine ionisierende Strahlung zum Einsatz, was die wiederholte Anwendung sicherer macht und sich besonders für gefährdete Bevölkerungsgruppen wie schwangere Frauen und junge Menschen eignet. Die kostengünstige und mobile Verfügbarkeit ist ein klarer Vorteil gegenüber MRT- und CT-Geräten. Demgegenüber steht als besondere Herausforderung die Abhängigkeit der Untersuchungsqualität vom Bediener sowie die begrenzte Durchdringung in tiefere Gewebeschichten beispielsweise bei adipösen Patienten (6).
Computertomographie
Bei der Computertomographie (CT) werden mehrere Röntgenmessungen aus unterschiedlichen Winkeln kombiniert, um Querschnittsbilder des Körpers zu erstellen. Diese Bilder können dann digital zusammengesetzt werden, um ein dreidimensionales Bild der inneren Strukturen des Patienten zu erstellen. Diese Methode ermöglicht eine aussergewöhnliche Detailgenauigkeit, insbesondere der Knochen, und liefert gleichzeitig wichtige Einblicke in den Zustand des Gewebes rund um die Gelenke. Bei Kristallarthropathien ist die CT wertvoll, da sie winzige Veränderungen in der Knochenstruktur erkennen und Kristallablagerungen sichtbar machen kann, die auf Standardröntgenaufnahmen möglicherweise nicht erkennbar sind. CT-Scans sind effektiv bei der Identifizierung von Erosionen und Verkalkungen, die bei fortgeschrittenen Kristallarthropathien typisch sind (7). Selbst kleine Tophi und verkalkte Ablagerungen im Weichteilmantel können erkannt werden und so einen Hinweis auf das Ausmass einer Erkrankung geben.
Im Vergleich zum Röntgen bietet das CT eine bessere Beurteilung der Knochenintegrität und des Gelenkraums, insbesondere in komplexen anatomischen Regionen wie der Wirbelsäule und dem Becken, die bei Projektionsaufnahmen mittels Röntgen sonst durch Überlagerungen limitiert beurteilbar sind. Detaillierte CT-Bilder sind darüber hinaus bei Planung chirurgischer Eingriffe von hohem Wert, da dreidimensionale Rekonstruktionen helfen, die genaue anatomische Anordnung und das Ausmass der Schädigung zu verstehen, was für erfolgreiche chirurgische Ergebnisse von entscheidender Bedeutung ist. Die CT liefert detailliertere Bilder von Knochen und Weichteilgewebe als die herkömmliche Radiographie, was in komplexen Fällen, in denen präzise anatomische Details erforderlich sind, besonders nützlich ist. Moderne CT-Scans sind schnell durchgeführt und in der Schweiz gut verfügbar. Im Vergleich zum konventionellen Röntgen bedeuten CT-Untersuchungen signifikant höhere angewandte Strahlendosen, was bei wiederholter Anwendung ein theoretisches Risiko darstellt. Bei der Erkennung früher Weichteilveränderungen sind CT-Scans darüber hinaus technisch bedingt Methoden wie MRT und Ultraschall unterlegen. Hinzu kommt, dass CT-Scans im Allgemeinen teurer sind als Röntgenaufnahmen und in kleineren medizinischen Einrichtungen bzw. bei Erstdiagnostik kaum zum Einsatz kommen.
Dual-Energy-basierte und Photon-Counting-Detektor Computertomographie
Fortschrittliche CT-bildgebende Verfahren verwenden unterschiedliche Röntgenenergiespektren, um zwischen Materialien ähnlicher Dichte, aber unterschiedlicher Atomzusammensetzung zu unterscheiden. Die sogenannte Dual-Energy CT (DECT) kann Bilder erstellen, die von zwei unterschiedlichen Röntgenenergiespektren stammen. Mittels komplexer Nachbearbeitung und Spezialsoftware ist im Nachhinein möglich, Aussagen über die atomare Zusammensetzung von Materialien zu treffen (8, 9). Die DECT kann insbesondere urathaltige Ablagerungen von anderen, vorwiegend kalziumbasierten Verkalkungen unterscheiden, indem die Materialzusammensetzung anhand der Schwächungsprofile bei unterschiedlichen Energien charakterisiert wird. Diese sogenannte Möglichkeit der Materialdifferenzierung zwischen verschiedenen Arten von Kristallen und anderen Substanzen im Gewebe ist einzigartig für Multi-Energie-CT-Methoden. In jüngster Vergangenheit sind zusätzlich Photonenzähldetektoren (PCD) in der CT-Bildgebung (PCD-CT) als vielversprechende Technologie aufgekommen (10). Dadurch kann die Bildqualität im Vergleich zum herkömmlichen CT deutlich verbessert werden, sodass hochauflösende Bilder bei geringerer Strahlendosis produziert werden. Auch hier ist Materialdifferenzierung durch Auswertung von Bildern verschiedener Röntgenenergiespektren möglich (11).
Magnetresonanztomographie
Die Magnetresonanztomographie (MRT) ist ein komplexes Bildgebungsverfahren, das den Ansatz zur Diagnose und Behandlung verschiedener Erkrankungen des Bewegungsapparates, einschliesslich Kristallarthropathien, ebenfalls verändert hat. Die MRT nutzt starke Magnete und Radiowellen, um detaillierte Bilder von Organen und Geweben im Körper zu erzeugen. Im Gegensatz zu Röntgen- oder CT-Scans ist die MRT nicht auf ionisierende Strahlung angewiesen, was sie auch bei wiederholter Anwendung unbedenklich macht. Sie liefert hochauflösende Bilder von Weichgeweben wie Muskeln, Sehnen, Bänder und Knorpel sowie Knochenmark. Mit Hinblick auf Kristallarthropathien ist die MRT effektiv bei der Identifizierung früher und subtiler Veränderungen des periartikulären Weichteilgewebes, die mit diesen Erkrankungen einhergehen. Die Empfindlichkeit der MRT ermöglicht es, frühe entzündliche Veränderungen in Weichteilen und Synovialmembranen sowie Knochenmarködeme zu erkennen, lange bevor diese Veränderungen auf Röntgen- oder CT-Scans sichtbar werden. Diese Früherkennungsfähigkeit ist entscheidend für den Beginn einer Behandlung, bevor es zu erheblichen Gelenkschäden kommt. Mit der MRT können Ablagerungen von Kristallen wie Mononatriumurat und Calciumpyrophosphat sichtbar gemacht werden. Während die Kristalle selbst nicht immer sichtbar sind, sind die Entzündungen und Gewebeveränderungen, die sie hervorrufen, auf MRT-Scans deutlich erkennbar und teils fast pathognomonisch (12). Die MRT eignet sich hervorragend zur Beurteilung der Integrität von Gelenkstrukturen, einschliesslich Knorpelverlust, Knochenerosion und Synovialproliferation. Diese Merkmale sind entscheidend für die Beurteilung der Schwere der Erkrankung und die Überwachung des Fortschreitens oder des Ansprechens auf die Behandlung.
Demgegenüber stehen primär die hohen Kosten von MRT-Untersuchungen sowie die verhältnismässig reduzierte Verfügbarkeit von MRT-Geräten. Die Durchführung von MRT-Scans dauert ausserdem auch deutlich länger als andere Modalitäten und findet in einer engen langen Röhre im Liegen statt. Dies stellt insbesondere für Patienten, die Schmerzen oder Schwierigkeiten, ruhig zu bleiben, haben, ein Problem dar. Darüber hinaus ist die Anwendung bei bestimmten Patientengruppen, beispielsweise Trägern von Herzschrittmachern, aufgrund der starken Magnetfelder nur eingeschränkt möglich.
Bildgebung bei Kristallarthropathien
Gicht
Gicht ist die klinisch symptomatische Form einer längerfristigen Ablagerung von Uratkristallen (üblicherweise Mononatriumurat) in Gelenken und anderen Weichteilgeweben. Mit einer Prävalenz von etwa 1 bis 6 % mit vermehrter Häufigkeit in den westlichen Ländern sowie einzelnen Ethnien ozeanisch-pazifischer Herkunft stellt die Gicht die häufigste Form der entzündlichen Arthritis dar. Das aktuelle Stufenkonzept des Krankheitsverlaufs der Gicht versteht, dass Uratdeposition bereits vor der klinischen Manifestation einer Gicht inkl. typischen «Flares» und Tophus-Bildung stattfindet.
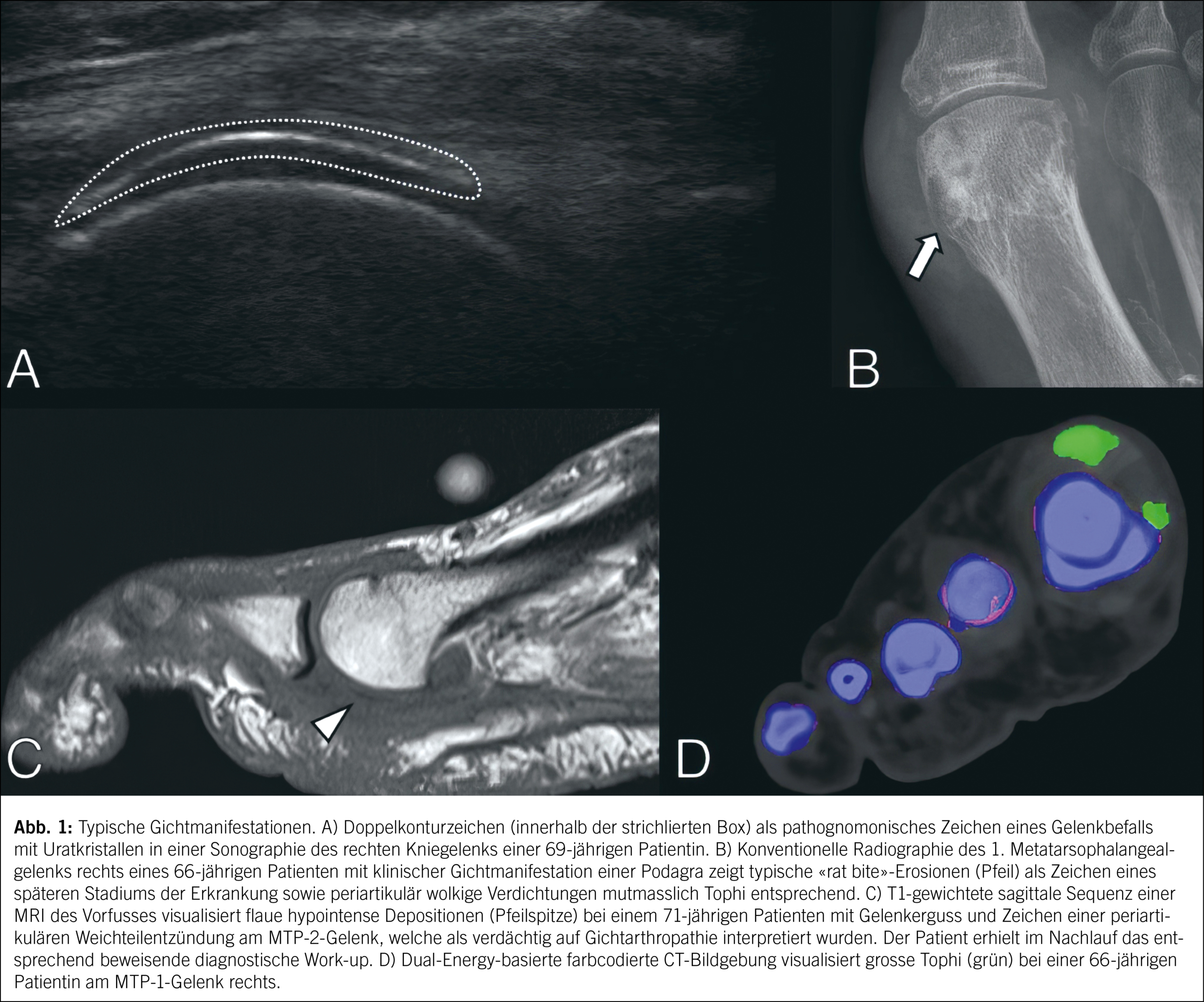
Daher und aufgrund des Fakts der häufigen Fehldiagnose oder verzögerten Diagnose einer Gicht respektive Hyperurikämie wird der Bildgebung seit knapp zwei Jahrzehnten eine immer wichtiger werdende Rolle in der Frühdiagnostik zugewiesen. Im Jahr 2016 erschienen mit einer EULAR- Richtlinie evidenzbasierte Empfehlungen für die Diagnose von Gicht, welche neben der Aspiration von Synovialflüssigkeit und klinischen Merkmalen auch bildgebenden Methoden zur Erkennung einen diagnostischen Stellenwert attestierten (13). Im Jahr 2018 sowie in den aktuellen Empfehlungen zur Verwendung von Bildgebung bei Kristallarthropathien wurden diese bildgebenden Kriterien weiter spezifiziert sowie neuere Methoden wie DECT explizit genannt (2, 13). Röntgenaufnahmen können in den frühen Stadien der Erkrankung unauffällig sein. Im fortgeschrittenen Stadium zeigen sich typische radiologische Zeichen wie gelenknahe Erosionen mit überhängenden Rändern, auch «rat bites» genannt. Diese Erosionen sind oft asymmetrisch und können von Weichteilschatten begleitet sein, die auf die Ablagerung von Tophi hinweisen. Tophi sind aggregierte Ablagerungen von Uratkristallen, die oft in den Weichteilen um die Gelenke herum sichtbar sind. Diese äussern sich meist durch wolkenartige Verdichtungen.
Der Ultraschall hingegen ist bereits sensitiv zur Detektion von Gicht in frühen Stadien. Ein charakteristisches Zeichen ist das sogenannte Doppelkonturzeichen, bei dem eine hyperechogene Linie auf der Gelenkknorpeloberfläche zu sehen ist, die durch die Ablagerung von Uratkristallen verursacht wird (14). Zudem können Ultraschalluntersuchungen Tophi als hyperechogene, inhomogene Strukturen darstellen, oft mit posteriorer Schallauslöschung.
Die MRT ist besonders nützlich zur Beurteilung von Gicht, wenn die Diagnose unklar ist. Typische Befunde bei Gicht umfassen synoviale Hypertrophie und Entzündungen, die durch Uratkristallablagerungen verursacht werden und bei der keine anderen kausalen Gründe identifiziert werden können. Tophi erscheinen in der MRT als Läsionen mit variabler Signalintensität, häufig mit einer hypointensen Kapsel und zentraler T1- und T2-gewichteten Hyperintensität. Die MRT ist auch nützlich, um Komplikationen wie Sehnenrisse und Knochenmarködeme zu beurteilen.
Die CT ist besonders wertvoll zur Darstellung der knöchernen Veränderungen und Tophi bei Gicht. Eine typische CT-Aufnahme zeigt hyperdense, gut abgrenzbare Tophi, die sowohl intraartikulär als auch extraartikulär auftreten können. Die DECT zeigt nach entsprechender Nachbearbeitung Uratkristalle in den charakteristischen farbcodierten Karten in Grün an (Abb. 1).
CPPD
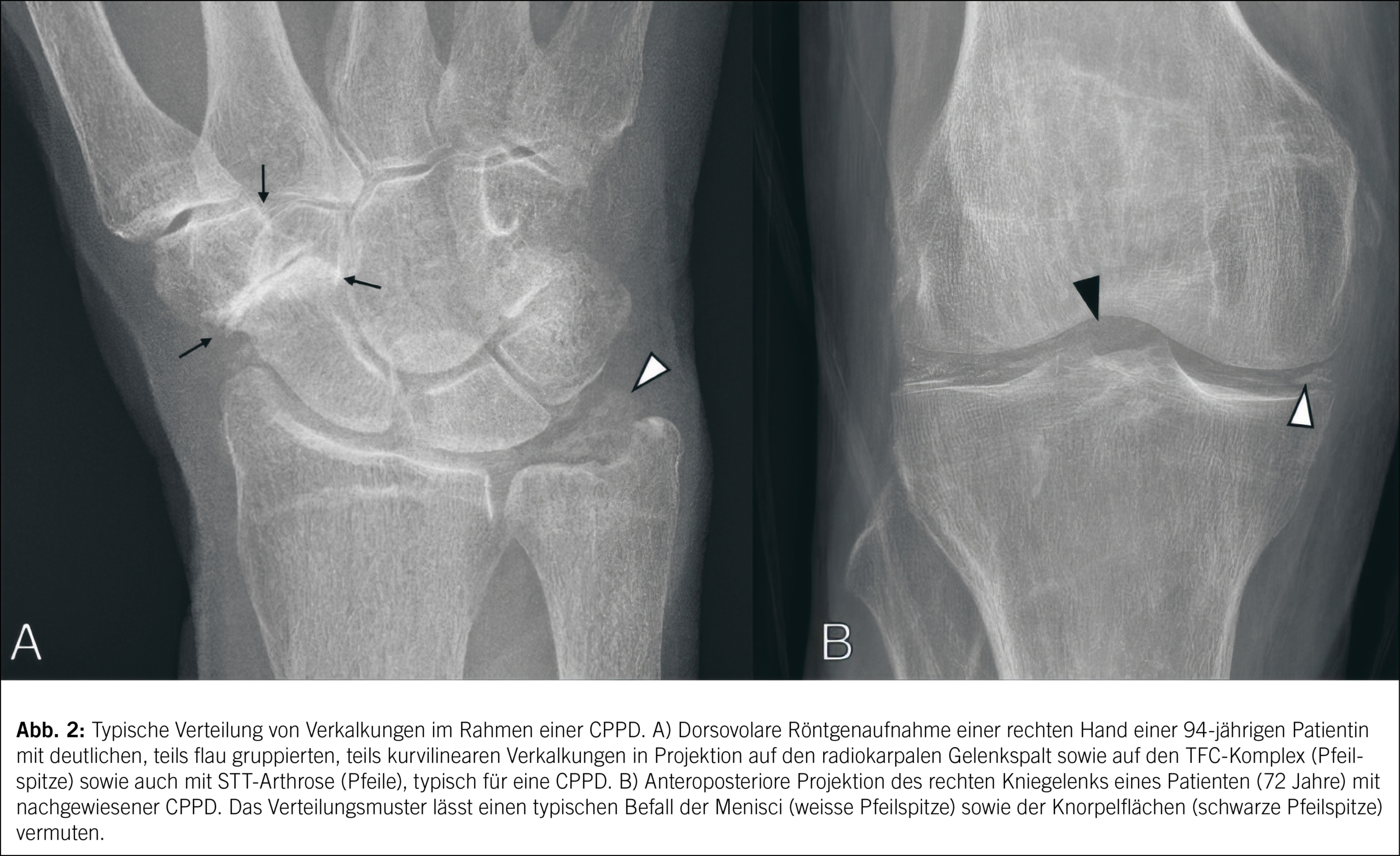
Die Diagnostik der Arthropathie durch Ablagerung von Kalziumpyrophosphat, der sogenannten Calcium Pyrophosphate Deposition Disease (CPPD), ist verhältnismässig noch komplexer im Vergleich zur Gicht. Dies führte unter anderem dazu, dass erst seit vergangenem Jahr eine evidenzbasierte Definition der Erkrankung existiert, welche von ACR und EULAR vertreten wird (15). Auch in der Diagnostik der CPPD spielen die bildgebenden Kriterien eine zunehmend grösser werdende Rolle, sodass in den aktuellen Empfehlungen bildgebende Merkmale einen existenziellen Anteil an Punkten des empfohlenen Scoring-Systems bilden. Darüber hinaus wird die CPPD als erwiesen interpretiert, wenn ein positives Resultat im Aspirat von Synovialflüssigkeit vorliegt oder pathognomonische klinische und bildgebende Befunde ohne Vorhandensein von Exklusionskriterien vorliegen (15). Konventionelle Röntgenaufnahmen sind oft die erste diagnostische Massnahme bei Verdacht auf CPPD.
Diese Aufnahmen können Verkalkungen im Knorpel (Chondrocalcinose) und gelegentlich auch in den Weichteilen sichtbar machen. Chondrocalcinose zeigt sich typischerweise als lineare Verkalkungen im hyalinen Knorpel und im fibrillären Knorpel der Menisci und Bandscheiben. Häufig sind Kniegelenke, Handgelenke und Symphyse betroffen. Als weiteres diagnostisches Zeichen sprechen Knorpelschäden und knöcherne Veränderungen wie subchondrale Zysten und Osteophyten, aber auch subchondrale Sklerosen und eine eher diffuse Verengung des Gelenkraums für eine CPPD. Erosionen, sofern vorhanden, sind im Gegensatz in der Regel weniger klar definiert (Abb. 2).
Im Ultraschall hingegen äussern sich als Pendant zu den konventionell radiologischen Verkalkungen echogene, lineare Strukturen im Knorpel, die oft parallel zur Oberfläche des Knorpels verlaufen. Das wichtigste Ultraschallmerkmal ist somit das Vorhandensein linearer oder punktförmiger echoreicher Signale im hyalinen Knorpel und Faserknorpel, bekannt als «Ultraschall-Chondrocalcinose». Die Sonographie kann auch kristallinduzierte Synovitiden und Bursitiden aufdecken. Die primäre Rolle der Computertomographie besteht in der Darstellung von Verkalkungen bei sekundär arthrotischen Gelenken, für welche ein chirurgischer Gelenkersatz geplant ist. Hinzu ist auch bei der CPPD die DECT hilfreich, um das Vorhandensein anderer Kristalle wie Harnsäurekristalle zu differenzieren. Ein typisches MRT-Merkmal bei CPPD ist eine niedrige bis mittlere Signalintensität von Verkalkungen in T1- und T2-gewichteten Sequenzen. Die MRT hilft insbesondere bei der Beurteilung von CPPD im Zusammenhang mit Knorpelschäden und anderen differenzialdiagnostischen intraartikulären Pathologien.
BCPD
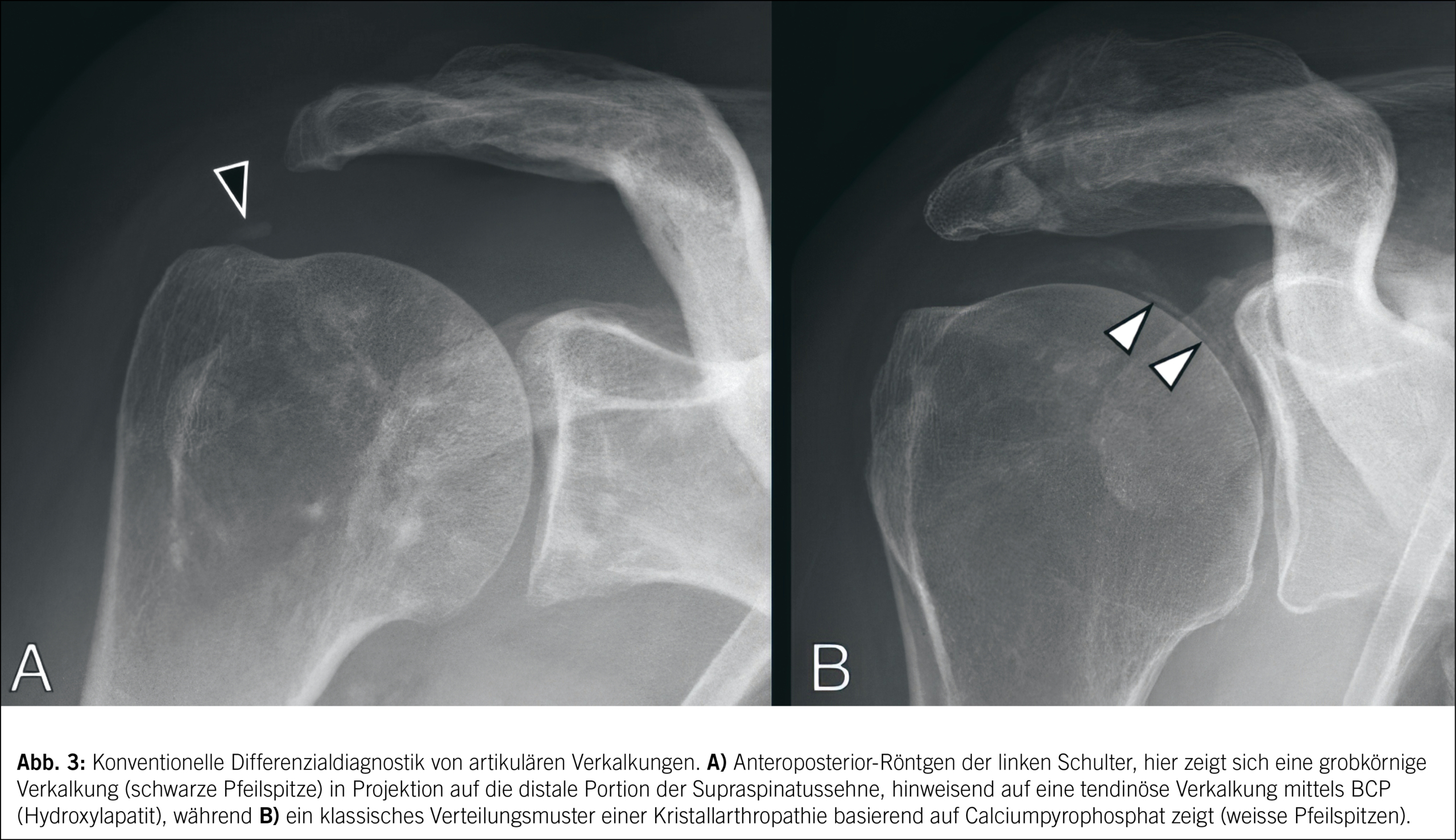
Bei der Deposition von Basiskalziumphosphaten (BCP), wie z. B. Calciumhydroxyapatit, handelt es sich um eine weitere spezifische Form von Kristallarthropathien. Die BCPD wird erstmals meist mittels Röntgen diagnostiziert, wobei Verkalkungen in den Weichteilen, insbesondere um die Gelenke, sichtbar gemacht machen. Ein besonders häufiger Befund sind dichte, amorphe Verkalkungen um Sehnen und Bänder. Bei der Tendinitis calcarea, einer häufigen Manifestation der BCPD, manifestieren sich Depositionen am häufigsten im Bereich der distalen Supraspinatussehne. Der Ultraschall bietet eine hohe Sensitivität bei der Detektion von BCPD-Verkalkungen. Diese zeichnen sich durch echogene, dichte Strukturen mit posteriorer Schallauslöschung aus (Abb. 3). Diese Methode ist besonders nützlich für die Beurteilung der Schulter, wo die BCPD am häufigsten in der Rotatorenmanschette auftritt. In der MRT können BCP-Verkalkungen indirekt durch Signalintensitätsveränderungen und umgebende Entzündungsreaktionen identifiziert werden. Hierbei ist eine niedrige Signalintensität der Verkalkungen in T1- und T2-gewichteten Sequenzen typisch. Dies ist besonders hilfreich bei der Beurteilung von BCPD im Zusammenhang mit Sehnenschäden und Enthesiopathien.
Die Computertomographie beurteilt hinsichtlich BCPD im Wesentlichen makroskopische Verkalkungen. In der Regel wird die CT jedoch hauptsächlich nur verwendet, wenn Röntgenaufnahmen unspezifisch sind oder wenn eine detailliertere Beurteilung von Verkalkungen erforderlich ist. Analog zum Prinzip bei zuvor genannten Kristalldepositionen kann die DECT auch im Fall der BCPD spezifisch angewandt werden, um diese z. B. von Harnsäurekristallen zu differenzieren. Ein essenzielles diagnostisches Zeichen der BCPD ist das Fehlen von Knochenerosionen, was BCPD von anderen kristallinen Arthropathien wie der Gicht unterscheidet.
EULAR-Empfehlungen zur Verwendung von Bildgebung bei Kristallarthropathien
In den aktuellen Empfehlungen der EULAR konnte man sich auf grundlegende Prinzipien und Empfehlungen für die Verwendung von Bildgebung bei den jeweiligen Formen von Kristallarthropathien sowie zur generellen Anwendung von bildgebender Diagnostik festlegen. Die Bildgebung bei Kristallarthropathien gilt als komplex und anspruchsvoll. Während Bildgebung die Möglichkeit bietet, unabhängig von klinischer Symptomatik Aussagen über das Ausmass an Kristalldeposition, den Entzündungsgrad sowie die strukturellen ossären und Weichteilschäden zu machen, zeigt sie auch Abnormalitäten, die möglicherweise nicht in Zusammenhang mit der klinisch symptomatischen Manifestation einer Kristallarthropathie stehen oder damit korrelieren. Daher sollten stets anamnestisch-klinische als auch laborchemische und (histo-)pathologische Befunde bei der radiologischen Diagnostik bereitstehen respektive in der Bildbefundung berücksichtigt werden. Aufgrund der Komplexität der Diagnostik ist ausserdem empfohlen, Bildgebung bei entsprechend ausgebildeten und erfahrenen Experten durchzuführen. Darüber hinaus sollten beim klinischen Verdacht einer Kristallarthropathie neben symptomatischen Regionen bzw. Gelenken auch krankheitstypische Lokalisationen untersucht werden wie Metatarsophalangealgelenke (Gicht), Knie- und Handgelenke (CPPD) sowie Schultern (BCPD).
Die Bildgebung von Gicht wird nunmehr mittels Ultraschall und DECT empfohlen, jedoch nicht mittels konventioneller Röntgenbildgebung. Neu besteht die Empfehlung, dass typische bildgebende pathognomonische Zeichen wie die «Doppelkontur» oder eindeutige Tophi im Ultraschall bzw. die positive Farbcodierung (grüne Spots) urathaltiger Weichteilformationen in verifizierten DECT-Analysetools als beweisend angenommen werden können und somit eine weitere Abklärung mittels Aspiration von Synovialflüssigkeit überflüssig wird. Hinsichtlich des Krankheitsmonitorings sind ebenfalls Ultraschall und DECT empfohlen. Im Fall von Verlaufsbildgebung könnten zusätzlich die Ausmessung von farbcodierten Ablagerungen in der DECT respektive die Volumetrie von Tophi im Ultraschall zukünftig für die Evaluierung und Vorhersage klinischer Flares relevant werden. Bei Nichtverfügbarkeit beider radiologischer Methoden ist ein Monitoring mittels konventionellen Röntgens möglich, um zumindest strukturelle ossäre Veränderungen zu detektieren.
Unabhängig von der Empfehlung zum Monitoring bleibt die Wahl des Intervalls der bildgebenden Verlaufskontrollen variabel, da der mannigfaltige klinische Verlauf bei diesen Erkrankungen keine Aussage zulässt über vernünftige Intervallzeiträume. Diese sollen daher in Abhängigkeit der klinischen Dynamik gewählt werden. Hinsichtlich Aspirationsdiagnostik von Synovialflüssigkeit wird ausserdem empfohlen, US-gezielt zu punktieren, sofern die übliche Technik und Wahl der Punktionsstelle anhand anatomischer Merkpunkte frustran verläuft oder aufgrund diverser Umstände erschwert erscheint.
Zusammenfassung
Kristallarthropathien werden zunehmend durch die Verwendung von Bildgebung diagnostiziert sowie deren Verlauf unter Therapie kontrolliert. Neuartige bildgebende sowie pathologische und labordiagnostische Methoden resultierten in einem neuen Verständnis von Kristalldeposition in Gelenken. Insbesondere die immer häufiger bewiesene Koexistenz mehrerer Kristallsorten innerhalb eines Gelenks oder einer Person führt dazu, dass sich in den diagnostischen und therapeutischen Guidelines ein langsamer Paradigmenwechsel hin zu vermehrter non-invasiver Diagnostik abzeichnet. Damit werden die Diagnostik und Behandlung aber auch deutlich komplexer, was eine regelmässige Auseinandersetzung mit aktuellen Empfehlungen verlangt. Durch moderne diagnostische Methoden, wie z. B. PCD-CT im radiologischen Bereich, oder Raman-Spektroskopie im labormedizinischen Bereich, werden Gelenkbeteiligungen systemischer Erkrankungen immer früher erkannt werden, wodurch eine frühe Erkennung, noch vor einer klinischen Symptomatik, möglich wird. Fortschrittliche CT-Technologien wie DECT-CT und PCD-CT haben die Diagnoselandschaft für Kristallarthropathien erheblich verbessert. Durch die Bereitstellung detaillierter und differenzierter Bildgebungsfunktionen verbessern diese Technologien nicht nur die diagnostische Genauigkeit, sondern tragen auch zu effektiveren und gezielteren Behandlungsstrategien bei. Da sich diese Technologien weiterentwickeln und immer zugänglicher werden, wird erwartet, dass ihr Einfluss auf die Behandlung von Kristallarthropathien zunehmen wird.
Institut für Diagnostische und Interventionelle Radiologie,
Universitätsspital Zürich
florian.huber@usz.ch
Institut für Diagnostische und Interventionelle Radiologie
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
jonas.getzmann@usz.ch
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Calthrop GT. X-ray diagnosis of gout. Rheumatism. 1946;3(3):43–49.
2. Mandl P, D’Agostino MA, Navarro-Compán V, et al. 2023 EULAR recommendations on imaging in diagnosis and management of crystal-induced arthropathies in clinical practice. Ann Rheum Dis. 2024;83(6):752–759. doi: 10.1136/ard-2023-224771.
3. Richette P, Doherty M, Pascual E, et al. 2018 updated European League Against Rheumatism evidence-based recommendations for the diagnosis of gout. Ann Rheum Dis. 2019. doi: 10.1136/annrheumdis-2019-215315.
4. Uffmann M, Schaefer-Prokop C. Digital radiography: the balance between image quality and required radiation dose. Eur J Radiol. 2009;72(2):202–208. doi: 10.1016/j.ejrad.2009.05.060.
5. Taljanovic MS, Melville DM, Gimber LH, et al. High-Resolution US of Rheumatologic Diseases. Radiographics. 2015;35(7):2026–2048. doi: 10.1148/rg.2015140250.
6. Chávez-López MA, Hernández-Díaz C, Moya C, et al. Inter- and intra-observer agreement of high-resolution ultrasonography and power Doppler in assessment of joint inflammation and bone erosions in patients with rheumatoid arthritis. Rheumatol Int. 2013;33(1):173–177. doi: 10.1007/s00296-011-2297-9.
7. Døhn UM, Ejbjerg BJ, Hasselquist M, et al. Rheumatoid arthritis bone erosion volumes on CT and MRI: reliability and correlations with erosion scores on CT, MRI and radiography. Ann Rheum Dis. 2007;66(10):1388–1392. doi: 10.1136/ard.2007.072520.
8. Omoumi P, Verdun FR, Guggenberger R, Andreisek G, Becce F. Dual-Energy CT: Basic Principles, Technical Approaches, and Applications in Musculoskeletal Imaging (Part 2). Semin Musculoskelet Radiol. 2015. p. 438–445. doi: 10.1055/s-0035-1569252.
9. Omoumi P, Becce F, Racine D, Ott JG, Andreisek G, Verdun FR. Dual-Energy CT: Basic Principles, Technical Approaches, and Applications in Musculoskeletal Imaging (Part 1). Semin Musculoskelet Radiol. 2015. p. 431–437. doi: 10.1055/s-0035-1569253.
10. Rajendran K, Petersilka M, Henning A, et al. First Clinical Photon-counting Detector CT System: Technical Evaluation. Radiology. 2022;303(1):130–138. doi: 10.1148/radiol.212579.
11. Huber FA, Becce F, Gkoumas S, et al. Differentiation of Crystals Associated With Arthropathies by Spectral Photon-Counting Radiography: A Proof-of-Concept Study. Invest Radiol. 2020. doi: 10.1097/RLI.0000000000000717.
12. Parathithasan N, Lee W-K, Pianta M, Oon S, Perera W. Gouty arthropathy: Review of clinico-pathologic and imaging features. J Med Imaging Radiat Oncol. 2016;60(1):9–20. doi: 10.1111/1754-9485.12356.
13. Richette P, Doherty M, Pascual E, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis. 2017;76(1):29–42. doi: 10.1136/annrheumdis-2016-209707.
14. Yuan H, Fan Y, Mou X, et al. Musculoskeletal Ultrasound in Monitoring the Efficacy of Gout: A Prospective Study Based on Tophus and Double Contour Sign. Balkan Med J. 2023;40(2):104–110. doi: 10.4274/balkanmedj.galenos.2022.2022-7-39.
15. Abhishek A, Tedeschi SK, Pascart T, et al. The 2023 ACR/EULAR Classification Criteria for Calcium Pyrophosphate Deposition Disease. Arthritis Rheumatol. 2023;75(10):1703–1713. doi: 10.1002/art.42619.
Therapeutische Umschau
- Vol. 81
- Ausgabe 5
- September 2024