- Calcium Pyrophosphate Deposition (CPPD) Disease – mehr als nur «Pseudogicht»
Einleitung
Die Ablagerung von Calciumpyrophosphatkristallen in hyalinen oder Faserknorpel wird als Chondrocalcinose bezeichnet. Es ist weitgehender Konsens, dass eine Chondrocalcinose asymptomatisch ist und keinen Krankheitswert aufweist. Sie bildet aber die Vorstufe zur sogenannten Calcium Pyrophosphate Deposition (CPPD) Disease. Diese umfasst im Wesentlichen drei Entitäten: erstens die akute Calciumpyrophosphat (CPP)-Arthritis («Pseudogicht»), zweitens die chronische CPP-Arthritis («Pseudo-RA») und drittens die Arthrose mit Calciumpyrophosphatablagerungen (1).
Die Prävalenz der Chondrocalcinose wird bis auf 7 % geschätzt (2) und steigt im Alter über 60 Jahre mit jeder Dekade an. In einer Studie unter 191 CPPD-Patientinnen und -Patienten zeigten 59.5 % Zeichen eines Crowned-Dens- Syndroms, wobei das mediane Alter bei 78.5 Jahren lag (3). Es zeigte sich auch, dass die Mehrzahl vor Durchführung der Studie nicht bekannt war, was vermuten lässt, dass das Ausmass des spinalen CPPD-Befalls eher unterschätzt wird. Die Chondrocalcinose kann mit bildgebenden Verfahren wie Röntgen (bis 60 %), Ultraschall (bis 88 %) und CT bzw. Dual-Energy-CT (DECT, bis 100 %) mit zunehmend hoher Sensitivität nachgewiesen werden; die Spezifizität war in diesen Studien meist über 90 % (1). Trotzdem können mit den bildgebenden Verfahren weiterhin Calciumpyrophosphatkristalle nicht definitiv von Hydroxylapatitkristallen oder anderen calciumhaltigen Kristallen unterschieden werden; es gibt Hinweise, dass dies mittels DECT oder Multi-engergy spectral photon-counting-CT möglich sein könnte (4).
Pathophysiologie
Im Gegensatz zur Chondrocalcinose hat die CPP-Arthritis (akut oder chronisch) einen sehr hohen Krankheitswert. Die absolute Prävalenz der CPP-Arthritis ist aktuell unklar, im rheumatologischen Alltag stellt sie jedoch ein häufiges Problem dar.
Es bleibt unklar, welche Mechanismen letztlich dazu führen, dass intracartilaginäre CPP-Kristalle in den Gelenkraum gelangen und dort dann zur Entzündung führen. Infrage kommen neben funktionell wirksamer Mutationen des ANKH- und ENPP1-Gens (involviert im cartilaginären Phosphatmetabolismus) auch genetische (Hypophosphatasie) oder metabolische (Hypomagnesiämie, Hyperferritinämie) Gründe einer Aktivitätsminderung der alkalischen Phosphatase (5). Ein Hyperparathyreodismus stellt ebenfalls einen Risikofaktor dar. Letztlich kommt es zu einem verminderten Abbau von Calciumpyrophosphat zu Phosphat, gefolgt von einer Kristallisation von CPP-Kristallen im Gelenk. Der frustrane Versuch von Neutrophilen und Makrophagen, diese Kristalle zu phagozytieren und zu lysieren, führt zu einer Aktivierung des NLRP3-Inflammasoms (5).
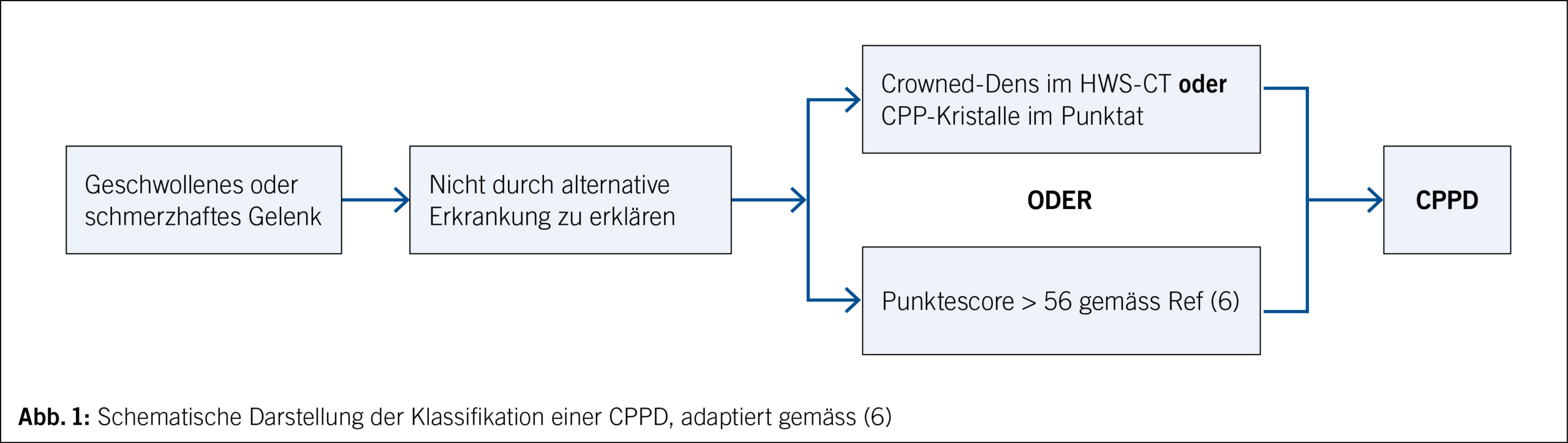
In der Akutphase führt dies zur Ausschüttung proinflammatorischer Zytokine wie IL-1-Beta und IL-18 sowie in der Folge zur IL-6-Stimulation und bisweilen stark erhöhten CRP-Werten. Lange wurden für die Diagnose einer CPPD die McCarty-Kriterien aus den 60er-Jahren verwendet, welche jedoch nie klinisch validiert wurden. Sie bestehen aus einer Trias aus Chondrocalcinose (z. B. Menisci des Kniegelenks), klinische Synovitis und Nachweis von positiv doppelbrechenden CPP-Kristallen. Da sich häufig keine Punktion des betroffenen Gelenks durchführen lässt (z. B. beim Crowned-Dens-Syndrom), sind diese Diagnosekriterien jedoch wenig praktikabel. Insbesondere eignen sie sich nicht als Klassifikationskriterien zur Durchführung von klinischen Studien. Vor diesem Hintergrund wurden im 2023 die ACR/EULAR-Klassifikationskriterien etabliert (6), welche sich aus vier klinischen, einem laborchemischen sowie drei radiologischen Domänen zusammensetzen. Hiermit kann, mittels Erreichen eines Punktescores, eine Erkrankung mit hinreichender Sicherheit als CPPD klassifiziert werden. Obwohl sich die Klassifikation als CPPD hiermit grösstenteils auf radiologische Kriterien stützen lässt, ist es wichtig, das Eintrittskriterium eines schmerzhaften bzw. geschwollenen Gelenks zu beachten (Abb. 1).
Klinische Bedeutung der CPP-Arthritis
Ähnlich wie bei der Gichtarthritis ist auch die CPP-Arthritis durch plötzliches Auftreten («wie angeworfen») im betroffenen Gelenk gekennzeichnet. Die Präsentation reicht von einer Monarthritis (Knie > Handgelenk) über polymyalgiforme Symptome bis zu einem Crowned-Dens- Syndrom. Der axiale Befall wird einigen Studien zufolge bis auf 24.3 % geschätzt (7) und sollte bei älteren Patienten als Differenzialdiagnose einer axialen Spondylarthritis gesehen werden. Gerade in hohem Alter finden sich im Akutstadium bisweilen CRP-Werte um 300 mg/l in Assoziation mit einer Minderung des Allgemeinzustands, Fieber und Delirium. Aufgrund dieser breiten und bisweilen dramatischen klinischen Präsentation sind die primären Differenzialdiagnosen beträchtlich (z. B. septische Arthritis, Riesenzellarteriitis, Meningitis).
Ein weiterer interessanter Aspekt ist die chronische CPP-Arthritis als «confounding factor» einer Rheumatoiden Arthritis (RA), da sowohl die radiocarpalen Gelenke, MCP-Gelenke, aber auch Flexoren- und Strecksehnen betroffen sein können. Anders als bei der RA findet sich jedoch meist kein schubförmiger, sondern eher ein chronischer Verlauf. In diesem Zusammenhang fällt auf, dass in einer neueren Studie bei 32.3 % der als seronegative RA-klassifizierten Patienten eine Chondrocalcinose bestand, während dies nur bei rund der Hälfte der seropositiven RA-Patienten der Fall war (8). Auch in der Studie von Codes-Mendez et al. erfüllten 18.9 % aller seronegativen RA-Patientinnen und -Patienten die 2023 ACR/EULAR-Kriterien für eine CPPD (9). Diese waren bei Symptombeginn mit 69.5 Jahren signifikant älter als die Vergleichsgruppe.
Dieser Aspekt scheint also sowohl numerisch als auch klinisch hoch relevant. Eine chronische CPP-Arthritis bzw. ein overlap zwichen RA und CPPD mit selbiger vermag das fehlende Ansprechen auf DMARD-Therapien und entsprechend häufige Therapiewechsel erklären. Bei RA-Patientinnen und -Patienten im höheren Alter und primärem Nichtansprechen auf DMARD mit verschiedenen «mode of action» sollte eine CPP-Arthritis also stets eine differenzialdiagnostische Überlegung sein und eine Punktion (zum Nachweis oder Ausschluss von CPP-Kristallen) angestrebt werden. Weitere und grössere Studien sind nötig, um das Ausmass und die Differenzierungsfaktoren dieses Problems bei Patientinnen und Patienten mit seronegativer RA noch besser zu erfassen.
Bedeutung jenseits der Arthritis
Darüber hinaus gab es in den letzten Jahren zahlreiche Veröffentlichungen, die auf eine erhöhte, nicht fatale kardiovaskuläre Morbidität bei einer durchgemachten CPP-Arthritis hinweisen (10, 11). Konkret wiesen Patientinnen und Patienten mit mindestens einer CPP-Arthritis-Attacke in einer Follow-up-Untersuchung über 10 Jahre ein deutlich erhöhtes kardiovaskuläres Risiko auf (11). Die Kontrollgruppe (3810 Patienten) zeigte zwar teilweise Hinweise für eine Chondrocalcinose, hatte aber keine dokumentierte CPP-Arthritis. Auch nach Adjustierung für klassische kardiovaskuläre Risikofaktoren war das Risiko in der CPP-Arthritis-Gruppe für MACE (major adverse cardiovascular events) innerhalb der ersten zwei Jahre nach einer CPP-Arthritis um 32 % erhöht. Nicht fatale kardiovaskuläre Ereignisse traten sogar bis zu 10 Jahren nach einer CPP-Arthritis mehr als doppelt so häufig auf.
Eine weitere Studie konnte zeigen, dass Patienten mit einer CPP-Arthritis ein deutlich erhöhtes Risiko für eine progrediente Arthrose und Totalendoprothesen in Knie und Hüftgelenk haben (12). Die reine Präsenz einer Chondrocalcinose hatte hingegen keinen signifikanten Einfluss auf die Progression einer Knie- oder Hüftarthrose (13) oder der Dauerhaftigkeit von Kniegelenkprothesen (14). Interessanterweise hatten dokumentierte CPP-Arthritis-Attacken langfristig auch anderweitige Auswirkungen auf die Knochengesundheit. Tedeschi et al. zeigte vor Kurzem, dass Patientinnen und Patienten mit mindestens einer Episode einer CPP-Arthritis auch über 15 Jahre ein deutlich gesteigertes Osteoporoserisiko haben verglichen mit Patientinnen und Patienten ohne CPP-Arthritis (15).
Therapie
Aus den oben genannten Beobachtungen lässt sich ableiten, dass die CPP-Arthritis nicht nur eine immobilisierende und mit hohem Leidensdruck verbundene Arthritis form darstellt, sondern – ähnlich wie die Gicht und andere rheumatologisch-entzündliche Erkrankungen – zunehmend als Systemerkrankung mit weitreichenden Folgen für das kardiovaskuläre Risiko und den Knochenmetabolismus gesehen werden muss. Konsequenterweise sollte sich eine Therapie entsprechend nicht nur auf die Behandlung der CPP-Arthritis beschränken, sondern auch die optimale Einstellung kardiovaskulärer Risikofaktoren sowie einer allfällig gesteigerten Knochenresorption beinhalten. Im Gegensatz zur klassischen Gicht existiert für die CPP-Arthritis/Pseudogicht jedoch keine ursächliche oder gar kurative Therapie, weswegen im Folgenden nur auf symptomatische Therapieansätze eingegangen werden kann.
Therapie der akuten CPP-Arthritis
Die Therapie einer akuten CPP-Arthritis unterscheidet sich nicht von der einer akuten Gichtarthritis. Infrage kommen in erster Linie eine intraartikuläre Glukokortikoidinfiltration (mit gleichzeitiger Möglichkeit einer ausgeweiteten Diagnostik sowie Entlastung des betroffenen Gelenks), systemische Glukokortikoide, NSAR, Colchicin sowie andere IL-1-Beta-antagonisierende Therapien (16).
Colchicin stellt einen starken Entzündungshemmer dar, der auch eine regulierende Funktion auf das NLPR-3-Inflammasom und die Ausschüttung von IL-1-Beta und IL-18 hat. Ausserdem werden durch Hemmung der Mitose die Teilungsraten infiltrierender Neutrophiler stark reduziert. Colchicin kann, wie bei der akuten Gichtattacke, zunächst in der Dosis von 1 mg, gefolgt von 0.5 mg 1 Stunde später sowie im Anschluss 0.5 mg 2 x täglich bis zur Regredienz der Symptomatik gegeben werden. In einer neuen Studie konnte gezeigt werden, dass Colchicin in der Akutbehandlung vergleichbar effektiv zu Prednison ist (17).
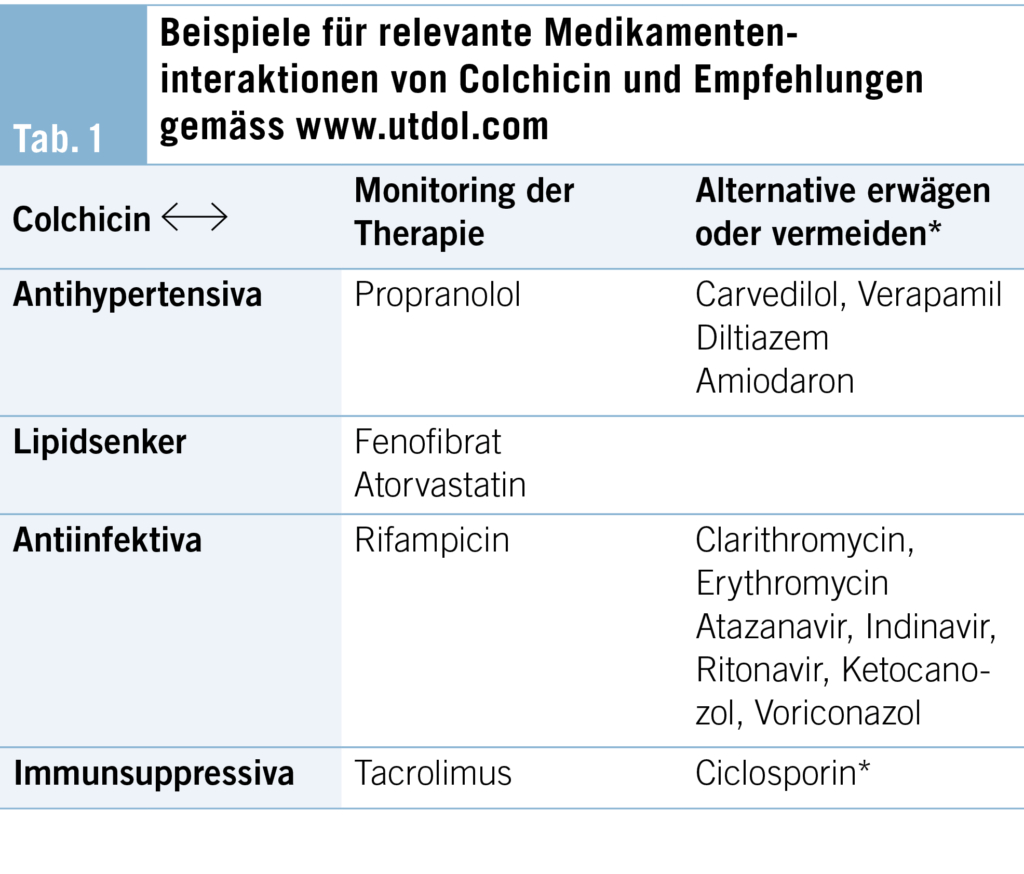
Es ist angeraten, vor der Verschreibung einen Interaktionscheck mit anderen Medikamenten durchzuführen, da es insbesondere bei Medikamenten, welche durch Cytochrom P3A4 (z. B. Clarithromycin, Ketoconazol, Ritonavir) oder P-Glycoprotein (z. B. Ciclosporin) metabolisiert werden, zu schwerwiegenden Nebenwirkungen kommen kann. Mögliche Interaktionen sind in Tab. 1 aufgeführt.
Bei Unverträglichkeiten (in der Regel Nausea oder Diarrhö), welche insbesondere bei Niereninsuffizienz vorkommen, sollte auf 0.5 mg täglich oder 2-täglich gewechselt werden. Im Verlauf sind Nebenwirkungen wie Rhabdomyolyse, Neurotoxizität und Myelotoxizität zu beachten. Hervorzuheben ist, dass für Colchicin, unabhängig von Kristallarthropathien, zahlreiche kardiovaskulär protektive Effekte beschrieben sind (siehe COLCOT-Studien) (18, 19). Aber auch bei Gicht gibt es mehrere Studien (20, 21), die in die gleiche Richtung deuten, weswegen im Analogieschluss ein kardioprotektiver Effekt bei Colchicin bei der Behandlung der CPP-Arthritis angenommen werden kann.
NSAR können bei fehlender Kontraindikation (z. B. Niereninsuffizienz, kardiovaskuläre Erkrankungen) ausdosiert ebenfalls zur Symptomminderung beitragen. Infrage kommt z. B. Naproxen 500 mg 12-stündlich oder in der Kombination mit Esomeprazol 500/20 mg 12-stündlich.
Systemische Glukokortikoide sollten jeweils im Kontext mit Komorbiditäten (z. B. Osteoporose, Glaukom, psychotische Erkrankungen, Diabetes mellitus etc.) evaluiert werden. Eine Dosierung von 0.5 mg/kg in der Akutphase mit schnellem Ausschleichen scheint hier vertretbar. Bei einer Monarthritis ist die intraartikuläre Glukokortikoidinfiltration häufig vorzuziehen.
Der IL-1-Antagonist Anakinra hat in der Praxis häufig einen schnellen Effekt und nur wenig Nebenwirkungen. In einer Schweizer Studie war der Effekt von Anakinra während einer akuten CPP-Arthritis dem von systemischen Glukokortikoiden nicht unterlegen (16). Allerdings ist das Medikament in dieser Indikation in der Schweiz nicht zugelassen und daher meist nur im stationären Setting oder nach vorhergehender Kostengutsprache zu verordnen.
Therapie der chronischen CPP-Arthritis
Die Therapie der chronischen CPP-Arthritis gestaltet sich häufig schwierig, insbesondere wenn sie sich phänotypisch wie eine Rheumatoide Arthritis (RA) darstellt und von einer seronegativen LORA (Late Onset RA) nicht zuverlässig unterschieden werden kann bzw. in Kombination mit einer RA vorkommt.
Colchicin wird weithin als Therapie der ersten Wahl verwendet und ist hinsichtlich der wahrscheinlichen kardioprotektiven Effekte und der niedrigen Kosten auch über den rein antiinflammatorischen Effekt hinaus empfehlenswert. Bisweilen ist auch eine Kombination mit niedrig dosiertem Prednison effektiv und mit weniger Nebenwirkungen vergesellschaftet, wenn auch hinsichtlich Osteoporose etc. nicht wünschenswert. Weitere Therapiekonzepte zeichnen sich allesamt dadurch aus, dass ihre Wirksamkeit nur in sehr kleinen und meist alten (1981–2002) Fallserien mit < 40 Teilnehmern untersucht wurden und daher nur fraglich als valid angesehen werden kann. Hierzu gehören Magnesiumsubstitution (auch bei normomagnesiämen Patienten) (24), Plaquenil (25) und Radiosynoviorthese (26). Methotrexat wird anekdotisch häufig als wirksam erachtet, eine kleine kontrollierte Studie von Finckh et al. von 2014 zeigte jedoch keinen Effekt in einem Crossover Setting (27).
In refraktären Fällen bzw. bei Kontraindikationen für die o. g. Therapien kommt auch eine dauerhafte oder bedarfsweise Gabe mit Anakinra infrage (23). Da die tägliche Gabe häufig mühsam und mit Lokalreaktionen und Immunogenizität vergesellschaftet ist, kann eine IL-1-Beta-Antagonisierung (nach vorgängiger Kostengutsprache) mit Canakinumab erwogen werden.
Ausblick
Die neuen ACR/EULAR-Kriterien für eine CPPD werden sicherlich die Anzahl klinischer Studien und damit die Hoffnung auf neue wirksame Therapien erhöhen. Es gibt bereits erste Ansätze neuartiger «targeted therapies». In einer Fallserie von 11 Patienten mit therapierefraktärer CPP-Arthritis konnte gezeigt werden, dass Tocilizumab 4 mg/kg – 8 mg/kg alle 4 Wochen (22) zu einer deutlichen Reduktion oder dem kompletten Ausschleichen einer dauerhaften Prednisontherapie geführt hat (28). Eine Erweiterung dieser Studie bei insgesamt 31 Patientinnen und Patienten zeigte ein gutes Ansprechen bei 23, wohingegen nur 2 nicht ansprachen (unpublizierte Daten). Aktuell ist eine randomisierte klinische Studie mit Tocilizumab gegen Placebo geplant.
Eine aktuelle Studie beschreibt das aktuelle Verschreibungsverhalten, die Sicherheit und die Therapietreue bei chronischer CPP-Arthritis in Europa. Überraschenderweise zeigen sich hierbei die Retentionsraten für Methotrexat und Tocilizumab höher als jene für Anakinra (29). Es bleibt hierbei anzumerken, dass häufig Kombinationstherapien eingesetzt wurden und nicht explizit beschrieben ist, wie viele Patienten auch für eine (überlappende) seronegative RA klassifizieren würden.
Ein weiterer neuartiger Ansatz könnten spezifische NLRP3-Inhibitoren wie Dapansutril sein, welche sich aktuell bereits in klinischen Studien zur Behandlung von Gichtarthritiden befinden (30). Da auch bei der CPP-Arthritis eine starke Induktion des NLRP3-Inflammasoms stattfindet, wäre diese Therapie im Analogieschluss zu Gicht zumindest wert, weiter evaluiert zu werden.
Universitätsklinik für Rheumatologie und Immunologie
Freiburgstrasse, Anna-Seiler Haus, Stock J
3010 Bern
tobias.manigold@insel.ch
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Cai K, Tedeschi SK. Review: Outcome measures in calcium pyrophosphate deposition. Best Pract Res Clin Rheumatol. Dezember 2021;35(4):101724.
2. Neame RL, Carr AJ, Muir K, Doherty M. UK community prevalence of knee chondrocalcinosis: evidence that correlation with osteoarthritis is through a shared association with osteophyte. Ann Rheum Dis. Juni 2003;62(6):513–8.
3. Haikal A, Everist BM, Jetanalin P, Maz M. Cervical CT-Dependent Diagnosis of Crowned Dens Syndrome in Calcium Pyrophosphate Dihydrate Crystal Deposition Disease. Am J Med. Februar 2020;133(2):e32–7.
4. Stamp LK, Anderson NG, Becce F, Rajeswari M, Polson M, Guyen O, u. a. Clinical Utility of Multi-Energy Spectral Photon-Counting Computed Tomography in Crystal Arthritis. Arthritis Rheumatol. Juli 2019;71(7):1158–62.
5. Rosenthal AK, Ryan LM. Calcium Pyrophosphate Deposition Disease. N Engl J Med. 30. Juni 2016;374(26):2575–84.
6. Abhishek A, Tedeschi SK, Pascart T, Latourte A, Dalbeth N, Neogi T, u. a. The 2023 ACR/EULAR Classification Criteria for Calcium Pyrophosphate Deposition Disease. Arthritis Rheumatol. Oktober 2023;75(10):1703–13.
7. Moshrif A, Laredo JD, Bassiouni H, Abdelkareem M, Richette P, Rigon MR, u. a. Spinal involvement with calcium pyrophosphate deposition disease in an academic rheumatology center: A series of 37 patients. Semin Arthritis Rheum. Juni 2019;48(6):1113–26.
8. Krekeler M, Baraliakos X, Tsiami S, Braun J. High prevalence of chondrocalcinosis and frequent comorbidity with calcium pyrophosphate deposition disease in patients with seronegative rheumatoid arthritis. RMD Open. Juni 2022;8(2):e002383.
9. Codes-Méndez H, Sainz L, Park HS, Corominas H, Diaz-Torne C. Application of the 2023 ACR/EULAR classification criteria for calcium pyrophosphate deposition disease in a seronegative rheumatoid arthritis cohort. RMD Open. 15. April 2024;10(2):e004173.
10. Bashir M, Sherman KA, Solomon DH, Rosenthal A, Tedeschi SK. Cardiovascular Disease Risk in Calcium Pyrophosphate Deposition Disease: A Nationwide Study of Veterans. Arthritis Care Res (Hoboken). Februar 2023;75(2):277–82.
11. Tedeschi SK, Huang W, Yoshida K, Solomon DH. Risk of cardiovascular events in patients having had acute calcium pyrophosphate crystal arthritis. Ann Rheum Dis. 25. Mai 2022;annrheumdis-2022-222387.
12. Harris D, Frampton C, Patel S, White D, Arad U. Acute calcium pyrophosphate crystal arthritis is associated with an increased rate of hip and knee joint surgery. Rheumatology (Oxford). 2. April 2024;63(4):977–82.
13. Latourte A, Rat AC, Ngueyon Sime W, Ea HK, Bardin T, Mazières B, u. a. Chondrocalcinosis of the Knee and the Risk of Osteoarthritis Progression: Data From the Knee and Hip Osteoarthritis Long-term Assessment Cohort. Arthritis Rheumatol. Mai 2020;72(5):726–32.
14. Moret CS, Iordache E, D’Ambrosi R, Hirschmann MT. Chondrocalcinosis does not affect functional outcome and prosthesis survival in patients after total or unicompartmental knee arthroplasty: a systematic review. Knee Surg Sports Traumatol Arthrosc. März 2022;30(3):1039–49.
15. Tedeschi SK, Hayashi K, Rosenthal A, Gill M, Marrugo J, Fukui S, u. a. Fractures in Patients With Acute Calcium Pyrophosphate Crystal Arthritis Versus Matched Comparators in a Large Cohort Study. Arthritis Rheumatol. 14. Januar 2024;
16. Cowley S, McCarthy G. Diagnosis and Treatment of Calcium Pyrophosphate Deposition (CPPD) Disease: A Review. Open Access Rheumatol. 2023;15:33–41.
17. Pascart T, Robinet P, Ottaviani S, Leroy R, Segaud N, Pacaud A, u. a. Evaluating the safety and short-term equivalence of colchicine versus prednisone in older patients with acute calcium pyrophosphate crystal arthritis (COLCHICORT): an open-label, multicentre, randomised trial. Lancet Rheumatol. September 2023;5(9):e523–31.
18. Tardif JC, Kouz S, Waters DD, Bertrand OF, Diaz R, Maggioni AP, u. a. Efficacy and Safety of Low-Dose Colchicine after Myocardial Infarction. N Engl J Med. 26. Dezember 2019;381(26):2497–505.
19. Roubille F, Bouabdallaoui N, Kouz S, Waters DD, Diaz R, Maggioni AP, u. a. Low-Dose Colchicine in Patients With Type 2 Diabetes and Recent Myocardial Infarction in the Colchicine Cardiovascular Outcomes Trial (COLCOT). Diabetes Care. 1. März 2024;47(3):467–70.
20. Solomon DH, Liu CC, Kuo IH, Zak A, Kim SC. Effects of colchicine on risk of cardiovascular events and mortality among patients with gout: a cohort study using electronic medical records linked with Medicare claims. Ann Rheum Dis. September 2016;75(9):1674–9.
21. Roth ME, Chinn ME, Dunn SP, Bilchick KC, Mazimba S. Association of colchicine use for acute gout with clinical outcomes in acute decompensated heart failure. Clin Cardiol. Juli 2022;45(7):733–41.
22. Dumusc A, Pazar Maldonado B, Benaim C, Zufferey P, Aubry-Rozier B, So A. Anakinra compared to prednisone in the treatment of acute CPPD crystal arthritis: A randomized controlled double-blinded pilot study. Joint Bone Spine. März 2021;88(2):105088.
23. Cipolletta E, Di Matteo A, Scanu A, Isidori M, Di Battista J, Punzi L, u. a. Biologics in the treatment of calcium pyrophosphate deposition disease: a systematic literature review. Clin Exp Rheumatol. 2020;38(5):1001–7.
24. Doherty M, Dieppe PA. Double blind, placebo controlled trial of magnesium carbonate in chronic pyrophosphate arthropathy. Annals of the Rheumatic Diseases. 1. Januar 1983;42(Supplement 1):106–7.
25. Rothschild B, Yakubov LE. Prospective 6-month, double-blind trial of hydroxychloroquine treatment of CPDD. Compr Ther. Mai 1997;23(5):327–31.
26. Doherty M, Dieppe PA. Effect of intra-articular yttrium-90 on chronic pyrophosphate arthropathy of the knee. Lancet. 5. Dezember 1981;2(8258):1243–6.
27. Finckh A, Mc Carthy GM, Madigan A, Van Linthoudt D, Weber M, Neto D, u. a. Methotrexate in chronic-recurrent calcium pyrophosphate deposition disease: no significant effect in a randomized crossover trial. Arthritis Res Ther. 15. Oktober 2014;16(5):458.
28. Latourte A, Ea HK, Frazier A, Blanchard A, Lioté F, Marotte H, u. a. Tocilizumab in symptomatic calcium pyrophosphate deposition disease: a pilot study. Ann Rheum Dis. August 2020;79(8):1126–8.
29. Damart J, Filippou G, Andrès M, Cipolletta E, Sirotti S, Carboni D, u. a. Retention, safety and efficacy of off-label conventional treatments and biologics for chronic calcium pyrophosphate crystal inflammatory arthritis. Rheumatology (Oxford). 1. Februar 2024;63(2):446–55.
30. Klück V, Jansen TLTA, Janssen M, Comarniceanu A, Efdé M, Tengesdal IW, u. a. Dapansutrile, an oral selective NLRP3 inflammasome inhibitor, for treatment of gout flares: an open-label, dose-adaptive, proof-of-concept, phase 2a trial. Lancet Rheumatol. Mai 2020;2(5):e270–80.
Therapeutische Umschau
- Vol. 81
- Ausgabe 5
- September 2024