- Chronisch entzündliche Darmerkrankungen in der Schwangerschaft
Die Inzidenz chronisch entzündlicher Darmerkrankungen ist im gebärfähigen Alter am höchsten. Die Diagnose selbst, aber auch die verschiedenen zur Verfügung stehenden Therapieoptionen führen bei betroffenen Frauen oft zu Unsicherheiten in Bezug auf Fertilität, Schwangerschaft und Stillzeit. Hier kann nicht nur durch eine gute Information betroffener Patientinnen, sondern auch durch eine Planung und Begleitung der Schwangerschaft eine optimale Voraussetzung für eine komplikationsfreie Schwangerschaft erreicht werden.
Einführung
Mit dem Begriff chronisch entzündliche Darmerkrankungen, im Englischen Inflammatory Bowel Disease (IBD), werden der Morbus Crohn (MC) und die Colitis ulcerosa (CU) zusammengefasst. Etwa die Hälfte der Betroffenen sind Frauen (1), viele betroffene Frauen erhalten im gebärfähigen Alter die Diagnose einer chronisch entzündlichen Darmerkrankung (2), in diesem Alter ist die höchste Inzidenz beschrieben (3). Neben allgemeinen Fragen zur Erkrankung, beschäftigt betroffene Frauen auch die Frage, inwieweit eine IBD eine Schwangerschaft beeinflussen kann und wie sich die entzündliche Aktivität, sowie die Medikation auf das Kind auswirken können. Hier ist eine gute Information und Kommunikation als Grundlage einer gemeinsamen Entscheidungsfindung zentral.
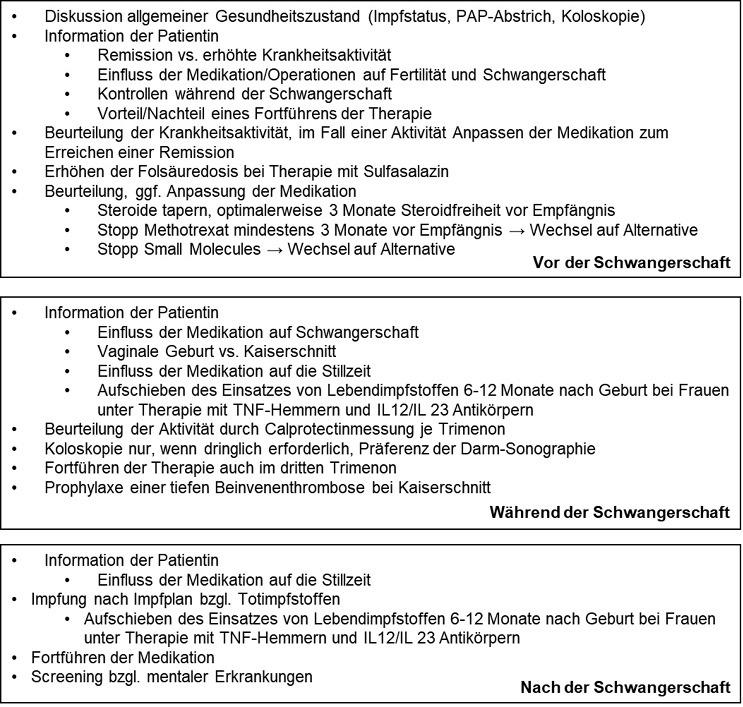
Das Ziel dieses Artikels ist es, einen Überblick über die «Best Practice» in der Betreuung von IBD-Patientinnen rund um eine Schwangerschaft zu geben, offene Fragen zu beantworten und so die Betreuung der Patientinnen zu verbessern. In diesem Zusammenhang hilfreich ist auch die in diesem Jahr publizierte aktualisierte Leitlinie zu Sexualität, Fertilität, Schwangerschaft und Stillphase der Europäischen Gesellschaft für Crohn und Colitis (ECCO), auf die sich dieser Artikel immer wieder beziehen wird (4). Eine Zusammenfassung der wichtigsten Punkte bietet die Abbildung 1.
Einfluss chronisch entzündlicher Darmerkrankungen auf die Fertilität
Frauen mit IBD in Remission und ohne chirurgische Eingriffe unterscheiden sich in Bezug auf die Fertilität nicht von der Normalbevölkerung (2,5-9). Es existieren allerdings oft offene Fragen bei Betroffenen, zum Teil aber auch im Behandlungsteam, die zu Unsicherheiten in Bezug auf eine Schwangerschaft führen. So zeigte eine Studie, die Hausärzte und IBD-Patienten zu ihrem IBD spezifischen Wissen befragten, dass nur 29.3% der IBD-Patienten ein gutes oder sehr gutes Schwangerschafts-assoziiertes Wissen hatten (10). Bei den Hausärzten lag dies bei 98.4% (10). Das mangelnde Wissen und daraus resultierende Fragen sind, neben der durch die IBD bestehenden Krankheitslast, ein relevanter Einflussfaktor darauf, dass der Anteil freiwillig kinderloser Frauen unter Patientinnen mit IBD mit 17% deutlich höher liegt als in der Normalbevölkerung (6%) (2,11). Dies, sowie Erkrankungs-assoziierte psychosoziale Faktoren und eine mögliche Beeinflussung durch Operationen, sind Faktoren, die dazu führen, dass Frauen mit IBD seltener Kinder haben (4,12-14). Weitere Einflussfaktoren sind eine verminderte Libido, Dyspareunie und chronische abdominelle Schmerzen (15,16). In der erwähnten Studie zu Schwangerschafts-assoziiertem IBD-Wissen berichteten zwei Drittel der Patientinnen von einer eingeschränkten Sexualfunktion, insbesondere einem verminderten sexuellen Verlangen (10). Bei männlichen IBD-Patienten wurde eine eingeschränkte Sexualfunktion seltener, nämlich bei 21.9% berichtet (10). In Bezug auf die Fertilität von Patientinnen mit IBD gibt es drei relevante Einflussfaktoren, die dem Behandlungsteam, aber insbesondere auch den Patientinnen bewusst sein sollten:
Einfluss der Erkrankungsaktivität auf die Fertilität
Diverse systematische Review Artikel weisen darauf hin, dass Frauen mit erhöhter entzündlicher Aktivität ihrer IBD eine verminderte Fertilität haben könnten (4,12,17,18). Als mögliche Pathomechanismen werden eine Aktivitäts-assoziierte peritoneale Inflammation (15), entzündliche Veränderungen im Bereich der Eileiter bzw. eine verminderte ovarielle Reserve diskutiert (15,19). In Bezug auf die ovarielle Reserve wurde jüngst eine Metaanalyse publiziert (20). Hier konnte entgegen bisheriger Datenlage nicht nur bei IBD-Patientinnen im Allgemeinen, sondern auch bei Patientinnen mit IBD in Remission eine signifikante Verminderung des Anti-Müller-Hormons mit entsprechend verminderter ovarieller Reserve nachgewiesen werden. Als weiterer Einflussfaktor auf die ovarielle Reserve konnte in dieser Metaanalyse auch eine Therapie mit Thalidomid identifiziert werden (20). Dies scheint für Patientinnen mit einem MC und weniger für solche mit einer CU eine Rolle zu spielen (15,21). Die ECCO-Guidelines weisen darauf hin, dass das Erreichen einer klinischen Remission die Wahrscheinlichkeit einer erfolgreichen Empfängnis erhöhen kann (4). In diesem Zusammenhang sollte auch erwähnt werden, dass eine entzündliche Aktivität zu Beginn einer Schwangerschaft mit einer anhaltenden entzündlichen Aktivität während der Schwangerschaft assoziiert ist (2). So konnte in einer Meta-Analyse ein erhöhtes Risiko für eine erhöhte Erkrankungsaktivität während der Schwangerschaft gezeigt werden bei Patientinnen mit einer IBD, die zu Beginn der Schwangerschaft bereits eine erhöhte Entzündungsaktivität zeigten, verglichen mit solchen Patientinnen, die zu Beginn der Schwangerschaft in Remission waren (MC: Risiko Ratio 2.0; 95% Konfidenzintervall (CI) 1.2-3.4; p=.006; CU: Risiko Ratio 2.0; 95% CI 1.5-3; p<.001) (22).
Einfluss der IBD-Therapie auf die Fertilität
Die meisten Medikamente zur Therapie einer IBD haben keinen Einfluss auf die Fertilität (15,23). Eine Ausnahme stellt Sulfasalazin dar, welches einen Einfluss auf die Spermienmotilität und – form haben und die Fertilität reduzieren kann (24). Entsprechend wird bei männlichen Patienten mit IBD und Kinderwunsch ein Wechsel von Sulfasalazin auf Mesalazin empfohlen (4,15). Bezüglich der Thiopurine liegen heterogene Studien vor, ein systematisches Review zeigte keinen Einfluss auf die Fertilität (4,25). Methotrexat hat einen teratogenen und abortiven Effekt und ist kontraindiziert, es wird zudem empfohlen eine Therapie mit Methotrexat mindestens 3 Monate vor einer Empfängnis zu stoppen (19,26). TNF Hemmer scheinen dagegen keinen Einfluss auf die Fertilität zu haben. Für andere Biologika gibt es nur limitierte Registerdaten, insgesamt wird aber in der aktuellen ECCO-Guideline ein Fortführen der Therapie mit Biologika empfohlen (4).
In Bezug auf die neueren Small Molecules Tofacitinib und Ozanimod gibt es ebenfalls nur sehr wenig Daten. Bei Ratten führte Tofacitinib in supratherapeutischen Dosen zu einer verminderten weiblichen Fertilität. Bei Gabe der empfohlenen Dosierung zeigte sich kein Einfluss (4). Auf die männliche Fertilität bzw. die Spermienmotilität oder -konzentration hatte Tofacitinib keinen Einfluss. Ozanimod hatte keinen Einfluss auf die Fertilität (4).
Einfluss IBD-assoziierter chirurgischer Eingriffe auf die Fertilität
Chirurgische Eingriffe können die Fertilität weiblicher IBD-Patientinnen beeinflussen. So konnte eine Meta-Analyse zeigen, dass das Risiko für eine Infertilität bei Patientinnen mit einer CU nach ilealer Pouch-Analer Anastomose (IPAA) um das Dreifache erhöht ist (27). Mögliche Ursachen sind Schädigungen autonomer Nervenbahnen im kleinen Becken, die veränderte Anatomie und Fibrosierung nach IPAA, Tubenadhäsionen oder -obstruktionen und psychosoziale Faktoren (15,28). Neben der verminderten Fertilität wird auch eine Assoziation von IBD-assoziierten Operationen mit Fehlgeburten, Kaiserschnitten und Inanspruchnahme von künstlicher Befruchtung beschrieben (4,29). Das Risiko für eine Infertilität kann durch die Operationstechnik beeinflusst werden. So konnten Beyer-Berjot et al. zeigen, dass das Risiko für eine Infertilität reduziert wird, wenn eine IPAA laparoskopisch und nicht offen operiert wurde (30). Hier ist davon auszugehen, dass die Risikoreduktion durch die atraumatischere Technik mit geringeren Adhäsionen bedingt ist (4,29). In einer aktuellen Kohortenstudie wurde das Infertilitätsrisiko nach chirurgischen Eingriffen bei IBD-Patienten analysiert (28). Verglichen mit der Kolektomie alleine war die Fertilität bei IPAA reduziert, insbesondere bei Patientinnen mit einer CU (HR 0.67, CI 0.50-0.88), sowie nach sog. Completion Proctectomy (HR 0.65, CI 0.49-0.85 für die CU), während sich keine weitere Verminderung zeigte für die ileorektale Anastomose (IRA) (HR 0.86, CI 0.63-1.17 für die CU) (28). Entsprechend sollte eine IRA in ausgewählten Fällen bei Patientinnen mit CU im gebärfähigen Alter trotz bekannter Risiken, wie persistierende Proktitis, IRA-Versagen oder Entwicklung einer Rektum-Dysplasie oder eines Rektumkarzinoms erwogen werden (4,28).
Einfluss der IBD auf die Schwangerschaft
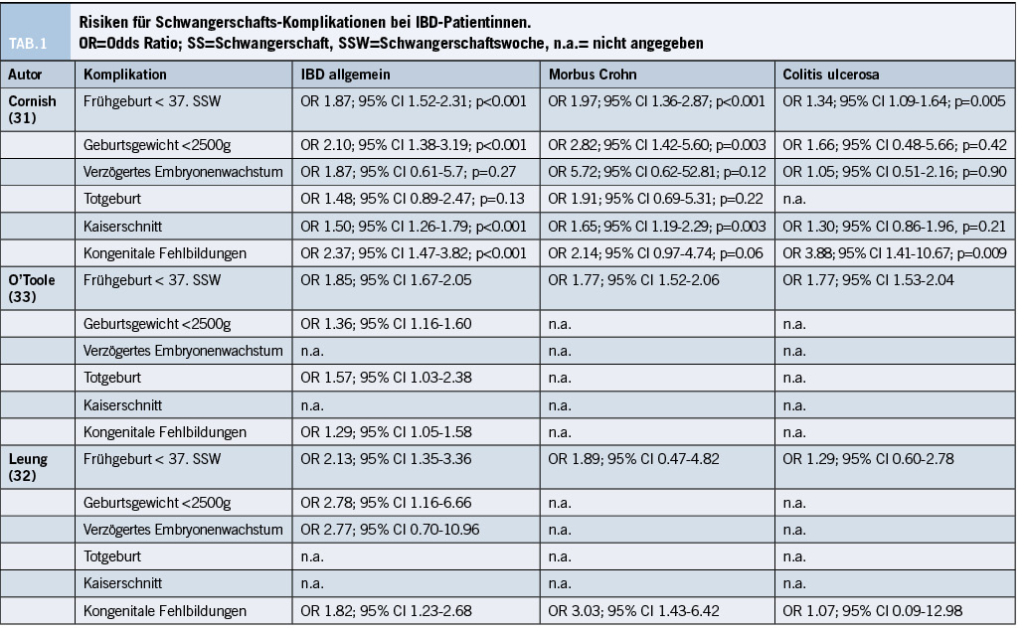
Über den Einfluss einer IBD auf den Verlauf einer Schwangerschaft gibt es mehrere grosse Metaanalysen. Cornish et al. analysierten 2007 das Outcome von 3’907 IBD-Schwangerschaften, sowie 320’531 Kontrollen. Sie beschrieben ein knapp 2-fach erhöhtes Risiko für eine Frühgeburt, ein über 2-fach erhöhtes Risiko für ein vermindertes Geburtsgewicht des Kindes, ein 1.5-fach erhöhtes Risiko für einen Kaiserschnitt und schliesslich ein knapp 2.5-fach erhöhtes Risiko für das Vorliegen einer kongenitalen Fehlbildung. Kein Unterschied zu den Kontroll-Patientinnen zeigte sich in Bezug auf Totgeburten bzw. eine zu kleine Grösse des Kindes für das Gestationsalter (Small for gestational age, SGA) (31). Detaillierte Angaben und eine Differenzierung nach MC, sowie CU zeigt die Tabelle 1. Im Jahre 2021 untersuchten Leung et al. in einer Metaanalyse aus 60 Studien den Unterschied bzgl. Schwangerschafts-Outcome zwischen IBD-Patientinnen und gesunden Kontrollen. Die Resultate waren vergleichbar (Tabelle 1) (32). O’Toole et al. analysierten 2015 die Schwangerschafts-Daten von 1’507 IBD-Patientinnen und 4‘614’271 Kontrollen. Auch ihre Angaben waren vergleichbar, mit allerdings geringerem Risiko für kongenitale Fehlbildungen (Tabelle 1) (33).
2019 untersuchten Tandon et al. verschiedene Schwangerschaftskomplikationen bei IBD-Patientinnen, verglichen mit Kontrollen (34). Sie verglichen 7’917 IBD-Schwangerschaften mit 3’253 Schwangerschaften bei gesunden Kontrollen. Es zeigte sich, dass das Risiko für einen Kaiserschnitt erhöht war (OR 1.79; 95% CI 1.16-2.77), wobei dies v.a. auf Patientinnen mit CU zutraf (OR 1.80; 95% CI 1.21-2.90) und nicht auf Patientinnen mit einem MC (OR 1.48; 95% CI 0.94-2.34). Das Risiko für einen Gestationsdiabetes war bei IBD-Patientinnen erhöht (OR 2.96; 95% CI 1.47-5.98), wie auch das Risiko für einen frühen vorzeitigen Blasensprung (OR 12.10; 95% CI 2.15-67.98). In dieser Metaanalyse zeigte sich kein erhöhtes Risiko für einen frühen Verlust der Schwangerschaft (OR 1.49; 95% CI 0.83-2.64; definiert als Verlust des Fötus vor der 20. SSW) (34). Prädiktoren für einen Kaiserschnitt bei Patientinnen mit CU waren Rauchen, Pankolitis und IPAA; Prädiktoren bei Patientinnen mit MC waren frühere intestinale oder perianale operative Eingriffe und eine aktive perianale Erkrankung (4,34).
Während diese Metaanalysen den allgemeinen Einfluss einer IBD auf den Verlauf der Schwangerschaft mit gesunden Kontrollen verglichen, untersuchten Kim et al. 2021 in einer Metaanalyse den Einfluss einer erhöhten Entzündungsaktivität auf den Verlauf einer Schwangerschaft. Verglichen wurden 2’223 Patientinnen mit aktiver und 4’469 Patientinnen mit inaktiver IBD. Das Vorhandensein einer erhöhten Entzündungsaktivität erhöhte das Risiko für ein geringes Geburtsgewicht (OR 3.81; 95% CI 1.81-8.02), Frühgeburt (OR 2.42; 95% CI 1.74-3.35), SGA (OR 1.48; 95% CI 1.19-1.85), Spontanabort (OR 1.87; 95% CI 1.17-3.0) und Totgeburt (OR 2.27; 95% CI 1.03-5.04) (35).
Auf die erhöhte entzündliche Aktivität gingen auch Leung et. al in ihrer Metaanalyse ein. Sie beschreiben bei aktiver IBD verglichen mit einer IBD in Remission ein erhöhtes Risiko für Frühgeburt (OR 2.06, 95% CI 1.21-3.51), für ein geringes Geburtsgewicht (OR 2.96, 95% CI 1.54-5.70) und ein SGA (OR 2.62; 95% CI 1.18-5.83) (32). Ein erhöhtes Risiko für kongenitale Fehlbildungen lag nicht vor.
Entbindungsmodus
Nicht selten unterziehen sich schwangere IBD-Patientinnen einem elektiven Kaiserschnitt (5,36). Die Rate an Kaiserschnitten bei MC-Patientinnen mit aktivem perianalem Befall, abgeheiltem perianalem Befall, sowie ohne perianalen Befall lag gemäss einem systematischen Review aus dem Jahr 2017 bei 46%, 43% und 27% (36). Das Risiko für ein Neuauftreten eines perianalen Befalls oder eines Rezidivs wurde durch eine vaginale Entbindung nicht erhöht. Auch für einen Dammschnitt, einen Dammriss oder eine instrumentelle Entbindung bestand kein erhöhtes Risiko. Es liess sich allerdings bei zwei Dritteln der Patientinnen mit aktivem perianalen Befall eine Zunahme der klinischen Symptomatik dokumentieren. Zudem schien eine unkomplizierte vaginale Entbindung bei Patientinnen mit UC nach IPAA Operation die Pouchfunktion moderat negativ zu beeinflussen (36).
In Bezug auf den Entbindungsmodus hat es in den letzten Jahren einige grössere Publikationen gegeben. Lever et al. untersuchten das perianale Outcome bei 179 Müttern mit IBD verglichen mit 31’258 Kontrollen (37). In dieser Studie ging eine IBD-Erkrankung mit einem um 45% erhöhten Risiko einher, mittels Kaiserschnitts zu entbinden (RR 1.45; 95% CI 1.16-1.81). Perianale Traumata im Rahmen der Geburt, inklusive den Anus involvierende Risse, waren in beiden Gruppen vergleichbar selten (2.23% (IBD) vs. 3.4% (Kontrollen)) (37). Ebenso berichtete eine israelische Studie, die in diesem Jahr publiziert wurde und 141 IBD-Patientinnen mit 1’119 Kontrollen verglich von einer erhöhten Wahrscheinlichkeit für die Durchführung eines Kaiserschnitts (34.8% vs. 24.1%) (38). Aufgrund dieser Datenlage können schwangere Patientinnen mit IBD in Bezug auf das Risiko durch eine vaginale Entbindung beruhigt werden. Bei Patientinnen mit aktivem perianalem Befall, vorgängiger rektovaginaler Fistel oder aber nach restorativer Proktokolektomie (IPAA) wird nach interdisziplinärer Diskussion gemäss ECCO-Guideline eher ein Kaiserschnitt empfohlen (4).
In Bezug auf den Entbindungsmodus und mögliche Komplikationen sollte auch erwähnt werden, dass bei IBD-Patientinnen das Risiko für eine tiefe Beinvenenthrombose nach Geburt deutlich erhöht ist, bei MC um das 6-fache (OR 6.12; 95% CI 2.91-12.9) und bei CU um das 8-fache (OR 8.44; 95% CI 3.71-19.2) (39). Ein weiterer, unabhängiger Risikofaktor für ein thrombogenes Ereignis stellte die Entbindung mittels Kaiserschnitts dar (OR 1.68; 95% CI 1.51-1.87).
Ebenfalls erhöht ist das postpartale Risiko für eine IBD-assoziierte Operation innerhalb von 30 Tagen nach Kaiserschnitt und dies unabhängig von der Indikation für den Kaiserschnitt oder einer gleichzeitige Immunsuppression (40).
Einfluss der IBD-Medikamente auf die Schwangerschaft und Stillzeit
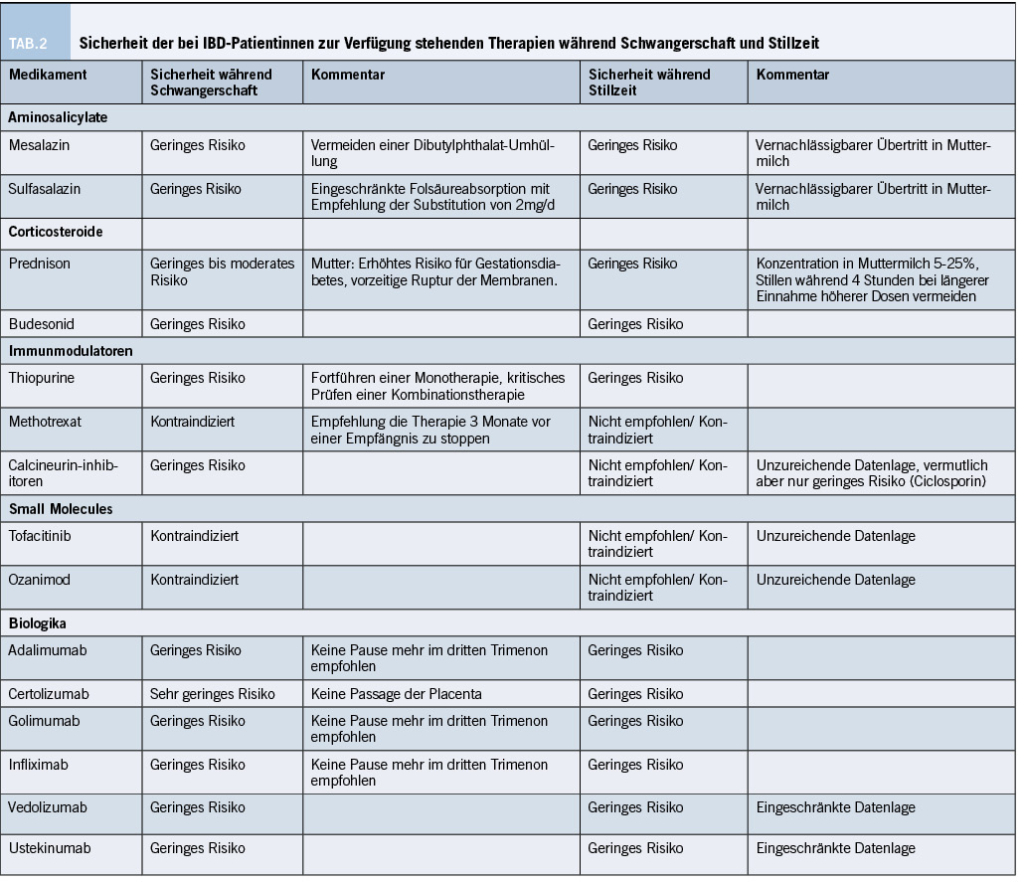
Die medikamentöse und mögliche Auswirkungen auf eine Schwangerschaft führen bei Patientinnen (und deren Ehemännern) oft zu Unsicherheiten und viele Fragen wollen beantwortet sein. Wichtig ist: Die meisten Medikamente dürfen während der Schwangerschaft eingenommen werden und weisen eine geringes Risiko auf. Die Datenlage wird im Folgenden erläutert, eine Übersicht bietet Tabelle 2.
Entbindungsmodus
Schwangerschaft: Aminosalicylate, inklusive Sulfasalazin, werden in der Schwangerschaft als sicher erachtet (4). So konnte in einer Metaanalyse aus dem Jahr 2008 keine erhöhte Rate an Spontanabort, häufigere Frühgeburten oder vermehrt kongenitale Fehlbildungen nachgewiesen werden (41,42). Eine gewisse Vorsicht ist geboten in Bezug auf solche Aminosalicylate, deren Überzüge Dibutylphthalat enthalten. Hier sind kongenitale Malformation des männlichen Urogenitaltraktes beschrieben worden. Zusätzlich gibt es aus Tierstudien Hinweise auf Skelettabnormalitäten sowie Dysregulation der Schilddrüsen- sowie reproduktiven Hormone beim Menschen (41,43). Die ECCO-Guideline empfiehlt im Falle einer Schwangerschaft einen Wechsel auf ein Nicht-Dibutyl-umhülltes Aminosalicylat. Zudem sollte beachtet werden, dass unter einer Therapie mit Sulfasalazin die Folsäureabsorption eingeschränkt sein kann, sodass hier eine Substitution von 2mg/d empfohlen wird (4).
Stillzeit: Aminosalicylate zeigen lediglich einen vernachlässigbaren Übertritt in die Muttermilch und gelten auch in der Stillzeit als wenig riskant (4,44).
Corticosteroide
Schwangerschaft: Ein kurzfristiger Einsatz von Corticosteroiden ist nicht mit einem negativen Einfluss auf die Schwangerschaft assoziiert. Grosse Evidenz erbrachte das sogenannte PIANO-Register, das den Einfluss einer Steroidtherapie auf die Schwangerschaft, sowie 12 Monate postpartum bei 1‘490 IBD-Patientinnen prospektiv untersuchte (45). Die Einnahme von Corticosteroiden war assoziiert mit einem erhöhten Risiko für Frühgeburten (OR 1.79; 95%
CI 1.18-2.73) sowie geringerem Geburtsgewicht (OR 1.76; 95% CI 1.07-2.88) und folglich häufiger intensivmedizinsichen Behandlungen des Kindes (OR 1.5; 95% CI 1.03-2.30) (45). Die Einnahme der Corticosteroide im zweiten oder dritten Trimenon war assoziiert mit schweren Infektionen des Kindes nach 9 und 12 Monaten (4% vs. 2% (9 Monate, p=0.03) und 5% vs. 2% (12 Monate, p=0.001)). Bereits eine frühere Publikation der Arbeitsgruppe beschrieb zudem ein erhöhtes Risiko für einen Gestationsdiabetes (OR 2.8; 95% CI 1.3-6.0) (46). 2011 wurde in einer grossen Kohorten-Studie, die alle Lebendgeburten in Dänemark von 1996 bis September 2008 einschloss, der Einfluss einer Corticosteroid Therapie auf die Entstehung einer Lippen-Kiefer-Gaumenspalte untersucht und hier kein Zusammenhang nachgewiesen (OR 1.05; 95% CI 0.80-1.38) (47).
Zum Einsatz von Budesonid und Budesonid MMX gibt es weniger Daten als zum Einsatz systemischer Corticosteroide. In der verfügbaren Literatur wird der Einsatz allerdings als sicher beschrieben (48,49). Die ECCO-Guideline bewertet einen kurzfristigen Einsatz von Corticosteroiden als sicher, empfiehlt aber bei der Entscheidungsfindung die beschriebenen maternal-fetalen Komplikationen zu berücksichtigen (4).
Stillzeit: Bei Frauen unter Therapie mit Corticosteroiden konnte eine Konzentration von 5-25% der Konzentration im Serum des Kindes nachgewiesen werden, sodass von einem gewissen Steroideffekt auszugehen ist (50). Die ECCO-Guideline empfiehlt daher bei Einnahme höherer Corticosteroiddosen über einen längeren Zeitraum das Stillen während 4 Stunden nach Einnahme des Corticosteroids zu vermeiden (4).
Thiopurine
Schwangerschaft: Der Einsatz von Thiopurinen wird in der Literatur zum Teil sehr konträr diskutiert. Bezüglich des Einflusses von Thiopurinen auf eine Schwangerschaft hat es verschiedene grosse Studien gegeben. Hutson et al. verglichen in einer Metaanalyse den Einfluss von Thiopurinen auf den Schwangerschaftsverlauf zwischen 494 IBD-Patientinnen mit und 2’782 IBD-Patientinnen ohne Thiopurin, sowie knapp 1.5 Millionen gesunder Frauen (51). Verglichen mit Frauen ohne IBD zeigten Frauen mit einem Thiopurin ein erhöhtes Risiko für eine kongenitale Fehlbildung des Kindes (OR 1.45; 95% CI 1.07-1.96). Verglich man IBD-Patientinnen mit und ohne Thiopurin-Therapie, zeigte sich kein erhöhtes Risiko (51), sodass hier angenommen werden kann, dass das erhöhte Risiko mehr durch die IBD selber, als die Therapie mit dem Thiopurin erklärt werden kann. Der Einfluss der Thiopurine auf eine Schwangerschaft wurde auch im bereits erwähnten PIANO Registers untersucht (52). Für IBD-Patientinnen mit Thiopurinen konnte lediglich für eine Frühgeburt ein erhöhtes Risiko detektiert werden (OR 1.67; 95% CI 1.26-2.20), nicht aber für ein zu geringes Geburtsgewicht oder aber kongenitale Fehlbildungen. Für IBD-Patienten mit Thiopurinen zeigte sich ein erhöhtes Risiko für kongenitale Fehlbildungen (OR 1.87 (95% CI 0.67-5.25) (52).
Eine grosse französische Studie untersuchte 27’729 Schwangerschaften (53). 3’554 der Patientinnen waren unter einer Thiopurin Monotherapie, 839 unter einer Kombinationstherapie mit einem TNF-Hemmer. Unter der Monotherapie zeigte sich, verglichen mit Patientinnen ohne Therapie, ein erhöhtes Risiko für eine Totgeburt (OR 2.04; 95% CI 1.18-3.55), eine Frühgeburt (OR 1.76; 95% CI 1.55-2.00), eine zu grosse Grösse für das Gestationsalter (OR 1.32; 95% CI 1.13-1.53) und ein vermindertes Risiko für ein SGA (OR 0.79; 95% CI 0.67-0.92) (53). Die Kombinationstherapie zeigte ein erhöhtes Risiko für eine Frühgeburt (OR 1.55; 95% CI 1.15-2.11) und für eine zu grosse Grösse für das Gestationsalter (OR 1.61; 95% CI 1.13-2.29), nicht aber für Totgeburt. Einschränkend muss erwähnt werden, dass die Autoren die Krankheitsaktivität nicht kontrollieren konnten und diese über IBD-assoziierte Operationen, Hospitalisationen und Steroidgebrauch schätzten, was eine relevante Verfälschung der Resultate bedeuten könnte. Die ECCO-Guidelines mahnen zu einer gewissen Vorsicht in Bezug auf eine Kombinationstherapie. Die Monotherapie mit Thiopurin soll fortgeführt werden, ein Fortführen einer Kombinationstherapie soll kritisch geprüft werden (4). Von einem Neubeginn einer Therapie mit einem Thiopurin in der Schwangerschaft wird angesichts verschiedener möglicher Nebenwirkungen (Myelosuppression, Hepatotoxizität und Pankreatitis) abgeraten (54).
Stillzeit: Während der Stillzeit werden Thiopurine als niedrig riskant bewertet. Ein Übertritt in die Muttermilch findet v.a. in den ersten 4 Stunden nach Medikamenteneinnahme statt (5,55). Eine prospektive Studie beschrieb keinen Unterschied in der Entwicklung bzw. Infektionen zwischen gestillten Kindern von IBD-Patientinnen u.a. mit Thiopurin-Therapie und nicht exponierten Kindern (56).
Methotrexat
Schwangerschaft: Aufgrund seiner Teratogenität ist eine Therapie mit Methotrexat während einer Schwangerschaft kontraindiziert (4). Patienten im gebärfähigen Alter sollten eine Form von Kontrazeption durchführen.
Stillzeit: Zu Methotrexat während der Stillzeit gibt es kaum Daten, daher wird von einer Einnahme während der Stillzeit abgeraten (4).
Calcineurininhibitoren
Schwangerschaft: Zum Einsatz der Calcineurininhibitoren Tacrolimus und Ciclosporin in der Schwangerschaft gibt es nur begrenzte Daten, die v.a. aus Transplantationsstudien stammen. Beide scheinen nicht mit einem erhöhten Risiko für kongenitale Fehlbildungen einherzugehen. Aufgrund des Nebenwirkungsprofils sollten die Calcineurininhibitoren aber nur in ausgewählten Fällen während einer Schwangerschaft erwogen werden (4).
Stillzeit: Zu Ciclosporin während der Stillzeit gibt es nur wenige Daten. Die wenigen Daten sprechen eher dafür, dass ein Einsatz möglich ist (5,57,58), die ECCO-Guidelines allerdings geben hier keine wirkliche Empfehlung und Ciclosporin sollte sicher nur unter Monitoring der Spiegel beim Kind fortgeführt werden, wenn erforderlich (4,5). Zu Tacrolimus während der Stillzeit gibt es nahezu keine Daten, sodass hier eine zuverlässige Aussage nicht möglich ist.
Small Molecules
Schwangerschaft: Tofacitinib ist ein oral verabreichter Janus-Kinase-Inhibitor, der neben der rheumatoiden Arthritis und Psoriasisarthritis für die Therapie der CU zugelassen ist. Für den Einsatz von Tofacitinib in der Schwangerschaft gibt es nur begrenzte Daten. Eine Studie, die den Einfluss bei 47 Schwangeren mit Arthritis untersuchte, berichtete vergleichbare Schwangerschafts-Outcomes verglichen zur Gesamtbevölkerung oder Patientinnen unter Therapie mit Biologika (59). In Bezug auf die CU gibt es bislang eine Studie, die den Einfluss von Tofacitinib auf eine Schwangerschaft untersuchte. Der Anteil an gesunden Neugeborenen, Schwangerschaftsabbrüchen und Spontanaborten unter 11 Patientinnen lag bei 36%, 18% und 18%. (60,61), es wurden keine Fälle von kindlichem Tod oder kongenitalen Fehlbildungen beschrieben. Aufgrund der limitierten Datenlage und da Tofacitinib in Tierstudien teratogen wirkte, ist es gemäss ECCO-Guideline kontraindiziert bei CU-Patientinnen (4).
Ozanimod ist ein oral verabreichter Sphingosin-1-Phosphat-Rezeptor-Modulator, der ebenfalls für die Therapie der CU zugelassen ist. Zum Einsatz von Ozanimod in der Schwangerschaft gibt es ebenfalls wenig Daten. Eine Studie berichtete vom Einfluss des Ozanimod bei 36 Schwangeren mit einer multiplen Sklerose (62). Es kam zu 24 Lebendgeburten mit 18 normalen und 3 zu früh geborenen, aber gesunden Säuglingen, je 1 Kind hatte einen neonatalen Ikterus, eine späte intrauterine Wachstumsretardierung und eine Doppelniere. Auch Ozanimod wird aufgrund der geringen Datenlage in der ECCO-Guideline als kontraindiziert beurteilt (4).
Stillzeit: Aufgrund noch unzureichender Daten in Bezug auf Tofacitinib und Ozanimod während der Stillzeit werden beide Substanzen in den ECCO-Guidelines als kontraindiziert bewertet (4).
Biologika
TNF-Hemmer (Infliximab, Adalimumab, Certolizumab, Golimumab)
Inzwischen werden alle TNF-Hemmer als Therapie mit geringem Risiko während einer Schwangerschaft eingeordnet. Zum Einfluss der TNF Hemmer auf Schwangerschaften bei IBD-Patientinnen hat es diverse Analysen gegeben.
Luu et al. untersuchten in einer retrospektiven Analyse Daten von 8726 schwangeren IBD-Patientinnen, von denen 12.9% unter Therapie mit einem TNF-Hemmer, hier v.a. Infliximab und Adalimumab. Eine Therapie mit einem TNF-Hemmer war assoziiert mit einem erhöhten Risiko für maternale Komplikationen (OR 1.49; 95% CI 1.31-1.67) und Infektionen (OR 1.31; 95% CI 1.16-1.47). Ein Fortführen der Therapie nach der 24. Schwangerschaftswoche beeinflusste das Risiko nicht, ein Unterbruch der Therapie ging aber mit einem erhöhten Risiko für einen Relapse einher (63). Chaparro et al. untersuchten in einer ebenfalls retrospektiven Analyse den Einfluss von TNF-Hemmern u.a. auf das Infektionsrisiko bei den Neugeborenen. Von 841 Kindern waren 46% mit einem TNF-Hemmer therapiert worden. Ein erhöhtes Infektionsrisiko zeigte sich nicht (64).
Auch das PIANO Register hat den Einfluss der TNF-Hemmer untersucht. Für Patientinnen unter Biologikatherapie fand sich keine Erhöhung bzgl. kongenitaler Malformationen, Spontanaborte, Frühgeburt, geringes Geburtsgewicht oder Infektionen des Kindes im ersten Lebensjahr. Einschränkend muss erwähnt werden, dass dies alle Biologika betrifft und nicht ausschliesslich die TNF-Hemmer, diese machten allerdings in der Studie mit mehr als 90% einen Grossteil der applizierten Biologika aus (3). Die ECCO-Guideline schätzt den Einsatz von TNF-Hemmern während der Schwangerschaft als wenig riskant ein und empfiehlt, v.a. auch wegen des erhöhten Relapse-Risikos und entgegen den Empfehlungen in der vorgängigen Guideline das Fortführen der Therapie ohne Pause im dritten Trimenon (4,65).
Stillzeit: TNF-Hemmer sind in geringen Mengen in der Muttermilch nachweisbar, allerdings nur in geringen Mengen. Es gitb keine Fallberichte zu unerwünschten Nebenwirkungen bei Säuglingen, weshalb die TNF-Hemmer in Bezug auf die Stillzeit als wenig riskant angesehen werden (2,5,56,66).
Anti-Integrin (Vedolizumab)
Schwangerschaft: Die Therapie mit Vedolizumab wird als Therapie mit geringem Risiko eingeschätzt (4). Eine Metaanalyse aus dem Jahr 2021 unter Einschluss von 213 Patientinnen mit Vedolizumab zeigte gesamthaft ein schlechteres Schwangerschafts-Outcome (OR 2.18; 95% CI 1.52-3.13) (67). Die Vedolizumab Gruppe hatte auch ein erhöhtes Risiko für Frühgeburt (OR 2.16; 95% CI 1.28-3.66), frühen Verlust der Schwangerschaft (OR 1.79; 95% CI 1.06-3.01), aber es zeigte sich kein Unterschied für Lebendgeburten oder kongenitale Malformationen (67). Die ECCO-Guideline kommt zum Schluss, dass Vedolizumab mit geringem Risiko, wohl aber mit einem gewissenhaften Follow-Up eingesetzt werden kann (4).
Stillzeit: Auch wenn es auch für Vedolizumab nur wenige Daten gibt, scheint der Einsatz in der Stillzeit sicher (2,56).
Anti-IL12/IL23 Antikörper (Ustekinumab)
Zum Einsatz von Ustekinumab in der Schwangerschaft bei IBD-Patientinnen hat es kleinere Studien gegeben. Der Einsatz wurde in zwei kleineren retrospektiven Studien (zusammen 164 Patientinnen) und einer prospektiven Studie (43 Patientinnen) als wenig riskant für schwangere IBD-Patientinnen eingeordnet (3,5,68-70). Die ECCO-Guideline bewertet auch Ustekinumab mit geringem Risiko, erwähnt aber, dass es wohl mit einem gewissenhaften Follow-Up eingesetzt werden kann (4).
Stillzeit: Auch für Ustekinumab gibt es noch begrenzte Daten zum Einsatz in der Stillzeit, die bisher vorliegenden Daten sprechen aber auch hier für ein niedriges Risiko (3,71).
Monitoring während der Schwangerschaft
Das Ziel sollte sein, die Schwangerschaft einer IBD-Patientin in Remission und mit einem mindesten 3-monatigen Steroid-freien Intervall zu beginnen (72). Zur Objektivierung einer Remission während einer Schwangerschaft werden je nach Literatur v.a. das fäkale Calprotectin (FC), das Serum CRP und die Endoskopie empfohlen (5,72). In Bezug auf das CRP ist aber zu erwähnen, dass es die intestinale Entzündung nur bedingt anzeigt und v.a. in der Schwangerschaft schlecht mit der Krankheitsaktivität korreliert (73-75). FC hingegen zeigt als fäkaler Entzündungsmarker die Krankheitsaktivität von IBD zuverlässig an, unabhängig von einer Schwangerschaft (76)(77)(78).
In Bezug auf Endoskopien während der Schwangerschaft gibt es nur wenig Daten. Eine grössere Kohortenstudie, die Daten eines Geburtsregisters untersuchte, berichtete in der Schwangerschaft von einem Endoskopie-assoziierten erhöhten Risiko für eine Frühgeburt, ein verzögertes Embryonenwachstum (small for gestational age), sowie ein zu geringes Geburtsgewicht (79). Es bestand allerdings kein erhöhtes Risiko für kongenitale Malformationen oder Totgeburten. Bei IBD-Patientinnen konnte ein erhöhtes Risiko für eine Frühgeburt und ein zu geringes Geburtsgewicht beobachtet werden, nicht aber für verzögertes Embryonenwachstum, Malformationen oder Totgeburt (79). Andere Studien konnten diese Risiken allerdings nicht bestätigen (80-84). Auch, wenn eine Endoskopie während der Schwangerschaft relativ sicher zu sein scheint, sollte sie nur in Ausnahmefällen durchgeführt werden, wenn die Resultate entscheidend für die IBD Behandlung zwingend sind. Hier sollte der ECCO-Guideline folgend die Interventionszeit möglichst niedrig gehalten werden, sowie eine möglichst geringe Menge an Sedativa verabreicht werden (4,85).
Besondere Fragestellungen nach der Geburt
Impfungen des Kindes
Da ein Grossteil der IBD-Medikamente die Placenta passieren und in die Muttermilch gelangen kann, stellt sich die Frage, inwieweit Impfungen des Neugeborenen nach der Geburt möglich und empfohlen sind. Im Zusammenhang mit Totimpfstoffen hat es keine Berichte zu unerwünschten Nebenwirkungen beim Neugeborenen gegeben und es wird eine Impfung gemäss Impfplan empfohlen (86). Vorsicht ist geboten beim Einsatz von Lebendimpfstoffen, dies v.a., da im Zusammenhang mit einer Bacillus Calmette-Guérin (BCG) Impfung fatal verlaufende Infektionen bei Neugeborenen berichtet wurden (87,88). Im Zusammenhang mit Infliximab gab die Europäische Arzneimittel Agentur 2022 sogar eine Empfehlung heraus während der ersten 12 Lebensmonate keine Lebendimpfstoffe bei Neugeborgenen einzusetzen, die gegenüber Infliximab exponiert waren (89). Ein kürzlich erschienener rheumatologischer Review-Artikel untersuchte 276 Kinder mit in utero Exposition gegenüber verschiedenen Biologika und Impfung mit einem Lebendimpfstoff (BCG, Rotavirus oder Masern/Mumps/Röteln) (88). Die Autoren berichteten bei 215 BCG-Impfungen von 8 unerwünschten Nebenwirkungen, von denen eine zum Tod führte. Alle Kinder, bei denen es zu unerwünschten Wirkungen kam, waren in utero gegenüber Infliximab exponiert gewesen (88). In Bezug auf Ustekinumab untersuchten Flanagan et al im vergangenen Jahr 19 schwangere IBD-Patientinnen unter Therapie mit Ustekinumab. Die Autoren kommen zu dem Schluss, dass auch bei Einsatz von Ustekinumab aufgrund einer Ustekinumab-Clearance erst nach 20 Wochen Vorsicht in Bezug auf den Einsatz von Lebendimpfstoffen geboten ist (90).
Mentale Gesundheit der Mutter
Ein besonderes Augenmerk sollte nach der Schwangerschaft auf die mentale Gesundheit der Mutter gelegt werden, da Patientinnen mit einer IBD nach einer Schwangerschaft ein erhöhtes Risiko für psychische Erkrankungen haben (HR 1.12; 95% CI 1.05-1.20), besonders für Angststörungen (HR 1.14; 95% CI 1.04-1.26) und Alkohol- oder Substanzmissbrauch (HR 2.73; 95% CI 1.42-5.26) (91).
Abteilung für Gastroenterologie und Hepatologie
Klinik für Innere Medizin, Kantonsspital Frauenfeld
Waldeggstrasse 8A
8500 Frauenfeld
christine.manser@stgag.ch
PD Dr. med. Christine Nadege Manser hat keine Interessenkonflikte.
Schlussfolgerungen
In der Behandlung von IBD Patientinnen sollte der Kinderwunsch frühzeitig angesprochen werden, weil damit viele Risiken vor, während und nach einer Schwangerschaft, sowohl für die Mutter als auch für das Kind, minimiert werden können.
1. Park J, Jeong GH, Song M et al. The global, regional, and national burden of inflammatory bowel diseases, 1990-2019: A systematic analysis for the global burden of disease study 2019. Dig Liver Dis 2023, DOI: 10.1016/j.dld.2023.04.003:
2. Mahadevan U, Robinson C, Bernasko N et al. Inflammatory Bowel Disease in Pregnancy Clinical Care Pathway: A Report From the American Gastroenterological Association IBD Parenthood Project Working Group. Gastroenterology 2019; 156: 1508-1524
3. Mahadevan U, Long MD, Kane SV et al. Pregnancy and Neonatal Outcomes After Fetal Exposure to Biologics and Thiopurines Among Women With Inflammatory Bowel Disease. Gastroenterology 2021; 160: 1131-1139
4. Torres J, Chaparro M, Julsgaard M et al. European Crohn’s and Colitis Guidelines on Sexuality, Fertility, Pregnancy, and Lactation. J Crohns Colitis 2023; 17: 1-27
5. Brondfield MN, Mahadevan U. Inflammatory bowel disease in pregnancy and breastfeeding. Nat Rev Gastroenterol Hepatol 2023; 20: 504-523
6. De Dombal FT, Watts JM, Watkinson G et al. Ulcerative colitis and pregnancy. Lancet 1965; 2: 599-602
7. Hudson M, Flett G, Sinclair TS et al. Fertility and pregnancy in inflammatory bowel disease. Int J Gynaecol Obstet 1997; 58: 229-237
8. Korelitz BI. Inflammatory bowel disease and pregnancy. Gastroenterol Clin North Am 1998; 27: 213-224
9. Ording Olsen K, Juul S, Berndtsson I et al. Ulcerative colitis: female fecundity before diagnosis, during disease, and after surgery compared with a population sample. Gastroenterology 2002; 122: 15-19
10. Vieujean S, De Vos M, D’Amico F et al. Inflammatory bowel disease meets fertility: A physician and patient survey. Dig Liver Dis 2023; 55: 888-898
11. Selinger CP, Ghorayeb J, Madill A. What Factors Might Drive Voluntary Childlessness (VC) in Women with IBD? Does IBD-specific Pregnancy-related Knowledge Matter? J Crohns Colitis 2016; 10: 1151-1158
12. Ban L, Tata LJ, Humes DJ et al. Decreased fertility rates in 9639 women diagnosed with inflammatory bowel disease: a United Kingdom population-based cohort study. Aliment Pharmacol Ther 2015; 42: 855-866
13. Tavernier N, Fumery M, Peyrin-Biroulet L et al. Systematic review: fertility in non-surgically treated inflammatory bowel disease. Aliment Pharmacol Ther 2013; 38: 847-853
14. Timmer A, Bauer A, Kemptner D et al. Determinants of male sexual function in inflammatory bowel disease: a survey-based cross-sectional analysis in 280 men. Inflamm Bowel Dis 2007; 13: 1236-1243
15. Leenhardt R, Riviere P, Papazian P et al. Sexual health and fertility for individuals with inflammatory bowel disease. World J Gastroenterol 2019; 25: 5423-5433
16. Timmer A, Bauer A, Dignass A et al. Sexual function in persons with inflammatory bowel disease: a survey with matched controls. Clin Gastroenterol Hepatol 2007; 5: 87-94
17. Lamah M, Scott HJ. Inflammatory bowel disease and pregnancy. Int J Colorectal Dis 2002; 17: 216-222
18. Palomba S, Sereni G, Falbo A et al. Inflammatory bowel diseases and human reproduction: a comprehensive evidence-based review. World J Gastroenterol 2014; 20: 7123-7136
19. Ronchetti C, Cirillo F, Di Segni N et al. Inflammatory Bowel Disease and Reproductive Health: From Fertility to Pregnancy-A Narrative Review. Nutrients 2022; 14:
20. Guo L, Liu Y, Li J et al. Inflammatory bowel disease can reduce ovarian reserve function in women: A systematic review and meta-analysis. Medicine (Baltimore) 2023; 102: e33113
21. Selinger CP, Nelson-Piercy C, Fraser A et al. IBD in pregnancy: recent advances, practical management. Frontline Gastroenterol 2021; 12: 214-224
22. Abhyankar A, Ham M, Moss AC. Meta-analysis: the impact of disease activity at conception on disease activity during pregnancy in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2013; 38: 460-466
23. Martin J, Kane SV, Feagins LA. Fertility and Contraception in Women With Inflammatory Bowel Disease. Gastroenterol Hepatol (N Y) 2016; 12: 101-109
24. Birnie GG, McLeod TI, Watkinson G. Incidence of sulphasalazine-induced male infertility. Gut 1981; 22: 452-455
25. Laharie D, Debeugny S, Peeters M et al. Inflammatory bowel disease in spouses and their offspring. Gastroenterology 2001; 120: 816-819
26. McDonald JW, Wang Y, Tsoulis DJ et al. Methotrexate for induction of remission in refractory Crohn’s disease. Cochrane Database Syst Rev 2014; 2014: CD003459
27. Waljee A, Waljee J, Morris AM et al. Threefold increased risk of infertility: a meta-analysis of infertility after ileal pouch anal anastomosis in ulcerative colitis. Gut 2006; 55: 1575-1580
28. Druvefors E, Myrelid P, Andersson RE et al. Female and Male Fertility after Colectomy and Reconstructive Surgery in Inflammatory Bowel Diesase: A National Cohort Study from Sweden. J Crohns Colitis 2023, DOI: 10.1093/ecco-jcc/jjad079:
29. Rajaratnam SG, Eglinton TW, Hider P et al. Impact of ileal pouch-anal anastomosis on female fertility: meta-analysis and systematic review. Int J Colorectal Dis 2011; 26: 1365-1374
30. Beyer-Berjot L, Maggiori L, Birnbaum D et al. A total laparoscopic approach reduces the infertility rate after ileal pouch-anal anastomosis: a 2-center study. Ann Surg 2013; 258: 275-282
31. Cornish J, Tan E, Teare J et al. A meta-analysis on the influence of inflammatory bowel disease on pregnancy. Gut 2007; 56: 830-837
32. Leung KK, Tandon P, Govardhanam V et al. The Risk of Adverse Neonatal Outcomes With Maternal Inflammatory Bowel Disease: A Systematic Review and Meta-analysis. Inflamm Bowel Dis 2021; 27: 550-562
33. O’Toole A, Nwanne O, Tomlinson T. Inflammatory Bowel Disease Increases Risk of Adverse Pregnancy Outcomes: A Meta-Analysis. Dig Dis Sci 2015; 60: 2750-2761
34. Tandon P, Govardhanam V, Leung K et al. Systematic review with meta-analysis: risk of adverse pregnancy-related outcomes in inflammatory bowel disease. Aliment Pharmacol Ther 2020; 51: 320-333
35. Kim MA, Kim YH, Chun J et al. The Influence of Disease Activity on Pregnancy Outcomes in Women With Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis. J Crohns Colitis 2021; 15: 719-732
36. Foulon A, Dupas JL, Sabbagh C et al. Defining the Most Appropriate Delivery Mode in Women with Inflammatory Bowel Disease: A Systematic Review. Inflamm Bowel Dis 2017; 23: 712-720
37. Lever G, Chipeta H, Glanville T et al. Perineal Outcomes After Delivery in 179 Mothers with Inflammatory Bowel Disease Compared to 31 258 Controls: A Single-Centre Cohort Study. J Crohns Colitis 2022; 16: 511-514
38. Avni Biron I, Hayat L, Ollech JE et al. Pregnancy Outcomes in a Cohort of Patients with Inflammatory Bowel Disease: Data from a Multidisciplinary Clinic in a Tertiary Center. J Clin Med 2023; 12:
39. Nguyen GC, Boudreau H, Harris ML et al. Outcomes of obstetric hospitalizations among women with inflammatory bowel disease in the United States. Clin Gastroenterol Hepatol 2009; 7: 329-334
40. Friedman S, Zegers FD, Riis Jolving L et al. Postpartum Surgical Complications in Women with Inflammatory Bowel Disease After Caesarian Section: A Danish Nationwide Cohort Study. J Crohns Colitis 2022; 16: 625-632
41. Grigorescu RR, Husar-Sburlan IA, Rosulescu G et al. Pregnancy in Patients with Inflammatory Bowel Diseases-A Literature Review. Life (Basel) 2023; 13:
42. Rahimi R, Nikfar S, Rezaie A et al. Pregnancy outcome in women with inflammatory bowel disease following exposure to 5-aminosalicylic acid drugs: a meta-analysis. Reprod Toxicol 2008; 25: 271-275
43. Hernandez-Diaz S, Mitchell AA, Kelley KE et al. Medications as a potential source of exposure to phthalates in the U.S. population. Environ Health Perspect 2009; 117: 185-189
44. Klotz U, Harings-Kaim A. Negligible excretion of 5-aminosalicylic acid in breast milk. Lancet 1993; 342: 618-619
45. Odufalu FD, Long M, Lin K et al. Exposure to corticosteroids in pregnancy is associated with adverse perinatal outcomes among infants of mothers with inflammatory bowel disease: results from the PIANO registry. Gut 2022; 71: 1766-1772
46. Lin KM, CF.; Dassopoulos, T.; Degli Esposti, SD.; Wolf, DC.; Degli Esposti, SD.; Beaulieu, DB.; Mahadevan, U. Pregnancy outcomes amongst mothers with inflammatory bowel disease exposed to systemic corticosteroids: results of the PIANO registry (abstract). Gastroenterology 2014; 41: 146
47. Hviid A, Molgaard-Nielsen D. Corticosteroid use during pregnancy and risk of orofacial clefts. CMAJ 2011; 183: 796-804
48. Beaulieu DB, Ananthakrishnan AN, Issa M et al. Budesonide induction and maintenance therapy for Crohn’s disease during pregnancy. Inflamm Bowel Dis 2009; 15: 25-28
49. Team A. Potential Risks of Immunosuppressant Drugs to the Pregnant Patient. . American College of Gastroenterology 2015, DOI:
50. Ost L, Wettrell G, Bjorkhem I et al. Prednisolone excretion in human milk. J Pediatr 1985; 106: 1008-1011
51. Hutson JR, Matlow JN, Moretti ME et al. The fetal safety of thiopurines for the treatment of inflammatory bowel disease in pregnancy. J Obstet Gynaecol 2013; 33: 1-8
52. Akbari M, Shah S, Velayos FS et al. Systematic review and meta-analysis on the effects of thiopurines on birth outcomes from female and male patients with inflammatory bowel disease. Inflamm Bowel Dis 2013; 19: 15-22
53. Meyer A, Drouin J, Weill A et al. Comparative study of pregnancy outcomes in women with inflammatory bowel disease treated with thiopurines and/or anti-TNF: a French nationwide study 2010-2018. Aliment Pharmacol Ther 2021; 54: 302-311
54. Shmidt E, Dubinsky MC. Inflammatory Bowel Disease and Pregnancy. Am J Gastroenterol 2022; 117: 60-68
55. Christensen LA, Dahlerup JF, Nielsen MJ et al. Azathioprine treatment during lactation. Aliment Pharmacol Ther 2008; 28: 1209-1213
56. Matro R, Martin CF, Wolf D et al. Exposure Concentrations of Infants Breastfed by Women Receiving Biologic Therapies for Inflammatory Bowel Diseases and Effects of Breastfeeding on Infections and Development. Gastroenterology 2018; 155: 696-704
57. Lahiff C, Moss AC. Cyclosporine in the management of severe ulcerative colitis while breast-feeding. Inflamm Bowel Dis 2011; 17: E78
58. Moretti ME, Sgro M, Johnson DW et al. Cyclosporine excretion into breast milk. Transplantation 2003; 75: 2144-2146
59. Clowse ME, Feldman SR, Isaacs JD et al. Pregnancy Outcomes in the Tofacitinib Safety Databases for Rheumatoid Arthritis and Psoriasis. Drug Saf 2016; 39: 755-762
60. Akiyama S, Steinberg JM, Kobayashi M et al. Pregnancy and medications for inflammatory bowel disease: An updated narrative review. World J Clin Cases 2023; 11: 1730-1740
61. Mahadevan U, Dubinsky MC, Su C et al. Outcomes of Pregnancies With Maternal/Paternal Exposure in the Tofacitinib Safety Databases for Ulcerative Colitis. Inflamm Bowel Dis 2018; 24: 2494-2500
62. Selmaj KW, Cohen JA, Comi G et al. Ozanimod in relapsing multiple sclerosis: Pooled safety results from the clinical development program. Mult Scler Relat Disord 2021; 51: 102844
63. Luu M, Benzenine E, Doret M et al. Continuous Anti-TNFalpha Use Throughout Pregnancy: Possible Complications For the Mother But Not for the Fetus. A Retrospective Cohort on the French National Health Insurance Database (EVASION). Am J Gastroenterol 2018; 113: 1669-1677
64. Chaparro M, Verreth A, Lobaton T et al. Long-Term Safety of In Utero Exposure to Anti-TNFalpha Drugs for the Treatment of Inflammatory Bowel Disease: Results from the Multicenter European TEDDY Study. Am J Gastroenterol 2018; 113: 396-403
65. van der Woude CJ, Ardizzone S, Bengtson MB et al. The second European evidenced-based consensus on reproduction and pregnancy in inflammatory bowel disease. J Crohns Colitis 2015; 9: 107-124
66. Fritzsche J, Pilch A, Mury D et al. Infliximab and adalimumab use during breastfeeding. J Clin Gastroenterol 2012; 46: 718-719
67. Bell C, Tandon P, Lentz E et al. Systematic review and meta-analysis: Safety of vedolizumab during pregnancy in patients with inflammatory bowel disease. J Gastroenterol Hepatol 2021; 36: 2640-2648
68. Wils P, Seksik P, Stefanescu C et al. Safety of ustekinumab or vedolizumab in pregnant inflammatory bowel disease patients: a multicentre cohort study. Aliment Pharmacol Ther 2021; 53: 460-470
69. Volger ST, I.; Lin, C.; O’Brien, CD.; Marano, CW.; Geldhof, A.;. Sa 1827 Pregnancy outcomes in women with psoriasis, psoriatic arthritis, Crohn’s disease and ulcerative colitis treated with Ustekinumab. Gastroenterology 2020; 158: S442
70. Chugh RL, M.; Weaver, K.; Beaulieu, D.; Scherl, E.; Mahadevan, U.;. S719 Maternal and Neonatal Outcomes in Vedolizumab and Ustekinumab Exposed Pregnancies: Results From the PIANO Registry. The American Journal of Gastroenterology 2022; 117: e502-e503
71. Bar-Gil Shitrit A, Ben-Horin S, Mishael T et al. Detection of Ustekinumab in Breast Milk of Nursing Mothers With Crohn Disease. Inflamm Bowel Dis 2021; 27: 742-745
72. Nguyen GC, Seow CH, Maxwell C et al. The Toronto Consensus Statements for the Management of Inflammatory Bowel Disease in Pregnancy. Gastroenterology 2016; 150: 734-757 e731
73. Klajnbard A, Szecsi PB, Colov NP et al. Laboratory reference intervals during pregnancy, delivery and the early postpartum period. Clin Chem Lab Med 2010; 48: 237-248
74. Schulze H, Esters P, Dignass A. Review article: the management of Crohn’s disease and ulcerative colitis during pregnancy and lactation. Aliment Pharmacol Ther 2014; 40: 991-1008
75. Tandon P, Leung K, Yusuf A et al. Noninvasive Methods For Assessing Inflammatory Bowel Disease Activity in Pregnancy: A Systematic Review. J Clin Gastroenterol 2019; 53: 574-581
76. Balint A, Berenyi A, Farkas K et al. Pregnancy does not affect fecal calprotectin concentration in healthy women. Turk J Gastroenterol 2017; 28: 171-175
77. Julsgaard M, Hvas CL, Gearry RB et al. Fecal Calprotectin Is Not Affected by Pregnancy: Clinical Implications for the Management of Pregnant Patients with Inflammatory Bowel Disease. Inflamm Bowel Dis 2017; 23: 1240-1246
78. Rottenstreich A, Mishael T, Granovsky SG et al. Clinical utility of fecal calprotectin in monitoring disease activity and predicting relapse in pregnant patients with inflammatory bowel diseases. Eur J Intern Med 2020; 77: 105-110
79. Ludvigsson JF, Lebwohl B, Ekbom A et al. Outcomes of Pregnancies for Women Undergoing Endoscopy While They Were Pregnant: A Nationwide Cohort Study. Gastroenterology 2017; 152: 554-563 e559
80. de Lima A, Zelinkova Z, van der Woude CJ. A prospective study of the safety of lower gastrointestinal endoscopy during pregnancy in patients with inflammatory bowel disease. J Crohns Colitis 2015; 9: 519-524
81. Ko MS, Rudrapatna VA, Avila P et al. Safety of Flexible Sigmoidoscopy in Pregnant Patients with Known or Suspected Inflammatory Bowel Disease. Dig Dis Sci 2020; 65: 2979-2985
82. Cappell MS, Colon VJ, Sidhom OA. A study at 10 medical centers of the safety and efficacy of 48 flexible sigmoidoscopies and 8 colonoscopies during pregnancy with follow-up of fetal outcome and with comparison to control groups. Dig Dis Sci 1996; 41: 2353-2361
83. Cappell MS, Fox SR, Gorrepati N. Safety and efficacy of colonoscopy during pregnancy: an analysis of pregnancy outcome in 20 patients. J Reprod Med 2010; 55: 115-123
84. Cappell MS, Sidhom O. Multicenter, multiyear study of safety and efficacy of flexible sigmoidoscopy during pregnancy in 24 females with follow-up of fetal outcome. Dig Dis Sci 1995; 40: 472-479
85. Committee ASoP, Shergill AK, Ben-Menachem T et al. Guidelines for endoscopy in pregnant and lactating women. Gastrointest Endosc 2012; 76: 18-24
86. Beaulieu DB, Ananthakrishnan AN, Martin C et al. Use of Biologic Therapy by Pregnant Women With Inflammatory Bowel Disease Does Not Affect Infant Response to Vaccines. Clin Gastroenterol Hepatol 2018; 16: 99-105
87. Cheent K, Nolan J, Shariq S et al. Case Report: Fatal case of disseminated BCG infection in an infant born to a mother taking infliximab for Crohn’s disease. J Crohns Colitis 2010; 4: 603-605
88. Goulden B, Chua N, Parker E et al. A systematic review of live vaccine outcomes in infants exposed to biologic disease modifying anti-rheumatic drugs in utero. Rheumatology (Oxford) 2022; 61: 3902-3906
89. European Medicines Agency. https://www.ema.europa.eu/en/documents/dhpc/direct-healthcare-professional-communication-dhpc-infliximab-remicade-flixabi-inflectra-remsima_en.pdf. In
90. Flanagan E, Prentice R, Wright EK et al. Ustekinumab levels in pregnant women with inflammatory bowel disease and infants exposed in utero. Aliment Pharmacol Ther 2022; 55: 700-704
91. Vigod SN, Kurdyak P, Brown HK et al. Inflammatory bowel disease and new-onset psychiatric disorders in pregnancy and post partum: a population-based cohort study. Gut 2019; 68: 1597-1605
Therapeutische Umschau
- Vol. 80
- Ausgabe 9
- Dezember 2023