- Dyspnoe bei Patienten in palliativen Situationen – das unsichtbare Symptom
Hintergrund und Definitionen
Dyspnoe ist bei Patient/-innen mit fortgeschrittenen malignen und nicht malignen Erkrankungen ein häufiges und belastendes Symptom, welches die Lebensqualität massiv einschränken kann. Die Prävalenz wird zwischen 10–70 % bei fortgeschrittenen malignen und 60–95 % bei fortgeschrittenen kardiorespiratorischen Erkrankungen beschrieben und nimmt am Lebensende zu (1–3). Dabei ist Dyspnoe nach der Definition der American Thoracic Society «eine subjektive Erfahrung einer unangenehmen Atmung, die in ihrer Ausprägung schwanken kann. Die Erfahrung wird von einem komplexen Zusammenspiel physischer, psychischer, sozialer und umweltbedingter Faktoren beeinflusst und kann sekundäre physiologische und verhaltensbezogene Reaktionen auslösen» (4). Angst und Panik können als Folge von Dyspnoe auftreten und diese wiederum die Dyspnoe verstärken.
Von refraktärer Dyspnoe wird gesprochen, wenn die Atemnot trotz adäquater Therapie anhält. Eine internationale Expertengruppe hat 2017 den Begriff «chronisches Atemnotsyndrom» oder «chronic breathlessness syndrome» für Patient/-innen mit therapierefraktärer Atemnot geprägt, wenn das Symptom trotz optimaler Behandlung der pathophysiologisch zugrunde liegenden Ursache fortbesteht und die Funktionsfähigkeit im Alltag einschränkt ist (5). Ziel ist es, den Krankheitscharakter des Symptoms darzustellen und damit den Zugang zu adäquater Behandlung zu fördern. Bei akuter Verschlechterung eines chronischen Atemnotsyndroms wird in der Literatur dementsprechend von «akuter auf chronische Dyspnoe» (acute-on-chronic dyspnea) gesprochen.
Dyspnoe kann als kontinuierliche Atemnot oder Atemnotattacken auftreten. Die kontinuierliche Atemnot beschreibt eine konstante Belastung durch Atemnot, die in ihrer Intensität üblicherweise variiert. Im Gegensatz dazu sind Atemnotattacken durch plötzliche und starke Anstiege der Atemnotsymptome gekennzeichnet. Diese Attacken können von wenigen Sekunden bis hin zu mehreren Stunden dauern, treten intermittierend auf und können unabhängig von kontinuierlicher Atemnot auftreten. Die Auslöser für Atemnotattacken können vielfältig sein und reichen von körperlicher Anstrengung über emotionale Belastungen bis hin zu Umgebungsfaktoren (11, 12).
Obwohl die Prävalenz hoch und die Bedeutung von Dyspnoe bekannt sind, haben Gesundheitsfachpersonen Schwierigkeiten, das Symptom zu erkennen, einzuschätzen und adäquat zu behandeln. Patient/-innen mit chronischem Atemnotsyndrom haben wiederholte, ungeplante Spitaleintritte, jedoch kaum vorausschauende Behandlungsplanung (5–8, 3).
Es handelt sich also um ein komplexes Symptom, das nur von Patient/-innen selbst beschrieben werden und mit einer hohen und multidimensionalen Einschränkung der Lebensqualität einhergehen kann. Dabei betrifft es nicht nur die Patient/-innen selbst, sondern auch ihr soziales Umfeld und Gesundheitsfachpersonen.
Ätiologie
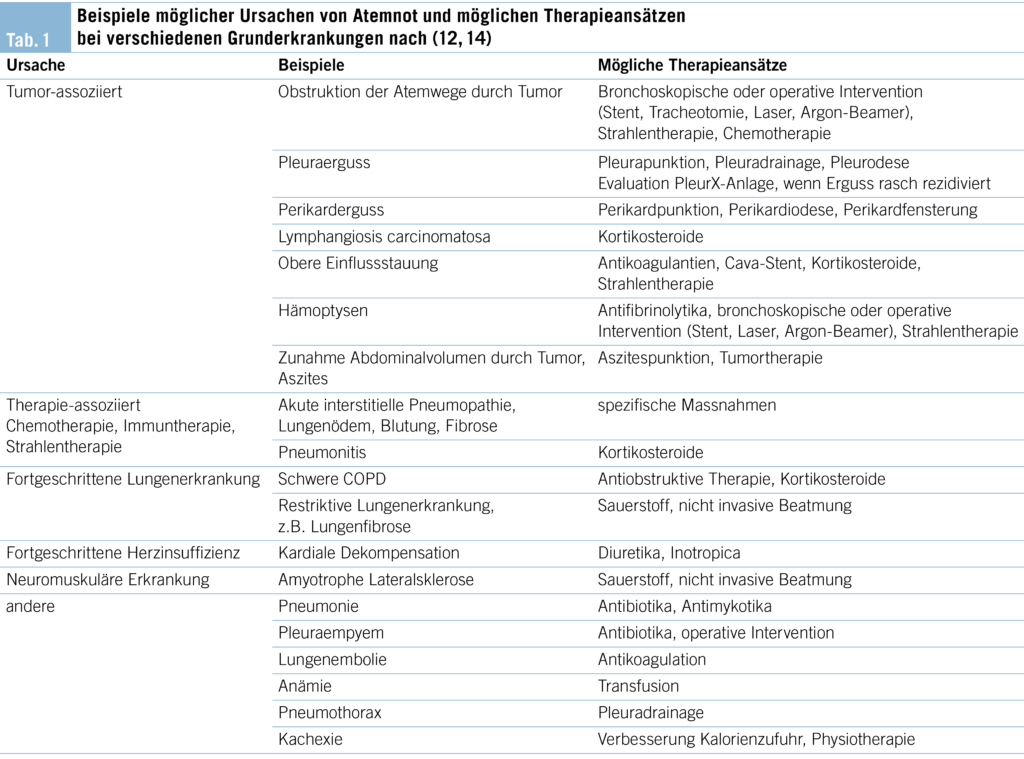
Die zugrunde liegende Ätiologie der Dyspnoe ist sehr vielfältig. Tabelle 1 zeigt Beispiele auf. Häufig, gerade bei Fortschreiten der Grunderkrankung liegen auch mehrere Ursachen vor (Tabelle 1).
Multidimensionales Modell bei komplexer Belastung
Die Intensität der subjektiv erlebten Dyspnoe lässt sich nicht zuverlässig aufgrund der Schwere der zugrunde liegenden Pathologie vorhersagen. Es kann eine hohe affektive Komponente bestehen, die durch persönliche, emotionale und erwartungsbezogene Faktoren beeinflusst wird (12, 15).
Das subjektive Erleben der Dyspnoe, die damit verbundene Funktionseinschränkung und multidimensionale Belastung begünstigen die Entstehung und den Erhalt eines Circulus vitiosus. Dieser komplexe Zusammenhang wird im Modell breathing–thinking–functioning (9, 10) anschaulich beschrieben und ermöglicht mit diesem Verständnis auch einen Behandlungsansatz:
Dyspnoe (breathing): führt zu dysfunktionalen Atemmustern mit Einsatz von Atemhilfsmuskulatur, Steigerung der Atemfrequenz, relativer Erhöhung des Totraumvolumens und Verringerung der alveolären Ventilation, was wiederum zu ineffizienter Atmung und erhöhter Atemarbeit führt.
Denken (thinking): Angst und Panik, die durch Dyspnoe ausgelöst werden, verstärken die Wahrnehmung der Dyspnoe und führen weiterhin zu einer Steigerung der Atemfrequenz und Erhöhung der Muskelspannung.
Funktionsfähigkeit (functioning): Um Dyspnoe zu vermeiden, reduzieren Patient/-innen häufig ihre körperliche Aktivität, dies führt zu muskulärer Dekonditionierung und begünstigt damit wiederum die Dyspnoe. Vermehrter Unterstützungsbedarf und soziale Isolation sind die Folgen und begünstigen ihrerseits das Vermeidungsverhalten.
Bedeutung für die Patient/-innen
Bei fortschreitender unheilbarer Erkrankung sowohl bei onkologischen als auch bei nicht onkologischen Erkrankungen gilt Dyspnoe als prognostisch ungünstiger Parameter.
Das Symptom wird häufig als massiv belastend und bedrohlich erlebt und ist mit Angst und Erstickungsängsten verbunden. Der Alltag der Patient/-innen ist stark durch die Limitationen der Dyspnoe geprägt und neben der Erschöpfung und eingeschränkten Mobilität hat das Symptom einen grossen Einfluss auf die eigene soziale Rolle, die nur eingeschränkt oder nicht mehr gelebt werden kann, und kann bis hin zur sozialen Isolation führen. Folgen können existenzielle Belastungssituationen, Hoffnungslosigkeit und Depression sein und sind gehäuft mit dem Wunsch einer palliativen Sedierung oder Sterbewunsch assoziiert (31).
Beurteilung und Erfassung, oder Dyspnoe ist das, was Patient/-innen sagen
In Anbetracht der massiven Auswirkungen der Dyspnoe auf die Lebensqualität und Lebenszeit der Patient/-innen ist die frühzeitige Erfassung und die individuelle Bedeutung der Dyspnoe von hoher Relevanz. Dennoch wird Dyspnoe beim chronischen Atemnotsyndrom oder bei akuter auf chronischer Atemnot als ein unterbehandeltes Symptom beschrieben, dessen Auswirkungen auf das Wohlbefinden der Patient/-innen und deren Angehörigen, im Gegensatz zu Schmerzen, massiv unterschätzt und damit zum unsichtbaren Symptom wird (6, 8).
Da es sich gemäss Definition um eine subjektive Erfahrung handelt, soll dementsprechend eine subjektive Erfassung des Symptoms erfolgen. Weiterhin ist es wichtig, neben der physischen und funktionalen Dimension auch die affektive und soziale Dimension zu erfassen, um Faktoren, die die Dyspnoe verstärken, zu identifizieren. Die Erfassung soll dabei regelmässig wiederholt werden (Box 1).
Als einfache Instrumente im ambulanten Setting oder im Stationsalltag eignen sich kategoriale Instrumente wie die Visuelle-Analog-Skala, VAS (keine–leichte–moderate–schwere Dyspnoe), oder numerische wie die Numerische-Rating-Skala, NRS (0–10). Diese eignen sich auch, um den Behandlungserfolg von eingeleiteten Massnahmen zu überprüfen. Wenn Patienten kognitiv eingeschränkt sind, ist eine Fremdeinschätzung durch die Angehörigen oder die Gesundheitsfachpersonen im Versorgungsnetz relevant (3–5, 10, 12).
Leitfragen beim Assessment können sein:
– Wie schwer/stark ist Ihre Luftnot? Jetzt? In den letzten 24 Stunden? Bei Anstrengung?
– Leiden Sie unter Atemnotattacken? Wie stark sind diese? Wie häufig und in welchen Situationen treten sie auf?
– Wie stark/schwer sind mit der Luftnot unangenehme Gefühle (z. B. Angst, Panik) verbunden?
– Wie stark sind Sie durch die Luftnot in Ihrem täglichen Leben beeinträchtigt?
Offene empathische Fragen können das individuelle Bild der Dyspnoe vervollständigen, dabei kann es hilfreich sein, Redewendungen zu verwenden, wie «für Ihre Behandlung möchte ich besser verstehen, welche Belastungen bei Ihnen mit der Luftnot einhergehen» oder «Was ist besonders belastend für Sie?»:
– Wie sieht Ihr Alltag mit der Luftnot aus? Können Sie sich selbst versorgen? Können Sie an sozialen Aktivitäten teilnehmen?
– Haben Sie Situationen erlebt, in denen Sie Angst, Panik oder Erstickungsangst hatten?
– Haben Sie Sorge, durch die Luftnot und die damit verbundenen Einschränkungen Ihre Angehörigen zu belasten?
Wichtig ist neben den Belastungen und Defiziten, auch mögliche Strategien zu erfragen, die die Patient/-innen bereits als positiv erlebt haben.
– Gibt es Massnahmen, die Ihnen bereits geholfen haben?
Objektive Parameter, wie zum Beispiel Sauerstoffsättigung, Lungenfunktionstests oder Atemfrequenz korrelieren nur mässig mit dem subjektiven Erleben der Dyspnoe (12, 15).
Um eine adäquate Behandlungsplanung zu ermöglichen, ist es weiterhin bedeutend, Krankheitsverständnis und Behandlungswünsche der Patient/-innen zu erfragen (18–20, 32).
– Wurde die Prognose ausreichend verstanden?
– Welche Ängste und Sorgen bestehen?
– Welche Ziele sollen erreicht werden?
– Welche Belastungen durch Diagnostik und Therapie werden hierfür in Kauf genommen?
Behandlung und Management
Grundsätzlich sollte immer überlegt werden, welche Ursachen der Dyspnoe zugrunde liegen können und welche ursächlichen Behandlungsmöglichkeiten bestehen. Tabelle 1 gibt einen Überblick möglicher Therapiemassnahmen.
Diagnostik und therapeutische Massnahmen sollen dabei immer auch die individuelle Situation und die Behandlungswünsche bzw. das gewünschte Therapieziel der Patient/-innen berücksichtigen. Gerade bei fortgeschrittener Erkrankungssituation oder am Lebensende sind die Belastungen, die mit Diagnostik und Therapie der Ursachen verbunden sind, sorgfältig abzuwägen (Box 2). So sind beispielsweise interventionelle Massnahmen bei einer Tage–Wochen dauernden Lebensdauer zu hinterfragen, ob die mit der Intervention verbundene Belastung überhaupt zumutbar ist und der mögliche Nutzen tatsächlich in der verbleibenden Lebenszeit erreichbar ist. Bei fortschreitender Erkrankung sollen die Behandlungswünsche in Bezug auf Diagnostik und Interventionen wie lebensverlängernde Massahmen regelmässig evaluiert werden. Symptomatische Therapiemassnahmen sind parallel empfohlen (12).
Die im folgenden genannten Therapieempfehlungen beziehen sich auf die symptomatische Linderung von therapierefraktärer Dyspnoe/chronischem Dyspnoesyndrom.
Aufgrund der oben beschriebenen multidimensionalen Belastung, die nicht notwendigerweise mit dem Ausmass der Pathologie korreliert, ist die alleinige Behandlung der ursächlichen Pathologie oft nicht ausreichend und ein multidimensionaler Therapieansatz von grundlegender Bedeutung, damit die Dyspnoe effektiv gelindert werden kann. Dabei sind allgemeine Massnahmen, nicht pharmakologische und pharmakologische Therapiemassnahmen zu berücksichtigen. Die Edukation von Patient/-innen zu Techniken und Verhaltensweisen, die ihnen ein Selbstmanagement der Dyspnoe ermöglichen, ist enorm wichtig. Durch die Fähigkeit, Situationen mit schwerer Atemnot oder Atemnotattacken zu kontrollieren, können Selbstvertrauen, Eigeninitiative und Sicherheitsgefühl gefördert und damit die Lebensqualität verbessert werden. Ausserdem sollen aufgrund der hohen affektiven Komponente der Dyspnoe Massnahmen zur Angstreduktion Teil des Therapiekonzeptes sein (16, 17).
Ziel ist es, eine gute Symptomkontrolle für die Patient/-innen zu ermöglichen und den oben beschriebenen Circulus vitiosus zu unterbrechen.
Es ist empfehlenswert, gemeinsam mit den Patient/-innen und Angehörigen einen Behandlungsplan für Notfallsituationen zu erstellen. Dieser Plan sollte neben medikamentösen Massnahmen auch allgemeine Massnahmen und ggf. einfach durchzuführende Übungen umfassen, die Patient/-innen allein oder mit Unterstützung von Angehörigen durchführen können (Box 3). Dies kann massgeblich zur Verbesserung der Symptomkontrolle und zu Verringerung von Hektik und Angst beitragen (10, 17, 20, 21).
Eine innovative Entwicklung in der multimodalen Behandlung von Atemnot ist die Einführung von sogenannten Atemnotservices oder Atemnotambulanzen, welche alle drei Pfeiler der Therapie (Allgemeinmassnahmen, nicht medikamentöse und medikamentöse Therapien) integrieren und individuell auf die Patient/-innen abstimmen (18–20).
Allgemeine und nicht pharmakologische Massnahmen (17, 22–24)
– Edukation und Information zu Selbstmanagement fördern Selbstwirksamkeit und können Ängste vermindern
– Anpassung Tagesplan mit Priorisierung von Aktivitäten und gutem Verhältnis von Aktivität und Pausen
– Selbst ruhig bleiben und Sicherheit für Patient/-innen und Angehörige vermitteln
– Kühlung des Gesichts durch frische Luft, Handfächer, Ventilator
– Erlernen von Atemtechniken
– Bequeme Sitz- oder Liegeposition finden
– Gehhilfen wir Rollator, Gehstock fördern zum einen die Mobilisierung und verlängern die Gehstrecke, vermutlich durch Unterstützung der Atemhilfsmuskulatur aufgrund Stabilisierung des Schultergürtels
– Entspannungsübungen zur Modulation der affektiven Komponente
– Erstellung Behandlungsplan/Notfallplan
Pharmakologische Massnahmen
Opioide
Derzeit sind Opioide die einzige Substanzgruppe mit ausreichender Evidenz in Studien zur symptomatischen Behandlung der therapierefraktären Dyspnoe bei Patient/-innen mit Tumoren oder ALS (25, 26). Dabei führen Opioide zu einer veränderten Wahrnehmung der Dyspnoe und zu einer Ökonomisierung der Atmung. Es gibt zahlreiche Studien, die die positive Wirkung von Opioiden bei der Linderung von Dyspnoe bei Patient/-innen mit malignen Erkrankungen belegen (28). Es gibt keinen Hinweis, dass eine adäquat durchgeführte Therapie der therapierefraktären Atemnot mit Opioiden zu einer klinisch relevanten Atemdepression führt (26, 27).
Bei Patient/-innen mit COPD oder Herzinsuffizienz war bislang auch von einem Benefit ausgegangen worden, der vor dem Hintergrund neuer Studien neu bedacht werden muss. So konnte gezeigt werden, dass es bei Patient/-innen mit COPD zwar eine Untergruppe von «Super-Respondern» gibt, die stark von der Opioidtherapie profitiert haben, andere jedoch keinen positiven Effekt bei Nebenwirkungen hatten (29). Für Patient/-innen mit Herzinsuffizienz konnte eine Metaanalyse zeigen, dass Opioide nicht zuverlässig wirken, keine der eingeschlossenen Studien zeigte eine signifikante Linderung der belastenden Atemnot durch Opioide, wobei keine Subgruppenanalyse der stark betroffenen Patient/-innen Stadium IV (NYHA) durchgeführt werden konnte (30). Für die Patient/-innen mit kardiorespiratorischen Erkrankungen und chronischem Atemnotsyndrom ergibt sich hieraus die Empfehlung einer sorgfältigen Patientenauswahl und vorsichtigem Titrationsversuch.
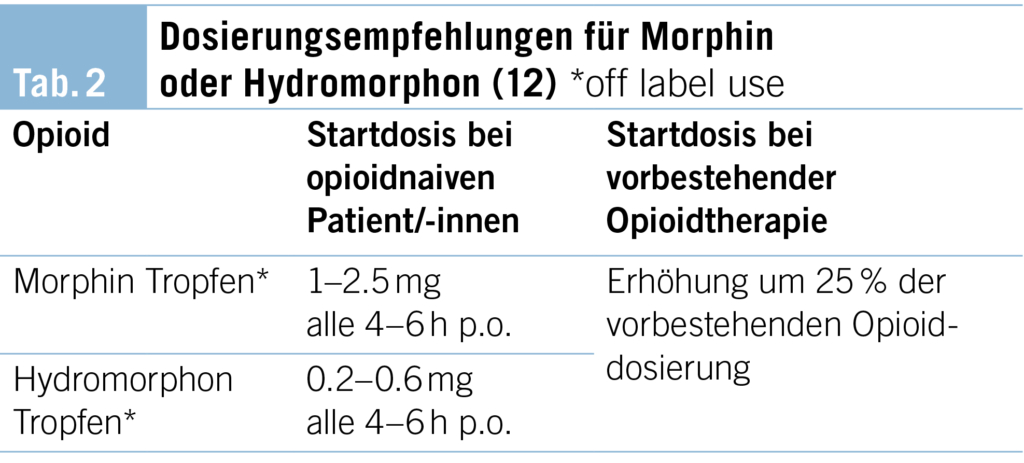
Die für die Linderung von Atemnot erforderlichen Opioiddosierungen sind in der Regel niedriger als in der Schmerztherapie. Übliche Anfangsdosierungen liegen bei 2.5 mg Morphin alle vier–sechs Stunden für Tumorpatienten und bei 1 mg alle vier–sechs Stunden für Nichttumorpatienten. Eine Symptomlinderung bei einer Tagesdosis von 10–20 mg Morphin p. o. kann für die Mehrheit der Patient/-innen erreicht werden (12) (Tabelle 2).
Gesundheitsfachpersonen und Patient/-innen können Sorge vor sedierender Nebenwirkung der Opioide haben, hier soll aktiv informiert werden, dass dies bei niedrigen Dosierungen und einer vorsichtigen Titration nicht zu erwarten ist.
Bei Atemnotattacken bzw. Verstärkung der Dyspnoe bei Belastung soll geprüft werden, ob eine Einnahme der Opioidreserve vor der (zu erwartenden) Belastung hilfreich sein kann.
Bei Patient/-innen mit Niereninsuffizienz muss auf Nebenwirkungen durch Kumulation der Morphinmetabolite geachtet werden. Es sollte die Wahl des Opioids anhand der klinischen Situation und dem Schweregrad der Niereninsuffizienz angepasst werden, wobei die Dosis reduziert und/oder das Dosierungsintervall verlängert werden kann. In der klinischen Praxis kann Hydromorphon für Patient/-innen mit Niereninsuffizienz empfohlen werden, wobei die Studienlage hier begrenzt ist (12).
Bei der Anwendung von Opioiden zur Linderung von Atemnot gelten die gleichen präventiven Massnahmen zur Vermeidung von Nebenwirkungen wie bei der Schmerztherapie. Dazu gehören beispielsweise eine dauerhafte Prophylaxe gegen Verstopfung und gegebenenfalls Antiemetika.
Benzodiazepine
Benzodiazepine wie Lorazepam und Midazolam werden seit Langem in der klinischen Praxis zur Behandlung von Atemnot bei fortgeschrittenen Erkrankungen eingesetzt und von vielen Therapierichtlinien empfohlen. Die klinische Erfahrung wird positiv bewertet, insbesondere bei Patient/-innen mit hoher affektiver Komponente. Jedoch konnte in einer systematischen Literaturübersicht und Metaanalyse keine statistisch signifikante Wirksamkeit nachgewiesen werden, obwohl eine Tendenz zur Linderung erkennbar ist (33). Eine mögliche Erklärung dafür ist, dass Benzodiazepine möglicherweise weniger die Intensität der Atemnot reduzieren (wie es in den Studien gemessen wurde), sondern eher den Umgang mit Atemnot verbessern.
Es besteht ein enger klinischer Zusammenhang zwischen Atemnot und Angst, und oft verbessert sich subjektiv die Atemnot nach einer Behandlung der Angst. Dies wird auch durch die gute Wirksamkeit von Entspannungstechniken zur Behandlung von Atemnotattacken bestätigt. Daher kann es sinnvoll sein, den oben beschriebenen Circulus vitiosus zwischen Angst und Atemnot, gerade bei Atemnotattacken, zu durchbrechen, indem man die Behandlung der Dyspnoe mit Opioiden mit Benzodiazepinen ergänzt. Dies ist auch in der fortgeschrittenen Krankheitssituation oder in der Sterbephase bei hoher affektiver Komponente sinnvoll. Prinzipiell sollten niedrige Startdosen gewählt werden und vorsichtig unter Berücksichtigung der Wirkung und möglichem sedierenden Effekt titriert werden. Am Lebensende sind, insbesondere bei gleichzeitig bestehender Unruhe, möglicherweise höhere Dosierungen notwendig (Tabelle 3).
Sauerstoff und Beatmung
Patient/-innen mit schwerer Hypoxämie, wie etwa in der Langzeittherapie der COPD, können von der Verabreichung von Sauerstoff profitieren. Derzeit wird der Benefit von hoch dosierten Sauerstoffgaben (high flow) untersucht. Die Indikation zur Sauerstoffgabe wird jedoch oft zu häufig und ohne genügende kritische Überlegung gestellt. Es konnte gezeigt werden, dass bei Krebspatient/-innen ohne Hypoxämie keine signifikanten Vorteile durch Sauerstoff im Vergleich zur Verwendung von Raumluft zur Symptomlinderung erreicht werden.
Die Entscheidung zur Sauerstofftherapie sollte strengen Kriterien folgen, da die Sauerstoffgabe auch potenzielle Nebenwirkungen wie Austrocknung der Schleimhäute, Bewegungseinschränkungen und unnötige Hospitalisierungen mit sich bringen kann. In der Sterbephase ist selten ein Benefit der Sauerstofftherapie zu erwarten. Es wird daher empfohlen, Sauerstoff, falls überhaupt, individuell bei jedem Patienten zu testen (34).
Manche Patientengruppen können von nicht invasiver Maskenbeatmung (beispielsweise COPD, ALS) profitieren, dies sollte in enger Zusammenarbeit mit den behandelnden Pneumologen evaluiert werden.
Dyspnoe in der Sterbephase
Dyspnoe und Angst stellen die häufigsten und äusserst belastende Symptome in der Sterbephase dar, sowohl für die Patienten selbst als auch für ihre Angehörigen und die Gesundheitsfachpersonen. Etwa 70–80 % der Patient/-innen mit fortgeschrittener Krebserkrankung leiden in den letzten Lebenstagen unter Dyspnoe (12, 14). Aufgrund der oft eingeschränkten Kommunikationsfähigkeit in diesem Stadium ist die Einschätzung der Symptomlast durch Angehörige und Gesundheitsfachpersonen von entscheidender Bedeutung. Klinische Anzeichen wie Unruhe, Mimik, Schwitzen, erhöhte Atemfrequenz und Anstrengung sind wichtige Faktoren bei der Beurteilung. Es ist wichtig, die Angehörigen über normale Veränderungen der Atmung in der Sterbephase aufzuklären, wie z.B. Rasselatmung, und sie professionell zu unterstützen.
Bei Unruhezuständen ist es entscheidend, mögliche körperliche Ursachen wie Schmerzen, Harnverhalt, Obstipation und Delir zu identifizieren und gegebenenfalls zu behandeln. Informationen über die Biografie und Vorerkrankungen der Patient/-innen oder der Angehörigen können dabei wertvoll sein. Neben der Behandlung behebbarer Ursachen bei Angst- und Unruhezuständen ist es wichtig, für eine ruhige Umgebung, vertrauensvolle Kommunikation und Kontinuität in der Betreuung zu sorgen.
Die medikamentöse Therapie erfolgt in der Regel mit Opioiden sowie Benzodiazepinen bei Angst und Unruhe. Dabei soll die Dosis unter regelmässiger Evaluation der Wirkung und möglicher Nebenwirkungen titriert werden. Die Applikation erfolgt meist parenteral, entweder subkutan oder intravenös.
Patient/-innen mit Krankheiten, bei denen Dyspnoe am Lebensende wahrscheinlich ist, benötigen eine einfühlsame und offene Kommunikation im Vorfeld, dabei stehen die Ängste und Wünsche der Patient/-innen im Mittelpunkt. Information und Diskussion über die Möglichkeit einer palliativen Sedierung bei unaushaltbarem Leiden kann für die Patient/-innen und Angehörigen entlastend sein.
Abteilung für Palliative Care, Departement Theragnostik, Universitätsspital Basel, Basel
Die Autorin hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Wee B, Browning J, Adams A, Benson D, Howard P, Klepping G, et al. Management of chronic cough in patients receiving palliative care: review of evidence and recommendations by a task group of the Association for Palliative Medicine of Great Britain and Ireland. Palliat Med. 2012;26(6):780-787. doi:10.1177/0269216311423793Palliat Med 2012; 26: 780-7 32.
2. Teunissen SC, Wesker W, Kruitwagen C, de Haes HC, Voest EE, de Graeff A. Symptom prevalence in patients with incurable cancer: a systematic review. J Pain Symptom Manage. 2007;34(1):94-104. doi:10.1016/j.jpainsymman.2006.10.015
3. Parshall MB, Schwartzstein RM, Adams L, Banzett RB, Manning HL, Bourbeau J, et al. An official American Thoracic Society statement: update on the mechanisms, assessment, and management of dyspnea. Am J Respir Crit Care Med. 2012;185(4):435-452. doi:10.1164/rccm.201111-2042ST
4. Johnson MJ, Yorke J, Hansen-Flaschen J, Lansing R, Ekström M, Similowski T, et al. Johnson, M.J., et al. Towards an expert consensus to delineate a clinical syndrome of chronic breathlessness. Eur Respir J. 2017;49(5):1602277. Published 2017 May 25. doi:10.1183/13993003.02277-2016
5. Ahmadi Z, Sandberg J, Shannon-Honson A, Vandersman Z, Currow DC, Ekström M. Is chronic breathlessness less recognised and treated compared with chronic pain? A case-based randomised controlled trial. Eur Respir J. 2018;52(3):1800887. Published 2018 Sep 15. doi:10.1183/13993003.00887-2018
6. Hutchinson A, Johnson MJ, Currow D. Acute-on-Chronic Breathlessness: Recognition and Response. J Pain Symptom Manage. 2019;57(5):e4-e5. doi:10.1016/j.jpainsymman.2019.01.012
7. Gysels M, Higginson IJ. Access to services for patients with chronic obstructive pulmonary disease: the invisibility of breathlessness. J Pain Symptom Manage. 2008;36(5):451-460. doi:10.1016/j.jpainsymman.2007.11.008
8. Spathis A, Booth S, Moffat C, Hurst R, Ryan R, Chin C, et al. The Breathing, Thinking, Functioning clinical model: a proposal to facilitate evidence-based breathlessness management in chronic respiratory disease. NPJ Prim Care Respir Med. 2017;27(1):27. Published 2017 Apr 21. doi:10.1038/s41533-017-0024-z
9. Booth S, Burkin J, Moffat C, et al. Managing breathlessness in clinical practice. London: Springer, 2014.
10. Simon ST, Higginson IJ, Benalia H, Gysels M, Murtagh FE, Spicer J, et al. Episodes of breathlessness: types and patterns – a qualitative study exploring experiences of patients with advanced diseases. Palliat Med. 2013;27(6):524-532. doi:10.1177/0269216313480255
11. Erweiterte S3-Leitlinie Palliativmedizin für Patienten mit einer nicht-heilbaren Krebserkrankung
Langversion 2.2 – 2020 (Internet).(abgerufen am 24.Februar 2024). Verfügbar unter: https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Palliativmedizin/Version_2/LL_Palliativmedizin_Langversion_2.2.pdf
12. Nuñez S, Hexdall A, Aguirre-Jaime A. Unscheduled returns to the emergency department: an outcome of medical errors?. Qual Saf Health Care. 2006;15(2):102-108. doi:10.1136/qshc.2005.016618
13. Pautex S Dyspnoe. In: Handbuch Palliativmedizin, Bern: Hogrefe; 2021. 101-106
14. von Leupoldt A, Balewski S, Petersen S, Taube K, Schubert-Heukeshoven S, Magnussen H, et al. Verbal descriptors of dyspnea in patients with COPD at different intensity levels of dyspnea. Chest. 2007;132(1):141-147. doi:10.1378/chest.07-0103
15. Booth S, Moosavi SH, Higginson IJ. The etiology and management of intractable breathlessness in patients with advanced cancer: a systematic review of pharmacological therapy. Nat Clin Pract Oncol. 2008;5(2):90-100. doi:10.1038/ncponc1034
16. Simon ST, Weingärtner V, Higginson IJ, Benalia H, Gysels M, Murtagh FEM et al. «I Can Breathe Again!» Patients’ Self-Management Strategies for Episodic Breathlessness in Advanced Disease, Derived From Qualitative Interviews. J Pain Symptom Manage. 2016;52(2):228-234. doi:10.1016/j.jpainsymman.2016.02.016
17. Bausewein C, Schunk M, Schumacher P, Dittmer J, Bolzani A, Booth S. Breathlessness services as a new model of support for patients with respiratory disease. Chron Respir Dis. 2018;15(1):48-59. doi:10.1177/1479972317721557
18. Booth S, Moffat C, Farquhar M, Higginson IJ, Burkin J. Developing a breathlessness intervention service for patients with palliative and supportive care needs, irrespective of diagnosis. J Palliat Care. 2011;27(1):28-36.
19. Higginson IJ, Bausewein C, Reilly CC, et al. An integrated palliative and respiratory care service for patients with advanced disease and refractory breathlessness: a randomised controlled trial. Lancet Respir Med. 2014;2(12):979-987. doi:10.1016/S2213-2600(14)70226-7
20. Booth S, Moosavi SH, Higginson IJ. The etiology and management of intractable breathlessness in patients with advanced cancer: a systematic review of pharmacological therapy. Nat Clin Pract Oncol. 2008;5(2):90-100. doi:10.1038/ncponc1034
21. Probst VS, Troosters T, Coosemans I, et al. Mechanisms of improvement in exercise capacity using a rollator in patients with COPD. Chest. 2004;126(4):1102-1107. doi:10.1378/chest.126.4.1102
22. Solway S, Brooks D, Lau L, Goldstein R. The short-term effect of a rollator on functional exercise capacity among individuals with severe COPD. Chest. 2002;122(1):56-65. doi:10.1378/chest.122.1.56
23. Bausewein C, Booth S, Gysels M, Higginson I. Non-pharmacological interventions for breathlessness in advanced stages of malignant and non-malignant diseases. Cochrane Database Syst Rev. 2008;(2):CD005623. Published 2008 Apr 16. doi:10.1002/14651858.CD005623.pub2
24. Barnes H, McDonald J, Smallwood N, Manser R. Opioids for the palliation of refractory breathlessness in adults with advanced disease and terminal illness. Cochrane Database Syst Rev. 2016;3(3):CD011008. Published 2016 Mar 31. doi:10.1002/14651858.CD011008.pub2
25. Ekström M, Bajwah S, Bland JM, Currow DC, Hussain J, Johnson MJ. One evidence base; three stories: do opioids relieve chronic breathlessness?. Thorax. 2018;73(1):88-90. doi:10.1136/thoraxjnl-2016-209868
26. Jennings AL, Davies AN, Higgins JP, Broadley K. Opioids for the palliation of breathlessness in terminal illness. Cochrane Database Syst Rev. 2001;(4):CD002066. doi:10.1002/14651858.CD002066
27. Johnson MJ, Abernethy AP, Currow DC. Gaps in the evidence base of opioids for refractory breathlessness. A future work plan?. J Pain Symptom Manage. 2012;43(3):614-624. doi:10.1016/j.jpainsymman.2011.04.024
28. Ekström M, Ferreira D, Chang S, Louw S, Johnson MJ, Eckert DJ, et al. Effect of regular, low-dose, extended-release morphine on chronic breathlessness in chronic obstructive pulmonary disease: the BEAMS randomized clinical trial. JAMA. 2022;328(20):2022–32.
29. Gaertner J, Fusi-Schmidhauser T, Stock S, Siemens W, Vennedey V. Effect of opioids for breathlessness in heart failure: a systematic review and meta-analysis. Heart. 2023;109(14):1064-1071. Published 2023 Jun 26. doi:10.1136/heartjnl-2022-322074.
30. Chochinov HM, Tataryn D, Clinch JJ, Dudgeon D. Will to live in the terminally ill. Lancet. 1999 Sep 4;354(9181):816-9. doi: 10.1016/S0140-6736(99)80011-7. PMID: 10485723.
31. Serious Illness Care Program, der Zukunftsdialog.(Internet).(abgerufen am 28.Februar 2024). Verfügbar unter: https://www.wuerdezentrum.de/wp-content/uploads/2023/03/Handbuch-Zukunftsdialog.
32. Simon ST, Higginson IJ, Booth S, Harding R, Weingärtner V, Bausewein C. Benzodiazepines for the relief of breathlessness in advanced malignant and non-malignant diseases in adults. Cochrane Database Syst Rev. 2016 Oct 20;10(10):CD007354. doi: 10.1002/14651858.CD007354.pub3. PMID: 27764523; PMCID: PMC6464146.
33. Abernethy AP, McDonald CF, Frith PA, Clark K, Herndon JE 2nd, Marcello J, et al. Effect of palliative oxygen versus room air in relief of breathlessness in patients with refractory dyspnoea: a double-blind, randomised controlled trial. Lancet. 2010 Sep 4;376(9743):784-93. doi: 10.1016/S0140-6736(10)61115-4. PMID: 20816546; PMCID: PMC2962424
34. Gesundheitliche Vorausplanung beider Basel. (Internet). (abgerufen am 05.April 2024). Verfügbar unter: https://www.gesundheitliche-vorausplanung-bb.ch
Therapeutische Umschau
- Vol. 81
- Ausgabe 4
- August 2024