- EoE und EGIDs – Eosinophile Ösophagitis und Eosinophile Gastrointestinale Erkrankungen
Die eosinophile Ösophagitis (EoE) wurde in den 1990er Jahren erstmals beschrieben als «orphan disease», dessen Inzidenz und Prävalenz in den letzten 20 Jahren jedoch drastisch zugenommen hat. Es handelt sich bei der EoE mittlerweile um die häufigste Ursache einer Dysphagie im jungen Erwachsenenalter. Die EoE wird endoskopisch diagnostiziert (mit Biopsien aus dem Ösophagus). Die Therapieoptionen bestehen aus diätetischen Massnahmen und Medikamenten. Zu letzteren zählen PPI (als off-label Medikation) sowie die zugelassenen Medikamente Jorveza (Budesonid, topisches Kortisonpräparat) und der monoklonale Antikörper Dupixent (Dupilumab, subkutan). Das Therapieansprechen ist hoch und das Langzeit-Outcome, wenn frühzeitig therapiert, exzellent. Häufig bleibt die Erkrankung jedoch unentdeckt, meist aufgrund von Kompensationsmechanismen seitens der Patient/-innen. Deutlich seltener als die EoE sind die Nicht-EoE eosinophilen gastrointestinalen Erkrankungen (EGIDs), bei denen die eosinophile Gewebeinfiltration in gastrointestinalen Segmenten distal des Ösophagus zu finden ist. Deren klinische Präsentation ist häufig unspezifisch. Pathophysiologisch sind Überlappungen mit der EoE vorhanden. Auch die Therapien erfolgen in Analogie zur EoE. Es ist mit einer steigenden Prävalenz und Inzidenz zu rechnen.
Einleitung
Während die eosinophile Ösophagitis (EoE) mittlerweile eine bekannte und relativ häufige Erkrankung darstellt, waren die eosinophile Gastritis, Gastroenteritis, Enteritis und Kolitis lange eine absolute Rarität. Aufgrund tiefer Fallzahlen, der unspezifischen klinischen Präsentation und der fehlenden diagnostischen Kriterien blieben deren Beziehung zur EoE unklar. Zudem bestand ein diagnostisches und begriffliches Durcheinander, was die Erkennung und Behandlung der eosinophilen Erkrankungen erschwerte. Die weltweit steigende Prävalenz, die zunehmende «Awareness» und v.a. eine kürzliche erschienene Konsensus-Publikation (1) schaffen dem nun Abhilfe. Neu wird der Terminus EGIDs (eosinophilic gastrointestinal diseases) als Überbegriff für alle eosinophilen Erkrankungen des Magen-Darm-Trakts verwendet, einschliesslich der EoE. Die EGIDs (deutsch: eosinophile gastrointestinale Erkrankungen) werden aufgeteilt in die EoE und die Nicht-EoE EGIDs. Bei Letzteren handelt es sich um eher seltene, aber zunehmend diagnostizierte chronisch-entzündliche Erkrankungen, gekennzeichnet durch gastrointestinale Symptome und endoskopische Veränderungen mit dem histologischen Nachweis einer erhöhten Anzahl an eosinophilen Granulozyten in der Schleimhaut der betroffenen gastrointestinalen Abschnitte. Je nach Verteilung der Eosinophilen kann es sich dann um die Subformen der eosinophilen Gastritis, Enteritis oder Kolitis handeln. Da die Eosinophilie jedoch häufig mehrere Abschnitte betrifft, ist der Terminus EGID zu bevorzugen. Davon abzugrenzen ist das idiopathische Hypereosinophilie-Syndrom mit gastrointestinaler Beteiligung. Zwar kann auch hier eine Eosinophilie im Magen-Darm-Trakt nachgewiesen werden, die Erkrankung ist jedoch nicht lokalisiert, sondern systemisch. Zentral in der Diagnostik all dieser Entitäten, sowohl EoE, Nicht-EoE EGIDs als auch der Hypereosinophilie ist der Ausschluss von sekundären Ursachen einer Eosinophilie (wie z.B. parasitäre Erkrankungen, unerwünschte Medikamenten-Nebenwirkungen, rheumatologische Systemerkrankungen oder ein banaler gastro-ösophagealer Reflux).
Den Erkrankungen gemeinsam ist eine Th2-induzierte und somit immun-vermittelte Entzündung der Schleimhaut mit einem erhöhten Eosinophileninfiltrat im Gewebe, wobei die Tiefe der betroffenen Gewebeschichten zwischen EoE und Nicht-EoE EGIDs variiert. Bei der EoE finden sich die Eosinophilen im Epithel (und teilweise in der Lamina propria), während bei den Nicht-EoE EGIDs Mukosa, alle Schichten (=transmural) und die Serosa betroffen sein können. Die EoE ist eine von den Nicht-EoE EGIDs eindeutig abgrenzbare Entität: sie ist lokalisiert (Ösophagus), betrifft die oberflächlichen Wandschichten (Epithel, Lamina propria), präsentiert sich häufig typisch (Dysphagie) und ist in der Regel einfach behandelbar (gutes Ansprechen auf Steroide). Demgegenüber steht die unspezifische Klinik der Nicht-EoE EGIDs, welche selten lokalisiert sind, eine diffuse Verteilung zeigen, und häufig ein tieferes Therapieansprechen zeigen. Eine EGID mit zusätzlicher Eosinophilie in den Ösophagusbiopsien ist somit klar von der klassischen EoE abzugrenzen. Man spricht dann von einer EGID mit ösophagealer Beteiligung. Die Krankheitsursachen sind komplex, wobei einerseits genetische Prädisposition (2, 3) aber auch Umwelt-Einflüsse (4) eine Rolle spielen. Im Folgenden gehen wir näher auf das bekannte Krankheitsbild der EoE ein, sowie in einem zweiten Abschnitt auf die jüngere Gruppe der EGIDs, wobei wir auf die Fortschritte in den letzten Jahren fokussieren, was zu einer deutlichen Entwirrung dieser unspezifischen Krankheitsgruppe geführt hat.
Eosinophile Ösophagitis
Die EoE ist eine chronische immun-vermittelte entzündliche Erkrankung des Ösophagus, welche durch mindestens 15 eosinophile Granulozyten im Epithel des Ösophagus gekennzeichnet ist (5). Eine unbehandelte EoE führt vom initial entzündlichen Phänotypen zu Bindegewebsveränderungen mit narbigen Strikturen/Stenosen des Ösophagus, welche das Risiko für komplette Speiseröhren-Obstruktionen (Bolusimpaktationen) deutlich steigern (6). Somit sind die frühzeitige Erkennung und Diagnosestellung äusserst wichtig. Männer sind im Vergleich zu Frauen 3x häufiger betroffen und die Diagnose erfolgt in der Regel im Kindes- und jungen Erwachsenenalter, wobei jedoch alle Alterskategorien betroffen sein können. Im Durchschnitt dauert es etwa fünf Jahre vom Symptombeginn bis zur Diagnosestellung der EoE. Trotz erhöhter «Awareness» hat sich in den letzten Jahren die diagnostische Verzögerung nicht verkürzt, was darauf zurückzuführen ist, dass sich die Patient/-innen relativ spät vorstellen (7). Häufig ist ihnen der Krankheitswert der Dysphagie nicht bewusst und sie haben sich mithilfe von Kompensationsmechanismen daran gewöhnt. Somit wird die Diagnose auch in der Schweiz immer noch eher spät, oft erst im Rahmen von Bolusimpaktationen, gestellt.
Wie den Atopien liegt auch der EoE pathophysiologisch eine durch Th2-Helferzellen induzierte Immunantwort zugrunde, an welcher die Zytokine Eotaxin-3, Interleukin-(IL-) 4, IL-5, IL-13 und die hierdurch rekrutierten Eosinophilen und Mastzellen beteiligt sind (8). Bei der EoE führt der Kontakt mit Eiweissbestandteilen gewisser Nahrungsmittelkategorien (tierische Milch, Weizen, Eier, Nüsse, Soja oder Meeresfrüchte) zur Triggerung dieser Th2-Immunantwort (9). Es handelt sich hierin jedoch nicht um eine typische IgE vermittelte Allergie vom Typ 1. Eine Allergietestung (Prick, RAST) hat daher in der EoE Diagnostik keinen Stellenwert. Nichtsdestotrotz, sind atopische Komorbiditäten bei EoE Patient/-innen gehäuft anzutreffen. Bis zu 75% leiden zeitgleich an einer allergischen Rhinokonjunktivitis, einem Asthma oder einem atopischen Ekzem. Ob jedoch eine Atopie die Entwicklung einer EoE begünstigt, ist zum jetzigen Zeitpunkt weiterhin unklar (10).
Seit Längerem ist eine genetische Komponente der EoE bekannt, obwohl es sich nicht um eine klassische Erbkrankheit handelt. Die Erkrankung tritt gehäuft in Familien auf: Die Konkordanz beträgt bei eineiigen Zwillingen 58%, bei zweieiigen Zwillingen 36%, bei Nicht-Zwillingsgeschwister 2.4% (11). Allgemein wird von einem erhöhten familiären Risiko von 10- bis 68-fach ausgegangen. Genome-wide association studies (GWAS) haben zur Identifikation mehrerer Gene geführt, welche in der Pathogenese der EoE eine wichtige Rolle spielen. Zu diesen gehören (u.a.) Thymus-Stroma-Lymphopoietin (TSLP), Calpain 14 (CAPN14), EMSY, LRRC32, STAT6 und ANKRD27 (8). Da nur ein Teil des Auftretens durch die Heritabilität erklärt werden kann, spielen Umwelt-Einflüsse und epigenetische Mechanismen eine wahrscheinlich grössere Rolle (11). Zu den möglichen Umweltfaktoren zählen: in-utero Exposition (mütterliche Infektionen/Fieber), Geburt durch Sectio, PPI und Antibiotika-Gebrauch in der frühen Kindheit, saisonale und klimatische Begebenheiten sowie Veränderungen im Mikrobiom (12).
Prävalenz
Die EoE ist eine relativ junge Erkrankung mit ihrem Erstbeschrieb anfangs der 1990er Jahre, zeitgleich durch Stephen Attwood und Alex Straumann (13, 14). Lange Zeit blieb die EoE eine Rarität, mit dem Status einer so genannten «orphan disease». Studien konnten aber einen rasanten Anstieg der Prävalenz und Inzidenz nachweisen, dies in mehreren Ländern und Regionen der westlichen Welt. Aktuell geht man von einer Inzidenz von 5-10/100‘000 pro Jahr und einer Prävalenz von 50-100/100’000 aus. Die Zunahme der Häufigkeit kann nur teilweise durch einen Anstieg der Gastroskopien («disease awareness») erklärt werden. Die Gründe für den Anstieg in Prävalenz und Inzidenz bleiben unklar. Eine Erklärung ist die «epithelial barrier defect» Hypothese. Kürzlich konnte gezeigt werden, dass durch Detergenzien die Permeabilität in der ösophagealen Schleimhaut erhöht wird und somit potentielle Allergene einfacher eine Immunantwort triggern könnten (15). Auch Aero-allergene scheinen eine Rolle zu spielen. Eine weitere Möglichkeit scheint die veränderte Zusammensetzung der Milch aufgrund veränderter industrialisierter Milchproduktion, wobei diese Hypothesen erst getestet werden müssen. Zusammengefasst kann festgehalten werden, dass die EoE mittlerweile eine sehr häufige Erkrankung ist und die Häufigkeit bei 1:2000 bis 1:1000 liegt und somit in die Nähe von anderen chronisch entzündlichen Darmerkrankungen rückt (Morbus Crohn, Colitis ulcerosa).
Klinik und Diagnostik
Das klassischste Symptom der EoE ist die Dysphagie. Die EoE ist die häufigste Ursache der Dysphagie bei Adoleszenten und jungen Erwachsenen. Bei Kindern sind die Beschwerden vielfältig, sie sind oft schlechte Esser und leiden an Reflux-ähnlichen Symptomen, Erbrechen, Bauchschmerzen sowie Gedeihstörungen. Aber auch bei Erwachsenen kommen nebst der Dysphagie teilweise atypische Präsentationen vor mit Erbrechen, retrosternalen Schmerzen oder Bauchschmerzen. Häufig haben die Patient/-innen bereits gewisse «Coping»-Strategien entwickelt wie vermehrtes Nachtrinken, langsames Essen mit ausgeprägtem Kauen oder Vermeiden gewisser Speisen. Als gefährlichste Komplikation kann es zur Bolusimpaktation kommen, bei welcher Nahrungsbestandteile im Ösophagus stecken bleiben und weder nach unten in den Magen noch durch Erbrechen wieder herausbefördert werden können.
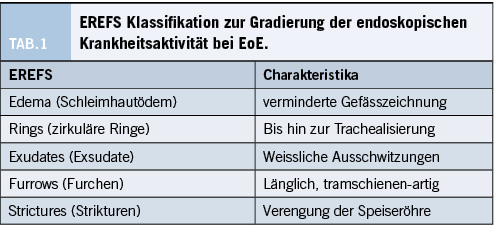
Der erste Schritt zur Abklärung einer Dysphagie für feste Speisen ist immer die obere Endoskopie. Bei der EoE können mehrere endoskopische Veränderungen vorhanden sein, welche in der endoskopischen Klassifikation EREFS zusammengefasst werden. Der EREFS Score reicht von 0 (keine Aktivität) bis 9 (maximale Aktivität). Hierbei handelt es sich um die folgenden Befunde (Tabelle 1) (16):
Diese Veränderungen können in allen möglichen Kombinationen auftreten. Schleimhautödem, weisses Exsudat und Furchen sprechen für eine akute Entzündung (inflammatorische Komponenten), während Ringe und Strikturen die Folge einer Fibrosierung darstellen (fibrostenotische Komponente).
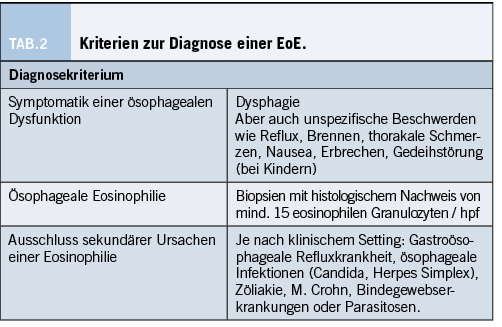
Zwar kann die EoE bereits aufgrund der Endoskopie vermutet werden, bestätigt ist sie aber erst durch die Biopsieentnahme. Zudem gibt es EoE Patient/-innen, bei denen sich der Ösophagus endoskopisch komplett unauffällig zeigt. Das Hauptkriterium in der EoE Diagnostik ist somit die ösophageale Eosinophilie mit mindestens 15 eosinophilen Granulozyten pro hochauflösendem Gesichtsfeld (high power filed, hpf) (17). Es ist jedoch gut bekannt, dass die Eosinophilen wohl nur einen Teil der Pathogenese ausmachen und evtl. sogar nur ein Bystander-Phänomen sind. Daher ist die Beschreibung von anderen EoE-typischen Veränderungen ebenso zentral. Hierzu gehören: Spongiose, Basalzonenhyperplasie, Infiltration mit Mastzellen und Lymphozyten sowie eine Fibrose der Lamina propria (18). Zusammengefasst sind folgende Kriterien nötig, um eine EoE zu diagnostizieren (Tabelle 2):
Die Präsenz von Symptomen ist zentral in der Diagnosestellung der EoE. Falls eine isolierte ösophageale Eosinophilie bei asymptomatischem Patient/-innen vorliegt, handelt es sich per definitionem nicht um eine EoE. In diesem Fall sei jedoch empfohlen, die Anamnese erneut und detailliert zu wiederholen. Häufig lassen sich Kompensationsmechanismen aufdecken, welche zur vermeintlich fehlenden Symptomatik führen (Bsp: Patient isst kein Fleisch mehr, langsames Essen, häufiges Nachtrinken). Zudem sei hier noch erwähnt, dass seit wenigen Jahren das Phänomen der sogenannten EoE-like Erkrankung (EoE-like disease, EoE variants) bekannt ist (19). Diese Patient/-innen präsentieren sich typisch für eine EoE, die Eosinophilen sind jedoch unter dem Wert von 15 pro hpf. Auch diese Werte haben eine gewisse Krankheitsrelevanz und eine Zuweisung an ein spezialisiertes EoE Zentrum sollte in Betracht gezogen werden (insbesondere, wenn der Leidensdruck hoch ist). Diese Patient/-innen scheinen von einer EoE Therapie zu profitieren. Unbehandelt geht die EoE-like disease in einem gewissen Prozentsatz in eine EoE über. Eine Langzeitbetreuung respektive ein regelmässiges Follow-up ist somit empfohlen.
Therapie
Die Behandlung der EoE zielt darauf ab, eine Linderung der Symptome mit Verbesserung der Lebensqualität der Betroffenen zu erreichen sowie die Entzündung zu reduzieren um Komplikationen zu verhindern (Strikturen, Bolusimpaktationen). Bei der Behandlung der EoE gilt das so genannte «3D»-Prinzip: Drugs (Medikamente wie Protonenpumpenhemmer (PPI), topische Steroide und neu Biologika), Diet (Elementardiät oder empirische Eliminationsdiät (1-/2 bis 6-fach Elimination) und Dilation (Aufweitung der Speiseröhre bei Striktur) (20).
Kortikosteroide
Topisch wirkende Kortikosteroide (englisch swallowed topical corticosteroids) haben sich in vielen Studien als wirksamste Medikamente zur Behandlung der EoE erwiesen. Durch Schlucken der topischen Kortikosteroide kann die EoE sowohl klinisch, endoskopisch als auch histologisch in Remission gebracht werden. Durch ihre lokale Wirksamkeit sind sie seit mehreren Jahren trotz des Off-Label-Gebrauchs die Therapie der 1. Wahl. Sowohl Fluticason propionat p.o. als auch visköses Budesonid p.o. haben sich als wirksam erwiesen (21, 22). Seit einigen Jahren ist in der Schweiz eine spezifisch für EoE entwickelte Budesonid-Schmelztablette zugelassen (Jorveza). Hierdurch kann in der Induktionstherapie eine Remissionsrate von bis 90% erreicht werden. Nach Sistieren der Behandlung kommt es jedoch bei fast allen Patient/-innen bereits innert Wochen bis wenigen Monaten zu einem Rückfall mit Wiederauftreten der Symptome (23, 24). Dies bedingt eine Erhaltungstherapie, durch welche eine Remission von 75-80% erreicht wird. Die topischen Kortikosteroide ermöglichen somit eine Kontrolle der EoE, aber keine Heilung. Im Gegensatz zu systemischen Steroiden sind die topischen Kortikosteroide nebenwirkungsarm. Eine der häufigsten Nebenwirkungen ist Soor im Mund, Rachen und/oder Ösophagus bei 5-10% der Patient/-innen, wobei dieser meist asymptomatisch verläuft und nur im Falle von Beschwerden einer Therapie bedarf (9).
Protonenpumpeninhibitoren
PPI und topische Steroide werden als Erstlinientherapien betrachtet. Ein früher üblicher PPI trial ist heute nicht mehr nötig. Eine Verwendung von PPI wird empfohlen bei EoE-Patient/-innen mit gleichzeitig bestehender gastroösophagealer Refluxkrankheit (GERD). (25) Aufgrund der Häufigkeit von GERD in der Allgemeinbevölkerung ist ein allfälliges gleichzeitiges Auftreten der Erkrankungen nicht unwahrscheinlich. Es ist möglich, dass ein sekundärer Reflux durch eine Beeinträchtigung des unteren Ösophagussphinkters hervorgerufen werden kann und dass eine Überempfindlichkeit der durch die EoE bedingt entzündeten Ösophagusschleimhaut refluxähnliche Symptome triggert (9). Die früher als PPI-responsive ösophageale Eosinophilie bezeichnete Untergruppe von EoE-Patient/-innen spricht auf eine PPI-Behandlung an, unabhängig davon ob ein Reflux vorhanden ist oder nicht. Daten aus der Praxis deuten darauf hin, dass topische Kortikosteroide für die Behandlung der EoE am wirksamsten sind, jedoch liegen bisher keine aussagekräftigen Studien vor, welche die Wirksamkeit und langfristige Sicherheit einer Behandlung mittels PPI vs. topischer Kortikosteroide untersuchen.
Dupilumab
Dupilumab ist ein humaner monoklonaler Antikörper, welcher den IL-4 und IL-13 Rezeptor blockiert. Hierdurch werden zwei Hauptzytokin-Pathways unterbunden. Da IL-4 und IL-13 bei weiteren Th2 mediierten Erkrankungen eine zentrale Rolle spielen, ist dieses Medikament auch bei Asthma, nasalen Polypen und atopischer Dermatitis effizient und hierfür in der Schweiz bereits zugelassen. Eine Therapie mit wöchentlich 300 mg subkutan war in der Induktions- und Erhaltungsphase bei EoE Patient/-innen wirksam und sehr sicher (26). Das Medikament ist in den USA und Europa bereits seit über einem Jahr zugelassen. Eine Zulassung in der Schweiz erfolgte just im August 2023, aktuell für Patient/-innen, welche ungenügend oder intolerant auf eine konservative Therapie reagiert haben. Das Zeitalter der Biologikatherapie hat somit auch bei der EoE begonnen. Der genaue Platz im Therapiealgorithmus muss in den nächsten Jahren geklärt werden. Aktuell scheint ein Einsatz v.a. bei den folgenden 3 Patient/-innengruppen sinnvoll:
1) fehlendes Ansprechen auf eine Standardtherapie (insbesondere Steroide);
2) Auftreten von Nebenwirkungen bei einer Standardtherapie (insbesondere Steroide); und
3) Vorliegen mehrerer Th2-mediierter Erkrankungen (27). Ob Dupilumab bei der Therapie der Fibrosierung einen besonderen Stellenwert hat, wird in laufenden Studien untersucht.
Diät
Bei der EoE wird durch den Kontakt mit gewissen Nahrungsmittelkategorien (tierische Milch, Weizen, Eier, Nüsse, Soja oder Meeresfrüchte) eine Th2-Immunantwort getriggert. Aufgrund dessen gibt es verschiedene Herangehensweisen um mittels Diät, resp. einer Ernährungsweise, eine histologische Remission der EoE zu erreichen. Eine hiervon ist die 1-2 «food elimination diet» (FED), bei welcher primär die Elimination von tierischen Milchprodukten (1-FED), allfällig ergänzt durch die Elimination von Weizen gewählt wird (2-FED). Studien zeigten, dass bereits die alleinige Elimination von tierischen Milchprodukten (1-FED) in 40% zu einer Remission führte. Eine andere Herangehensweise ist die 6-FED (28). Hierbei erfolgt die empirische Elimination der 6 häufigsten Nahrungsmittelallergene (Milchprodukte, Weizen, Eier, Nüsse und Hülsenfrüchte, Soja, Meeresfrüchte) und im Verlauf werden die Nahrungsmittel nacheinander Schritt für Schritt wiederbegonnen. Die histologische Krankheitsaktivität wird hierbei endoskopisch mittels Biopsieentnahmen überwacht. Die Elimination sämtlicher in der 6-FED enthaltenen Nahrungsmittel ist schwierig und mehrfache Gastroskopien sind nötig, sodass die Umsetzung und Akzeptanz der 6-FED unter den Patient/-innen eher gering ausfällt. Als Alternative hat sich der step-up approach durchgesetzt (29), bei welchem mit einer 2-FED begonnen wird (Milch und Weizen) und erst eine restriktivere Diät erfolgt (4-FED dann 6-FED), falls die 2-FED ohne Effekt bleibt. Eine kürzlich publizierte Studie stellt jedoch beide Verfahren in Frage, da bereits mit einer simplen Milcheliminationsdiät ein vergleichbarer Effekt erzielt werden kann (histologische Remission bei 6-FED betrug 40% vs. 34% bei 1-FED) (30).
Dilatation
Die Dilatation des Ösophagus ist eine effektive Behandlung von bereits vorhandenen Strikturen, welche fibrostenotische Zeichen der chronischen Entzündung sind, sowie der hiermit einhergehenden Dysphagie-Symptome. Jedoch wird die Schleimhautentzündung hierdurch nicht behandelt. Es bestehen verschiedene technische Möglichkeiten, welche je nach Kasus sowie Präferenz des behandelnden Gastroenterologen verwendet werden: 1) Bougierung in Savary Technik; 2) Bougierung mittels BougieCap; oder 3) Ballondilatation. Die Dilatation erfolgt schrittweise und repetitiv, um Perforationen zu verhindern. Ein Zieldurchmesser der Speiseröhre von 15-18 mm sollte angestrebt werden. In geübten Händen ist die Dilatation eine sehr sichere Methode und die Perforationsrate unter 0.1% (31).
Algorithmus
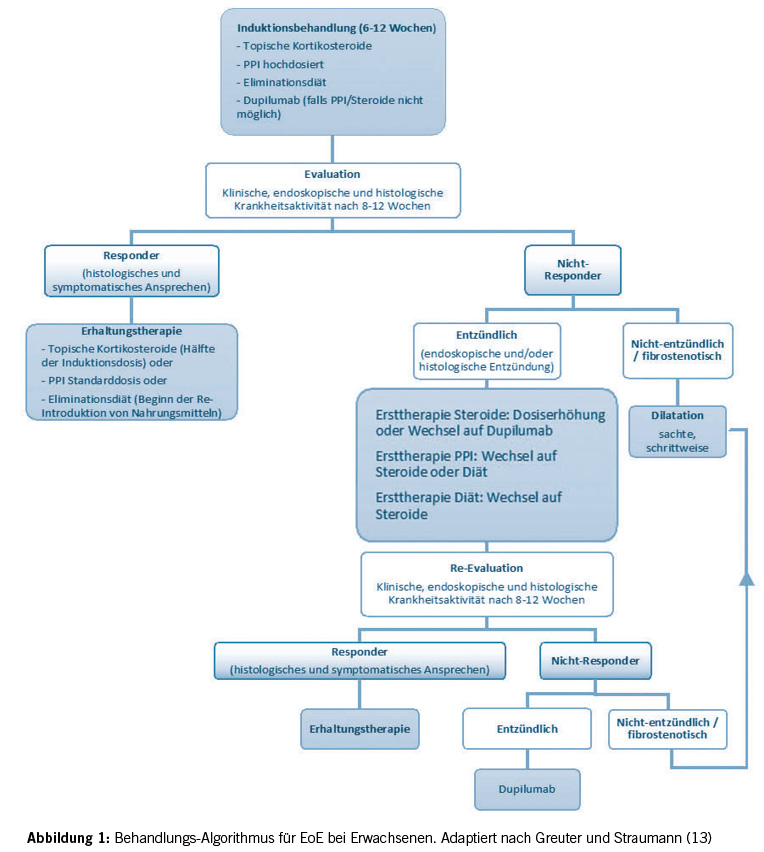
Als Erstlinienbehandlung empfohlen werden PPI, Diät oder topische Kortikosteroide. Eine Kombination ist nicht sinnvoll. Ebenso ist von einer alleinigen Dilatationstherapie abzuraten, da hierdurch die zugrundeliegende Inflammation nicht behandelt wird. Die Dilatation ist daher nur als Zusatztherapie gedacht. Die Therapiewahl sollte mit den Patient/-innen individuell besprochen werden. Der Therapieeffekt sollte jedoch spätestens nach 12-wöchiger Behandlung endoskopisch kontrolliert werden (32). Aufgrund der Chronizität der Erkrankung sind zudem jährliche endoskopische Kontrollen indiziert, dies auch bei beschwerdefreien Patient/-innen, da die Korrelation zwischen klinischer und histologischer Aktivität nicht sehr gut ist. Die medikamentöse respektive diätetische Therapie ist lebenslang, da es nach dem Absetzen der Therapie innerhalb weniger Monate bei fast allen Patient/-innen zu einem Rezidiv kommt. Siehe Abbildung 1.
Nicht-EoE EGIDs
Nicht-EoE EGIDs können den Magen (eosinophile Gastritis), den Dünndarm (eosinophile Enteritis, Jejunitis oder Ileitis) und das Kolon (eosinophile Kolitis) betreffen. Sie lassen sich sowohl isoliert in einem intestinalen Abschnitt, z.B. Jejunum (EoJ) oder Duodenum (EoD), als auch in mehreren Abschnitten in beliebiger Kombination finden. Auch die Tiefe des Befalls der jeweiligen Schleimhautschichten kann variieren (mukosal vs. transmural vs. serös). Sind mehrere Segmente betroffen, so erfolgt die Namensgebung anhand der involvierten Segmente, z.B. eosinophile Duodenitis und Colitis. Zwar wurden diagnostische Schwellenwerte (Eos/hpf) für die verschiedenen Nicht-EoE-EGIDs vorgeschlagen, ein Konsens für Diagnostik und Therapiemonitoring bestehen aktuell jedoch nicht. Betreffend pathophysiologische Mechanismen ist weniger bekannt als bei der EoE, es werden aber signifikante Überlappungen angenommen. In einer amerikanischen Multizenter-Studie wurden kürzlich Gene identifiziert, welche mit einer eosinophilen Gastritis assoziiert sind und somit eine Unterscheidung zu sonstigen Gastritiden zulassen. Zu diesen gehören (u.a.) CCL26, IL13RA2, IL5, CLC, CDH26, KLK7 und MUC4, sowie Eotaxin-3 und TSLP (33). Daten zur eosinophilen Kolitis sind spärlich. Es scheint jedoch auch hier ein spezifisches Transkriptom vorzuliegen (987 Gene), welches die Unterscheidung zu chronisch entzündlichen Darmerkrankungen (Colitis ulcerosa, Morbus Crohn) und zu anderen Nicht-EoE EGIDs erlaubt (34). Im Folgenden gehen wir detaillierter auf die vorliegenden demographischen Daten, die klinische Präsentation, mögliche Diagnostik sowie Therapien der Nicht-EoE EGIDs ein.
Demographie
Eine kürzlich durchgeführte Metaanalyse ergab, dass die Prävalenz von Nicht-EoE EGIDs bei Patient/-innen mit gastrointestinalen Symptomen bis zu 2.4 % betragen könnte (35). In den USA zeigte sich eine Gesamtprävalenz der eosinophilen Gastroenteritis, welche sowohl die eosinophile Gastritis als auch Enteritis beinhaltet, von 5.1 pro 100.000. Bei der eosinophilen Kolitis beträgt die Prävalenz 2.1 pro 100.000. Allgemein scheint die Prävalenz bei Kaukasiern höher als bei Asiaten oder Afrikanern, während die eosinophile Gastroenteritis im Kindesalter und die eosinophile Kolitis im Erwachsenenalter häufiger vorkommen (36). Insgesamt muss aber von einer relativ hohen Dunkelziffer ausgegangen werden. Mit einer erhöhten «disease awareness» werden die Prävalenz- und Inzidenzzahlen sicher steigen. Diese scheinen aktuell jedoch (noch) deutlich tiefer zu liegen als bei der EoE.
Klinik und Diagnostik
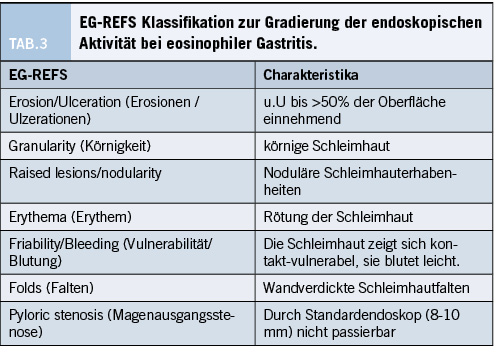
Nicht-EoE EGIDs äussern sich mit unspezifischen gastrointestinalen Symptomen, unter anderem Bauchschmerzen, Nausea, Erbrechen, Diarrhoe sowie Gewichtsverlust (36). Die klinische Präsentation variiert je nach betroffenem Abschnitt (Nausea und Erbrechen eher bei Gastritis, Diarrhoe eher bei Kolitis). Es können auch schwere Erscheinungsformen oder Komplikationen wie Protein-Verlust Enteropathie, Aszites (insbesondere bei serösen Formen), Volvulus, Ulzera oder Perforationen beobachtet werden, auch wenn diese Präsentationen insgesamt selten sind (37). Die Diagnose einer nicht-EoE EGID basiert auf dem bioptisch gesicherten Vorliegen einer eosinophilen Infiltration des Magen-Darm-Trakts, der fehlenden Beteiligung anderer Organe und dem Fehlen anderer Ursachen der intestinalen Eosinophilie (u.a. parasitöse Darminfektionen, Morbus Crohn/Colitis ulcerosa, eosinophile Granulomatose mit Polyangiitis, ehem. Churg-Strauss Vaskulitis). Sind andere Organe betroffen und liegt insbesondere eine Bluteosinophilie vor, muss an ein Hypereosinophilie-Syndrom (HES) mit gastrointestinaler Beteiligung gedacht werden. In den letzten Jahren wurden – in Analogie zur EoE – auch endoskopische Veränderungen beschrieben, welche mit Nicht-EoE EGIDs einher gehen können. Am besten beschrieben sind diese im Magen, wo kürzlich die so genannte EG-REFS Klassifikation publiziert wurde (38). Der EG-REFS reicht von 0 (keine Aktivität) bis 46 (maximale Aktivität). Die einzelnen Befunde sind in Tabelle 3 aufgeführt.
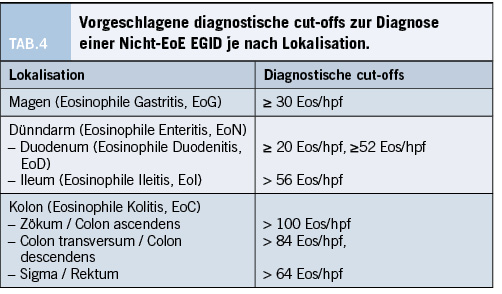
Wie bei der Diagnostik der EoE ist auch bei den Nicht-EoE EGIDs die Gewebe-Eosinophilie das diagnostische Hauptakriterium. Ein Konsens betreffend der cut-offs besteht jedoch nicht. Insgesamt ist festzuhalten, dass mehr Eosinophile toleriert werden, je weiter distal sich das GI Segment befindet. Folgende Mindestzahlen wurden in der Literatur beschrieben (in jeweils 5 hpfs): (39-41).
Therapie
Aktuell ist kein Medikament für die Indikation der Nicht-EoE EGIDs zugelassen. Es bestehen jedoch verschiedene Therapieoptionen, in Analogie zur EoE. Diät und Medikamente sind hier ebenfalls als «entweder-oder» Strategie zu verstehen. Eine Kombinationstherapie macht aus pathophysiologischer Sicht keinen Sinn, wird aber in schweren Fällen (mangels Alternativen) teilweise eingesetzt. Im Folgenden gehen wir auf die verschiedenen Therapieoptionen (off-label) genauer ein.
Diät
Bei motivierten Patient/-innen sowie milder Klinik kann bei Nicht-EoE EGIDs eine Initialbehandlung mittels Diät in Analogie zur EoE (1-2-FED mit step-up approach, 6-FED oder Elementardiät) erfolgen. Diese sollte für mindestens 4-6 Wochen, unter Anleitung einer in EGIDs ausgebildeten Ernährungsberatung durchgeführt werden. Das Therapieansprechen ist endoskopisch und histologisch zu dokumentieren. Bei schweren Formen ist aufgrund des verzögerten Therapieansprechens auf diätetische Massnahmen zu verzichten.
Glukokortikoide
Systemische Glukokortikoide sind die verbreitetste Behandlung für Nicht-EoE EGIDs (42, 43). Wir empfehlen eine probatorische Behandlung mit Prednison (20-40 mg/Tag), mit anschliessendem Ausschleichen. Ein klinisches Ansprechen tritt in der Regel innerhalb von 2 Wochen ein (44). Bei einigen Patient/-innen ist jedoch eine längere Induktions-Therapie (mehrere Monate) nötig, um die Symptome zu lindern. Patient/-innen, die unmittelbar nach Absetzen der Steroide einen Rückfall erleiden, benötigen meist eine langfristige niedrig dosierte Erhaltungstherapie mit Prednison (5-10 mg/d). Eine Alternative zu den systemischen Steroiden bieten topische Steroide, wobei hier ein Präparat zu wählen ist, welches im Bereich des betroffenen Segments wirkt.
Biologika
Verschiedene Biologika wurden für Nicht-EoE EGIDs eingesetzt, die meisten davon in kleinen Fallserien. Zu den potentiell wirksamen Biologika zählen der anti-IgE Antikörper Omalizumab, die anti IL-5 Antikörper Mepolizumab, Reslizumab und Benralizumab, der anti-Integrin Antikörper Vedolizumab, der anti IL-4/IL-13 Antikörper Dupilumab sowie der anti Siglec-8 Antikörper Lirentelimab. Letzterer führt zu einer raschen Depletion von Eosinophilen und zu einer Hemmung der Mastzellen. Eine randomisiert kontrollierte Phase II Studie war vielversprechend (45). Die Daten konnten aber nicht bestätigt werden. Reslizumab war in einer randomisierten Studie bei Patient/-innen mit Hyper-eosinophilie Syndrom (und gastrointestinaler Beteiligung) sowie in einer kleinen Phase II Studie wirksam. Das grösste Potential bietet jedoch wohl Dupilumab, welches mittlerweile für die EoE zugelassen ist, und in klinischen Studien bei Nicht-EoE EGIDs getestet wird.
Zusammenfassung
Die eosinophile Ösophagitis ist ein zentrales Krankheitsbild in der Gastroenterologie und aufgrund der Häufigkeit auch in der hausärztlichen Sprechstunde. Es handelt sich dabei um die häufigste Ursache einer Dysphagie im Kindes- und jungen Erwachsenenalter. Früh erkannt, ist sie einfach und wirksam zu behandeln. Es sind zwei EoE spezifische Medikamente zugelassen, das topische Kortisonpräparat Jorveza sowie das subkutan applizierte Dupilumab (Dupixent). Eine Zuweisung in die gastroenterologische Sprechstunde (zur zeitnahen Gastroskopie) ist essentiell. Neben der EoE spielen die eosinophilen gastrointestinalen Erkrankungen eine zunehmende Rolle und bleiben bis anhin häufig unerkannt aufgrund der unspezifischen klinischen Präsentation. Auch hier ist die enge Zusammenarbeit mit einem Gastroenterologen, am besten mit spezifischen Kenntnissen im Bereich der eosinophilen Erkrankungen, empfohlen.
Leitender Arzt Gastroenterologie, GZO Spital
Spitalstrasse 66
8620 Wetzikon
thomas.greuter@gzo.ch
Finanzielle Unterstützung:
Diese Arbeit wurde u.a. unterstützt durch den Schweizerischen Nationalfonds zur Förderung der Wissenschaft (P2ZHP3_168561), die Novartis Stiftung für Biomedizinische Forschung, die EoE Stiftung sowie durch einen “Training Grant” des NIH-geförderten “Consortium of Eosinophilic Gastrointestinal Disease Researchers” (CEGIR, U54 AI117804)
Interessenkonflikte:
Thomas Greuter erhielt Beraterhonorare von Sanofi-Regeneron, Janssen, BMS, Takeda, Abbvie und Dr Falk Pharma GmbH, Reiseunterstützung von Dr Falk Pharma GmbH, Takeda und Vifor, sowie Vortragshonorare von Norgine und Amgen. Catrina Waldegg hat keine Interessenskonflikte.
1. International Consensus Recommendations for EosinophilicDellon ES GN, Abonia JP, Alexander JA, Arva NC, Atkins D, et al. International Consensus Recommendations for Eosinophilic Gastrointestinal Disease Nomenclature. Clinical Gastroenterology and Hepatology. 2022:2474–84.
2. Wen T SE, Grotjan TM, Kemme KA, Abonia JP, Putnam PE, Franciosi JP, Garza JM, Kaul A, King EC, Collins MH, Kushner JP, Rothenberg ME. Molecular diagnosis of eosinophilic esophagitis by gene expression profiling. . Gastroenterology. 2013 Dec:1289-99.
3. Kottyan LC PS, Weirauch MT, Rothenberg ME, Martin LJ. The genetic etiology of eosinophilic esophagitis. Journal of Allergy and Clinical Immunology. 2020 Jan:9-15.
4. Jensen ET DE. Environmental factors and eosinophilic esophagitis. Journal of Allergy and Clinical Immunology. 2018 Jul:32-40.
5. Liacouras CA, Furuta GT, Hirano I, Atkins D, Attwood SE, Bonis PA, et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol. 2011;128(1):3-20.e6; quiz 1-2.
6. Schoepfer AM, Safroneeva E, Bussmann C, Kuchen T, Portmann S, Simon HU, et al. Delay in diagnosis of eosinophilic esophagitis increases risk for stricture formation in a time-dependent manner. Gastroenterology. 2013;145(6):1230-6.e1-2.
7. Murray FR, Kreienbuehl AS, Greuter T, Nennstiel S, Safroneeva E, Saner C, et al. Diagnostic Delay in Patients With Eosinophilic Esophagitis Has Not Changed Since the First Description 30 Years Ago: Diagnostic Delay in Eosinophilic Esophagitis. Am J Gastroenterol. 2022;117(11):1772-9.
8. O’Shea KM AS, Dellon ES, Gupta SK, Spergel JM, Furuta GT, Rothenberg ME. Pathophysiology of Eosinophilic Esophagitis. Gastroe<nterolog. 2018 Jan:333-45.
9. Biedermann L SA, Greuter T, Schreiner P. Eosinophilic esophagitis-established facts and new horizons. Seminars in Immunopathology. 2021.
10. González-Cervera J AÁ, Redondo-González O, Cano-Mollinedo MM, Terreehorst I, Lucendo AJ. Association between atopic manifestations and eosinophilic esophagitis: A systematic review and meta-analysis. Annals of Allergy, Asthma & Immunology. 2017 May:582-90.
11. Alexander ES ML, Collins MH, et al. Twin and family studies reveal strong environmental and weaker genetic cues explaining heritability of eosinophilic esophagitis. Journal of Allergy and Clinical Immunology. 2014 Nov:1084-92.
12. Jensen ET, Dellon ES. Environmental factors and eosinophilic esophagitis. J Allergy Clin Immunol. 2018;142(1):32-40.
13. Attwood SE, Smyrk TC, Demeester TR, Jones JB. Esophageal eosinophilia with dysphagia. A distinct clinicopathologic syndrome. Dig Dis Sci. 1993;38(1):109-16.
14. Straumann A, Spichtin HP, Bernoulli R, Loosli J, Vögtlin J. [Idiopathic eosinophilic esophagitis: a frequently overlooked disease with typical clinical aspects and discrete endoscopic findings]. Schweiz Med Wochenschr. 1994;124(33):1419-29.
15. Doyle AD, Masuda MY, Pyon GC, Luo H, Putikova A, LeSuer WE, et al. Detergent exposure induces epithelial barrier dysfunction and eosinophilic inflammation in the esophagus. Allergy. 2023;78(1):192-201.
16. Hirano I, Moy N, Heckman MG, Thomas CS, Gonsalves N, Achem SR. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut. 2013;62(4): 489-95.
17. Lucendo AJ, Molina-Infante J, Arias Á, von Arnim U, Bredenoord AJ, Bussmann C, et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017;5(3):335-58.
18. Collins MH, Martin LJ, Alexander ES, Boyd JT, Sheridan R, He H, et al. Newly developed and validated eosinophilic esophagitis histology scoring system and evidence that it outperforms peak eosinophil count for disease diagnosis and monitoring. Dis Esophagus. 2017;30(3):1-8.
19. Greuter T, Straumann A, Fernandez-Marrero Y, Germic N, Hosseini A, Yousefi S, et al. Characterization of eosinophilic esophagitis variants by clinical, histological, and molecular analyses: A cross-sectional multi-center study. Allergy. 2022.
20. Straumann A, Katzka DA. Diagnosis and Treatment of Eosinophilic Esophagitis. Gastroenterology. 2018;154(2):346-59.
21. Dellon ES KD, Collins MH, et al. Safety and efficacy of budesonide oral suspension maintenance therapy in patients with eosinophilic esophagitis. Clinical Gastroenterology and Hepatology. 2019.
22. Ketchem CJ RC, Stefanadis Z, et al. Treatment with compounded fluticasone suspension improves the clinical, endoscopic, and histologic features of eosinophilic esophagitis. Diseases of the esophagus. 2021.
23. Dellon ES WJ, Arrington A, McGee SJ, Covington J, Moist SE, Gebhart JH, Galanko JA, Baron JA, Shaheen NJ. Rapid Recurrence of Eosinophilic Esophagitis Activity After Successful Treatment in the Observation Phase of a Randomized, Double-Blind, Double-Dummy Trial. Clinical Gastroenterology and Hepatology. 2020.
24. Greuter T BC, Safroneeva E, Schoepfer AM, Biedermann L, Vavricka SR, Straumann A. Long-Term Treatment of Eosinophilic Esophagitis With Swallowed Topical Corticosteroids: Development and Evaluation of a Therapeutic Concept. Am J Gastroenterol 2017.
25. Liacouras CA FG, Hirano I et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol. 2011.
26. Dellon ES RM, Collins MH, Hirano I, Chehade M et al. Dupilumab in Adults and Adolescents with Eosinophilic Esophagitis. The new england journal of medicine. 2022 Dec:2317 – 30.
27. Greuter T, Hirano I, Dellon ES. Emerging therapies for eosinophilic esophagitis. J Allergy Clin Immunol. 2020;145(1):38-45.
28. Arias A G-CJ, Tenias JM, Lucendo AJ. Efficacy of dietary interventions for inducing histologic remission in patients with eosinophilic esophagitis: a systematic review and meta-analysis. Gastroenterology. 2014 Jun:1639-48.
29. Molina-Infante J, Arias Á, Alcedo J, Garcia-Romero R, Casabona-Frances S, Prieto-Garcia A, et al. Step-up empiric elimination diet for pediatric and adult eosinophilic esophagitis: The 2-4-6 study. J Allergy Clin Immunol. 2018;141(4):1365-72.
30. Kliewer KL GN, Dellon ES, Katzka DA, Abonia JP, Aceves SS, et al. One-food versus six-food elimination diet therapy for the treatment of eosinophilic oesophagitis: a multicentre, randomised, open-label trial.: The Lancet Gastroenterology & Hepatology; 2023.
31. Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther. 2013;38(7):713-20.
32. Lucendo AJea. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017.
33. Shoda T, Wen T, Caldwell JM, Collins MH, Besse JA, Osswald GA, et al. Molecular, endoscopic, histologic, and circulating biomarker-based diagnosis of eosinophilic gastritis: Multi-site study. J Allergy Clin Immunol. 2020;145(1): 255-69.
34. Shoda T, Collins MH, Rochman M, Wen T, Caldwell JM, Mack LE, et al. Evaluating Eosinophilic Colitis as a Unique Disease Using Colonic Molecular Profiles: A Multi-Site Study. Gastroenterology. 2022;162(6):1635-49.
35. Visaggi P GM, Barberio B, Maniero D, Greco E et al. Treatment Trends for Eosinophilic Esophagitis and the Other Eosinophilic Gastrointestinal Diseases: Systematic Review of Clinical Trials. Digestive and Liver Disease. 2023 Feb:208-22.
36. Mansoor E SM, Cooper GS. Prevalence of Eosinophilic Gastroenteritis and Colitis in a Population-Based Study, From 2012 to 2017. Clinical Gastroenterology and Hepatology. 2017 Nov:1733-41.
37. Walker MM PM, Talley NJ. Eosinophilic gastroenteritis and other eosinophilic gut diseases distal to the oesophagus. The Lancet Gastroenterology and Hepatology. 2018 Apr:271-80.
38. Hirano I, Collins MH, King E, Sun Q, Chehade M, Abonia JP, et al. Prospective Endoscopic Activity Assessment for Eosinophilic Gastritis in a Multisite Cohort. Am J Gastroenterol. 2022;117(3):413-23.
39. Genta RM, Sonnenberg A, Turner K. Quantification of the duodenal eosinophil content in adults: a necessary step for an evidence-based diagnosis of duodenal eosinophilia. Aliment Pharmacol Ther. 2018;47(8):1143-50.
40. Lwin T, Melton SD, Genta RM. Eosinophilic gastritis: histopathological characterization and quantification of the normal gastric eosinophil content. Mod Pathol. 2011;24(4):556-63.
41. Collins MH. Histopathologic features of eosinophilic esophagitis and eosinophilic gastrointestinal diseases. Gastroenterol Clin North Am. 2014;43(2): 257-68.
42. Kinoshita Y, Oouchi S, Fujisawa T. Eosinophilic gastrointestinal diseases – Pathogenesis, diagnosis, and treatment. Allergol Int. 2019;68(4):420-9.
43. Pineton de Chambrun G, Gonzalez F, Canva JY, Gonzalez S, Houssin L, Desreumaux P, et al. Natural history of eosinophilic gastroenteritis. Clin Gastroenterol Hepatol. 2011;9(11):950-6 e1.
44. Chen MJ, Chu CH, Lin SC, Shih SC, Wang TE. Eosinophilic gastroenteritis: clinical experience with 15 patients. World J Gastroenterol. 2003;9(12):2813-6.
45. Dellon ES, Peterson KA, Murray JA, Falk GW, Gonsalves N, Chehade M, et al. Anti-Siglec-8 Antibody for Eosinophilic Gastritis and Duodenitis. N Engl J Med. 2020;383(17):1624-34.
Therapeutische Umschau
- Vol. 79
- Ausgabe 9
- Dezember 2023